新的生物素特异性单克隆抗体及其用途的制作方法
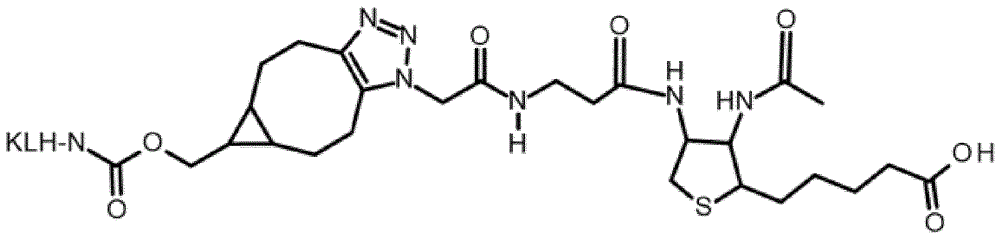
发明背景在活的生物以及在体外生物化学中,生物素的主要功能是共底物的功能,其作为具有羧基转移酶活性的酶的辅基是需要的,例如,丙酮酸羧化酶和乙酰辅酶a羧化酶。在细菌中,生物素通过生物素蛋白连接酶与生物素羧基载体蛋白附着。此外,已知许多化学过程,生物素可以借助所述化学过程共价附着到几乎任何感兴趣的分子上的合适基团。作为共同特征,戊酸侧链的羧基官能的碳原子在偶联反应中与感兴趣的分子上的适当(接收)基团反应,或与接头的反应基反应,其中接头本身或者已经连接到感兴趣的分子,或者一旦生物素附着到接头,接头就与分子偶联。通常,通过戊酸侧链的羧基官能的碳原子将生物素到各种化学位点的这种附着被称为生物素化。抗生物素蛋白和/或链霉抗生物素蛋白(=(链霉)抗生物素蛋白)分别对生物素的非凡亲和力(ka=1015m-1)是蛋白质和配体的最强已知非共价相互作用之一。它允许复杂混合物中的生物素化的分子被(链霉)抗生物素蛋白特异性结合。由于这个原因,抗生物素蛋白和/或链霉抗生物素蛋白用于大量免疫学检测测定中。除了对(链霉)抗生物素蛋白具有强亲和力外,两个进一步的性质使生物素特别适合于标记蛋白质和其他大分子。首先,生物素分子显著小于蛋白质。其分子大小允许一个或多个生物素分子与感兴趣的分子缀合,同时使这种分子的生物功能损失减至最小。其次,生物素的戊酸侧链的末端碳原子可以容易地衍生化,从而促进与感兴趣的分子,特别是蛋白质上的反应性部分的缀合。值得注意的是,生物素化不改变生物素的杂环部分的结构。在通过戊酸侧链的末端碳原子进行生物素化后,生物素部分保持了与(链霉)抗生物素蛋白特异性相互作用的能力,这是因为负责与抗生物素蛋白型蛋白质的结合口袋的特异性相互作用的生物素分子的部分是由与四氢噻吩环稠合的脲基环代表的杂环结构不受影响。生物素的杂环结构也被现有技术中针对生物素的单克隆抗体(mabs)靶向。kohenf.等人(methodsinenzymology279(1997)451-463)使用生物素化的牛血清清蛋白(与n-羟基琥珀酰亚胺生物素缀合的bsa)作为免疫原产生单克隆抗体。该文献报道了能够结合生物素化的蛋白质的生物素部分的抗体的抗原结合区域的氨基酸序列的分析。与据报道与生物素的二环环状系统相互作用的抗生物素蛋白和链霉抗生物素蛋白多肽序列的同源序列段进行了序列比对。值得注意的是,在生物素特异性抗体的cdr2和cdr3中鉴定了与抗生物素蛋白和链霉抗生物素蛋白的多肽序列的相似性。结果解释为因为在生物素结合口袋的氨基酸序列中,共同模式是生物素结合所必需的。dakshinamurti,k等人(biochem.j.237(1986)477-482)报道了使用偶联有活化形式的生物素(n-羟基琥珀酰亚胺生物素)的匙孔䗩血蓝蛋白(klh)作为免疫原的鼠mabs的产生和表征。获得了几种杂交瘤克隆,并且各自的mabs在结合游离的生物素、半抗原缀合的生物素、蛋白质缀合的生物素和生物胞素中有效。值得注意的是,生物胞素是天然存在的生物素衍生物,是由戊酸羧基官能和氨基酸l-赖氨酸形成的酰胺。这种衍生化的生物素被dakshinamurti,k等人(见上)的mabs结合的事实指示了靶向生物素的杂环结构(即,与四氢噻吩环稠合的脲基环)的结合特异性。虽然dakshinamurti,k等人(见上)报道的mabs的确结合缀合的生物素且也结合游离的生物素,但jp2008-094721公开了一种mab,其特异性结合蛋白质缀合的生物素,但不与游离生物素结合。表1总结了现有技术抗体的讨论的性质。表1针对生物素产生的单克隆抗体的结合性质报道与生物素化的靶结合与游离生物素结合dakshinamurti,k等人(biochem.j.237(1986)477-482)是是kohenf.等人(m.enzymol.279(1997)451-463)是未测定jp2008-094721是否尚无报道否是类似于dakshinamurti,k等人(见上)的报道,wo00/50088a2涉及具有可比较的性质的抗体;具体而言,报道了对缀合的生物素具有的亲和力比对游离生物素的相应亲和力高一至四个数量级的抗体。该文献公开了用抗原进行免疫,生物素通过戊酸部分的羧基官能的碳原子与所述抗原缀合。在第一筛选步骤中,鉴定了与缀合的生物素结合的抗体;公开了后来的第二筛选步骤,其旨在鉴定即使在有限定量的游离生物素的情况下也分泌能够结合缀合的生物素的单克隆抗体的克隆。值得注意的是,该文献没有提到这样的单克隆抗体,所述单克隆抗体一方面与游离生物素(不与另一分子共价结合并且在水溶液中处于解离形式的生物素)结合,但另一方面不与生物素化的分子上的生物素部分结合,即,也可以被(链霉)抗生物素蛋白结合的生物素部分。indykh.e.等人internationaldairyjournal35(2014)25-31报道了一种用于检测乳中游离生物素的光学生物传感器测定。使用具有cm5传感器芯片的biacoreq生物传感器;在胺修饰的传感器表面上,生物素通过其nhs-活化的戊酸末端羧基的共价偶联来固定。值得注意的是,与传感器芯片偶联的生物素分子的取向与生物素化的分子上的生物素相同,即,对应于也可以被(链霉)抗生物素蛋白结合的生物素部分。因此,主要暴露生物素的杂环结构用于抗体结合。在有不同浓度的游离生物素作为竞争剂的情况下,使用生物素传感器芯片表征了三种不同生物素特异性多克隆抗体和两种不同单克隆抗体的结合性质。值得注意的是,到现在为止,在现有技术中还没有发现描述特异性结合游离生物素而不是生物素化的靶分子上缀合的生物素的单克隆抗体的公开内容。这种抗体将主要从其“尾”结合生物素,即,将显著地与生物素的戊酸部分相互作用。特别地,到现在为止,尚未描述这样的抗体,其一方面特异性结合游离生物素,但另一方面不结合缀合的生物素,其中缀合的生物素通过戊酸部分的羧基官能的碳原子与靶分子附着,由此生物素的杂环“头”结构位于远离靶分子处。此外,到现在为止,没有这样的单克隆抗体是已知的,其在水溶液中表征为对游离生物素的亲和力ks[游离]高于相同单克隆抗体对缀合的生物素的亲和力ks[缀合],其中所述缀合的生物素通过戊酸部分的羧基官能的碳原子缀合(参见上文),并且其中ks[游离]与ks[缀合]相差至少50、100、500、1,000、5,000、10,000、50,000或至少100,000倍。johnsonl.c.(“thesynthesisofnewbiotinderivativesandtheirbioactivity”,于2017年2月16日从因特网检索的提交到graduatefacultyofthelouisianastateuniversityandagriculturalandmechanicalcollege(us)的2002年12月的理学硕士论文;url:http://etd.lsu.edu/docs/available/etd-0927102-135929/unrestricted/johnson_thesis.pdf)描述了生物素的杂环“头”结构衍生化的化学反应。公开了其中生物素的杂环结构中包含的1'-n原子通过衍生化靶向的实施方案。wuf.-b.等人clinicachimicaacta308(2001)117-126公开了一种在竞争性免疫测定中抵消基质干扰的方法。由与靶(血清甲状腺素)特异性抗体结合的固定的第二抗体组成的初始测定配置被进行替换。通过下述提供所述替换,即,首先固定生物素化的牛血清清蛋白(bsa),后面是将链霉抗生物素蛋白与生物素化的bsa结合,后面是将靶特异性抗体与链霉抗生物素蛋白结合,其中在这个步骤之前将靶特异性抗体生物素化。发现这样的配置为测定的靶(血清甲状腺素)提供了增加的结合能力,并从而增加了对基质干扰的抗性。本发明提供式i的化学结构(见下文),其特别地将衍生化的二氨基生物素(diaminobiotin)的戊酸“尾”部分呈现为相应结构的远端(最末端)部分。通过衍生化生物素类似物二氨基生物素并通过将其“头”部分附着到式i结构的剩余部分,戊酸部分被主要暴露并提供用于物理相互作用,包括与免疫细胞受体和抗体的相互作用。本研究的主题是查明与根据式i的衍生化生物素相互作用的抗体是否将具有可以靶向戊酸“尾”部分的结合性质。在本研究中,进一步测试了可以使用式i结构得出并且能够与这种结构反应的单克隆抗体是否也将具有根据本发明的所期望的抗体的性质。因此,本发明的所期望的抗体是特异性结合生物素的单克隆抗体,其中生物素不与另一分子共价结合。同样地,与上述推理一致,本发明的所期望的抗体是特异性结合生物素的单克隆抗体,其中生物素在水溶液中处于解离形式。同时,本发明的所期望的抗体不与生物素化的靶分子上的缀合的生物素结合,其中生物素通过戊酸部分的羧基与靶分子附着。在这种生物素化的靶分子中,生物素的“头”结构的缀合形式存在并且可以例如被(链霉)抗生物素蛋白结合。因此,本发明人着手查明是否可以制备和分离抗体以特异性结合未缀合的(游离的)生物素。与较早报道已经描述的与生物素的“头”部分结合的抗体相比,这种与生物素的结合将具有完全不同的结构基础。对于这个公开内容来说,本发明的目的是提供特异性结合式i化合物的单克隆抗体,(式i)其特征在于它还与生物素结合,其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且其中r选自h、oh、cooh、nh2、叠氮基、马来酰亚胺基和z,其中z是a或b,其中a是m-l,其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是连接x和m的接头,且其中b是其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合。进一步的目的是提供与式i分子和生物素结合但不与缀合的生物素结合的单克隆抗体,所述缀合的生物素通过戊酸部分的羧基官能的碳原子与大分子附着。作为进一步的目的,本发明的抗体与包含化学上未修饰的戊酸部分的生物素结合。因此,目的是分离单克隆抗体,其对在生物素化的靶分子上的缀合的生物素具有的亲和力为对游离生物素的亲和力的选自至多1/50、1/100、1/500、1/1,000、1/5,000、1/10,000或更低。换言之,目的是分离单克隆抗体,其对游离生物素具有的亲和力为对在生物素化的靶分子上的缀合的生物素的亲和力的选自至少50、100、500、1,000、5,000和至少10,000倍。现在已令人惊讶地发现,可以产生和分离这种单克隆抗体。近来,高剂量生物素补充已变得“流行”。生物素被认为是角蛋白的关键贡献者,且因此高剂量生物素可以改善毛发、甲和皮肤的质量和数量。生物素是水溶性的并且迅速排泄。然而,如果采用高剂量生物素补充,则可能存在循环中相当高水平的生物素,并且循环中的生物素也将存在于用于测量分析物的用于体外分析的样品中,即,在诸如血清或血浆的样品中。包含在样品中的生物素,如果以高水平存在,则可能干扰用于测量分析物的测定,其采用(链霉)抗生物素蛋白包被的固相和生物素化的特异性结合剂。因此,随着高剂量生物素补充剂的使用增加,越来越需要在基于(链霉)抗生物素蛋白-生物素结合对的测定中降低样品中异常高的生物素水平与来自相同样品的分析物测量的潜在干扰。研究本文公开的抗体是否可用于减少生物素的潜在干扰是进一步的任务。已经令人惊讶地发现,在这样的测定中,其中(链霉)抗生物素蛋白/生物素对用于将生物素化的分析物特异性结合剂结合到(链霉)抗生物素蛋白包被的固相上,能够结合生物素但不结合生物素化的靶分子上的生物素部分的单克隆抗体对于抵消由样品中异常高水平的生物素在用于测量这种样品中的分析物的方法中引起的潜在干扰特别有用。发明概述本文报道了特异性结合式i化合物的单克隆抗体,(式i)其特征在于它还与生物素结合,其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且其中r选自h、oh、cooh、nh2、叠氮基、马来酰亚胺基和z,其中z是a或b,其中a是m-l,其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是连接x和m的接头,且其中b是其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合。进一步报道了用于测量样品中的分析物的方法,其中(链霉)抗生物素蛋白/生物素结合对用于将生物素化的分析物特异性结合剂结合到(链霉)抗生物素蛋白包被的固相上,所述方法包括向样品添加(a)本文报道的抗体,(b)生物素化的分析物特异性结合剂,(c)(链霉)抗生物素蛋白包被的固相,后面是测量通过(链霉)抗生物素蛋白和生物素化的分析物特异性结合剂与固相结合的分析物。进一步报道了用于测量样品中的分析物的方法,其中(链霉)抗生物素蛋白/生物素结合对用于将生物素化的分析物特异性结合剂结合到标记上,所述方法包括向样品添加(a)本文报道的抗体,(b)生物素化的分析物特异性结合剂,(c)与标记结合的(链霉)抗生物素蛋白,后面是分离包含分析物、生物素化的分析物特异性结合剂和标记的链霉抗生物素蛋白的复合体,并测定与分析物结合的标记的量。进一步报道了本文报道的抗体在用于测量样品中分析物的方法中的用途,其中(链霉)抗生物素蛋白/生物素对用于将生物素化的分析物特异性结合剂结合至(链霉)抗生物素蛋白包被的固相或标记的(链霉)抗生物素蛋白。进一步报道了免疫测定测试试剂盒,其至少包括(a)本文公开的抗体,(b)生物素化的分析物特异性结合剂,和(c)(链霉)抗生物素蛋白包被的固相或标记的(链霉)抗生物素蛋白。进一步报道了根据式i的免疫原(式i)其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且其中r选自h、oh、cooh、nh2、叠氮基、马来酰亚胺基和z,其中z是a或b,其中a是m-l,其中m是多肽,且l是连接x和m的接头,且其中b是其中m是多肽,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合。进一步报道了用于产生本文公开的抗体的方法,所述方法包括以下步骤:(a)用本文公开的免疫原免疫实验动物,从而诱导产生与所述免疫原结合的抗体的b-细胞,(b)或者通过杂交瘤技术或者通过b-细胞pcr技术,获得步骤(a)由b-细胞产生的结合所述免疫原的单克隆抗体,(c)进一步选择步骤(b)的抗体与生物素的结合,从而获得本文公开的抗体。进一步报道了用于产生本文公开的抗体的方法,所述方法包括以下步骤:a)用本文公开的免疫原免疫实验动物,从而诱导产生与所述免疫原结合的抗体的b-细胞,b)或者通过杂交瘤技术或者通过b-细胞pcr技术,获得步骤(a)由b-细胞产生的结合所述免疫原的单克隆抗体,c)选择步骤(b)的抗体与生物素的结合,和d)选择那些不与式ii化合物结合的抗体,(式ii)从而获得本文公开的抗体。发明详述在一个实施方案中,本发明涉及与式i化合物特异性结合的单克隆抗体,(式i)其特征在于它还与生物素结合,其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且r选自h、oh、cooh、nh2、叠氮基、马来酰亚胺基和z,其中z是a或b,其中a是m-l,其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是连接x和m的接头,且其中b是其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合。令人惊讶的是,已经发现基于本文公开的材料和方法可以可靠地产生与式i结构(其在下文进一步更详细地描述)和生物素两者结合的单克隆抗体,其也在下文进一步更详细地举例说明。对本公开内容来说,在本文提及的所有方面和实施方案中,术语“(链霉)抗生物素蛋白”和抗生物素蛋白型蛋白质可以互换使用。抗生物素蛋白型蛋白质通常被理解为具有至少一个结合口袋的蛋白质,所述结合口袋能够特异性结合生物素的杂环结构,所述生物素的杂环结构由与四氢噻吩环稠合的脲基环代表。凭借着这种性质,抗生物素蛋白型蛋白质能够与生物素化的靶分子结合,其中生物素通过生物素的戊酸侧链的羧基官能的碳原子与所述分子共价结合。抗生物素蛋白型蛋白质的几个实施方案是本领域已知的。更具体地,抗生物素蛋白型蛋白质可选自抗生物素蛋白,中性抗生物素蛋白(neutravidin),链霉抗生物素蛋白,bradavidin,traptavidin,其生物素结合变体,其混合物,其单体、二聚体、三聚体、四聚体或多聚体,其缀合的形式和与常规生物素化的感兴趣的分子结合的抗体。已知在它们天然存在的形式中,许多抗生物素蛋白型蛋白质(尤其是那些不是抗体的蛋白质),特别是抗生物素蛋白和链霉抗生物素蛋白,是同型四聚体;即,它们由四个相同的亚基组成。在单体抗生物素蛋白型蛋白质的变体的实施方案中,天然存在的形式可以是二-三-或四-寡聚体,其中每个单体都具有生物素结合口袋。在实施方案中,抗生物素蛋白型蛋白质选自单体、同型二聚体、同型三聚体和同型四聚体。同样更具体地,抗生物素蛋白型蛋白质可以是具有抗原结合口袋的抗体,所述抗原结合口袋能够特异性结合生物素的杂环结构,所述生物素的杂环结构由与四氢噻吩环稠合的脲基环代表。具有这种性质的抗体的实例在现有技术中是已知的并且在上文引用。在甚至更具体的实施方案中,如果抗生物素蛋白型蛋白质特异性结合图3a中结构(式ii)的生物素部分,则可以鉴定所述抗生物素蛋白型蛋白质。尽管抗生物素蛋白型蛋白质可能能够结合游离生物素,但重要的是抗生物素蛋白型蛋白质不能特异性结合图2c中的结构(式iiia),其描述了适合于产生本发明的单克隆抗体的免疫原。更具体地,抗生物素蛋白型蛋白质不特异性结合图3c中的结构(式iiic),其描述了可用于鉴定本发明的单克隆抗体的半抗原偶联的筛选剂。甚至更具体地,抗生物素蛋白型蛋白质不特异性结合图3b中的结构(式iiib),其描述了用于鉴定特异性结合生物素“尾”方面的单克隆抗体的另一种半抗原偶联的筛选剂。在一个实施方案中,根据本公开内容的(链霉)抗生物素蛋白选自抗生物素蛋白、中性抗生物素蛋白、链霉抗生物素蛋白,bradavidin、traptavidin、其生物素结合变体及其混合物。当提及本公开内容中的“(链霉)抗生物素蛋白”或抗生物素蛋白型蛋白质时,应理解这些术语同等地包括其任何变体,但须所述变体能够以至少一个结合口袋非共价地结合生物素,所述结合口袋能够与生物素的杂环结构特异性结合,所述生物素的杂环结构由与四氢噻吩环稠合的脲基环代表。在这方面,变体是“功能等同的多肽”,这是因为形成至少一个结合口袋的氨基酸具有与在考虑中的原始抗生物素蛋白型蛋白质的氨基酸序列相似的静电和立体化学属性,其中变体包含氨基酸的一个或多个保守氨基酸取代、类似氨基酸取代和/或缺失和/或添加,其不显著影响或改变结合口袋的氨基酸的功能。“功能等同”还包括相对于各自参考的氨基酸序列的同源氨基酸序列。“保守取代”适用于氨基酸和核酸序列两者。关于特定的核酸序列,“保守取代的”是指那些编码相同或基本相同的氨基酸序列的核酸,或者在核酸不编码氨基酸序列的场合,是指基本上相同的序列。由于遗传密码的简并性,大量功能相同的核酸编码任何给定的蛋白质。例如,密码子gca、gcc、gcg和gcu都编码氨基酸丙氨酸。因此,在由密码子确定丙氨酸的每个位置,密码子可以在不改变编码的多肽的情况下改变为所述的相应密码子的任何一个。这种核酸变异是“沉默变异”,其是保守修饰的变异的一种。本文中编码多肽的每个核酸序列也描述了所述核酸的每种可能的沉默变异。本领域普通技术人员将认识到核酸中的每个密码子(除了通常是甲硫氨酸的唯一密码子的aug和通常是色氨酸的唯一密码子的tgg之外)都可以被修饰以产生功能相同的分子。因此,编码多肽的核酸的每个沉默变异都隐含在每个所描述的序列中。关于氨基酸序列,本领域普通技术人员将认识到,在改变导致氨基酸被化学上相似的氨基酸取代的场合,肽、多肽或蛋白质序列中改变氨基酸序列中的单个氨基酸或小百分比的氨基酸的个别取代是“保守取代”。提供功能相似的氨基酸的保守取代表是本领域普通技术人员已知的。提供功能相似的氨基酸的保守取代表是本领域普通技术人员已知的。以下八组各含有相互为保守取代的氨基酸:术语“保守氨基酸取代”是指所有这样的取代,其中取代的氨基酸具有与参考序列中的相应氨基酸相似的结构或化学性质。举例来说,保守氨基酸取代涉及一种脂族或疏水氨基酸(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸或色氨酸)用另一种的取代;一种含羟基的氨基酸(例如,丝氨酸和苏氨酸)用另一种的取代;一种酸性残基(例如,谷氨酸或天冬氨酸)用另一种的取代;一种含酰胺的残基(例如,天冬酰胺和谷氨酰胺)用另一种的置换;一种芳族残基(例如,苯丙氨酸和酪氨酸)用另一种的置换;一种碱性残基(例如,赖氨酸、精氨酸和组氨酸)用另一种的置换;以及一种小氨基酸(例如,丙氨酸、丝氨酸、苏氨酸和甘氨酸)用另一种的置换。如本文所用的,关于氨基酸序列的“缺失”和“添加”是指向氨基末端、羧基末端、氨基酸序列内部或其组合缺失或添加一个或多个氨基酸,例如,添加可以是向本申请的抗体主题之一。如本文所用的,“同源序列”具有与相应的参考序列至少70%、至少80%、至少90%、至少95%或至少99%同源的氨基酸序列。至少90%相同的序列每参考序列的10个氨基酸具有不多于1个改变,即,缺失、添加或取代的任何组合。通过使用例如dnastartm程序中的megaligntm项目比较变体的氨基酸序列与参考序列来确定百分比同源性。在两个或更多个核酸或多肽序列的上下文中,术语“相同”或百分比“同一性”是指两个或更多个相同的序列或子序列(subsequence)。当在如使用以下序列比较算法之一(或者本领域普通技术人员可用的其他算法)或通过手工比对和目测检查所测量的比较窗口或者指定区域上在最大对应方面进行比较和比对时,如果序列具有一定百分比的相同氨基酸残基或核苷酸,则所述序列为“基本相同的”(即,在指定区域上约60%同一性、约65%、约70%、约75%、约80%、约85%、约90%或约95%同一性)。这个定义还涉及测试序列的互补物(complement)。该同一性可以存在于长度至少约50个氨基酸或核苷酸的区域上,或长度为75-100个氨基酸或核苷酸的区域上,或者在未指定的场合,存在于遍及多核苷酸或多肽的整个序列。编码本公开内容多肽的多核苷酸,包括来自除人以外的物种的同源物,可以通过包括以下步骤的方法获得:在严格杂交条件下用具有本公开内容的多核苷酸序列的标记的探针或其片段筛选文库,和分离含有所述多核苷酸序列的全长cdna和基因组克隆。这种杂交技术是本领域技术人员众所周知的。对于序列比较,一般一个序列充当参考序列,测试序列与其进行比较。当使用序列比较算法时,将测试和参考序列输入计算机,如果需要的话,指定子序列坐标,并指定序列算法程序参数。可以使用默认程序参数,或可以指定备择参数。然后,序列比较算法基于程序参数计算测试序列相对于参考序列的百分比序列同一性。对本公开内容来说,应理解术语“生物素”或“游离生物素”可互换使用并表示天然存在的化合物,即,d(+)-生物素。生物素(d(+)-生物素;c10h16n2o3s;mw=244.31g/mol;iupac名称:5-[(3as,4s,6ar)-2-氧代-1,3,3a,4,6,6a-六氢噻吩并[3,4-d]咪唑-4-基]戊酸),cas登记号58-85-5包含与四氢噻吩环稠合的脲基环,和与四氢噻吩环的碳原子之一附着的戊酸取代基。生物素的基本结构很久以来就是已知的,且例如由melvilled.b.等人(j.biol.chem.146(1942)487-492)报道。生物素具有三个连续的手性碳原子,且因此四种非对映异构的外消旋形式是可能的。在非对映异构的外消旋形式中,仅d(+)-生物素在自然界中存在,而其他异构体是合成来源的。生物活性形式是图1a和图1b中所示的(3as,4s,6ar)构型。根据marqueta.(pure&appl.chem.49(1977)183-196),在d(+)-生物素的晶体结构中,脲基环是平面的,而四氢噻吩环具有信封构象,如图1b所示。戊酸侧链没有完全伸直而是扭转的,并且在侧链的c6原子与脲基环的n'3原子之间存在相互作用;据报道,该相互作用对生物素的反应性有影响。如glaselj.a.(biochemistry5(1966)1851-1855)和lettr.&marqueta./tetrahedron30(1974)3365-3377)报道的nmr研究所示的,在溶液中也报道了四氢噻吩环的信封构象。术语“生物素部分”用于指分子的生物素相关部分或生物素衍生部分,如例如,通过任何类型的生物素化或化学偶联获得的。通过戊酸侧链的羧基官能的碳原子将生物素附着到感兴趣的分子上的适当化学基团被称为“生物素化”或“常规生物素化”。因此,“生物素化的”感兴趣的分子的生物素残基具有面向外部的环结构(即,与四氢噻吩环稠合的脲基环),而生物素残基的线性部分面向内部,朝向生物素化的分子的表面。面向外部的环结构可以被抗生物素蛋白型蛋白质结合。因此,重要的是生物素的杂环结构需要被暴露以通过抗生物素蛋白型蛋白质特异性结合。torregiania.和finig.biospectroscopy4(1998)197-208报道了二氨基生物素与链霉抗生物素蛋白的相互作用。术语“(链霉)抗生物素蛋白/生物素结合对”是本领域技术人员完全已知的。它指出了这样的事实,即,一方面的生物素(包括生物素化的分子的生物素部分)和另一方面的(链霉)抗生物素蛋白代表这个结合对的两个成员。如上文所述的,该结合对由于具有非共价相互作用已知的最高结合亲和力之一是引人注意的。本文使用的冠词“一个(a)”和“一种(an)”是指该冠词的一个或多于一个(即,至少一个)语法对象。举例来说,“抗体”意指一种抗体或多于一种抗体。术语“抗体”包括各种形式的抗体结构,包括但不限于完整抗体和抗体片段。根据本发明的抗体优选是山羊、绵羊、小鼠、兔或大鼠抗体,嵌合抗体或进一步的基因工程抗体,只要保留根据本发明的特征性质。“抗体片段”包含全长抗体的一部分,优选其可变结构域,或至少其抗原结合部位。抗体片段的实例包括双抗体、单链抗体分子和由抗体片段形成的多特异性抗体。scfv抗体例如描述于huston,j.s.,methodsinenzymol.203(1991)46-88。此外,抗体片段包括单链多肽,其具有vh结构域的特征,即能够与vl结构域一起组装,或具有与igf-1结合的vl结构域的特征,即能够与vh结构域一起组装成功能性抗原结合部位,且从而提供根据本发明的抗体的性质。如本文所用的术语“单克隆抗体”或“单克隆抗体组合物”是指单一氨基酸组成的抗体分子的制剂。术语“特异性结合剂”用于表示使用能够特异性结合感兴趣的分析物或被感兴趣的分析物特异性结合的试剂。用于免疫测定的许多不同测定配置是本领域已知的。取决于特定的测定配置,可以使用各种生物素化的特异性结合剂。在一个实施方案中,生物素化的特异性结合剂选自生物素化的分析物特异性结合剂、与固相结合的生物素化的分析物和与固相结合的生物素化的抗原。术语“分析物特异性结合剂”是指特异性结合感兴趣的分析物的分子。在本公开内容意义上的分析物特异性结合剂一般包括能够结合分析物(其他术语感兴趣的分析物;靶分子)的结合或捕获分子。在一个实施方案中,分析物特异性结合剂对其相应的靶分子即分析物具有至少107l/mol的亲和力。在其他实施方案中,分析物特异性结合剂对其靶分子具有108l/mol或甚至109l/mol的亲和力。如本领域技术人员将理解的,术语特异性用于表示样品中存在的其他生物分子不显著结合对分析物特异的结合剂。在一些实施方案中,与除靶分子之外的生物分子的结合水平导致的结合亲和力仅为靶分子亲和力的10%、更优选仅为5%或更低。在一个实施方案中,除对分析物之外,没有对其他分子的结合亲和力是可测量的。在一个实施方案中,分析物特异性结合剂将满足上述关于亲和力以及关于特异性的最低标准。在抗体的上下文中使用的术语“分析物特异性结合”是指抗体与其在分析物上的靶表位的免疫专一相互作用,即,抗体与分析物上的表位的结合。抗体通过其在分析物上的表位的分析物特异性结合的概念对于本领域技术人员来说是完全清楚的。术语“多肽”、“肽”和“蛋白质”是指氨基酸残基的聚合物。该术语适用于天然存在的氨基酸聚合物以及其中一个或多个氨基酸残基是非天然编码的氨基酸的氨基酸聚合物。如本文所用的,该术语包括氨基酸链,其中氨基酸残基通过共价肽键连接。多肽、肽和蛋白质使用标准序列符号书写,其中氮末端位于左侧,且羧基末端位于右侧。标准单字母符号已使用如下:a-丙氨酸、c-半胱氨酸、d-天冬氨酸、e-谷氨酸、f-苯丙氨酸、g-甘氨酸、h-组氨酸、s-异亮氨酸、k-赖氨酸、l-亮氨酸、m-甲硫氨酸、n-天冬酰胺、p-脯氨酸、q-谷氨酰胺、r-精氨酸、s-丝氨酸、t-苏氨酸、v-缬氨酸、w-色氨酸、y-酪氨酸。如本文所用的术语“肽”是指氨基酸聚合物,其具有最多到5个氨基酸的长度。如本文所用的术语“多肽”是指氨基酸的聚合物,其具有6个或更多个氨基酸的长度。术语“蛋白质”表示多肽链或具有进一步修饰的多肽链,例如糖基化、磷酸化、乙酰化或其他翻译后修饰。“半抗原”是小分子(例如,杀虫剂、杀真菌剂、药物、激素、毒素、合成肽等),其不直接诱导免疫应答,例如抗体的形成。已经确立了通过将半抗原与免疫原性载体(例如抗原性大分子)缀合来产生针对其的抗体的技术。对本公开内容来说,半抗原被理解为是低分子量分子,特别是具有10,000da或更低的分子量,其直到并且除非与免疫原性载体如蛋白质缀合,否则不引起免疫应答。一旦形成抗体,它就可以与半抗原结合。由此产生的抗体可用于许多领域,特别是在免疫诊断试剂盒或生物传感器的开发中。因此,术语“半抗原”表示10,000da或更小的小分子,其仅在与免疫原性载体(例如至少30个氨基酸的多肽)附着时才可引起免疫应答。在这个意义上,并且在实施方案中,半抗原是不完全的抗原,其独自不能促进抗体形成,但是当与至少30个氨基酸的蛋白质缀合时可以这样做。示例性的半抗原是苯胺、邻-、间-和对-氨基苯甲酸、醌、组胺-琥珀酰-甘氨酸(hsg)、肼苯哒嗪(hydralazine)、卤烷、铟-dtpa、荧光素、洋地黄毒苷、茶碱、溴脱氧尿苷、类固醇化合物和二硝基苯酚。在具体实施方案中,半抗原不是生物素并且不含有生物素部分。在一个具体实施方案中,半抗原是洋地黄毒苷或茶碱或荧光素或溴脱氧尿苷。在根据式i的化合物的公开内容上下文中的半抗原,作为化合物的部分的半抗原被理解为与化合物的剩余部分共价偶联,其中半抗原部分(即,10,000da或更低的化学结构)仅当附着于免疫原性载体如至少30个氨基酸的多肽时才能够引起免疫应答。“分离的”抗体是已经从其天然环境的组分中鉴定和分离和/或回收的抗体。其天然环境的污染组分是将与抗体的研究、诊断或治疗用途相干扰的材料,并且可能包括酶、激素和其他蛋白质或非蛋白质溶质。在一些实施方案中,如使用例如考马斯蓝或银染料,在还原或非还原条件下通过sds-page测定的,将抗体纯化至大于95重量%的抗体,并且在一些实施方案中,至大于99%。免疫球蛋白g类别的抗体通常是约150,000道尔顿的异四聚体糖蛋白,由两条相同的轻(l)链和两条相同的重(h)链组成。每条轻链通过一个共价二硫键与重链连接,而二硫键的数目在不同免疫球蛋白同种型的重链中有变化。每条重链和轻链也具有规则间隔的链内二硫键。每条重链在一端具有可变结构域(vh),后面是许多恒定结构域。每条轻链在一端具有可变结构域(vl),且在其另一端具有恒定结构域;轻链的恒定结构域与重链的第一恒定结构域对准,并且轻链可变结构域与重链的可变结构域对准。认为特定的氨基酸残基形成在轻链和重链可变结构域之间的界面。抗体的“可变区”或“可变结构域”是指抗体重链或轻链的氨基末端结构域。重链的可变结构域可称为“vh”。轻链的可变结构域可称为“vl”。这些结构域通常是抗体中最可变的部分并含有抗原结合部位。术语“可变”是指可变结构域的某些部分在抗体中的序列差异巨大,并且用于每种特定抗体对其特定抗原的结合和特异性的事实。然而,变异性不是均匀地分布在抗体的整个可变结构域中的。它集中在轻链和重链可变结构域两者中称为高变区(hvrs)的三个区段中。可变结构域的更高度保守的部分称为构架区(fr)。天然重链和轻链的可变结构域各自包含四个fr区,主要采取β片层构型,通过三个hvrs连接,其形成连接β片层结构的环,并且在一些情况下形成β片层结构的一部分。每个链中的hvrs通过fr区域紧靠着保持在一起,并且与来自另一条链的hvrs一起有助于形成抗体的抗原结合部位(参见kabat等人,sequencesofproteinsofimmunologicalinterest,第5版,nationalinstituteofhealth,bethesda,md(1991))。恒定结构域不直接与抗体与抗原的结合有关,但表现出各种效应子功能,例如抗体参与抗体依赖性细胞毒作用。来自任何脊椎动物物种的抗体(免疫球蛋白)的“轻链”都可以基于其恒定结构域的氨基酸序列被分配为两种明显不同的类型之一,称为κ(κ)和λ(λ)。在根据本发明的方法中使用的抗体可以来自任何动物来源。在一个实施方案中,抗体是人、鼠(例如,小鼠和大鼠)、驴、猴、兔、山羊、豚鼠、骆驼、马或鸡抗体。依赖于其重链恒定结构域的氨基酸序列,可以将抗体(免疫球蛋白)分配到不同的类别。人免疫球蛋白有五个主要类别:iga、igd、ige、igg和igm,且这些中的几个可以进一步分为亚类(同种型),例如,igg1、igg2、igg3、igg4、iga1和iga2。对应于不同免疫球蛋白类别的重链恒定结构域分别称为α、δ、ε、γ和μ。不同类别的免疫球蛋白的亚基结构和三维构型是众所周知的,并且通常在例如abbas等人cellularandmol.immunology,第4版(w.b.saunders,co.,2000)中描述。抗体可以是通过抗体与一种或多种其他蛋白质或肽的共价或非共价缔合形成的较大融合分子的一部分。术语“全长抗体”、“完整抗体”和“全抗体”在本文中可互换使用,以指基本上完整形式的抗体,而不是如下定义的抗体片段。该术语特别指具有含有fc区的重链的抗体。“抗体片段”包含完整抗体的一部分,优选包含其抗原结合区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;单链抗体分子;scfv、sc(fv)2;双抗体;和由抗体片段形成的多特异性抗体。抗体的木瓜蛋白酶消化产生两个相同的抗原结合片段,称为“fab”片段,每个片段都具有单个抗原结合部位,和残留的“fc”片段,其名称反映了其易于结晶的能力。胃蛋白酶处理产生f(ab')2片段,其具有两个抗原结合部位并且仍然能够交联抗原。fab片段含有重链和轻链可变结构域,并且还含有轻链的恒定结构域和重链的第一恒定结构域(ch1)。fab'片段与fab片段的不同之处在于在重链ch1结构域的羧基末端添加了少数残基,包括来自抗体-铰链区的一个或多个半胱氨酸。fab'-sh是本文中fab'的名称,其中恒定结构域的一个或多个半胱氨酸残基带有游离硫醇基。f(ab')2抗体片段最初是作为fab'片段对产生的,其在它们之间具有铰链半胱氨酸。抗体片段的其他化学偶联也是已知的。“fv”是含有完整抗原结合部位的最小抗体片段。在一个实施方案中,双链fv种类由处于紧密,非共价缔合的一个重链和一个轻链可变结构域的二聚体组成。在单链fv(scfv)种类中,一个重链和一个轻链可变结构域可以通过柔性肽接头共价连接,从而使得轻链和重链可以缔合于类似于双链fv种类(sc(fv)2)中的“二聚体”结构中。在这个构型中,每个可变结构域的三个hvrs才相互作用以在vh-vl二聚体的表面上限定抗原结合部位。总起来说,六种hvrs赋予抗体抗原结合特异性。然而,即使单个可变结构域(或仅包含三个对抗原特异的hvrs的fv的一半)也具有识别和结合抗原的能力,尽管其亲和力低于整个结合部位。本公开内容包括单价fab片段和单链fv,其衍生自能够特异性结合游离生物素的单克隆抗体,如本文所公开的。与天然存在的抗体形式相比,单价种类由于其较小的分子量可以在水溶液中更快地扩散。另一方面是在合适的条件下,特别是scfv抗体可以在原核表达系统中重组产生。术语“双抗体”是指具有两个抗原结合部位的抗体片段,该片段包含与同一多肽链中的轻链可变结构域(vl)连接的重链可变结构域(vh)(vh-vl)。通过使用太短以致于不允许同一链上的两个结构域之间配对的接头,该结构域被迫与另一条链的互补结构域配对并产生两个抗原结合部位。双抗体可以是二价的或双特异性的。双抗体更充分地描述于例如ep404097;wo1993/01161;hudson等人,nat.med.9:129-134(2003);和holliger等人,pnasusa90:6444-6448(1993)。三链抗体和四链抗体也描述于hudson等人,nat.med.9:129-134(2003)。如本文所用的术语“单克隆抗体”是指从基本上均质的抗体群体获得的抗体,即,除了可能以少量存在的可能突变(例如天然存在的突变)之外,构成群体的个别抗体是相同的。因此,修饰语“单克隆”表示抗体不是离散抗体的混合物的特征。在某些实施方案中,这种单克隆抗体一般包括包含结合靶的多肽序列的抗体,其中所述靶结合性多肽序列通过包括从多个多肽序列中选择单个靶结合性多肽序列的方法获得。例如,选择方法可以是从多个克隆中选择独特的克隆,例如杂交瘤克隆、噬菌体克隆或重组dna克隆的库。应当理解,可以进一步改变选择的靶结合性序列,例如,以提高对靶的亲和力、以使靶结合性序列人源化、以改善其在细胞培养物中的产生、以降低其在体内的免疫原性、以产生多特异性抗体等,且包含改变的靶结合性序列的抗体也是本发明的单克隆抗体。与一般包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂的每种单克隆抗体针对抗原上的单一决定簇。除了它们的特异性外,单克隆抗体制剂由于它们一般不被其他免疫球蛋白污染而是有利的。修饰语“单克隆”表示抗体从基本上均质的抗体群体获得的特征,并且不应解释为需要通过任何特定方法产生抗体。例如,根据本发明使用的单克隆抗体可以通过多种技术制备,包括,例如,杂交瘤方法(例如,kohler和milstein.,nature,256:495-97(1975);hongo等人,hybridoma,14(3):253-260(1995),harlow等人,antibodies:alaboratorymanual,(coldspringharborlaboratorypress,2nded.1988);haemmerling等人,monoclonalantibodiesandt-cellhybridomas563-681(elsevier,n.y.,1981))、重组dna方法(参见,例如,美国专利no.4,816,567)、噬菌体展示技术(参见,例如,clackson等人,nature,352:624-628(1991);marks等人,j.mol.biol.222:581-597(1992);sidhu等人,j.mol.biol.338(2):299-310(2004);lee等人,j.mol.biol.340(5):1073-1093(2004);fellouse,pnasusa101(34):12467-12472(2004);和lee等人,j.immunol.methods284(1-2):119-132(2004),以及在具有部分或全部人免疫球蛋白基因座或编码人免疫球蛋白序列的基因的动物中生产人或人样抗体的技术(参见,例如,wo1998/24893;wo1996/34096;wo1996/33735;wo1991/10741;jakobovits等人,pnasusa90:2551(1993);jakobovits等人,nature362:255-258(1993);bruggemann等人,yearinimmunol.7:33(1993);美国专利nos.5,545,807;5,545,806;5,569,825;5,625,126;5,633,425;和5,661,016;marks等人,bio/technology10:779-783(1992);lonberg等人,nature368:856-859(1994);morrison,nature368:812-813(1994);fishwild等人,naturebiotechnol.14:845-851(1996);neuberger,naturebiotechnol.14:826(1996);和lonberg和huszar,intern.rev.immunol.13:65-93(1995)。本文中的单克隆抗体特别包括“嵌合”抗体,其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而一条或多条链的剩余部分与衍生自另一个物种或属于另一个抗体类别或亚类的抗体中的相应序列相同或同源,以及这种抗体的片段,只要它们表现出所期望的生物活性(例如,美国专利no.4,816,567和morrison等人,pnasusa81:6851-6855(1984))。嵌合抗体包括primatized®抗体,其中抗体的抗原结合区衍生自通过例如用感兴趣的抗原免疫猕猴产生的抗体。当在本文中使用时,术语“高变区”、“hvr”或“hv”是指抗体可变结构域的区域,其在序列中是高变的和/或形成结构上确定的环。通常,抗体包含六个hvrs;vh中的三个(h1、h2、h3)和vl中的三个(l1、l2、l3)。在天然抗体中,h3和l3显示出六种hvrs的最多样性,且特别是h3被认为在赋予抗体精细特异性方面起独特作用。参见,例如,xu等人immunity13:37-45(2000);johnson和wumethodsinmolecularbiology248:1-25(lo,ed.,humanpress,totowa,nj,2003)。实际上,仅由重链组成的天然存在的骆驼科动物抗体在没有轻链的情况下也是功能性的和稳定的。参见,例如,hamers-casterman等人,nature363:446-448(1993)和sheriff等人,naturestruct.biol.3:733-736(1996)。许多hvr描述正在使用中并且包含在本文中。作为kabat互补性决定区(cdrs)的hvrs基于序列变异性并且是最常用的(kabat等人,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md(1991))。chothia代之以指的是结构环的位置(chothia和leskj.mol.biol.196:901-917(1987))。abmhvrs代表kabatcdrs和chothia结构环之间的折衷,并且由oxfordmolecular的abm抗体建模软件使用。“接触”hvrs基于对可用的复杂晶体结构的分析。来自这些hvrs中的每一个的残基记录如下。hvrs可以包括如下的“扩展的hvrs”:vl中的24-36或24-34(l1)、46-56或50-56(l2)和89-97或89-96(l3),以及vh中的26-35(h1)、50-65或49-65(h2)和93-102、94-102或95-102(h3)。对于这些扩展的hvr定义中的每一个,可变结构域残基根据见上kabat等人编号。表述“如kabat中的可变结构域残基编号”或“如kabat中的氨基酸位置编号”及其变化形式,是指见上kabat等人中用于抗体汇编的重链可变结构域或轻链可变结构域的编号系统。使用这个编号系统,实际的线性氨基酸序列可含有对应于可变结构域的fr或hvr的缩短或插入的较少或额外的氨基酸。例如,重链可变结构域可包含在h2的残基52之后的单个氨基酸插入(根据kabat的残基52a)和在重链fr残基82之后插入的残基(例如,根据kabat的残基82a、82b和82c等)。通过在抗体序列与“标准”kabat编号的序列的同源性区域比对,可以确定给定抗体的残基的kabat编号。术语“实验动物”表示非人动物。在一个实施方案中,实验动物选自大鼠、小鼠、仓鼠、兔、骆驼、美洲驼、非人灵长类动物、羊、狗、牛、鸡、两栖动物、鲨鱼和爬行动物。在一个实施方案中,实验动物是兔。本公开内容基于衍生化的二氨基生物素(cas登记号22342-46-7),与(2s,3s,4r)-顺-5-(3,4-二氨基四氢-2-噻吩基)戊酸,顺-3,4-二氨基-2-四氢噻吩戊酸同义。如本文所报道的二氨基生物素在对应于生物素的杂环环结构的n'1和n'3位的两个氮原子衍生化。特别是由于在n'1原子的较大取代基,但是也因为在n'3氮原子的较小取代基,如本文所报道的任何根据式i的分子都与(链霉)抗生物素蛋白的结合口袋不相容。由于几个原因,在二生物素衍生物的情况下不能发生本领域已知的对于生物素杂环结构的必不可少的紧密相互作用。这些包括脲基环不像生物素中那样存在,并且二氨基生物素的两个氨基都带有取代基,从而在空间上阻碍根据式i的衍生化二氨基生物素进入抗生物素蛋白型蛋白质的生物素结合口袋。假设一旦根据式i的化合物用作免疫原,这个结构就也防止形成与常规生物素化的感兴趣的分子结合的抗体。同时,所述结构仍然保持了生物素的“尾”方面,且假设包含在免疫原中的衍生化二氨基生物素可能适合于产生针对生物素的所期望的单克隆抗体。事实上,在本文公开的所有方面的一个实施方案中,根据本发明的单克隆抗体不结合常规生物素化的分子,即,与生物素缀合的分子,其中生物素部分的戊酸侧链的羧基官能的碳原子与所述分子共价偶联。在具体实施方案中,根据本发明的抗体不结合在图3a中描述的式ii的化合物(式ii)。相反,根据本发明的单克隆抗体结合式i的化合物,其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且其中r选自h、oh、cooh、nh2、叠氮基、马来酰亚胺基和z,其中z包含半抗原。在具体实施方案中,根据本发明的单克隆抗体特异性结合选自在图2c中描述的化合物(式iiia)和在图3c中描述的化合物(式iiic)的化合物。在更具体的实施方案中,单克隆抗体对选自在图2c中描述的化合物(式iiia)和在图3c中描述的化合物(式iiic)的化合物的结合亲和力为对在图3a中描述的式ii化合物(式ii)的结合亲和力的至少50倍。在再另一个更具体的实施方案中,单克隆抗体与选自在图2c中描述的化合物(式iiia)和在图3c中描述的化合物(式iiic)的化合物的结合亲和力为对在图3a中描述的式ii化合物(式ii)的结合亲和力的至少500、至少1,000、至少5,000、至少10,000、至少50,000和至少100,000倍。因此,在本文公开的所有方面的另一个具体实施方案中,单克隆抗体对生物素化的靶分子(包括但不限于在图3a中描述的式ii的示例性化合物)上缀合的生物素的亲和力为对游离生物素的亲和力的选自至多1/50、1/100、1/500、1/1,000、1/5,000和至多1/10,000。换句话说,根据本发明的单克隆抗体对未缀合的(游离的)生物素具有的亲和力为对生物素化的靶分子上缀合的生物素的亲和力的选自至少50、100、500、1,000、5,000和至少10,000倍。令人惊讶的是,根据本发明的单克隆抗体还与在图3b中描述的式iiib化合物结合。作为此处的关键特征,生物素的杂环部分的n'1原子被修饰并带有取代基。因此,因为这个组的抗体能够特异性结合(i)在脲基环的n'1原子被取代的生物素(参见图1a),所以这些单克隆抗体存在交叉反应性。在更具体的实施方案中,单克隆抗体对在图3b中描述的式iiib化合物的结合亲和力为对式ii化合物的结合亲和力的至少50倍。在再另一个更具体的实施方案中,单克隆抗体与式iiib化合物的结合亲和力为对在图3a中描述的式ii化合物的结合亲和力的至少500、至少1,000、至少5,000、至少10,000、至少50,000和至少100,000倍。已经开发了用于检测和定量生物化学和生物样品中感兴趣的分析物的许多方法和系统。能够测量痕量微生物、药物、激素、病毒、抗体、核酸和其他蛋白质的方法和系统对研究人员和临床医生具有重大价值。许多测定方法利用分析物特异性结合剂从样品中捕获感兴趣的具体靶分子,并允许测定所述靶分子。在其他测定中,可以通过固相结合的分析物和样品中的分析物与可检测地标记的分析物特异性结合剂的竞争性结合来检测感兴趣的分析物。在血清学测定中,对抗原例如传染剂的抗体直接或在所谓的双抗原夹心测定中检测。一般,通过附着于一种或多种分析物特异性结合剂的可观察的“标记”的存在或不存在来指示感兴趣的分析物的存在。现在绝大多数免疫测定用种种方法采用固相。通常,测定中使用的至少一种特异性结合剂直接或间接地与固相结合。(链霉)抗生物素蛋白-生物素结合对的特征在于极高的结合亲和力。由于这个原因,(链霉)抗生物素蛋白-生物素结合对广泛用于任何合适的生物素化的特异性结合剂与包被有(链霉)抗生物素蛋白的固相的间接结合。“夹心测定”是一种测定类型,它是最有用和最常用的测定之一。存在夹心测定技术的许多变化形式,并且所有这些变化形式都意图包括在本发明中。简而言之,在典型的正向测定中,将未标记的抗体固定在“固相”上,并使待测样品与结合的分子接触。这个捕获抗体的固定可以通过直接吸附到固相,或间接地,例如通过特异性结合对,例如通过(链霉)抗生物素蛋白-生物素结合对。在足以允许形成抗体-抗原复合体的时间段的适当的温育时间段后,然后添加与抗原结合的,用能够产生可检测信号的报道分子标记的第二抗体,并温育,从而允许时间足以形成抗体-抗原-标记的抗体的夹心复合体。洗去任何未反应的材料,并通过观察由报道分子产生的信号确定分析物的存在。结果可以是定性的,通过简单观察可见信号,或者可以通过与含有已知量的分析物的对照样品比较来定量。对本发明来说,在典型的夹心测定中,第一生物素化的分析物特异性结合剂,例如,生物素化的抗体与固相非共价结合,所述固相用(链霉)抗生物素蛋白包被。固相一般是玻璃或聚合物,最常用的聚合物是纤维素、聚丙烯酰胺、尼龙、聚苯乙烯、聚氯乙烯或聚丙烯。固相可以是管、珠、微量培养板的盘或适合于进行免疫测定的任何其他表面的形式。包被方法是本领域众所周知的,且通常由交联、共价结合或物理吸附组成。通常对(链霉)抗生物素蛋白包被的固相进行处理以阻断非特异性结合,并在其用于测试程序中的准备中进行洗涤。将待测样品的等分试样与第一或捕获抗体和标记的第二抗体接触,并温育达足够的时间段(例如,2-40分钟或过夜,如果更方便的话)且在合适的条件(例如,从室温至40℃,例如25℃至32℃(包括25℃和32℃)),以允许第一或捕获抗体与相应抗原以及抗原与结合抗原上的另一表位的第二抗体之间的结合,从而形成夹心复合体。接着,添加(链霉)抗生物素蛋白包被的固相,并温育达足够的时间段(例如,2-40分钟或过夜,如果更方便的话)且在合适的条件(例如,从室温至40℃,例如25℃至32℃(包括25℃和32℃)),以允许第一或捕获抗体和固相之间的结合。第二抗体与报道分子连接,该报道分子用于指示第二抗体与第一抗体和感兴趣的抗原的复合体的结合。测定的变化形式包括同时测定,其中样品和标记的抗体两者同时添加到结合的抗体或能够通过(链霉)抗生物素蛋白/生物素结合对与固相结合的抗体。这些技术对于本领域技术人员来说是众所周知的,包括将容易显而易见的任何微小的变化形式。在进一步的备择设置中,形成夹心复合体,其中提供第一生物素化的抗体,提供用半抗原标记的第二抗体,并使两种抗体与含有相应抗原的样品接触。在容许形成包含第一和第二抗体以及抗原的夹心的条件下温育时,添加携带标记的(链霉)抗生物素蛋白,并且通过能够特异性结合与第二抗体附着的半抗原的固相捕获复合体。在洗涤步骤后,由固相结合的标记的量表明感兴趣的抗原的存在和量。通常,关于本文的所有方面和实施方案,本公开内容提供了式i的化合物,(式i)其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且其中r选自h、oh、cooh、nh2、叠氮基、马来酰亚胺基和z,其中z是a或b,其中a是m-l,其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是连接x和m的接头,且其中b是其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合。式i结构的第一个关键特征是二氨基生物素部分,在其包含未修饰的、未缀合的戊酸侧链的意义上的生物素类似物,和在生物素中的情况一样。据推测,侧链相对于二氨基生物素部分的四氢噻吩结构的构象不是完全随机的。不受理论约束,这个假设基于与关于生物素的结论的可能类推、生物素的nmr数据以及断定在一方面作为戊酸侧链一部分的c6原子和另一方面n'3原子之间相互作用的以前的解释。因此,到现在为止,未答复的问题是生物素分子的“尾”部分是否实际上适合于被单克隆抗体识别,所述“尾”部分与可由(链霉)抗生物素蛋白结合的杂环“头”部分相对(远离)。更具体地,本公开内容解决了甚至二氨基生物素的“尾”部分是否适合于被单克隆抗体识别,以及它是否可以模仿未缀合的(游离)生物素的“尾”部分的问题。对本报道来说,二氨基生物素的两个氮原子都带有取代基。因此,包含在式i原子中的二氨基生物素部分中的n'3原子是重要的特征,这是因为除了n'1之外,它也是修饰的对象。因此,作为结构单元制备了如本文所提供的衍生化的二氨基生物素,其尤其允许免疫原和用于检测和筛选所期望的抗体的分子的形成。具体地为了这个目的,末端基团r可以选择为z,其中z是a或b,其中a是m-l,其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是连接x和m的接头,且其中b是其中m选自(i)不含生物素部分的半抗原和(ii)多肽,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合。在具体实施方案中,r是叠氮基,其可以在称为“点击(click)”化学的一类反应中用作反应性配偶体。因此,半抗原和生物素衍生物的缀合物可以用具有生物正交(bioorthogonal)官能团的反应基形成。反应基的具体实施方案是叠氮基,利用所述叠氮基可以用炔或膦作为反应配偶体进行“点击”反应(j.c.jewett,c.r.bertozzi,chem.soc.rev.2010,39,1272)。叠氮化物与膦进行斯托丁格(staudinger)反应,叠氮化物与炔进行[3+2]环加成。对本领域技术人员而言,尤其已知环辛炔衍生物用于在温和条件下修饰生物分子(wo2006/050262)。在其中r是z且z是b的具体实施方案中,二氨基生物素部分通过1'n原子的-x取代基与m连接,其中b从炔与作为r的实施方案的叠氮基的[3+2]环加成获得。术语“接头”表示双官能或多官能部分,其可用于将第一部分与第二部分或更多部分缀合(连接)。包含彼此结合的第一和第二部分的缀合物可以使用具有两个反应性官能团(functionalities)的接头方便地制备。在这种缀合物中,两个部分“通过”这个接头结合。如对于技术人员而言显而易见的,在这种缀合物中,接头的官能部分作为键的一部分而不是作为未反应的官能部分存在。如本文所定义的,术语“反应基”或“反应性官能团”是指任何基团,其适合与胺基团反应,优选n-羟基琥珀酰亚胺基团或马来酰亚胺基,以使接头与氨基结合;或者基团,其适合于第二官能团结合,例如用于与sh-基团反应,优选马来酰亚胺基,以使接头与sh-基团结合。在具体实施方案中,异双官能接头选自nhs-马来酰亚胺接头,其基于n-羟基琥珀酰亚胺和马来酰亚胺反应基;琥珀酰亚胺基-(peg)nnhs-peg-马来酰亚胺接头,nhs-卤代乙酰基接头;和nhs-吡啶联硫基接头。在特别优选的实施方案中,异双官能接头是琥珀酰亚胺基-(peg)nnhs-peg-马来酰亚胺接头。在具体实施方案中,l具有1至200个原子的主链长度。换句话说,如果主链长度在1至200个原子之间,则z和r之间的最短连接由1至200个原子组成。在存在环状系统的情况中,在评估接头长度时,取环状系统中最少的原子数目。例如,亚苯基环计算出接头中四个原子的长度。在式i的一个实施方案中,l是具有下述作为主链的接头:直链或支链饱和的,不饱和的,未取代的或取代的c1-c20烷基链,或由碳原子,取代的碳原子和/或一个或多个选自o、n、p和s或取代的n、p、s原子的原子组成的1-200个原子链,或如前所述的链,其中主链含有一个或多个环状或杂环芳族或非芳族环状系统。在式i的一个实施方案中,接头l具有下述作为主链:直链或支链饱和的,不饱和的,未取代的或取代的c1-c100烷基链,或由碳原子,取代的碳原子和/或一个或多个选自o、n、p和s或取代的n、p或s原子的原子组成的1-100个原子链,或如前所述的链,其中主链含有一个或多个环状或杂环芳族或非芳族环状系统。在式i的一个实施方案中,接头l具有下述作为主链:直链或支链饱和的,不饱和的,未取代的或取代的c1-c50烷基链,或由碳原子,取代的碳原子和/或一个或多个选自o、n、p和s或取代的n、p或s原子的原子组成的1-50个原子链,或如前所述的链,其中主链含有一个或多个环状或杂环芳族或非芳族环状系统。在式i的一个进一步的实施方案中,接头l具有下述作为主链:直链或支链饱和的,不饱和的,未取代的或取代的c1-c20烷基链,或由碳原子,取代的碳原子和/或一个或多个选自o、n、p和s或取代的n、p或s原子的原子组成的1-20个原子链,或如前所述的链,其中主链含有一个或多个环状或杂环芳族或非芳族环状系统。在式i的另一个具体实施方案中,l是接头,其在(同)双官能交联剂与通过接头连接的两个部分的每一个上的适当化学基团反应时获得,(同)双官能交联剂由下述例示辛二酸双-(2,5-二氧代-吡咯烷-1-基)酯在式i的另一个具体实施方案中,l是接头,其在(杂)双官能交联剂与通过接头连接的两个部分的每一个上的适当化学基团反应时获得,(杂)双官能交联剂可以选自nhs-马来酰亚胺交联剂,例如,amas(n-α-马来酰亚胺乙酰氧基琥珀酰亚胺酯)bmps(n-β-马来酰亚胺丙基-氧琥珀酰亚胺酯)gmbs(n-γ-马来酰亚胺丁酰氧基琥珀酰亚胺酯)磺基-gmbs(n-γ-马来酰亚胺丁酰氧基磺基琥珀酰亚胺酯)mbs(m-马来酰亚胺苯甲酰-n-羟基琥珀酰亚胺酯)磺基-mbs(m-马来酰亚胺苯甲酰-n-羟基磺基琥珀酰亚胺酯)smcc(4-(n-马来酰亚胺甲基)环己烷-1-甲酸琥珀酰亚胺酯)磺基-smcc(4-(n-马来酰亚胺甲基)环己烷-1-甲酸磺基琥珀酰亚胺酯)emcs(n-ε-马来酰亚胺己酰氧基琥珀酰亚胺酯)磺基-emcs(n-ε-马来酰亚胺己酰氧基磺基琥珀酰亚胺酯)smpb(4-(p-马来酰亚胺苯基)丁酸琥珀酰亚胺酯)磺基-smpb(4-(n-马来酰亚胺苯基)丁酸磺基琥珀酰亚胺酯)smph(6-((β-马来酰亚胺丙酰胺基)己酸琥珀酰亚胺酯)lc-smcc(4-(n-马来酰亚胺甲基)环己烷-1-羧基-(6-氨基己酸)琥珀酰亚胺酯)磺基-kmus(n-κ-马来酰亚胺十一烷酰氧基磺基琥珀酰亚胺酯)琥珀酰亚胺基-(peg)n-马来酰亚胺或nhs-peg-马来酰亚胺交联剂,例如,sm(peg)2(加入聚乙二醇的smcc交联剂)nhs-pegn-马来酰亚胺琥珀酰亚胺基-([n-马来酰亚胺丙酰胺基]-二-乙二醇)酯sm(peg)4(加入聚乙二醇的smcc交联剂)nhs-pegn-马来酰亚胺琥珀酰亚胺基-([n-马来酰亚胺丙酰胺基]-四-乙二醇)酯sm(peg)6(加入聚乙二醇的、长链smcc交联剂)nhs-pegn-马来酰亚胺琥珀酰亚胺基-([n-马来酰亚胺丙酰胺基]-六-乙二醇)酯sm(peg)8(加入聚乙二醇的、长链smcc交联剂)nhs-pegn-马来酰亚胺琥珀酰亚胺基-([n-马来酰亚胺丙酰胺基]-八-乙二醇)酯sm(peg)12(加入聚乙二醇的、长链smcc交联剂)nhs-pegn-马来酰亚胺琥珀酰亚胺基-([n-马来酰亚胺丙酰胺基]-十二-乙二醇)酯sm(peg)24(加入聚乙二醇的、长链smcc交联剂)nhs-pegn-马来酰亚胺琥珀酰亚胺基-([n-马来酰亚胺丙酰胺基]-二十四-乙二醇)酯nhs-卤代乙酰基交联剂,例如,sia(碘乙酸琥珀酰亚胺酯)sbap(3-(溴乙酰胺基)丙酸琥珀酰亚胺酯)siab((4-碘乙酰基)氨基苯甲酸琥珀酰亚胺酯)磺基-siab((4-碘乙酰基)氨基苯甲酸磺基琥珀酰亚胺酯)和nhs-吡啶联硫基交联剂,例如spdp3-(2-吡啶联硫基)丙酸琥珀酰亚胺酯lc-spdp6-[3(2-吡啶联硫基)丙酰胺基]己酸琥珀酰亚胺酯磺基-lc-spdp(6-(3'-(2-吡啶联硫基)丙酰胺基)己酸磺基琥珀酰亚胺酯)smpt(4-琥珀酰亚胺氧羰基-α-甲基-α(吡啶联硫基)甲苯)peg4-spdp(加入聚乙二醇的、长链spdp交联剂)peg12-spdp(加入聚乙二醇的、长链spdp交联剂)和α-[3-(o-吡啶二硫基)丙酰胺基]-ω-(丙酸琥珀酰亚胺酯)十六(乙二醇)在式i的实施方案中,r是a或b,且a是m-l,且b包含m-l,其中m是多肽。因此,本文的原始公开内容和本发明的另一个一般方面(其也与本文公开的所有其他方面和实施方案相关)是根据式i的免疫原,(式i)其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且其中a是m-l,其中m是至少30个氨基酸的多肽,且优选为匙孔䗩血蓝蛋白,且l是连接x和m的接头,且其中b是其中m是至少30个氨基酸的多肽,且优选为匙孔䗩血蓝蛋白,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合。重要的是,多肽能够引起对衍生化的二氨基生物素部分的免疫应答,而单独的二氨基生物素的免疫原性低。在实施方案中,多肽选自大鼠、兔、小鼠、猪或牛血清清蛋白,牛或猪甲状腺球蛋白,卵清蛋白,破伤风类毒素,明胶,大豆胰蛋白酶抑制剂,匙孔䗩血蓝蛋白和类似物质。在具体实施方案中,多肽是匙孔䗩血蓝蛋白(klh)。在一个实施方案中,与所有其他方面和实施方案相关的本公开内容还提供了制备特异性结合根据本公开内容的免疫原的多克隆抗体(包括抗体、其抗体片段及其抗原结合片段)的方法。该方法包括:(a)提供根据本发明的免疫原;(b)在致使动物的免疫系统产生抗体的条件下用所述免疫原免疫实验动物;和(c)从所述动物中取出与生物素特异性结合的抗体。动物可以是绵羊、山羊、兔、大鼠、小鼠等。本文的原始公开内容和本发明的另一个一般方面(其也与本文公开的所有其他方面和实施方案相关)是产生根据本发明的抗体的方法,所述方法包括以下步骤:(a)用根据本发明的免疫原免疫实验动物,从而诱导产生与所述免疫原结合的抗体的b-细胞,(b)或者通过杂交瘤技术或者通过b-细胞pcr技术,获得步骤(a)由b-细胞产生的结合所述免疫原的单克隆抗体,(c)进一步选择步骤(b)的抗体与生物素的结合,从而获得根据本发明的抗体。在实施方案中,在式i中,r包含m,并且m的具体实施方案是半抗原,其中所述半抗原不含有生物素部分。因此,本文的原始公开内容和本发明的另一个一般方面(其也与本文公开的所有其他方面和实施方案相关)是根据式i的化合物,(式i)其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且其中r是a或b,其中a是m-l,其中m是不含有生物素部分的半抗原,且l是连接x和m的接头,且其中b是其中m是不含有生物素部分的半抗原,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合。在具体实施方案中,r是a,并且衍生化的二氨基生物素包含在图3c的结构(式iiic)中,其用于检测和筛选根据本发明的所期望的抗体。根据这个方面的化合物在捕获所期望的抗体中特别有用,例如,在鉴定使用根据本发明的免疫原产生的多克隆或单克隆抗体的方法中。这种抗体将特异性结合化合物的生物素部分,也就是说该化合物能够捕获根据本发明的所期望的抗体。在这方面,半抗原必须不是和/或必须不含有进一步的生物素部分,以保持化合物的捕获特异性。因此,不是生物素和/或不含生物素的合适的半抗原选自二硝基苯酚、苯胺、氨基苯甲酸、肼苯哒嗪、荧光素和洋地黄毒苷。在具体实施方案中,m是洋地黄毒苷。具体实施方案是图3c中公开的化合物,其包含洋地黄毒苷(式iiic)。进一步地,根据本文公开的所有方面的具体实施方案是单克隆抗体,其首先特异性结合根据式i的化合物,(式i)其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且r是a或b,其中a是m-l,其中m是不含有生物素部分的半抗原,且l是连接x和m的接头,且其中b是其中m是不含有生物素部分的半抗原,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合,且其次特异性结合在图3c中描述的化合物(式iiic)。在更具体的实施方案中,单克隆抗体首先特异性结合在图2c中描述的化合物(式iiia),且其次特异性结合在图3c中描述的化合物(式iiic)。令人惊讶的是,另外发现本文各方面和实施方案中描述的单克隆抗体不仅结合如上所具体限定和描述的式i化合物,而且它们还结合衍生化的生物素,其特征在于与在式i中不同,二氨基生物素被生物素替代,且生物素的脲基环的n'1原子带有取代基,通过该取代基,生物素部分与载体共价附着。因此,根据本文公开的所有方面的具体实施方案是单克隆抗体,其首先特异性结合根据式i的化合物,(式i)其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且r是a或b,其中a是m-l,其中m是不含有生物素部分的半抗原,且l是连接x和m的接头,且其中b是其中m是不含有生物素部分的半抗原,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合,且其次特异性结合在图3b中所示的式iiib化合物。本文的原始公开内容和本发明的另一个一般方面(其也与本文公开的所有其他方面和实施方案相关)是产生根据本发明的抗体的方法,所述方法包括以下步骤:(a)用根据本发明的免疫原免疫实验动物,从而诱导产生与所述免疫原结合的抗体的b-细胞,(b)或者通过杂交瘤技术或者通过b-细胞pcr技术,获得步骤(a)由b-细胞产生的结合所述免疫原的单克隆抗体,(c)进一步选择步骤(b)的抗体与生物素的结合,从而获得根据本发明的抗体。通过杂交瘤技术产生生产单克隆抗体的细胞系是本领域技术人员众所周知的。本领域技术人员已知的b-细胞pcr技术利用了这样的事实,即,从b-细胞可以分离总mrna并转录成cdna。利用特异性引物,可以扩增编码同源vh-和vl-区的核酸。几乎没有获得相同的序列。该方法提供了与相同抗原结合的高度多样的抗体。用于扩增编码vh-的核酸的引物可用于从来自nmri-小鼠、亚美尼亚仓鼠、balb/c-小鼠以及叙利亚仓鼠和兔的细胞获得的cdna。在本文报道的所有方法的一个实施方案中,氨基酸序列衍生自扩增的vh-编码核酸,并且通过确定evql/qvql到vss(vh-区域)以及divm/diqm到kleik(vl-区域)的氨基酸序列来鉴定确切的起始点和终点。本文还报道了使用b-细胞pcr产生抗体的方法,其包括以下步骤:(a)提供(成熟的)b-细胞群体(从实验性非人动物的血液获得),(b)用至少一种荧光染料(在一个实施方案中用1-3种或2-3种荧光染料)染色所述b-细胞群体的细胞,(c)在个别容器中(在一个实施方案中,容器是多孔板的孔)沉积染色的b-细胞群体的单个细胞,(d)在有饲养细胞的情况下培养沉积的个别b-细胞,(e)确定个别b-细胞培养中分泌的抗体的结合特异性,(f)通过逆转录酶pcr和核苷酸测序确定特异性结合抗体的可变轻链和重链结构域的氨基酸序列,并从而获得单克隆抗体可变轻链和重链结构域编码核酸,(g)将单克隆抗体轻链和重链可变结构域编码核酸引入用于表达抗体的表达盒中,(h)将核酸引入细胞中,(i)培养所述细胞并从所述细胞或细胞培养物上清液回收抗体,并从而产生抗体。在一个实施方案中,非人动物选自大鼠、小鼠、仓鼠、兔、非人灵长类动物、羊、狗、牛、鸡、两栖动物和爬行动物。在本文公开的用于产生单克隆抗体的方法的具体实施方案中,在步骤(c)中,在竞争性测定中进行选择,其中使用生物素作为抗体与选自在图2c中描述的式iiia、在图3b中描述的式iiib和在图3c中描述的式iiic的化合物组的化合物结合的竞争剂。这些化合物已在上文讨论过。所述化合物在捕获所期望的抗体中特别有用。这种抗体将特异性结合一种或两种化合物的生物素部分,也就是说一种或两种化合物能够捕获根据本发明的所期望的抗体。在这方面,如在式iiib和式iiic中所例示的半抗原必须不是和/或必须不含有进一步的生物素部分,以保持各化合物的捕获特异性。因此,半抗原用于将捕获试剂锚定在固相上,如例如,用作为半抗原的洋地黄毒苷所例示的。另一个重要步骤是选择和/或确认抗体,特别是使用本文公开的免疫原和通过本文公开的方法产生的单克隆抗体,实际上能够结合生物素。因此,竞争性结合测定确保当在水溶液中与游离生物素接触时抗体能够结合生物素。因此,在本文公开的用于产生单克隆抗体的方法的实施方案中,在步骤(c)中,在竞争性测定中进行选择,其中使用生物素作为抗体与本文公开的免疫原结合的竞争剂。在本文公开的用于产生单克隆抗体的方法的另一个实施方案中,在步骤(c)中,在竞争性测定中进行选择,其中使用生物素作为抗体与式iiib化合物(式iiib)结合的竞争剂。在本文公开的用于产生单克隆抗体的方法的另一个实施方案中,在步骤(c)中,在竞争性测定中进行选择,其中使用生物素作为抗体与式iiic化合物(式iiic)结合的竞争剂。在本文公开的用于产生单克隆抗体的方法的另一个实施方案中,在步骤(c)中,在竞争性测定中进行选择,其中使用生物素作为抗体与式iiia化合物(式iic)结合的竞争剂。更一般地,在本文公开的用于产生单克隆抗体的方法的另一个实施方案中,在步骤(c)中,在竞争性测定中进行选择,其中使用生物素作为抗体与根据式i的化合物结合的竞争剂。在具体实施方案中,r是半抗原,其中所述半抗原不含生物素部分。如本公开内容的实施例中所证明的,本发明在其各方面和实施方案中现在提供了特异性结合式i化合物的新单克隆抗体,(式i)其特征在于它还与生物素结合,其中x选自(ch2)n,其中n为1至20的整数,[(ch2)p-o]k-(ch2)m,其中p为2或3,m为2或3,k为1至30的整数,以及[(ch2)r-conh]s-(ch2)t,其中r为1至5的整数,t为0至5的整数,且s为1至5的整数,且其中r选自h、oh、cooh、nh2、叠氮基、马来酰亚胺基和z,其中z是a或b,其中a是m-l,其中m选自(i)不含有生物素部分的半抗原和(ii)多肽,且l是连接x和m的接头,且其中b是且其中b是其中m选自(i)不含有生物素部分的半抗原和(ii)多肽,且l是接头,借此用星号作标记的氮原子与相邻的x的ch2基团共价结合。本发明的单克隆抗体可通过根据本发明和如本文所公开的方法获得。如上所述,根据本发明的单克隆抗体的特征在于它不结合式ii的化合物。在式ii中,生物素部分通过接头通过戊酸侧链的羧基官能的碳原子与半抗原偶联。因此,该分子例示了根据本发明的所期望的抗体不结合的常规生物素化的分子。因此,本文的原始公开内容和本发明的另一个一般方面(其也与本文公开的所有其他方面和实施方案相关)是用于产生不结合生物素化的分子的抗体的方法,其中生物素部分通过接头通过戊酸侧链的羧基官能的碳原子与半抗原偶联,所述方法包括以下步骤:(a)用根据本发明的免疫原免疫实验动物,从而诱导产生与所述免疫原结合的抗体的b-细胞,(b)或者通过杂交瘤技术或者通过b-细胞pcr技术,获得步骤(a)由b-细胞产生的结合所述免疫原的单克隆抗体,(c)选择步骤(b)的抗体与生物素的结合,和(d)选择那些不与生物素化的分子结合的抗体,从而获得不与生物素化的分子结合的根据本发明的抗体。在具体实施方案中,步骤(d)用在图3a中描述的根据式ii的化合物进行。因此,更具体地,公开了一种产生不与式ii化合物结合的抗体的方法,所述方法包括以下步骤:(a)用根据本发明的免疫原免疫实验动物,从而诱导产生与所述免疫原结合的抗体的b-细胞,(b)或者通过杂交瘤技术或者通过b-细胞pcr技术,获得步骤(a)由b-细胞产生的结合所述免疫原的单克隆抗体,(c)选择步骤(b)的抗体与生物素的结合,和(d)选择那些不与式ii化合物结合的抗体,从而获得不与根据式ii的化合物结合的根据本发明的抗体。特别是在测量样品中分析物的方法中,其中(链霉)抗生物素蛋白/生物素结合对用于将生物素化的分析物特异性结合剂结合到(链霉)抗生物素蛋白包被的固相上,如果样品中含有特别高的量的生物素,则分析物的测量可能变得不准确。由于这个原因,非常期望清除生物素。这个技术问题可以通过样品预处理来解决,即,在样品经受测量分析物的方法之前借助去除游离生物素的过程。然而,这将涉及不期望的大量离散工作步骤,如例如,将样品与包被有(链霉)抗生物素蛋白的磁性颗粒混合,温育混合物从而将生物素结合到颗粒上,后面是磁性地去除颗粒。这种样品预处理方法不仅消耗诸如原材料和时间的资源;此外,这种方法具有改变样品(例如,其体积和组成)的风险,这本身又可能导致分析物检测和测量中的不期望的效果。令人惊讶地发现,根据本发明的能够结合生物素并且不与常规生物素化的感兴趣的分子结合的单克隆抗体提供了降低生物素干扰的精巧解决方案。当充当生物素清除剂时,抗体的生物素结合性质是这样的以致其不与例如生物素化的分析物特异性结合剂与(链霉)抗生物素蛋白的结合相干扰。因此,根据本发明的单克隆抗体证明是抵消由可能存在于样品中的高水平生物素引起的干扰的有力工具。本文的原始公开内容和本发明的另一个一般方面(其也与本文公开的所有其他方面和实施方案相关)是根据本发明的抗体在用于测量样品中的分析物的方法中的用途,其中(链霉)抗生物素蛋白/生物素对用于将生物素化的分析物特异性结合剂结合到(链霉)抗生物素蛋白包被的固相上。本文的原始公开内容和本发明的另一个一般方面(其也与本文公开的所有其他方面和实施方案相关)是用于测量样品中的分析物的方法,其中(链霉)抗生物素蛋白/生物素结合对用于将生物素化的分析物特异性结合剂结合到(链霉)抗生物素蛋白包被的固相上,所述方法包括向样品添加a)根据本发明的抗体,b)生物素化的分析物特异性结合剂,c)(链霉)抗生物素蛋白包被的固相,后面是测量通过(链霉)抗生物素蛋白和生物素化的分析物特异性结合剂与固相结合的分析物。本公开内容提供了清除样品中包含的潜在干扰未缀合的(游离)生物素的方法,从所述样品中应测量分析物,且所述测量方法利用(链霉)抗生物素蛋白/生物素结合对。优选地,清除步骤在(链霉)抗生物素蛋白/生物素对形成之前进行。因此,在实施方案中,提供了用于测量样品中的分析物的方法,其中(链霉)抗生物素蛋白/生物素结合对用于将生物素化的分析物特异性结合剂结合到(链霉)抗生物素蛋白包被的固相上,所述方法包括向样品添加a)根据本发明的抗体,b)生物素化的分析物特异性结合剂,c)(链霉)抗生物素蛋白包被的固相,后面是测量通过(链霉)抗生物素蛋白和生物素化的分析物特异性结合剂与固相结合的分析物,其中步骤(a)和任选的还有步骤(b)在步骤(c)之前进行。在再另一个实施方案中,步骤(a)和步骤(b)在进行步骤(c)之前同时进行。在再另一个实施方案中,步骤(b)和步骤(c)在步骤(a)已进行后同时进行。在再另一个实施方案中,所有三个步骤(a)、(b)和(c)同时进行。令人惊讶地是,本发明的单克隆抗体在技术上甚至适合作为供在用于测量样品中分析物的方法中使用的游离生物素的有效清除剂,所述样品含有游离生物素,其中(链霉)抗生物素蛋白/生物素对用于将生物素化的分析物特异性结合剂结合到(链霉)抗生物素蛋白包被的固相或标记的(链霉)抗生物素蛋白上,其中样品、本发明的单克隆抗体、生物素化的结合剂和(链霉)抗生物素蛋白包被的固相或标记的链霉抗生物素蛋白的任一种同时彼此接触。关于如本文所公开的分析物检测和/或测量的所有方面和实施方案,含水液体样品可以用于根据本公开内容的方法中的用于特异性体外检测分析物的方法中。可能已知样品包含分析物,或者可能怀疑样品包含分析物。在一个实施方案中,在根据本公开内容的方法中使用的用于体外诊断的样品是选自全血、血清、血浆、液、尿或唾液的体液。在一个实施方案中,怀疑包含或包含分析物的样品是血清、血浆或液。在一个实施方案中,怀疑包含或包含分析物的样品是血清或血浆。本文的原始公开内容和本发明的另一个一般方面(其也与本文公开的所有其他方面和实施方案相关)是免疫测定测试试剂盒,其在单独的容器中包括至少(a)根据本发明任一项权利要求的抗体,(b)生物素化的分析物特异性结合剂,和(c)(链霉)抗生物素蛋白包被的固相。术语单个容器单元涉及这样的事实,即,对于许多自动分析仪,如来自rochediagnostics的elecsys®分析仪系列,测量某种分析物所需的试剂以“试剂包”的形式提供,即,作为安装在分析仪上且在不同的区室中包含测量感兴趣的分析物所需的所有关键试剂的一个容器单元。在一个实施方案中,本发明涉及试剂盒,其中所述结合对的第一配偶体是抗生物素蛋白或链霉抗生物素蛋白,并且其中所述结合对的所述第二配偶体选自生物素或生物素类似物,例如氨基生物素(aminobiotin)、亚氨基生物素(iminobiotin)或脱硫生物素。提供以下实施例和附图以帮助理解本发明,本发明的真实范围在所附权利要求中陈述。应理解,可以在不脱离本发明的精神的情况下对所陈述的程序进行修改。附图说明图1a:d(+)-生物素;b:d(+)-生物素图2与实施例1和2相关的合成方案图3a:式ii的化合物;b:式iiib的化合物;c:式iiic的化合物图4来自抗体动力学筛选测定的示例性动力学特征。虚线:dig-生物素-缀合物-m-d.g-fab'复合体注射的spr结合信号。实线:补充有300nmd-生物素的dig-生物素-缀合物-m-d.g-fab'复合体的spr结合信号。一般,观察到三类游离d-生物素阻断动力学。a:完全的d-生物素竞争。b:中间的d-生物素阻断。c:没有d-生物素的信号干扰。从a类和b类中选择合适的抗体候选物用于后来的详细研究。图5引导抗体候选克隆lspric50测量的示例性spr传感图叠加图(overlayplot)。将270nmdig-生物素-缀合物与浓度为270nm(未显示)、90nm、30nm(两次)、10nm、3.3nm和1nm的游离d-生物素混合。含有90nm游离d-生物素浓度的混合物产生最低响应信号,并且1nm游离d-生物素产生最高响应信号(标记的)。x表示报道点的位置,其用于ic50计算。图6a动力学筛选测定实验spr配置。首先,将预先形成的dig-生物素-缀合物-m-d.g-fab'用作溶液中的分析物,以监控分子量增加的缀合的d-生物素的结合。其次,将d-生物素添加到分析物混合物中以与缀合物结合竞争。bspr测定实验配置。在有和没有d-生物素浓度系列的情况下测量dig-生物素-缀合物相互作用。在没有d-生物素的情况下,dig-生物素-缀合物的浓度依赖性系列用于确定兔抗体动力学与dig-生物素-缀合物的关系曲线。在分析物样品混合物中用恒定浓度的dig-生物素-缀合物和渐增浓度的游离d-生物素进行ic50测量。c备择spr测定实验配置。在有和没有d-生物素浓度系列的情况下测量dig-生物素-缀合物相互作用。在没有d-生物素的情况下,dig-生物素-缀合物的浓度依赖性系列用于确定兔抗体动力学与dig-生物素-缀合物的关系曲线。在这种情况下,dig-生物素-缀合物被表面展示的m-d.g抗体捕获,而兔抗体或其片段用作溶液中的浓度依赖性分析物。在分析物样品混合物中用恒定浓度的兔抗体和渐增浓度的游离d-生物素进行ic50测量。实施例1二氨基生物素的衍生化和合成步骤以获得免疫原1.15-{3-氨基-4-[3-(9h-芴-9-基甲氧羰基氨基)-丙酰氨基]-四氢-苯硫-2-基}-戊酸的合成使用干燥的溶剂和干燥的原材料在惰性气氛(氩)中进行反应。将220mgfmoc-β-丙氨酸(cas登记号35737-10-1,其他名称n-[(9h-芴-9-基甲氧基)羰基]-β-丙氨酸)和112mghobt(苯并三唑-1-醇,n-羟基苯并三唑,cas编号2592-95-2)溶解于7.5ml无水dmf(二甲基甲酰胺)中。添加105mg1,3-二异丙基-碳二亚胺并于室温搅拌1小时。添加溶解于7.5mldmf中的140mg二氨基生物素(cas登记号22342-46-7)并将混合物搅拌过夜。蒸发溶剂后,将反应混合物通过制备型hplc进一步纯化。产量为174mg。hplc-esi-ms:m+512.41.25-{3-乙酰氨基-4-[3-(9h-芴-9-基甲氧羰基氨基)-丙酰氨基]-四氢-苯硫-2-基}-戊酸的合成使用干燥的溶剂和干燥的原材料在惰性气氛(氩)中进行反应。将174mg5-{3-氨基-4-[3-(9h-芴-9-基甲氧羰基氨基)-丙酰氨基]-四氢-苯硫-2-基}-戊酸溶解于10mldmf中,并添加416mg乙酸酐。将反应混合物于室温搅拌过夜。通过蒸发除去溶剂,且产物在真空下干燥。产量为94mg。hplc-esi-ms:m+554.41.35-[3-乙酰氨基-4-(3-氨基-丙酰氨基)-四氢-苯硫-2-基]-戊酸的合成将94mg5-{3-乙酰氨基-4-[3-(9h-芴-9-基甲氧羰基氨基)-丙酰氨基]-四氢-苯硫-2-基}-戊酸溶解于10mldmf中,并添加2.5ml哌啶。将混合物于室温搅拌3小时。产量为52mg粗产物。1.45-{3-乙酰氨基-4-[3-(2-叠氮基-乙酰氨基)-丙酰氨基]-四氢-苯硫-2-基}-戊酸=叠氮基-β-ala-二氨基生物素的合成使用干燥的溶剂和干燥的原材料在惰性气氛(氩)中进行反应。将7mg5-[3-乙酰氨基-4-(3-氨基-丙酰氨基)-四氢-苯硫-2-基]-戊酸和8mg叠氮基乙酸琥珀酰亚胺基酯(cas登记号824426-32-6)溶解于10mldmf中,并添加8mg三乙胺。搅拌过夜后,通过蒸发除去溶剂,且粗产物用制备型hplc纯化。产量2mghplc-esi-ms:m+415.41.5klh-sxa1028-叠氮基-ala-二氨基生物素(式iiia,参见图2c)在0.1m磷酸钾缓冲液(ph7.2,10ml)中的匙孔䗩血蓝蛋白(30mg,sigmaaldirch#8283)与(1r,8s,9s)-双环[6.1.0]壬-4-炔-9-基甲基琥珀酰亚胺碳酸酯(6.6mg,22.6μmol,synaffixproduct#sx-a-1028)反应。将混合物于室温搅拌5小时。通过针对0.1m磷酸钾缓冲液(ph7.2)透析除去未反应的环辛炔。将叠氮基-ala-二氨基生物素(3.52mg,8.5μmol)溶解于dmso中,并添加到环辛炔衍生的klh中。将混合物于4℃搅拌过夜。通过针对0.1m磷酸钾缓冲液(ph7.2)透析除去未反应的叠氮基-ala-二氨基生物素。通过测量280nm处的吸光度测定蛋白质含量。实施例2用于体外筛选单克隆抗体的包含二氨基生物素衍生物的试剂的合成dig-3-cme-amcap-β-ala-生物素如上所述合成5-[3-乙酰氨基-4-(3-氨基-丙酰氨基)-四氢-苯硫-2-基]-戊酸(实施例1)。洋地黄毒苷-3-cme-amcap-nhs酯(其他名称:洋地黄毒苷nhs-酯,卡-20(22)-烯内酯,3-[2-[[6-[(2,5-二氧代-1-吡咯烷基)氧基]-6-氧代己基]氨基]-2-氧代乙氧基]-12,14-二羟基-,(3β,5β,12β)-)=casnr.129273-26-3如de3836656a1中所述合成,或者作为可商业获得的产品(merck-sigma)获得。将20mg洋地黄毒苷-3-cme-amcap-nhs酯溶解于3mldmf中,并添加6μl三乙胺。然后,添加10mg5-[3-乙酰氨基-4-(3-氨基-丙酰氨基)-四氢-苯硫-2-基]-戊酸,并将混合物于室温搅拌3.5小时。通过蒸发除去溶剂,并通过制备型hplc色谱法分离产物。实施例3生物素在n'1原子的衍生化(1)fmoc-β-丙氨酸-酰基氯向在干燥条件下的烧瓶中的4.7gfmoc-β-丙氨酸(iris,faa1300)缓慢添加约20ml亚硫酰氯。将混合物于室温搅拌50分钟,且然后加热以回流10分钟。冷却后,蒸发混合物,将残余物溶解于无水甲苯中三次,且每次蒸发。产量为5.1g。(2)fmoc-β-丙氨酰-生物素生物素的羧酸通过在有dmap(0.63g)的情况下使生物素(2.48g)与在15ml无水吡啶中的叔丁基氯二苯基硅烷(6.5ml)于室温在惰性氩气氛中反应过夜来保护,如fang和bergstrom在nucleicacidsresearch,2003,vol.31,no.2,708中所述的。添加4.9g溶解于10ml二氯甲烷中的fmoc-β-丙氨酸-酰基氯并于室温搅拌3.5小时。蒸发混合物,添加dmf并再次蒸发。将残余物溶解于dmf-h2o(3:1)中,且添加50mmol碳酸钾并将混合物搅拌30分钟。用柠檬酸酸化至ph4后,用乙酸乙酯萃取产物,并通过柱色谱法(二氧化硅,洗脱液乙酸乙酯/甲醇)纯化。hplc-esi-ms:m+=538.3da。产量为1.5g。(3)β-丙氨酰-生物素=5-[3-(3-氨基-丙酰)-2-氧代-六氢-噻吩并[3,4-d]咪唑-6-基]-戊酸通过将1.67gfmoc-β-丙氨酰-生物素溶解于20%哌啶在dmf中的混合物(60ml)中来裂解fmoc保护基。蒸发混合物并在真空下干燥。然后,通过制备型hplc使用反相二氧化硅和h2o-乙腈梯度分离产物。hplc-esi-ms:m+=316.3da。产量为0.55g。实施例4合成用于筛选单克隆抗体的进一步的试剂(1)dig-3-cme-amcap-dadoo-生物素洋地黄毒苷-3-cme-amcap-nhs酯(其他名称:洋地黄毒苷nhs-酯,卡-20(22)-烯内酯,3-[2-[[6-[(2,5-二氧代-1-吡咯烷基)氧基]-6-氧代己基]氨基]-2-氧代乙氧基]-12,14-二羟基-,(3β,5β,12β)-)=casnr.129273-26-3如de3836656a1中所述合成,或者作为可商业获得的产品(merck-sigma)获得。将21mg洋地黄毒苷-3-cme-amcap-nhs酯溶解于3mldmf中,并添加6μl三甲胺。然后,添加14mg生物素-dadoo,并将混合物于室温搅拌2小时。通过蒸发除去溶剂,并通过制备型hplc色谱法分离产物。hplc-esi-ms:m+=918.7da。产量:23mg。(2)dig-3-cme-amcap-β-ala-生物素如上所述合成β-丙氨酰-生物素=β-ala-生物素=5-[3-(3-氨基-丙酰)-2-氧代-六氢-噻吩并[3,4-d]咪唑-6-基]-戊酸(实施例1)。洋地黄毒苷-3-cme-amcap-nhs酯(其他名称:洋地黄毒苷nhs-酯,卡-20(22)-烯内酯,3-[2-[[6-[(2,5-二氧代-1-吡咯烷基)氧基]-6-氧代己基]氨基]-2-氧代乙氧基]-12,14-二羟基-,(3β,5β,12β)-)=casnr.129273-26-3如de3836656a1中所述合成,或者作为可商业获得的产品(merck-sigma)获得。将20mg洋地黄毒苷-3-cme-amcap-nhs酯溶解于3mldmf中,并添加6μl三乙胺。然后,添加10.5mgβ-ala-生物素,并将混合物于室温搅拌3.5小时。通过蒸发除去溶剂,并通过制备型hplc色谱法分离产物。hplc-esi-ms:m+=859.6da。产量:16mg。实施例5免疫兔用于产生结合游离生物素的抗体在本公开内容中,报道了具有清除游离生物素能力的抗体的开发。为此,只有当生物素的戊酸部分的cooh-基团可及且不用于缀合时,我们才产生与生物素结合的抗体。根据本发明的抗体不与生物素化的分子结合,即,常规的生物素-缀合物,其中生物素通过羧基的碳原子共价偶联。为了产生这种抗体,用klh-生物素缀合物(参见上文,实施例1,klh缀合物[nn])免疫12-16周龄的nzw兔。所有兔都经受反复免疫。在第一个月,每周对动物进行免疫。从第二个月起,每月对动物进行一次免疫。对于第一次免疫,将500μgklh缀合物[nn](式iiia)溶解于1ml140mmnacl中,并在1mlcfa(完全弗氏佐剂)中乳化。对于所有后面的免疫,cfa被ifa(不完全弗氏佐剂)替代。在免疫开始后第35天评价动物的滴度。实施例6免疫的动物的抗体滴度分析设计血清滴定的实验配置以测定可以区分(i)常规类型的缀合的生物素,即,通过戊酸部分的羧基官能的碳原子与载体缀合的生物素,和(ii)环结构共价附着到载体的缀合的生物素的多克隆抗体的量。本文提供了式iiia、式iiib和式iiic的化合物(分别描述于图2c、3b和3c。进一步提供了式ii的化合物(描述于图3a中)。在实施方案中,首先用5μg/ml多克隆绵羊抗-dig抗体(sigma)包被96孔板。洗涤步骤后,用5%bsa(roche)封闭板以减少背景信号。为了捕获不同的生物素-dig结合物(cme-amcap-β-ala-生物素(式iiib)和dig-3-cme-amcap-dadoo-生物素(式ii)),将抗-dig包被的板与250ng/ml缀合物在分开的孔中温育。在另外的洗涤步骤后,将兔血清在含有1%bsa的pbs中稀释,并将稀释液(dilutions)添加到板中。以1:300、1:900、1:2,700、1:8,100、1:24,300、1:72,900、1:218,700和1:656,100的稀释度测试血清。用hrp-标记的f(ab')2山羊抗兔fcγ(dianova)和abts(roche)作为底物检测结合的抗体。通过稀释曲线的50%信号降低来设置分析的动物的滴度。表2用二氨基生物素-klh免疫原免疫的实验动物血清的滴定,其中生物素类似物以二氨基生物素衍生物的形式与klh偶联。显示来自3只免疫的动物的多克隆血清优先与dig-3-cme-amcap-β-ala-生物素结合,其与免疫原相似,这是因为生物素和二氨基生物素所共有的侧链方面被呈递用于抗体结合,且其中特别地,戊酸侧链的cooh-基团可及。dig-3-cme-amcap-dadoo-生物素仅被微弱检测到。实施例7开发结合游离生物素的单克隆抗体为了开发能够与溶液中的生物素(即,游离生物素)结合并且与常规生物素化的靶没有交叉反应性的抗体,使用如seeber等人(2014),plosone.2014年2月4日;9(2)所述的b-细胞克隆。为了富集抗原反应性b-细胞,将生物素化的小鼠抗-dig抗体(roche)与链霉抗生物素蛋白包被的磁珠(miltenyi)结合。然后,制备免疫的动物的pbmc库并与250ng/mldig-3-cme-amcap-β-ala-生物素一起温育。温育1小时后,用pbs洗涤细胞,并与预包被的抗-dig磁珠一起温育。为了富集抗原反应性b-细胞,使用macs柱(miltenyi)。如seeber等人(2014),plosone.2014年2月4日;9(2)所述进行b-细胞分选和温育。在进行elisa之前24小时,为了鉴定抗原反应性克隆,向细胞培养物上清液中添加2μg/ml链霉抗生物素蛋白以中和游离生物素。这是作为预防措施进行的,这是因为培养基或细胞来源中的游离生物素可以阻断上清液中的抗体与筛选试剂dig-3-cme-amcap-β-ala-生物素(式iiib)的相互作用。对于elisa,96孔板用5μg/ml多克隆山羊抗兔-igg抗体包被。洗涤步骤后,用5%bsa封闭板以减少背景信号。将板再次洗涤,并将30μl兔b-细胞培养物转移至96孔板中并于室温温育1小时。在另一个洗涤步骤之后,将50ng/ml阳性筛选试剂,dig-3-cme-amcap-β-ala-生物素,或阴性筛选试剂,dig-3-cme-amcap-dadoo-生物素(式ii)添加到孔中并于室温温育1小时。为了检测与筛选试剂结合的抗体,将3μg/mlpod标记的多克隆绵羊抗-dig-抗体添加到板中。在最后的洗涤步骤后,添加abts(roche)作为pod底物,并通过测量405nm处的od鉴定阳性克隆。结果在表3中给出。表3产生抗体的6个鉴定的克隆的elisa结果,所述抗体特征在于与根据式iiib的阳性筛选试剂但不与根据式ii的阴性筛选试剂特异性结合。实施例8通过单克隆抗体结合生物素为了证明新产生的所期望的抗体(包括由表3中所示克隆所代表的那些)另外与游离生物素结合,设计并进行竞争elisa测定。为此,首先如seeber等人(2014),plosone.2014年2月4日;9(2)所述克隆抗体。为了产生含有抗体的上清液,用编码抗生物素抗体的相关重链和轻链的表达质粒瞬时转染hek细胞。1周培养时间后,测定瞬时转染中抗生物素抗体的浓度,并将每个所选克隆的浓度调节至5μg/ml。对于elisa,96孔板用5μg/ml多克隆山羊抗兔-igg抗体包被。洗涤后,用5%bsa封闭板以减少背景信号。将板再次洗涤,并将来自瞬时转染的30μl抗体上清液(5μg/ml)转移到96孔板的每个孔中,并于室温温育1小时。将每个选择的克隆成一排地添加到8个不同的孔中以进行生物素滴定。温育后,将板再次洗涤3次以除去克隆上清液中存在的链霉抗生物素蛋白/生物素复合体。对于阳性对照,将50ng/ml阳性筛选试剂,dig-3-cme-amcap-β-ala-生物素(式iiib)对于每个抗体添加到一个孔中,并于室温温育1小时。为了测试游离生物素的结合,进行了滴定。为此,将游离生物素以渐增的浓度添加到dig-3-cme-amcap-β-ala-生物素中。向50ng/mldig-3-cme-amcap-β-ala-生物素的量中添加浓度为10ng/ml、20ng/ml、40ng/ml、80ng/ml、160ng/ml、320ng/ml和640ng/ml的生物素。然后,再次洗涤板,且对于与dig-3-cme-amcap-β-ala-生物素结合的抗体的检测,向板添加3μg/mlpod标记的多克隆绵羊抗-dig-抗体。在最后的洗涤步骤后,添加abts(roche)作为pod底物,并通过测量405nm处的od(光密度)来检测信号。值得注意的是,观察到作为在有筛选试剂的情况下渐增的生物素浓度的结果降低的信号降低。这表明游离生物素溶液和dig-3-cme-amcap-β-ala-生物素竞争结合所选的抗体。实施例9在免疫学测定中抵消生物素干扰用于elecsystsh测定的对照样品,precicontroluniversal2掺加了浓度逐渐升高的生物素(例如,0、100和200ng/ml生物素终浓度)。含有抗tsh检测抗体的elecsystsh销售试剂盒的试剂2以未修饰形式(对照)和修饰形式使用,另外含有300μg/ml根据本发明的单克隆抗生物素抗体。夹心测定根据用于elecsystsh测定的常规测定规程进行:简言之,将50μl样品(具有或不具有生物素的precicontroluniversal2)与60μl含有生物素化的抗-tsh抗体的elecsystsh试剂盒的试剂1和50μl含有有或没有进一步添加300μg/ml单克隆抗生物素抗体的钌化(ruthenylated)抗-tsh抗体的试剂2一起温育。于37℃温育9分钟后,添加40μlelecsystsh试剂盒的链霉抗生物素蛋白包被的磁珠悬浮液,将反应温育另外9分钟,且最后将反应混合物吸入测量测定池中,在那里微粒被磁捕获到电极表面上。然后用procell除去未结合的物质。然后向电极施加电压诱导基于电化学发光的光发射,其通过光电倍增管测量。使用对照试剂,样品中存在100或200ng/ml生物素导致显著信号下降至参考信号(不含生物素的样品)的53%或16%。与此相反,在试剂r2中含有生物素结合抗体的试剂盒的修饰形式中,生物素的干扰作用显著降低。实施例10动力学抗体筛选动力学筛选在gehealthcarebiacore4000仪器上于37℃进行。根据制造商的说明书,将biacorecm5系列s传感器安装到仪器中,并进行流体动力学寻址(address)和预先调节。系统缓冲液是hbs-ep(10mmhepes(ph7.4),150mmnacl,1mmedta,0.05%(w/v)p20)。样品缓冲液是补充有1mg/mlcmd(羧甲基葡聚糖,fluka)的系统缓冲液。在生物传感器上确立兔抗体捕获系统。多克隆山羊抗兔iggfc捕获抗体garbfcγ(代码编号:111-005-046,批号#105332,jacksonimmunoresearch)根据制造商的说明书使用nhs/edc化学固定。将10mm乙酸钠缓冲液(ph4.5)中的30μg/mlgarbfcγ预浓缩至流动测定池1、2、3和4中的斑点1、2、4和5,并以10.000rugarbfcγ固定。接着用1m乙醇胺ph8.5使传感器饱和。斑点1和5用于相互作用测量,且斑点2和4用作参考。将每种兔抗体克隆悬浮液在样品缓冲液中1:2稀释,并以30μl/分钟的流速注射1分钟。监控以响应单位(ru)表示的兔抗体捕获水平(cl)。由于0.9kdadig-生物素-缀合物的分子量对于spr筛选仪器的灵敏度范围来说太小,所以将300nmdig-生物素-缀合物(dig-3-cme-amcap-β-ala-生物素(bmono.15420318))于室温与900nm<dig>m-d.g-fab'预温育2小时。mab<dig>m-d.g-fab以kd5pm亲和力结合洋地黄毒苷。m-d.g-fab'也以皮摩尔亲和力结合dig-生物素-缀合物中的洋地黄毒苷部分,并且不与garbfcγ捕获系统相干扰。m-d.g-fab'不与抗生物素兔克隆和游离d-生物素相干扰。使用50kdam-d.g-fab',将0.9kdadig-生物素-缀合物加载另外的质量。这导致具有50.9kda分子量的高度稳定的免疫复合体,这对于spr筛选仪器的灵敏度范围是最佳的。m-d.g-fab'是单体的,且既没有产生也不可检测分析物亲合力(avidity)效应。将预先形成的dig-生物素-缀合物-m-d.g-fab'复合体以30μl/分钟单独注射5分钟,以监控与相应表面展示的抗生物素兔mab的缔合相。监控缀合物从兔克隆的解离达5分钟。在每个动力学速率测定循环后,通过1分钟注射10mm甘氨酸ph2.0,后面是2分钟以20μl/分钟注射10mm甘氨酸ph2.25,从生物传感器捕获系统中完全洗涤兔克隆。在第二筛选配置中,鉴定了对d-生物素结合干扰敏感的兔抗生物素抗体。通过于室温温育过夜制备分析物混合物,由300nmdig-生物素-缀合物,900nm<dig>m-d.g-fab'和300nm游离d-生物素(d-生物素,casno.:58-85-5,目录号:47868,supelco)组成。如前所述但以溶液中的这个分析物混合物进行动力学筛选。在另一个实施方案中,使用不同的dig-生物素-缀合物和<dig>m-d.g-fab'浓度。图6解释了用于筛选的实验配置。通过biacore4000评价软件监控两种分析物单一浓度动力学的动力学痕迹(trace)。此外,动力学数据由报道点表征和动力学测定解释。两个报道点,即,在分析物注射结束前不久记录的信号,后期结合(bindinglate)(bl),和在解离时间结束前不久的信号,后期稳定性(stabilitylate)(sl),用于表征分析物/抗原结合稳定性。此外,根据朗格缪尔(langmuir)模型计算解离速率常数kd(1/s),并根据式ln(2)/(60*kd)计算以分钟表示的抗体/抗原复合体半衰期。摩尔比,结合化学计量用下式计算:mw(抗体)/mw(抗原)*bl(抗原)/cl(抗体)。最后,将每种抗生物素兔mab的动力学痕迹叠加在一个分析图中。主要通过目测检查这些叠加图,选择抗体,其显示在有300nm游离d-生物素的情况下有效的dig-生物素-缀合物结合信号降低。有效意味着超过90%的dig-生物素-结合物结合信号降低。在另一个实施方案中,选择具有80%、70%、60%和50%信号降低的抗体。将选择的抗体转移至详细的ic50分析。图4示例性地显示了通过基于spr的动力学筛选测量的三种抗体阻断特征。a类显示dig-生物素-缀合物结合的完全d-生物素阻断。b类以对d-生物素信号干扰具有仅仅中等敏感性的抗体为特色,而c类对d-生物素不敏感。详细的基于spr的功能分析详细的动力学研究在gehealthcaret200仪器上于37℃进行。根据制造商的说明书,将biacorecm5系列s传感器安装到仪器中,并进行流体动力学寻址(address)和预先调节。系统缓冲液是hbs-ep(10mmhepes(ph7.4),150mmnacl,1mmedta,0.05%(w/v)p20)。样品缓冲液是补充有1mg/mlcmd(羧甲基葡聚糖,fluka)的系统缓冲液。在一个实施方案中,在cm5生物传感器上确立兔抗体捕获系统。多克隆山羊抗兔iggfc捕获抗体garbfcγ(代码编号:111-005-046,批号#105332,jacksonimmunoresearch)根据制造商的说明书使用nhs/edc化学固定。将10mm乙酸钠缓冲液(ph4.5)中的30μg/mlgarbfcγ预浓缩至流动测定池1、2、3和4,并以10.000rugarbfcγ固定。接着用1m乙醇胺ph8.5使传感器饱和。将来自起始动力学筛选步骤的选择的兔抗体克隆在样品缓冲液中以各500nm稀释,并以5μl/分钟的流速在生物传感器上捕获2分钟,后面是用10-倍浓缩的hbs-ep系统缓冲液于60μl/分钟的2分钟洗涤步骤。监控以响应单位(ru)表示的兔抗体捕获水平(cl)。t200仪器的更高灵敏度回避了通过<dig>m-d.g-fab'的额外的分子量加载。以60μl/分钟注射一系列分析物达5分钟,监控缔合相(associationphase)和解离相(dissociationphase)达5分钟。首先,以300nm注射dig-生物素-缀合物分析物,省略溶液中的d-生物素。然后,将4nm、8nm、15nm、30nm、90nm和270nm的渐增d生物素浓度添加至dig-生物素-缀合物混合物中。产生传感图叠加图以分析通过渐增的d-生物素浓度的存在的dig-生物素-缀合物结合信号抑制。在渐增的d-生物素浓度范围内绘制来自分析物缔合相的信号平台的后期结合报道点,并且使用biaevaluation软件中的点对点(point-to-point)模式确定d-生物素ic50值。此外,目测研究传感图叠加图的d-生物素的竞争性能,并估计%信号抑制。在另一个实施方案中,通过比较0nmd-生物素和270nmd-生物素样品注射来计算%信号阻断。图6显示了ic50测量的spr实验配置。图6b示出了优选的实施方案。图5示例性显示了这个竞争测定的结果。显示的是抗体引导候选物5d9。样品中游离d-生物素浓度越高,dig-生物素-缀合物结合信号越低,且因此估计抗体对d-生物素结合的敏感性。克隆l的ic50测定为ic50=60nmd-生物素。在另一个实施方案中,测定dig-生物素-缀合物结合抗体的动力学参数ka[1/ms]、kd[1/s]、t1/2diss[分钟]、kd[m]和结合化学计量(摩尔比)。测定了克隆5d9的37℃动力学,其中ka=2.2*10e51/ms,kd=2.0*10e-3(1/s),t1/2diss=6分钟,mr=1.1。对dig-生物素-缀合物的亲和力是kd=9nm。在一个实施方案中,t200仪器测定配置如上所述。dig-生物素-缀合物以0nm、4nm、8nm、15nm、30nm、90nm和270nm的浓度系列注射。使用biacore评价软件确定动力学参数。在另一个实施方案中,由备择的传感器表面配置测定dig-生物素-缀合物抗体结合的动力学参数ka[1/ms]、kd[1/s]、t1/2diss[分钟]、kd[m]和结合化学计量(摩尔比)。在一个实施方案中,在cm5生物传感器上确立鼠抗体捕获系统。根据制造商的说明书使用nhs/edc化学固定多克隆兔抗小鼠igg捕获抗体(rbamigg(兔抗小鼠igg),pab<m-igg>rb-igg(is),br-1008-38,2017-08,gehealthcare)。将10mm乙酸钠缓冲液(ph5.0)中的30μg/mlgarbfcγ预浓缩至流动测定池1、2、3和4,并以10.000ru固定。接着用1m乙醇胺ph8.5使传感器饱和。以10μl/分钟捕获约300ru的30nmmab<dig>m-19/11-igg(q)(roche,28.1.1999,引入(entrance)19.5.2017,id.2157861)达1分钟。以30μl/分钟于150nm注射dig-生物素-缀合物2分钟,以通过m-19/11-igg稳定捕获。图6描述了测定配置。这个测定优选用于重组表达的兔抗生物素fab'片段的动力学测定。然后如上所述以浓度依赖性系列注射抗生物素兔抗体或其片段以测定结合动力学。实施例11itc实验itc实验直接确定所选的抗体对溶液中游离生物素的亲和力以及结合反应的热力学参数和化学计量。所有itc实验均在vp-itc微热量计(malverninstruments)上进行。实验于25℃在磷酸盐缓冲液(25mm磷酸钾ph7.4,150mm氯化钾)中进行。对于示例性单克隆抗体(参见表5),蛋白质浓度为750μg/ml,从而导致对于互补位10μm的摩尔浓度。生物素浓度为100μm。在10μl注射之间以310rpm的搅拌速度和200s时间间隔进行滴定。从数据拟合中排除对于每个样品的第一次注射。使用nanoanalyzedataanalysis软件包(版本3.6.0)将实验数据拟合至理论曲线,以提供kd(以m表示的解离常数)、n(结合的化学计量)和δh(以kcal/mol表示的焓的变化)的值。热力学参数(δg和δs)使用以下方程式从kd和δh计算:其中r是通用气体常数,t是温度且δg、δh和δs是吉布斯自由能、焓和熵的变化。表5实施例12从原核细胞发酵纯化fab片段表达的本发明多肽分泌到宿主细胞的周质中并从宿主细胞的周质中回收。可以通过离心或过滤收获细胞。在具有2.0-8.0的ph的适当缓冲液中或使用完全发酵培养液将生物质重悬浮后,通过物理、化学或酶促方法破裂细胞。一旦细胞被破裂,就可通过离心或过滤除去细胞碎片或全细胞。多肽的纯化可涉及几个沉淀步骤和阳离子、阴离子交换层析、疏水作用、混合模式、亲和或凝胶过滤层析上的分级分离。对于痕量结合的生物素的除去,用结合剂如链霉抗生物素蛋白处理多肽溶液可能是必要的。对于多肽的最终制剂,可以进行透析、超滤或超透析(ultradialysis)步骤。多肽可以作为液体、冷冻液体或作为喷雾干燥或冷冻干燥的固体贮藏。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺