诱导的多能性干细胞的评价方法及选择方法、以及诱导的多能性干细胞的制备方法与流程
本发明涉及诱导的多能性干细胞的评价方法及选择方法,以及诱导的多能性干细胞的制备方法。
背景技术:
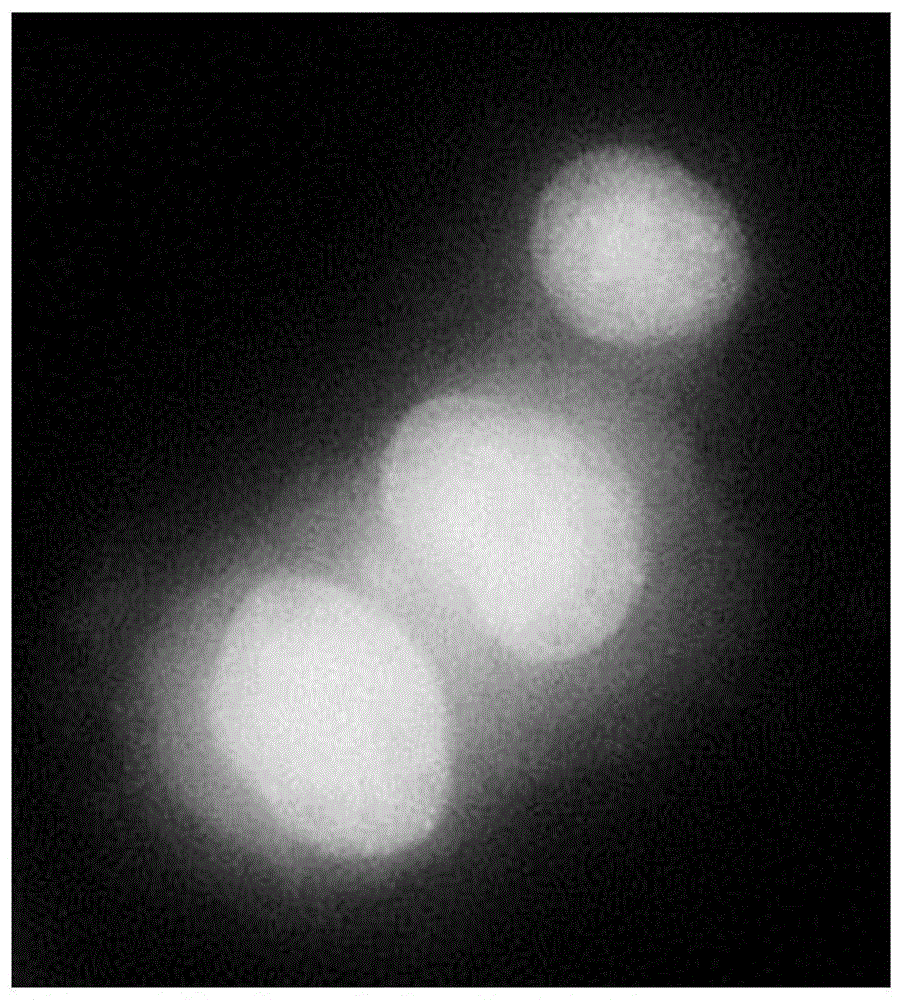
:诱导的多能性干细胞(ips细胞)为对体细胞进行人工操作而制作的多能性干细胞,其实例包括:由yamanaka等2006年从小鼠细胞、2007年从人细胞建立的ips细胞。与胚胎干细胞(es细胞)不同,诱导的多能性干细胞不使用受精卵而从各个生物体的体细胞制作。因此,期待其避免使用es细胞时的隐患的伦理的问题、移植时的排斥反应。因此,源自诱导的多能性干细胞的分化细胞在再生医疗中的应用受到热切关注。在使用诱导的多能性干细胞实现再生医疗时,担心源自移植细胞的癌变。认为癌变的原因除了与使用的诱导的多能性干细胞的品质有关,以及未分化的细胞的污染。报告称在诱导的多能性干细胞的制备过程中,可能出现例如,在培养建立的诱导的多能性干细胞的步骤中,在基因组结构中发生变化,导致对于细胞增殖来说有利的变化的细胞群。由于对细胞增殖有利地工作的基因组结构的变化与癌变密切相关。因此,发生了该变化的细胞群体,成为了在诱导的多能性干细胞的再生医疗应用中的风险因子。认为基因组结构的变化,与基因组结构的变化的容易度,即基因组不稳定性具有密切的关系。因此,为了排除该风险因子,临床应用中使用的诱导的多能性干细胞,需要在实施长期培养后,最终通过实施细胞和核的形态的观察、以及例如观察有丝分裂中期的染色体的数量和形态的核型分析、检验基因的突变的全基因组序列分析、作为单核苷酸多态性分析的snps(singlenucleotidepolymorphism)分析、作为拷贝数多态性分析的cnv(copynumbervariation)分析等的试验,由此选择基因组结构的稳定性高的高品质的诱导的多能性干细胞(非专利文献1)。现有技术文献非专利文献非专利文献1:martins-taylork.,xur.h.:concisereview:genomicstabilityofhumaninducedpluripotentstemcells.stemcells30(1):p22-27,2012本发明要解决的问题然而,上述试验费时且昂贵,因此,为了推进使用诱导的多能性干细胞的再生医疗,提供新的诱导的多能性干细胞的评价方法、具有基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞的选择方法、及具有基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞的制备方法成为课题。本发明的目的在于提供:与常规方法相比,可迅速且廉价地实施的新的诱导的多能性干细胞的评价方法,具有基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞的选择方法,具有基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞的制备方法,及具有基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞。解决技术问题的方案即,本发明提供下述[1]~[24]:[1]用于评价诱导的多能性干细胞的方法,其包括下述步骤(1)~(3):(1)提供培养的诱导的多能性干细胞的步骤;(2)测定提供的诱导的多能性干细胞中具有异常核酸结构的细胞器的自发频率的步骤;和(3)识别上述自发频率为参考值以下的诱导的多能性干细胞和上述自发频率超过参考值的诱导的多能性干细胞的步骤。[2]如[1]所述的评价方法,其中,上述具有异常核酸结构的细胞器为微核。[3]如[1]或[2]所述的评价方法,其中,上述自发频率的参考值为胚胎干细胞中自发频率的统计值。[4]如[3]所述的评价方法,其中,上述胚胎干细胞为人胚胎干细胞。[5]如[1]或[2]所述的评价方法,其中,上述自发频率的参考值是作为标准的诱导的多能性干细胞中自发频率的统计值。[6]如[2]所述的评价方法,其中,上述自发频率的参考值为2%。[7]如[1]~[6]中任一项所述的评价方法,其中,上述诱导的多能性干细胞为人的诱导的多能性干细胞。[8]用于选择诱导的多能性干细胞的方法,其包括下述步骤(1)~(4):(1)提供培养的诱导的多能性干细胞的步骤;(2)测定提供的诱导的多能性干细胞中具有异常核酸结构的细胞器的自发频率的步骤;(3)识别上述自发频率为参考值以下的诱导的多能性干细胞和上述自发频率超过参考值的诱导的多能性干细胞的步骤;和(4)选择上述自发频率为参考值以下的诱导的多能性干细胞的步骤。[9]如[8]所述的选择方法,其中,上述具有异常核酸结构的细胞器为微核。[10]如[8]或[9]所述的选择方法,其中,上述自发频率的参考值为胚胎干细胞中自发频率的统计值。[11]如[10]所述的选择方法,其中,上述胚胎干细胞为人胚胎干细胞。[12]如[8]或[9]所述的选择方法,其中,上述自发频率的参考值是作为标准的诱导的多能性干细胞中自发频率的统计值。[13]如[9]所述的选择方法,其中,上述自发频率的参考值为2%。[14]如[8]~[13]中任一项所述的选择方法,其中,上述诱导的多能性干细胞为人的诱导的多能性干细胞。[15]用于制备诱导的多能性干细胞的方法,其包括下述步骤(1)~(4):(1)提供建立和培养的诱导的多能性干细胞的步骤;(2)测定提供的诱导的多能性干细胞中具有异常核酸结构的细胞器的自发频率的步骤;(3)识别上述自发频率为参考值以下的诱导的多能性干细胞和上述自发频率超过参考值的诱导的多能性干细胞的步骤;和(4)选择上述自发频率为参考值以下的诱导的多能性干细胞的步骤。[16]如[15]所述的制备方法,其中,在上述(1)步骤前,进一步包括下述步骤:(a)建立诱导的多能性干细胞的步骤;以及(b)培养建立的诱导的多能性干细胞的步骤。[17]如[15]或[16]所述的制备方法,其中,上述具有异常核酸结构的细胞器为微核。[18]如[15]~[17]中任一项所述的制备方法,其中,上述自发频率的参考值为胚胎干细胞中自发频率的统计值。[19]如[18]所述的制备方法,其中,上述胚胎干细胞为人胚胎干细胞。[20]如[15]~[17]中任一项所述的制备方法,其中,上述自发频率的参考值为诱导的多能性干细胞中自发频率的统计值。[21]如[17]所述的制备方法,其中,上述自发频率的参考值为2%。[22]如[15]~[21]中任一项所述的制备方法,其中,上述诱导的多能性干细胞为人的诱导的多能性干细胞。[23]诱导的多能性干细胞,其微核自发频率为2%以下。[24]用于评价诱导的多能性干细胞的方法,其包括下述步骤(1)~(3):(1)提供培养的诱导的多能性干细胞的步骤;(2)测定提供的诱导的多能性干细胞中具有异常核酸结构的细胞器的自发频率的步骤;和(3)将上述自发频率为参考值以下的诱导的多能性干细胞,评价为与上述自发频率超过参考值的诱导的多能性干细胞相比,分化效率更高的诱导的多能性干细胞的步骤。发明效果根据本发明,可以提供新的诱导的多能性干细胞的评价方法、具有基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞的选择方法、具有基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞的制备方法、及具有基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞。附图说明图1示出人ips细胞“2”的样本图像,作为通过人ips细胞的核形态的观察(实施例3)得到的正常细胞的典型的图像。图2示出人ips细胞“d-1r(-)#2”的样本图像,作为通过人ips细胞的核形态的观察(实施例3)得到的异常细胞的典型的图像。核膜表面不光滑但具有多角形样形状,并且明显观察到怀疑具有核膜损伤的细胞。图3示出人ips细胞“f-1r(+)#1”的样本图像,作为通过人ips细胞的核形态的观察(实施例3)得到的异常细胞的典型的图像。明显观察到在1个细胞中具有2个以上的核的多核细胞。图4示出人ips细胞“9”的样本图像,作为通过人ips细胞的核形态的观察(实施例3)得到的异常细胞的典型的图像。明显观察到具有从核膜的突起结构的细胞。具体实施方式以下,对具体实施方式进行详细说明。<通用术语的说明>除有特别记述以外,本说明书中通用的术语为以下含义。“具有异常核酸结构的细胞器”,是指具有由核酸构成的异常结构的细胞器,其由染色体异常而形成,并在从分裂后期至间期或休止期的细胞中发现。具体而言,可列举微核、npb(核质桥)、nbud(核芽)。“具有异常核酸结构的细胞器的自发频率”(以下,有时记作自发频率),是指具有异常核酸结构的细胞器的频率,其是在普通的维持培养期间等,在没有进行任何可以影响具有异常核酸结构的细胞器的形成的专门的处理的状态下测定的。具有异常核酸结构的细胞器的频率可以通过计算在所有细胞中,具有具有异常核酸结构的细胞器的细胞占的比例而确定。“微核”是指在从分裂后期至间期或休止期的细胞的细胞质内发现的、具有小于主核的异常核酸结构的细胞器。已知微核产生的原因是源于染色体结构异常的无着丝粒的染色体片段或由于在有丝分裂期染色体分配异常而没能向极点移动的整个染色体,微核成为在有丝分裂期间产生的染色体异常的指标。微核频率显示在一定的培养时期,发生由于细胞分裂引起的染色体的结构异常或数目异常的频率。“微核的自发频率”,即自发微核的频率,是指在普通的维持培养期间等,在没有进行任何可以影响微核形成的专门的处理的状态下测定的微核频率,如相对于细胞的微核触发因子的暴露等。已知即使没有对微核触发因子的暴露等,在普通的有丝分裂的过程中也会概率地产生dna的复制错误、染色体分配异常等,这转而引起染色体异常的自然产生和微核的形成。在细胞中产生了微核的情况下,一些微核导致细胞死亡并通过细胞的自稳调节功能作为异常细胞被迅速排除;而残存的细胞则作为具有微核的细胞而被检测到。因此,微核自发频率可以作为完全示出细胞的遗传信息的稳定性的指标,例如在引起染色体异常的细胞分裂过程中发生各种异常的可能性、除去一时产生的异常的自稳调节功能的程度等。“干细胞”是指具有分裂并产生与原来的细胞相同的细胞的能力即自我复制能力以及分化为不同种类的细胞的能力,并能够持续地增殖的细胞。“多能性干细胞”是指能够体外培养,并且具有分化为来自胚胎的三胚层(外胚层、中胚层及内胚层)的组织的能力即多能性的干细胞。“多能性干细胞”可以从受精卵、克隆胚胎、生殖干细胞或组织内干细胞等建立。“多能性干细胞”的更具体例,包括:胚胎干细胞(es细胞)和由体细胞诱导成的诱导的多能性干细胞(ips细胞)。“es细胞”是指具有自我复制能力和多能性的干细胞,是指源自早期胚胎的多能性干细胞。胚胎干细胞在1981年最初建立,在1989年以后也应用于敲除小鼠的制作。人胚胎干细胞在1998年建立,在再生医疗中也持续利用。“诱导的多能性干细胞”是从体细胞诱导成的多能性干细胞,意指通过将体细胞重编程而人工地赋予类似胚胎干细胞的多能性的细胞。可列举例如,通过将成纤维细胞等已分化的细胞通过如oct3/4、sox2、klf4、myc等基因的表达而重编程,由此建立的具有多能性的ips细胞(inducedpluripotentstemcell)等。2006年,由yamanaka等人从小鼠成纤维细胞建立了诱导的多能性干细胞(cell,2006,126(4),p663-676)。2007年,从人成纤维细胞建立了具有与胚胎干细胞相似的多能性的诱导的多能性干细胞(cell,2007,131(5),p861-872;science,2007,318(5858),p1917-1920;natbiotechnol.,2008,26(1),p101-106)。本发明使用的诱导的多能性干细胞可以使用本身已知的方法由体细胞制备,也可以是已经建立的诱导的多能性干细胞。另外,对作为本发明使用的诱导的多能性干细胞的来源的体细胞没有特别限定。诱导的多能性干细胞的来源没有特别限定。可列举例如:源自小鼠、大鼠、仓鼠、豚鼠等啮齿类的诱导的多能性干细胞,及源自人、猴、猩猩、黑猩猩等灵长类的诱导的多能性干细胞,优选为源自人的诱导的多能性干细胞。“核型分析”是指用于检验对象细胞的染色体的结构、数量上是否异常,即是否有与正常的核型不同的特征的分析方法,所述方法包括通过将对象细胞进行一定时间的培养,添加秋水仙酰胺等有丝分裂抑制剂而使分裂中期细胞富集,并由其制备染色体样品,实施可以将一个细胞中的单个染色体区别的染色,并在显微镜下观察各个染色体。对于核型分析,广泛使用g带法或q带法等经典鉴别染色法、使用了染色体特异性dna探针的荧光原位杂交(fish;fluoresceceinsituhybridization)法等。关于ips细胞的核型分析的报告汇集于“stemcells30(1),p22-27,2012”中等,其中在一部分的ips细胞中发现了核型异常,并且具有多个报告例的特征的异常已知有12号染色体的三体等。核型分析的特征在于,通过直接观察染色体的结构的形态学特征或染色体数量的增减,可以鉴定异常的种类,然而,对个体的染色体的观察需要足够经验。另外,由于观察需要极大的努力,因此可检验的细胞数限于极少数,存在着以下问题:难以检测不频发的异常,难以定量估计异常产生的频率,并难以在细胞之间定量比较它们。在核型分析中,由于分析了某一个时间点的染色体的特征,因此,难以定量比较培养期间与有丝分裂相关的时间进程的变化。“全基因组序列分析”是指分析方法,其包括:将对象细胞中的dna片段化,使用各种测序进行平行分析以便汇总性地指定dna分子的全碱基序列,并检测dna突变。在分析仪器和技术显著进步的背景下,目前已经能够进行使用新一代测序仪的高精度分析。全基因组序列分析为分辨率非常高的分析方法,其提供关于后述的snps、cnv的信息,并能够在单个碱基水平检测低频率产生的dna的突变。一方面,该分析存在需要昂贵成本和时间长的问题,对于检验大量的建立的诱导的多能性干细胞的全部并选择具有良好品质的株而言,是不实用的。“snps分析”是指检测在对象细胞中的dna中观察到的单核苷酸多态性(snps)的分析方法。snps是指在个体群体中以一定以上的频率发现的dna中的单碱基的突变。在人类中至今也已报告了各种snps,已指出了snps与个体差异如疾病敏感性的关联。对于snps分析,上述全基因组序列分析中的汇总性分析方法和利用聚合酶链式反应(pcr)迅速检测已知的snps的方法是已知的。另外,通过利用在微区间中排列了无数的snp序列探针的snp阵列,可以有效地分析大量的snps的存在的有无。虽然可以通过使用snp阵列的分析以高分辨率对较小的突变进行分析,但成本、时间仍然构成障碍,对将该分析用作大量的诱导的多能性干细胞的选择方法而言,是非实用性的。“cnv分析”是指包括检测对象细胞中dna中发现的拷贝数多态性(cnv)的分析方法。cnv意味着基因数量的变动,例如当通常在每1个细胞中存在2个基因(2个拷贝)时,仅有1个拷贝(缺失)或存在3个拷贝以上(重复)等,已被指出与显示碱基序列变动的snps共同的与个体差异的关联。对于cnv分析,可以利用与snps分析相似的方法,已知有全基因组序列分析、通过pcr的分析法、比较基因组杂交(cgh)法、利用snp阵列的分析方法等。ips细胞的snp分析及cnv分析的结果汇集于“stemcells30(1),p22-27,2012.”等,并且已知有多个特征性突变,例如12号染色体短臂12p的重复和17号染色体长臂17q21座的缺失。与其它分析方法类似,成本和时间也构成障碍,利用cnv分析作为大量的诱导的多能性干细胞的选择方法,是非实用性的。“基因组结构的稳定性高且癌变的风险低”是指,与自发频率超过后述参考值的诱导的多能性干细胞相比,在细胞或核的形态异常较少,通过诸如核型分析、全基因组序列分析、snps分析或cnv分析等现有的基因组结构的评价方法得到良好结果,或向一定的细胞种类的分化效率高,作为它们的结果而言,向肿瘤细胞分化的风险低。如本文所用,“向一定的细胞种类的分化效率高”是指,与使用了自发频率超过后述的参考值的诱导的多能性干细胞的分化效率相比,可以以更高频率得到目标的分化细胞。也指在假设临床应用的现有的分化方法中,以与常规的分化效率相比以更高频率得到目标的分化细胞。假设可临床应用的现有的分化方法包括:向t细胞的分化方法、向间充质干细胞的分化方法、向造血干细胞的分化方法、向红细胞的分化方法、向血小板的分化方法、向血管内皮细胞的分化方法、向心肌细胞的分化方法、向骨骼肌的分化方法、向神经干细胞的分化方法、向大脑皮质神经细胞的分化方法、向大脑边缘系统(cerebrumlimbicsystem)神经细胞的分化方法、向多巴胺能神经细胞的分化方法、向肝细胞的分化方法、向骨的分化方法、向软骨的分化方法、向原始生殖细胞的分化方法、向胰腺细胞的分化方法、向视网膜细胞的分化方法、向角膜细胞的分化方法、向肾脏细胞的分化方法、向肺泡上皮细胞的分化方法、向支气管上皮细胞的分化方法、向肠道的分化方法等。作为向t细胞的分化方法,可以适当选择并使用各种已知的诱导分化方法。已知的分化诱导方法的实例包括“timmermans,f.等,j.immunol.,2009,182,68879-6888”中记载的从人es细胞诱导t淋巴细胞的方法。另外,例如,可以通过“nishimura,t.等cellstemcell,2013,12,114-126”中记载的方法,诱导从人外周血t淋巴细胞建立的人ips细胞向t淋巴细胞分化。在一个实施方式中,本发明提供用于评价诱导的多能性干细胞的方法,其包括:(1)提供培养的诱导的多能性干细胞的步骤;(2)测定提供的诱导的多能性干细胞中的具有异常核酸结构的细胞器的自发频率的步骤;以及(3)识别前述自发频率为参考值以下的诱导的多能性干细胞和前述自发频率超过参考值的诱导的多能性干细胞的步骤。(以下简称为“本发明的评价方法”)。在另外的实施方式中,本发明提供用于选择诱导的多能性干细胞的方法,其在本发明的评价方法的步骤(3)后,进一步包括(4)选择前述自发频率为参考值以下的诱导的多能性干细胞的步骤(以下简称为“本发明的选择方法”)。在该实施方式中,可以将与自发频率超过参考值的诱导的多能性干细胞相比,前述自发频率为参考值以下的诱导的多能性干细胞选择作为基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞。在另一个实施方式中,本发明提供用于制备诱导的多能性干细胞的方法(以下简称为“本发明的制备方法”),在所述方法中,将本发明的选择方法的步骤(1)替换为提供建立和培养的诱导的多能性干细胞的步骤。在进一步的实施方式中,本发明提供用于制备源自诱导的多能性干细胞的分化细胞的方法,其中,在本发明的制备方法的步骤(4)后,进一步包括(5):对在(4)中选择的诱导的多能性干细胞进行诱导分化,以提供分化细胞的步骤。即,本发明提供用于制备源自诱导的多能性干细胞的分化细胞的方法,其包括:(1)提供建立和培养的诱导的多能性干细胞的步骤;(2)测定所提供的诱导的多能性干细胞中的具有异常核酸结构的细胞器的自发频率的步骤;(3)识别上述自发频率为参考值以下的诱导的多能性干细胞与上述自发频率超过参考值的诱导的多能性干细胞的步骤;以及(4)选择上述自发频率为参考值以下的诱导的多能性干细胞的步骤;以及(5)对在(4)中选择的诱导的多能性干细胞进行诱导分化,以提供分化细胞的步骤上述源自诱导的多能性干细胞的分化细胞的制备方法,也可以在上述(1)步骤前,进一步包括下述步骤:(a)建立诱导的多能性干细胞的步骤;以及(b)培养建立的诱导的多能性干细胞的步骤。在进一步的实施方式中,本发明提供诱导的多能性干细胞,其作为具有基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞,微核自发频率为2%以下、1.9%以下、1.8%以下、1.7%以下、1.6%以下、1.5%以下、1.4%以下或1.3%以下。以下,对各步骤进行具体说明。<提供培养的诱导的多能性干细胞的步骤>用于建立诱导的多能性干细胞的方法只要包括将特定的重编程因子导入体细胞的步骤即可,没有特别限定。可列举例如:采集体细胞,通过引入重编程因子如oct3/4、sox2、klf4、myc等而使其人工表达,选择已获得多能性的细胞并进行扩大培养的步骤;通过使用逆转录病毒载体或仙台病毒载体将重编程因子(oct3/4、sox2、klf4及c-myc)导入人外周血淋巴细胞并将其进行培养的步骤(nishimura,t.等cellstemcell2013,12,114-126)等。体细胞的实例包括但不限于:外周血中的淋巴细胞、皮肤等的成纤维细胞、皮肤细胞、视觉细胞、脑细胞、毛细胞、口腔粘膜、肺细胞、肝细胞、胃粘膜细胞、肠细胞、脾细胞、胰细胞、肾细胞、神经干细胞、造血干细胞、源自智齿等的间充质干细胞、组织干细胞、组织祖细胞、血液细胞(例如,外周血单核细胞(包括t细胞及非t细胞)、脐带血细胞等)、上皮细胞、内皮细胞(例如,血管内皮细胞)、肌细胞等。重编程因子中含有的基因的实例包括:oct3/4、sox2、sox1、sox3、sox15、sox17、klf4、klf2、c-myc、n-myc、l-myc、nanog、lin28、fbx15、eras、ecat15-2、tcl1、beta-catenin、lin28b、sall1、sall4、esrrb、nr5a2、tbx3或glis1等。这些重编程因子可以单独使用或组合使用。重编程因子的组合的实例包括:在wo2007/069666、wo2008/118820、wo2009/007852、wo2009/032194、wo2009/058413、wo2009/057831、wo2009/075119、wo2009/079007、wo2009/091659、wo2009/101084、wo2009/101407、wo2009/102983、wo2009/114949、wo2009/117439、wo2009/126250、wo2009/126251、wo2009/126655、wo2009/157593、wo2010/009015、wo2010/033906、wo2010/033920、wo2010/042800、wo2010/050626、wo2010/056831、wo2010/068955、wo2010/098419、wo2010/102267、wo2010/111409、wo2010/111422、wo2010/115050、wo2010/124290、wo2010/147395、wo2010/147612、huangfud,等(2008),nat.biotechnol.,26:795-797、shiy,等(2008),cellstemcell,2:525-528、eminlis,等(2008),stemcells.26:2467-2474,、huangfud,等(2008),natbiotechnol.26:1269-1275、shiy,等(2008),cellstemcell,3,568-574、zhaoy,等(2008),cellstemcell,3:475-479、marsona,(2008),cellstemcell,3,132-135、fengb,等(2009),natcellbiol.11:197-203、judsonr.l.等,(2009),nat.biotech.,27:459-461、lyssiotisca,等(2009),procnatlacadsciusa.106:8912-8917、kimjb,等(2009),nature.461:649-643、ichidajk,等(2009),cellstemcell.5:491-503、hengjc,等(2010),cellstemcell.6:167-74、hanj,等(2010),nature.463:1096-100、malip,等(2010),stemcells.28:713-720、maekawam,等(2011),nature.474:225-229中记载的组合。作为将重编程因子导入体细胞的方法,当重编程因子为dna形态时,例如病毒载体、质粒、人工染色体等,可列举诸如脂质转化、脂质体、显微注射等的方法等;当重编程因子为rna形态时,例如,可列举诸如脂质转化、显微注射等的方法等;当重编程因子为蛋白质的形态时,可列举脂质转化、细胞膜穿透肽(例如,源自hiv的tat及聚精氨酸)的融合、显微注射等。使用病毒载体的方法的实例包括但不限于:使用逆转录病毒载体的方法、使用附加型载体的方法,使用id制药公司的重编程试剂盒“cytotune(注册商标)-ips2.0”代表的那样的仙台病毒载体的方法、使用慢病毒载体的方法、使用了腺病毒载体的方法等。用于培养诱导的多能性干细胞的方法,只要在维持未分化状态的状态下使诱导的多能性干细胞生存或增殖即可,没有特别限定。可列举例如:包括在添加了各种因子的培养基中暴露细胞并维持未分化状态以确保进行生存或增殖的方法。另外,可列举:经丝裂霉素c处理的小鼠成纤维细胞上的饲养层上培养法、使用人工基底膜基质的无饲养层培养法等,但在本发明中培养的方法并不限定于此。作为培养基的例子,包括但不限于:eagle培养基(例如:dmem、bme、mem、αmem)、ham's培养基(例如:f10培养基、f12培养基)、rpmi培养基(例如:rpmi-1640培养基、rpmi-1630培养基)、mcdb培养基(例如:mcdb104、107、131、151、153培养基)、费舍尔培养基、199培养基、或市售的培养基[灵长类es细胞用培养基(灵长类es/ips细胞用培养液、reprocell公司)、小鼠es细胞用培养基(tx-wes培养基、thrombx公司)、无血清培养基(mtesr、stemcelltechnology公司)、reproff、stemspan(注册商标)sfem、stemspan(注册商标)h3000、stemlineii、esf-b培养基、esf-c培养基、csti-7培养基等]。此外,也可以根据需要使用这些培养基的混合物,可列举例如:dmem/f12培养基等。在培养基中,可以适当添加:10~20%的血清(胎牛血清(fbs)、人血清、马血清)或血清代替物(ksr等)、胰岛素、各种维生素、l-谷氨酰胺、各种氨基酸如非必需氨基酸等、β-巯基乙醇、各种细胞因子(白介素类(il-2、il-7、il-15等)、干细胞因子(scf)、激活素等)、各种激素、各种生长因子(白血病抑制因子(lif)、碱性成纤维细胞生长因子(bfgf)、tgf-β等)、各种细胞外基质、各种细胞粘附分子、抗生素如青霉素/链霉素、嘌呤霉素等、ph指示剂如酚红等,等等。培养可以在例如:含有1~10%、优选为2~5%co2的大气中,于30~40℃、优选为37~38.5℃,进行25~50天左右。为了确保对于以高精度测定微核自发频率而言足够观察的细胞数量,使诱导的多能性干细胞扩大培养至1×103细胞以上、优选为1×104细胞以上、更优选为5×104细胞以上,由此可以有效测定微核自发频率。提供由此获得的“培养的诱导的多能性干细胞”或“建立、培养的诱导的多能性干细胞”的形式,没有特别限定。例如,可以在培养基中提供培养的细胞,或可以以冻存的状态提供细胞。或者,也可以以在培养皿或制备的切片上的固定状态(标本化的状态)提供细胞。细胞的提供者和受供者可以相同,也可以不同。<测定具有异常核酸结构的细胞器的自发频率的步骤>在本发明中,用于测定具有异常核酸结构的细胞器的自发频率的方法不受限定,可以采用各种已知的方法。以下主要记载了关于具有异常核酸结构的细胞器的自发频率测定,其中,所述细胞器是微核。具有异常核酸结构的细胞器并不限于微核。作为微核自发频率的测定,可列举例如以下方法。回收培养之后的细胞,用细胞固定液替代培养基而固定细胞。将固定后的细胞悬浮液,制备成悬浮液为稍稍白浊的程度的细胞密度后滴加到载玻片上,空气干燥以制备微核样本。对微核样本实施染色,并在具备有与染色方法相容的光学系统的显微镜下观察细胞。如后所述,也可以在回收细胞前添加细胞质分裂抑制剂。在未使用细胞质分裂抑制剂的情况下,微核自发频率可以通过测定不具有微核的细胞的细胞数及具有微核的细胞的细胞数,并计算具有微核的细胞占观察的总细胞的比例而求出。在使用细胞质分裂抑制剂的情况下,微核自发频率可以通过测定2核细胞的细胞数及具有微核的2核细胞的细胞数,并计算具有微核的2核细胞占总2核细胞的比例而确定。对微核样本的制备中使用的细胞固定液的组成没有特别限定,可列举:乙醇、甲醇、乙醇与乙酸的混合物、甲醇与乙酸的混合物、或多聚甲醛稀释液等。为了良好地保持细胞质并促进观察,可以在固定前进行低渗处理。对低渗液的组成没有特别限定,可列举例如:75mmkcl溶液等。对微核样本的染色法没有特别限定,可列举例如:使用吖啶橙和吉姆萨染色法的核及细胞质的双重染色法、利用dapi(2-(4-脒基苯基)-1h-吲哚-6-甲脒)、hoechst33342、hoechst33258、pi(碘化丙啶)、溴化乙锭、sybr(注册商标)gold、sybr(注册商标)green或其它核酸染色试剂的核染色方法等。对作为观察对象的细胞数没有特别限定,一般而言,为了保证统计学精度而观察1000个细胞以上的对象细胞。微核样本的观察步骤也可以通过使用图像分析装置如成像细胞计数器等而自动化进行。另外,为了容易地实施多个样品的试验,也可以不回收细胞而在培养容器如96孔板上直接固定细胞并在培养容器表面上制作微核样本。使用上述图像分析装置,可以实现高通量自动分析。作为图像分析装置的适用例,有报告“mutatres2013,751(1),p1-11”等,但不限定于此。或者,也可以对回收的细胞悬浮液实施适当的染色,并使用流式细胞仪、激光扫描细胞仪等流动通道系统(flowpathsystem)中的细胞分析装置来自动分析大量的细胞。作为流式细胞仪的利用例,已有报告“mutatres2010,703(2),p191-199”等,但不限定于此。对于微核自发频率的测定而言,除微核以外,也可以测定nbud等除了微核以外的细胞器的自发频率。为了得到与有丝分裂动力学有关的信息等,可以在回收细胞前添加细胞质分裂抑制剂。添加细胞质分裂抑制剂,也确保了npb的自发频率的测定。细胞质分裂抑制剂以不引起明显细胞毒性的浓度及处理时间进行使用。作为细胞质分裂抑制剂的例子,可列举3~6μg/ml的细胞松弛素b稀释液等,但不限定于此。作为测定npb的自发频率的方法,可以利用与使用细胞质分裂抑制剂时微核自发频率的测定方法相同的方法,但所述方法不限定于此。<识别自发频率为参考值以下的诱导的多能性干细胞和自发频率超过参考值的诱导的多能性干细胞的步骤>在本步骤中,基于自发频率是否为参考值以下或自发频率是否超过参考值,来识别测定了自发频率的诱导的多能性干细胞。这里,“参考值”可以基于已知安全性高的es细胞的自发频率而确定。另外,也可以基于多个es细胞系中的自发频率的统计值而确定。例如,可以通过多次实验计算各es细胞系自发频率的平均值,将es细胞系之间的自发频率的平均值进行比较,将平均值最大的es细胞系的该平均值作为参考值采用。在这种情况下,优选的参考值为例如2%。或者,可以对每个es细胞系,通过多次实验计算自发频率平均值的最大值,将es细胞系之间的自发频率平均值的最大值进行比较,将最大值最高的es细胞系的该最大值作为参考值采用。或者,“参考值”也可以基于作为标准的ips细胞中的自发频率的统计值确定。例如,对于根据现有的品质评价指标确认为安全性高的特定的ips细胞系,可以通过多次实验计算自发频率的平均值,将ips细胞系之间的自发频率的平均值进行比较,将自发频率平均值最大的ips细胞系的该平均值作为参考值采用。或者,可以对各ips细胞系,通过多次实验计算自发频率的最大值,将ips细胞系间的自发频率的最大值进行比较,将最大值最大的ips细胞系的该最大值作为参考值采用。另外,可以将ips细胞系的自发频率的50%百分位数(中位数)作为参考值,也可以将30%百分位数作为参考值,也可以将平均值作为参考值采用。具体而言,对由多个细胞系构成的特定的ips细胞系,可以通过多次实验计算自发频率的平均值,将该ips细胞系中的自发频率的平均值的中位数、30%百分位数或平均值等作为参考值采用。然后,可以将自发频率为参考值以下的诱导的多能性干细胞,作为基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞识别。另外,如后述的实施例所示那样,显示自发频率为参考值以下的诱导的多能性干细胞,与自发频率超过该参考值的诱导的多能性干细胞相比,分化效率更高。因此,在本发明的另外的实施方式中,提供诱导的多能性干细胞的评价方法,其中,将上述识别步骤替代为以下评价步骤:将自发频率为参考值以下的诱导的多能性干细胞评价为与自发频率超过参考值的诱导的多能性干细胞相比,分化效率更高的诱导的多能性干细胞。<选择自发频率为参考值以下的诱导的多能性干细胞的步骤>在本步骤中,选择自发频率为参考值以下的诱导的多能性干细胞,作为基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞。通过利用现有的方法进行基因组结构的评价或测定分化效率,可以确认所选择的诱导的多能性干细胞为基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞。另外,通过将微核自发频率的参考值设为2%以下、1.9%以下、1.8%以下、1.7%以下、1.6%以下、1.5%以下、1.4%或1.3%以下而选择诱导的多能性干细胞,由此可以得到基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞。<对选择的诱导的多能性干细胞进行诱导分化以提供分化细胞的步骤>在本发明中对选择的诱导的多能性干细胞进行诱导分化的方法不受限定,可以利用各种已知的分化方法。已知的分化方法的实例包括:向t细胞的分化方法、向间充质干细胞的分化方法、向造血干细胞的分化方法、向红细胞的分化方法、向血小板的分化方法、向血管内皮细胞的分化方法、向心肌细胞的分化方法、向骨骼肌的分化方法、向神经干细胞的分化方法、向大脑皮质神经细胞的分化方法、向大脑边缘系统神经细胞的分化方法、向多巴胺能神经细胞的分化方法、向肝细胞的分化方法、向骨的分化方法、向软骨的分化方法、向原始生殖细胞的分化方法、向胰腺细胞的分化方法、向视网膜细胞的分化方法、向角膜细胞的分化方法、向肾脏细胞的分化方法、向肺泡上皮细胞的分化方法、向支气管上皮细胞的分化方法、向肠道的分化方法等。作为向t细胞的分化方法,可以适当选择并使用各种已知的诱导分化方法。作为已知的诱导分化方法的例子,包括在“timmermans,f.等,j.immunol.,2009,182,68879-6888”中记载的从人es细胞诱导t淋巴细胞的方法。另外,可以通过例如在“nishimura,t.等,cellstemcell,2013,12,114-126”中记载的方法,使从人外周血t淋巴细胞建立的人ips细胞向t淋巴细胞诱导分化。以下,结合实施例对本发明进行更为详细的说明,但本发明并不限于这些。实施例参考例1人es细胞的微核自发频率的测定(1)人es细胞对由京都大学的前沿医科学研究所提供的5种人es细胞株khes-1、khes-2、khes-3、khes-4及khes-5进行了微核自发频率的测定。对人es细胞而言,根据在“ueno,m.等,pnas2006,103(25),9554-9559”、“watanabe,k.等,natbiotech2007,25,681-686”中记载的方法,接种在经丝裂霉素c处理的小鼠成纤维细胞(reprocell)上,于37℃、2%co2条件下进行维持培养。对此时的培养基而言,在dmem/f12培养基(sigma-aldrich)中补充了20%knockouttmserumreplacement(ksr,invitrogen)、0.1mm非必需氨基酸(neaa;invitrogen)、2mml-谷氨酰胺(sigma-aldrich)及0.1mm2-巯基乙醇(wako)而成的培养基(以下,记作hes培养基)中,补充了bfgf(wako)(khes-1为10ng/ml、khes-2为30ng/ml、khes-3为15ng/ml、khes-4及khes-5为20ng/ml)并使用。对于khes-2、khes-3、khes-4及khes-5,进一步在上述培养基中添加y-27632(wako)(10μm)并使用。从维持培养开始1天之后起每天交换培养基,换成除了不包含y-27632以外分别具有相同组成的培养基。将经过了维持培养并粘附在细胞培养皿上的人es细胞,用磷酸盐缓冲盐水(pbs,invitrogen)洗涤2次之后,向该平皿添加补充了0.25%胰蛋白酶(invitrogen)、1mg/ml胶原酶iv(invitrogen)、20%ksr及1mmcacl2(nacalaitesque)的pbs,并在37℃、2%co2条件下培养5分钟。向上述平皿添加hes培养基之后,通过吹打而剥离细胞,回收包含细胞的培养基并离心(1000rpm、3分钟)。从离心后的上述培养物除去上清后,向沉淀添加补充了y-27632(wako)(20μm)的hes培养基,以便将细胞团块悬浮,并将得到的细胞团块悬浮液接种在以0.1%明胶(sigma-aldrich)包被的细胞培养皿(bdfalcon)上,于37℃、2%co2条件下培养2小时。将不粘附在平皿上的人es细胞团块与培养基一起回收,由此得到了不包含小鼠成纤维细胞的人es细胞团块的悬浮液。将悬浮液离心(1000rpm,1分钟)而除去上清后,添加补充了y-27632(20μm)的trypletmexpress(invitrogen),将细胞于37℃热水浴中培养5分钟。通过吹打使细胞分散为单个细胞后,添加hes培养基,以得到了分散为单个细胞的细胞悬浮液。(2)微核自发频率的测定方法和结果将(1)中得到的细胞悬浮液离心(1000rpm、5分钟),将上清替换为磷酸盐缓冲盐水(pbs,日水制药)。将得到的细胞悬浮液再次离心(1000rpm、5分钟)而除去上清,添加加热至37℃的75mmkcl(wako),进行5分钟的低渗处理。向低渗处理后的细胞悬浮液添加1/5体积的固定液(甲醇(nacalaitesque):冰乙酸(nacalaitesque)=3:1),将细胞半固定并离心(4℃、1000rpm、5分钟)。离心后,将上清替换为新鲜的固定液,将细胞固定并离心(4℃、1000rpm、5分钟)。除去上清,并将残余物以使得悬浮液为稍稍白浊的程度的细胞密度再悬浮于甲醇中,并将悬浮液滴加到载玻片上,风干而制成了微核样本。微核样本用100μg/ml吖啶橙(wako)溶液染色,在荧光显微镜下使用宽带(wide-band)blue激发的滤光片观察细胞。对每个细胞株而言对2块载玻片进行观察,对每块载玻片测定1000个人es细胞,即测定每细胞株2000个的人es细胞中具有微核的细胞数,算出微核自发频率。将结果示于表1。根据表1,最高的微核自发频率为2%。由于es细胞是癌变风险低而认为安全的,因此,可以采用该2%作为参考值。[表1]人es细胞的微核自发频率人es细胞株测定时刻的从建立起计的传代数微核自发频率khes-1361.05%khes-2302.00%khes-3261.20%khes-4371.50%khes-5351.60%实施例1人ips细胞的微核自发频率及分化效率的测定(1)人ips细胞在京都大学ips细胞研究所金子研究室中,依照“nishimura,t.等,cellstemcell2013,12,114-126”中记载的方法,进行了对于从人外周血淋巴细胞建立的人ips细胞株“2”、“3”、“5”、“9”、“10”、“11”及“12”共计7株人ips细胞的微核自发频率及分化效率的测定。(2)微核自发频率的测定方法将(1)中记载的人ips细胞根据“nishimura,t.等,cellstemcell2013,12,114-126”中记载的方法,接种在经丝裂霉素c处理的小鼠成纤维细胞(reprocell)上,于37℃、2%co2条件下进行维持培养。作为此时的培养基,在dmem/f12培养基(sigma-aldrich)中添加了20%ksr、2mml-谷氨酰胺、1%neaa及10μm2-巯基乙醇并补充了bfgf5ng/ml而使用。使用胰蛋白酶-edta(sigma-aldrich)从进行了维持培养的人ips细胞中仅除去小鼠成纤维细胞后,将人ips细胞悬浮于d-pbs(2%fbs)中,并用作用于微核自发频率测定的样品。使用该细胞悬浮液,依照参考例1(2)中记载的方法制作了微核样本,并进行观察。对每块载玻片测定1000个人ips细胞,即每细胞株2000个人ips细胞中具有微核的细胞数,算出微核自发频率。将结果示于表2。根据参考例1,当参考值为2%时,在该参考值以下的人ips细胞株为“2”及“3”。(3)分化效率的测定方法对于(1)中记载的人ips细胞,依照“nishimura,t.等,cellstemcell2013,12,114-126”中记载的方法,进行了向t细胞系列的诱导分化。使用针对表面抗原cd4及cd8的抗体进行了免疫染色,并使用流式细胞仪测定了cd4+cd8+细胞与cd45+cd3+cd7+细胞的比例,并用作分化效率。将结果示于表2。[表2]人ips细胞的微核自发频率和分化效率根据参考例1及实施例1可知,人es细胞的微核自发频率为1.05%~2.00%,稳定而低,与此相对,人ips细胞的微核自发频率因株而异变动较大,为1.35%~3.80%。认为其原因在于,人es细胞是在产生的过程中从早期胚胎起就没有进行基因操作而建立的,它们的基因组结构稳定,但人ips细胞通过在重编程期间的基因操作而形成异质性群体,基因组结构的包括稳定性在内的性质的变动比较大,根据选择的株而异。根据测定了从人ips细胞向t细胞系列的分化效率的实施例1的结果,确认了微核自发频率与分化效率之间的相关关系。在参考值设为2%的情况下,微核自发频率为参考值以下的人ips细胞株“2”及“3”,与微核自发频率超过参考值的人ips细胞株相比显示高3倍以上的分化效率。实施例2源自人ips细胞的t细胞中的微核自发频率的测定对于人ips细胞株“2”、“12”,依照“nishimura,t.等cellstemcell2013,12,114-126”中记载的方法,进行了向cd8sp(单阳性)t细胞的诱导分化。将得到的cd8spt细胞(以下,将该细胞记作再分化t细胞)扩大培养,并依照以下方法测定微核自发频率。即,将再分化t细胞以1.0×106细胞/ml的细胞密度接种在用1.0μg/ml抗cd3抗体okt3(ebioscience)包被的12孔板(bdfalcon)上,以给予增殖刺激。作为接种时的培养基,使用了添加有10%人血清ab(novabiologics)、1%青霉素链霉素(nacalaitesque)、100u/mlil-2(wako)、10ng/mlil-7(wako)及10ng/mlil-15(r&dsystems)的rpmi-1640培养基(含有l-谷氨酰胺,wako)(以下,记作rh培养基)。在17小时的增殖刺激后,对再分化t细胞进行总量回收,向细胞悬浮液(90μl)中加入rh培养基(60μl),并将细胞接种在未用okt3包被的96孔板(nunc)上。从再接种起约24小时后,除去上清(15μl),加入补充60μg/ml细胞松弛素b(wako)的rh培养基15μl(细胞松弛素b的最终浓度:6μg/ml)。从细胞松弛素b添加起33小时后,除去上清,添加pbs并搅拌混合物。离心(1500rpm、3分钟)之后,再次将上清用pbs替换并搅拌混合物。再次离心(1500rpm、3分钟)后,除去上清,添加加热至37℃的75mmkcl并进行5分钟的低渗处理。向低渗处理后的细胞悬浮液添加1/5体积的固定液(甲醇:冰乙酸=3:1),将细胞半固定并离心(4℃、1500rpm、3分钟)。离心后,将上清替换为新鲜的固定液,将细胞固定并离心(4℃、1500rpm、3分钟)。再次将上清替换为新鲜的固定液,将细胞固定并离心(4℃、1500rpm、3分钟)。此外,将上清替换为甲醇,将细胞固定并离心(4℃、1500rpm、3分钟)。除去上清后,将残余物以使得悬浮液为稍稍白浊的程度的细胞密度再悬浮于甲醇中,并将悬浮液滴加到载玻片上,风干而制成了微核样本。微核样本用40μg/ml吖啶橙溶液染色,在荧光显微镜下使用宽带blue激发滤光片观察细胞。对于株“2”观察了1000个2核细胞,对于株“12”观察了1500个2核细胞,测定具有微核的2核细胞数,计算总2核细胞中,具有微核的2核细胞占的比例。将结果示于表3。表3还显示了实施例1中测定的微核自发频率。[表3]再分化t细胞中的微核的自发频率人ips细胞中的微核自发频率与分化后的t细胞中的微核自发频率也是相关的,并且有可能通过利用本发明的选择方法选择人ips细胞株,而获得具有基因组结构的稳定性高和癌变的风险低的分化细胞。实施例3人ips细胞的微核自发频率的测定、核型分析及核形态的观察(1)人ips细胞在京都大学ips细胞研究所金子研究室中,使用“cytotune(注册商标)-ips2.0”(id制药),进行了对从人外周血淋巴细胞建立的人ips细胞株“d-1r(-)#1”、“d-1r(-)#2”、“f-1r(-)#2”、“f-1r(+)#1”及“f-3r(+)#1”共计5株的人ips细胞的微核自发频率的测定。另外,对在上述5株基础上加上实施例1中记载的人ips细胞7株,共计12株人ips细胞分别进行了对核形态的观察,对从该12株中除去“f-1r(+)#1”的共计11株的人ips细胞进行了核型分析。(2)微核自发频率的测定将进行了(1)中记载的微核自发频率测定的5株的人ips细胞,根据“无饲养层下的人ips细胞的建立及维持培养(来自cira网站)”中记载的方法接种在imatrix(nippi)上,于37℃、2%co2条件下进行维持培养。作为此时的培养基,使用了stemfitak03n(味之素有限公司)。使用0.5×triple(商品商标)select(thermofisherscientific)处理进行了维持培养的人ips细胞,以制备单细胞悬浮液,将人ips细胞悬浮于stemfitak03n,并用作用于微核自发频率测定的样品。将该细胞悬浮液离心(1000rpm、3分钟),将上清替换为磷酸盐缓冲盐水(pbs,日水制药)。将细胞悬浮液再次离心(1000rpm、3分钟),除去上清,添加加热至37℃的75mmkcl(wako)进行5分钟的低渗处理。向低渗处理后的细胞悬浮液添加1/5体积的固定液(甲醇(nacalaitesque):冰乙酸(nacalaitesque)=3:1),将细胞半固定并离心(4℃、1000rpm、3分钟)。离心后,将上清替换为新鲜的固定液,将细胞固定并离心(4℃、1000rpm、3分钟)。除去上清后,将残余物以使得悬浮液为稍稍白浊的程度的细胞密度再悬浮于2%固定液(甲醇:冰乙酸=98:2)中,并将悬浮液滴加到载玻片上,风干而制成了微核样本。微核样本用50μg/ml吖啶橙溶液染色,在荧光显微镜下使用宽带blue激发的滤光片观察细胞。对每个细胞株而言对2块载玻片进行观察,对每块载玻片测定1000个人ips细胞,即每细胞株2000个的人ips细胞中具有微核的细胞数,算出微核自发频率。将结果与实施例1(2)的微核自发频率测定结果共同示于表4。(3)核形态的观察将(2)中制作的5株的载玻片上的人ips细胞的微核样本、及实施例1(2)中制作的7株的载玻片上的人ips细胞的微核样本,如在微核自发频率的测定中同样用吖啶橙溶液染色,在荧光显微镜下使用宽带blue激发的滤光片观察核形态。在进行核形态的观察时,将满足以下[1]及[2]的细胞判定为“正常细胞”,将不满足[1]或[2]中的任一项的细胞或不满足[1]及[2]的细胞判定为“异常细胞”,将样本中大多数的细胞由正常细胞组成的人ips细胞株判定为“正常”株,将在样本中明显具有异常细胞的人ips细胞株判定为“异常”株。将结果示于表4。将代表性的正常细胞或异常细胞的图像示于图1~图4。[1]核膜的外缘明晰,且每个细胞具有1个核。[2]核膜中没有确认到损伤或诸如突起的异常结构,形状为光滑圆形或椭圆形。(4)核型分析将(1)中记载的共计11株的人ips细胞,进行类似于(2)或实施例1(2)的维持培养,回收细胞而制成细胞悬浮液,用作核型分析样品。核型分析委托了株式会社lsimedience实施。由细胞悬浮液制作分裂期的染色体样本,进行基于g带法的鉴别染色,将染色体按染色体编号进行分类,在每株人ips细胞株对20个细胞进行了分析。在核型分析中,具有染色体的结构异常(缺失,插入,倒位,易位,伴随染色体切割的染色体的异常结构)和/或数量的异常(不同于2对46根的染色体数量,如单体、三体、4倍体)细胞判定为“异常细胞”,并将没有显示任一种异常的细胞判定为“正常细胞”,将其中20个经分析的细胞全部为正常细胞的人ips细胞株判定为“正常”株,将具有1个以上的异常细胞的人ips细胞株判定为“异常”株。将结果示于表4。[表4]人ips细胞的微核自发频率、核形态观察结果和核型分析结果1)核膜表面不光滑但具有多角形样形状,并明显观察到怀疑具有核膜损伤的细胞。2)明显观察到在1个细胞中具有2个以上的核的多核细胞。3)明显观察到具有从核膜的突起结构的细胞。4)在20个细胞的一个中发现染色体缺失。5)在20个细胞的一个中发现染色体重复。确认了微核自发频率与示出基因组结构中有无异常的核型或核的形态之间的相关关系。在将参考值设为2%的情况下,微核自发频率为参考值以下的人ips细胞株的全部4株的核型和核形态均正常,与此相对,在微核自发频率超过参考值的人ips细胞株中的8株中,有7株显示核型或核形态中的至少一者具有异常。即,启示了通过利用本发明的选择方法选择人ips细胞株,由此得到基因组结构的稳定性高且癌变的风险较低的细胞的可能性。实施例4微核自发的频率为参考值以下的人ips细胞的制备(1)人ips细胞依照“nishimura,t.等,cellstemcell2013,12,114-126”中记载的方法,从人外周血淋巴细胞建立人ips细胞株。(2)微核自发频率的测定根据“nishimura,t.等,cellstemcell2013,12,114-126”中记载的方法,将(1)中记载的人ips细胞,接种在经丝裂霉素c处理的小鼠成纤维细胞(reprocell)上,于37℃、2%co2条件下进行维持培养。作为此时的培养基,在dmem/f12培养基(sigma-aldrich)中添加了20%ksr、2mml-谷氨酰胺、1%neaa及10μm2-巯基乙醇,并补充了bfgf5ng/ml而使用。使用胰蛋白酶-edta(sigma-aldrich)从进行了维持培养的人ips细胞中仅除去小鼠成纤维细胞,将人ips细胞悬浮于d-pbs(2%fbs)中,用作用于微核自发频率测定的样品。使用该细胞悬浮液,依照参考例1(2)中记载的方法制作了微核样本,并进行观察。对每块载玻片测定1000个人ips细胞,即每细胞株2000个人ips细胞中具有微核的细胞数,算出微核自发频率。识别了微核自发频率为2%以下的诱导的多能性干细胞与微核自发频率超过2%的诱导的多能性干细胞。通过选择微核自发频率为2%以下的诱导的多能性干细胞,获得了人ips细胞株作为微核自发频率为2%以下的诱导的多能性干细胞。识别了微核自发频率为1.3%以下的诱导的多能性干细胞、与微核自发频率超过1.3%的诱导的多能性干细胞。然后,通过选择微核自发频率为1.3%以下的诱导的多能性干细胞,获得了人ips细胞株作为微核自发频率为1.3%以下的诱导的多能性干细胞。根据这样的结果,可认为通过测定建立的各个诱导的多能性干细胞的微核自发频率,并选择示出与es细胞相同水平微核自发频率的细胞株,由此可以简便地以低成本有效地制备基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞,诱导的多能性干细胞的临床应用的可能性被进一步提高了。本申请基于在日本提交的专利申请号2016-252672(申请日:2016年12月27日),通过引用将其内容全部并入本说明书。工业实用性通过测定建立的诱导的多能性干细胞的微核自发频率,并选择示出与es细胞相同水平的微核自发频率的细胞株,由此可以简便地以低成本有效地制备基因组结构的稳定性高且癌变的风险低的诱导的多能性干细胞。由此,可以更有效地制作高品质的诱导的多能性干细胞银行,并可将其用于研究和医疗。另外,期望使用诱导的多能性干细胞的基础研究和临床应用的可能性进一步提高,例如,使在以往的技术中已然放弃的可临床应用的自体诱导多能性干细胞的选择变得更加现实。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1