双链连接的细胞毒性药物偶联物的制作方法
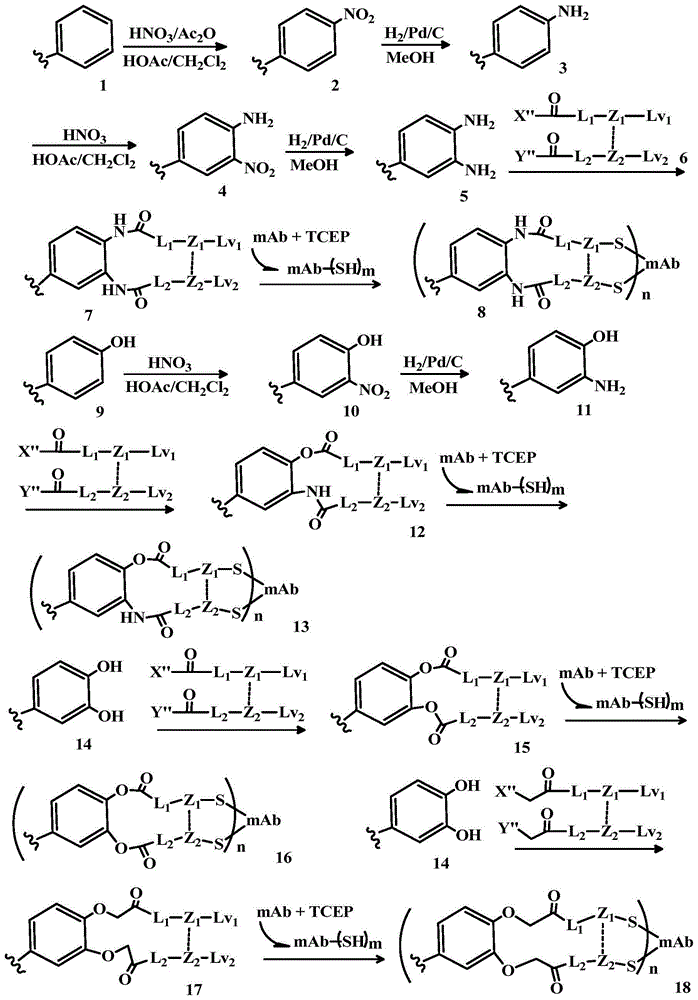
本发明涉及细胞毒性分子与细胞结合分子以双链连接方式的偶联。它涉及细胞毒性药物/分子与细胞结合分子以双链接偶联的方法,特别是当该药物具有氨基,羟基,二氨基,氨基-羟基,二羟基,羧基,肼,醛和巯基等双官能团时所用的方法。本发明还涉及以特定方式制备含双链连接体的细胞结合分子-药物(细胞毒性分子)偶联物的方法。
技术背景
抗体-药物偶联物(adc)已成为最有希望的癌症靶向治疗方法之一,brentuximabvedotin(adcetris)对复发/难治性霍奇金淋巴瘤(okeley,n.等,hematoloncol.clin.north.am,2014,28,13-25;gopal,a.等,blood2015,125,1236-43)和ado-trastuzumabemtansine治疗复发的her2+乳腺癌(peddi,p.和hurvitz,s.ther.adv.med.oncol.2014,6(5),202–9;lambert,j.和chari,r.j.med.chem.2014,57,6949-64)的临床成功证明了这一点。adc的三个重要组成部分,单克隆抗体,细胞毒性分子和选择性连接体,以及连接位点都是adc成功的重要因素。对adc组件的研究已有约三十年的历史。然而,可选的连接体技术仍然有限,因为偶联的药物必须含有某些反应性官能团,体循环稳定,并且在与抗原结合、被细胞内吞时后容易被释放,更重要的是,连接体-药物组分一旦在循环过程中脱靶,不能损害正常组织(ponte,j.等,bioconj.chem.2016,27(7),1588-98;dovgan,i.等sci.rep.2016,6,30835;ross,p.l.和wolfe,j.l.j.pharm.sci.105(2),391-7;chen,t.等j.pharm.biomed.anal.2016,117,304-10)。
在早期的adc开发时,其中的连接体,特别是靶向液体肿瘤的adc连接体很不稳定,会导致在循环中释放游离药物,造成脱靶毒性(bander,n.h.等,clin.adv.hematol.oncol.2012,10,1-16)。在当前一代的adc上,连接体更稳定,细胞毒性分子效力更强(behrens,c.r.和liu,b.mabs,2014.6,46-53)。然而,迄今为止,脱靶毒性仍然是adc药物开发的主要挑战(roberts,s.a.等,regul.toxicol.pharmacol.2013,67,382-91)。例如,在临床实践中,ado-trastuzumabemtansine(t-dm1,
为解决脱靶毒性问题,研究者在adc分子设计上试图扩大连接体-有效载荷和共轭化学的范围,不只是使用单一的有效有效载荷,尤其是解决靶向疾病的adc上连接体-有效负载的效能问题(lambert,j.m.therdeliv2016,7,279-82;zhao,r.y.等,2011,j.med.chem.54,3606-23)。如今,许多药物开发者和学术机构都非常注重开发新型的可靠的特异性连接体和定点偶联方法,这些adc具有更长的循环半衰期,更高的疗效,可能更低的脱靶毒性,更好的体内药代动力学(pk)特性,以及生产时有更好的批次间一致性(hamblett,k.j.等,clin.cancerres.2004,10,7063-70;adem,y.t.等,bioconjugatechem.2014,25,656-664;boylan,n.j.bioconjugatechem.2013,24,1008–1016;strop,p.等2013chem.biol.20,161-67;wakankar,a.mabs,2011,3,161–172)。迄今报道的这些特异性偶联方法包括在抗体上引入改造的半胱氨酸(junutula,j.r.等nat.biotechnol.2008,26,925–32;junutula,j.r.等2010clin.cancerres.16,4769;美国专利8,309,300;7,855,275;7,521,541;7,723,485;wo2008/141044),引入硒代半胱氨酸(hofer,t.等biochemistry2009,48,12047–57;li,x.等methods2014,65,133–8;美国专利8,916,159),引入含有五氟芳香试剂标签的半胱氨酸(zhang,c.等nat.chem.2015,8,1–9),引入巯基岩藻糖(okeley,n.m.等2013bioconjugatechem.24,1650),或引入非天然氨基酸(axup,j.y.等,proc.nat.acad.sci.usa.2012,109,16101-6;zimmerman,e.s.等,2014,bioconjug.chem.25,351–361;wu,p.等,2009proc.natl.acad.sci.106,3000-5;rabuka,d.等,nat.protoc.2012,7,1052-67;美国专利8,778,631;美国专利申请20100184135;wo2010/081110,wo2006/069246,wo2007/059312;美国专利7,332,571;7,696,312和7,638,299;wo2007/130453;美国专利7,632,492和7,829,659),通过二溴马来酰胺(jones,m.w.等j.am.chem.soc.2012,134,1847–52),双砜试剂(badescu,g.等bioconjug.chem.2014,25,1124–36;wo2013/190272,wo2014/064424),二溴哒嗪二酮(maruani,a.等nat.commun.2015,6,6645)重新桥接还原的分子间二硫化物,通过半乳糖基和唾液酸转移酶(zhou,q.等bioconjug.chem.2014,25,510–520;美国专利申请20140294867),甲酰甘氨酸生成酶(fge)(drake,p.m.等bioconj.chem.2014,25,1331–41;carrico,i.s.等美国专利7,985,783;8,097,701;8,349,910,和美国专利申请20140141025,20100210543),磷酸泛酰巯基乙胺基转移酶(pptases)(grünewald,j.等bioconjug.chem.2015,26,2554–62),转肽酶a(beerli,r.r.等plosone2015,10,e0131177),可与streptoverticilliummobaraense转谷氨酰胺酶(mtg)(strop,p.bioconj.chem.2014,25,855–62;strop,p.等,chem.biol.2013,20,161–7;美国专利8,871,908)或与微生物转谷氨酰胺酶(mtgase)(dennler,p.等,2014,bioconjug.chem.25,569–78;siegmund,v.等angew.chemie-int.ed.2015,54,13420–4;美国专利申请20130189287;美国专利7,893,019)作用的遗传导入的谷氨酰胺标签,可在蛋白质主链外部形成异肽键-肽键的酶/细菌(kang,h.j.等science2007,318,1625–8;zakeri,b.等proc.natl.acad.sci.usa2012,109,e690–7;zakeri,b.&howarth,m.j.am.chem.chem.soc.2010,132,4526–7)等而偶联。
我们已经公开了几种使天然抗体的链间二硫键被还原产生的一对巯基再桥联的偶联方法,例如使用溴代马来酰亚胺和二溴代马来酰亚胺连接体(wo2014/009774),2,3-二取代的琥珀酸/2-单取代的/2,3-二取代的富马酸或马来酸连接体(wo2015/155753,wo20160596228),乙炔二羧酸连接体(wo2015/151080,wo20160596228)或肼连接体(wo2015/151081)。用这些连接体和方法制备的adc比通过抗体上的半胱氨酸或赖氨酸残基的传统非选择性偶联物具有更好的治疗指数窗口。在本专利申请,我们公开了新的双链连接体和它们与细胞毒性分子的偶联方法,特别是细胞毒性分子含有二氨基,氨基-羟基,二羟基,羧基,醛和巯基等双链接基团时的方法。用双链连接体制备的免疫偶联物在靶向递送期间半衰期延长,并且在血液循环期间对非靶细胞,组织或器官的暴露最小化,具有更小的脱靶毒性。
发明概述
本发明描述了抗体与细胞毒性分子通过双链连接体偶联,特别是当细胞毒性分子具有氨基,羟基,二氨基,氨基-羟基,二羟基,羧基,肼或巯基等两个官能团。它还提供了双链连接体,用于以特定方式将细胞结合分子与细胞毒性分子偶联的方法。
在本发明的一个方面,双链连接体以结构式(i)表示:
其中
“-”代表单键;
“-----”任选为单键,双键或者可缺省;
n和m1分别为1到20的整数;
方框中与z1和z2连接的细胞结合剂/分子可以是目前已知的,或者即将变为已知的任何种类的分子,与具有治疗意义或生物学修饰的细胞群的片段,结合,复合或反应。优选地,细胞结合剂/分子是免疫治疗蛋白,抗体,抗体片段或具有超过四个氨基酸的肽;
方框中的细胞毒性分子/剂是治疗药物,或免疫治疗蛋白质/分子,或用于增强细胞结合剂的结合或稳定的功能分子,或细胞表面受体结合配体,或抑制细胞增殖的分子;
x和y,无论相同或不同,独立地为通过下列基团与细胞毒性药物连接的官能团:二硫化物,硫醚,硫酯,肽,腙,醚,酯,氨基甲酸酯,碳酸酯,胺(二,三或四级),亚胺,环杂烷基,杂芳族,烷氧基或酰胺键;优选地,x和y独立地选自nh,nhnh,n(r1),n(r1)n(r2),o,s,s-s,o-nh,o-n(r1),ch2-nh,ch2-n(r1),ch=nh,ch=n(r1),s(o),s(o2),p(o)(oh),s(o)nh,s(o2)nh,p(o)(oh)nh,nhs(o)nh,nhs(o2)nh,nhp(o)(oh)nh,n(r1)s(o)n(r2),n(r1)s(o2)n(r2),n(r1)p(o)(oh)n(r2),os(o)nh,os(o2)nh,op(o)(oh)nh,c(o),c(nh),c(nr1),c(o)nh,c(nh)nh,c(nr1)nh,oc(o)nh,oc(nh)nh,oc(nr1)nh,nhc(o)nh,nhc(nh)nh,nhc(nr1)nh,c(o)nh,c(nh)nh,c(nr1)nh,oc(o)n(r1),oc(nh)n(r1),oc(nr1)n(r1),nhc(o)n(r1),nhc(nh)n(r1),nhc(nr1)n(r1),n(r1)c(o)n(r1),n(r1)c(nh)n(r1),n(r1)c(nr1)n(r1);或c1-c6烷基;c2-c8烯基,杂烷基,烷基环烷基或杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,环烷基,杂烷基环烷基,烷基羰基或杂芳基;
z1和z2相同或不同,独立地是连接细胞结合分子的官能团,与之形成二硫化物,醚,酯,硫醚,硫酯,肽,腙,氨基甲酸酯,碳酸酯,胺(仲,叔或季),亚胺,环杂烷基,杂芳族,烷基肟或酰胺键;优选地,z1和z2独立地具有以下结构c(o)ch,c(o)c,c(o)ch2,arch2,c(o),nh,nhnh,n(r1),n(r1)n(r2),o,s,s-s,o-nh,o-n(r1),ch2-nh,ch2-n(r1),ch=nh,ch=n(r1),s(o),s(o2),p(o)(oh),s(o)nh,s(o2)nh,p(o)(oh)nh,nhs(o)nh,nhs(o2)nh,nhp(o)(oh)nh,n(r1)s(o)n(r2),n(r1)s(o2)n(r2),n(r1)p(o)(oh)n(r2),os(o)nh,os(o2)nh,op(o)(oh)nh,c(o),c(nh),c(nr1),c(o)nh,c(nh)nh,c(nr1)nh,oc(o)nh,oc(nh)nh,oc(nr1)nh,nhc(o)nh,nhc(nh)nh,nhc(nr1)nh,c(o)nh,c(nr1)nh,oc(o)n(r1),oc(nh)n(r1),oc(nr1)n(r1),nhc(o)n(r1),nhc(nh)n(r1),nhc(nr1)n(r1),n(r1)c(o)n(r1),n(r1)c(nh)n(r1),n(r1)c(nr1)n(r1);或c1-c8烷基,c2-c8杂烷基,烷基环烷基,杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,环烷基,杂烷基环烷基,烷基羰基,杂芳基;
优选地,z1和z2与细胞结合剂/分子上的巯基对相连接。巯基优选为通过还原剂将细胞结合剂的链间二硫键还原而产生,还原剂包括二硫苏糖醇(dtt),二硫赤藓糖醇(dte),l-谷胱甘肽(gsh),三(2-羧乙基)膦(tcep),2-巯基乙胺(β-mea),或/和β巯基乙醇(β-me,2-me);
l1和l2是包含c,n,o,s,si和p原子的链状结构,最优含0-500个原子,共价连接x和z1,y和z2。l1和l2中的各个原子以所有可能的化学方式结合,比如形成亚烷基,亚烯基和亚炔基,醚,聚氧化烯,酯,胺,亚胺,多胺,肼,腙,酰胺,脲,氨基脲,卡巴肼,烷氧胺,氨基甲酸酯,氨基酸,肽,酰氧基胺,异羟肟酸,或上述组合。优选地,l1和l2相同或不同,独立选自o,nh,s,nhnh,n(r3),n(r3)n(r3’),聚氧乙烯单元如(och2ch2)por3,或(och2ch(ch3))por3,或nh(ch2ch2o)pr3,或nh(ch2ch(ch3)o)pr3,或n[(ch2ch2o)pr3]-[(ch2ch2o)p’r3’],或(och2ch2)pcoor3,或ch2ch2(och2ch2)pcoor3,其中p和p'独立地是选自0至约1000的整数,或上述的组合;c1-c8烷基;c2-c8杂烷基,烷基环烷基,杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,环烷基,杂烷基环烷基,烷基羰基或杂芳基;
其中r3和r3’独立地为h;c1-c8烷基;c2-c8杂烷基,烷基环烷基或杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,杂烷基环烷基,烷基羰基或杂芳基;或c2-c8酯,醚或酰胺;或1-8个氨基酸;或结构式为(och2ch2)p或(och2ch(ch3))p聚氧乙烯基,其中p是0至约5000的整数,或上述组合;
l1或l2可任选地由下列一个或多个连接体组分组成:6-马来酰亚胺基己酰基(“mc”)、马来酰亚胺丙酰基(“mp”)、缬氨酸-瓜氨酸(“val-cit”或“vc”)、丙氨酸-苯丙氨酸(“ala-phe”or“af”)、对氨基芐氧基-羰基(“pab”)、4-硫代戊酰基(“spp”)、4-(n-马来酰亚胺甲基)环己烷-1酰基(“mcc”)、(4-乙酰基)氨基苯酰基(“siab”)、4-硫丁酰基(spdb)、4-硫-2-羟基磺酰基-丁酰基(2-sulfo-spdb),或含有1-8个天然或非天然氨基酸单元的天然或非天然肽。天然氨基酸最好选自天冬氨酸、谷氨酸、精氨酸、组氨酸、赖氨酸、丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、硒代半胱氨酸、酪氨酸、苯丙氨酸、甘氨酸、脯氨酸、色氨酸、丙氨酸;
此外,l1和l2独立地可以含有以下亲水结构之一:
x2,x3,x4,x5,和x6独立地选自nh;nhnh;n(r3);n(r3)n(r3’);o;s;c1-c6烷基;c2-c6杂烷基,烷基环烷基或杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,环烷基,杂烷基环烷基,烷基羰基,杂芳基;或1-8个氨基酸;其中r3和r3'独立地为h;c1-c8烷基;c2-c8杂烷基,烷基环烷基或杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,杂烷基环烷基,烷基羰基或杂芳基;c1-c8酯,醚或酰胺;或结构式为(och2ch2)p或(och2ch(ch3))p聚氧乙烯基,其中p是0至约5000的整数,或上述组合;
x1,和y1,独立地为o,nh,ch2,n(ch3),nhnh,s,c(o)o,c(o)nh;m1=1-20;
此外,l1,l2,x,y,z1,和z2独立地,可以缺省,但l1和z1,或l2和z2不可同时缺省。
另一方面,本发明提供了如下面结构式(ii)的易反应的双链连接体,其中细胞结合分子的两个或多个残基可以同时或依次与之反应,形成结构式(i)。
其中:
“-”代表单键;“-----”任选为单键,双键或三键或者可以缺省;
如果“-----”代表三键,lv1和lv2均可缺省;
方框中的细胞毒性分子,m1,x,y,l1,l2,z1,和z2与结构式(i)中定义相同;
lv1和lv2代表相同或不同的离去基团,可以与细胞结合分子上的巯基,胺,羧酸,硒醇,苯酚或羟基反应。此类离去基团包括但不限于,卤化物(例如氟化物,氯化物,溴化物和碘化物)、甲磺酰基、甲苯磺酰基、三氟甲基磺酰基、三氟甲基磺酸酯、硝基苯酚基、n-琥珀酰亚胺基(nhs)、苯酚基;二硝基苯酚基;五氟苯酚基、四氟苯酚基、三氟苯酚基、二氟苯酚基、一氟苯酚基、五氯苯酚基、1h-咪唑-1-基、一氯苯酚基、二氯苯酚基、三氯苯酚基、四氯苯酚基、n-(苯并三唑基)氧基、2-乙基-5-苯基异恶唑-3′-磺酰基、苯基恶二唑-磺酰基、2-乙基-5-苯基异恶唑基、苯基恶二唑基(oda)、恶二唑基、不饱和碳(碳-碳、碳-氮、碳-硫、碳-磷、硫-氮、磷-氮、氧-氮或碳-氧之间的双键或三键),或者与mitsunobu反应的缩合试剂作用产生的中间体分子,或者下列结构之一:
r1和r2独立地选自h,c1-c8烷基,c2-c8烯基,杂烷基,烷基环烷基或杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,环烷基,杂烷基环烷基,烷基羰基或杂芳基,或c2-c8酯,醚或酰胺;或含有1-8个氨基酸的肽;或具有式(och2ch2)p或(och2ch(ch3))p的聚氧乙烯基,其中p是0至约1000的整数,或上述基团的组合。
另一方面,本发明提供了如以下结构式(iii)的易反应双链连接体,细胞毒性分子的两个或多个官能团可以同时或依次与之反应形成结构式(i)。
其中:
m1,n,细胞结合剂/分子,l1,l2,z1,和z2如结构式(i)所示;
x’和y’是可以独立地同时或依次与细胞毒性药物的官能团反应,形成x和y官能团,其中x和y如式(i)中所定义;
x’和y’优选为n-羟基琥珀酰亚胺酯,对硝基苯酯,二硝基苯酯,五氟苯基酯,吡啶基二硫化物,硝基吡啶基二硫化物,马来酰亚胺基,肼,卤代乙酸酯,乙炔二羧基,酰卤化合物。优选地,x’和y’具有以下结构之一:
另一方面,本发明提供了如下面结构式(iv)的易反应双链连接体,其中细胞毒性分子和细胞结合分子可以独立地,与之同时或依次反应形成结构式(i)。
其中m1,l1,l2,z1和z2与结构式(i)中定义相同;lv1和lv2与结构式(ii)中相同,x’和y’与结构式(iii)中相同;
本发明进一步涉及结构式(i)中的细胞结合分子-药物偶联物的制备方法。
图例说明
图1显示了本专利申请的双链连接体偶联物的一般合成方法,一端是药物分子的苯二胺,苯基二醇或氨基苯酚基团,另一端的细胞结合分子上的一对巯基,其中波浪线是药物的其余部分或缺省的药物的连接部分(这里未示出)。
图2显示了酪氨酸(tyr)和tubutyrosine(tut)类似物的合成,其在苯环上具有氨基或硝基,用于与细胞结合分子双链连接。
图3显示了tubulysin类似物片段的合成
图4显示了tubulysin类似物片段的合成
图5显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图6显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图7显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图8显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图9显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图10显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图11显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图12显示了双链连接体片段的合成和其与tubutyrosine(tup)类似物(tubulysin片段)的双链连接。
图13显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图14显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图15显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图16显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图17显示了通过抗体上的一对巯基将含有双链连接体的tubulysin类似物与抗体偶联,和具有双酰胺双链连接体的tubuphenylalaine(tup)类似物的合成
图18显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图19显示了通过抗体上的一对巯基将含有双链连接体的tubulysin类似物与抗体偶联,和具有双酰胺双链连接体的tubuphenylalaine(tup)类似物的合成
图20显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图21显示了含有双链连接体的tubulysin类似物的合成及通过抗体中的一对巯基与其偶联。
图22显示了二甲基奥瑞他汀类似物的片段的合成
图23显示了含有双链连接体的二甲基奥瑞他汀f类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图24显示了含有双链连接体的二甲基奥瑞他汀f类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图25显示了含有双链连接体的二甲基奥瑞他汀f类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图26显示了含有双链连接体的二甲基奥瑞他汀f类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图27显示了含有双链连接体的二甲基奥瑞他汀f类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图28显示了含有双链连接体的二甲基奥瑞他汀f类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图29显示了在芳环上含有二氨基的amatoxin类似物的合成
图30显示了含有双链连接体的amatoxin类似物的合成及其通过抗体中的一对巯基与抗体偶联。
图31显示了双链连接体的合成及其与amatoxin类似物的连接。
图32显示了含有双链连接体的amatoxin类似物的合成及其通过抗体中的一对巯基与抗体偶联。
图33显示了含有双链连接体的amatoxin类似物的合成及其通过抗体中的一对巯基与抗体偶联。
图34显示了含有双链连接体的amatoxin类似物的合成及其通过抗体中的一对巯基与抗体偶联。
图35显示了含有双链连接体的amatoxin类似物和二甲基auristatinf类似物的合成,以及它们通过抗体上的一对巯基与抗体偶联。
图36显示了含有双链连接体的tubulysin类似物和cbi二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图37显示了含有双链连接体的cbi二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图37显示了含有双链连接体的cbi二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图39显示了含有双链连接体的cbi二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图40显示了含有双链连接体的cbi二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图41显示了含有双链连接体的pbd二聚体类似物的合成
图42显示了含有双链连接体的pbd二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图43显示了含有双链连接体的pbd二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图44显示了含有双链连接体的pbd二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图45显示了含有双链连接体的pbd二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图46显示了含有双链连接体的pbd二聚体类似物的合成,以及它们通过抗体中的一对巯基与抗体偶联。
图47比较了偶联物和t-dm1在人胃肿瘤n87细胞模型上的抗肿瘤作用,化合物为a-3a,b-6a,b-12a,b-15a,b-18a,b-20a,b-21a,b-24a,b-28a,c-3a,d-2a,采用pbs对照,静脉注射,a-3a,b-6a,b-12a,b-15a,b-18a,b-20a,b-21a,b-24a,b-28a和t-dm1一次给药3mg/kg,c-3a和d-1a一次给药1mg/kg。所有12种偶联物均显示出抗肿瘤活性。偶联物b-24a,c-3a,b-20a,b-21a和d-20a表现出比t-dm1更好的抗肿瘤活性。偶联物b-18a,b-15a,a-3a,b-6a,b-28a和b-12a组的活性比t-dm1更差。剂量为3mg/kg的t-dm1抑制肿瘤生长28天,但其在试验期间的无法消除肿瘤。相反,从第15天至第43天,偶联物b-20a,b-21a和d-20a可以根除一些动物的肿瘤。
图48显示了在处死动物后,pbs对照组和a-3a,b-15a,b-21a和t-dm1偶联物试验组动物和剥离出的肿瘤,偶联物b-21a组中的8只动物中,5只没有发现肿瘤(标记为无)。偶联物b-15a组的8只动物中,5只因其肿瘤太大,在第43天死亡(标记为死亡)。
图49显示了与常规单链连接的偶联物t-1a和t-dm1相比,偶联物b-21a在小鼠血清中的稳定性研究。这表明含有双链连接体的偶联物比含有单链连接的常规偶联物在小鼠血清中更稳定。
技术实现要素:
定义
“烷基”是指在烷烃上除去一个或两个氢原子而产生的脂肪烃基团或单价基团。它可以是直链或是支链的,在链中具有c1-c8(1-8个碳原子)。“支链”是指直链烷基上连接有一个或多个低碳数的烷基,如甲基、乙基或丙基。示例性的烷基包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基、正戊基、3-戊基、辛基、壬基、癸基、环戊基、环己基、2,2-二甲基丁基、2,3-二甲基丁基、2,2-二甲基戊基、2,3-二甲基戊基、3,3-二甲基戊基、2,3,4-三甲基戊基、3-甲基-己基、2,2-二甲基己基、2,4-二甲基己基、2,5-二甲基己基、3,5-二甲基己基、2,4-二甲基戊基、2-甲基庚基、3-甲基庚基、正庚基、异庚基、正辛基和异辛基。c1-c8烷基可以是未被取代的或被一个或多个基团取代,包括但不限于-c1-c8烷基、-o-(c1-c8烷基)、-芳基、-c(o)r'、-oc(o)r'、-c(o)or'、-c(o)nh2,-c(o)nhr'、-c(o)n(r')2、-nhc(o)r'、-sr'、-s(o)2r'、-s(o)r'、-oh、-卤素、-n3、-nh2、-nh(r')、-n(r')2和-cn;其中每个r'独立地选自于-c1-c8烷基和芳基。
“卤素”指氟、氯、溴或碘原子;优选氟和氯原子。
“杂烷基”指其中1至4个碳原子独立地被选自o、s和n的杂原子所取代的c2-c8烷基。
“碳环”指含有3到8个碳原子的饱和或不饱和单环,或含有7到13个碳原子的饱和或不饱和双环。单环碳环有3到6个环原子,典型的有5或6个环原子。双环碳环有7到12个环原子,构成[4,5]、[5,5]、[5,6]或[6,6]的双环系统,或有9个或10个环原子,构成[5、6]或[6,6]的双环系统。具有代表性的c3-c8的碳环包括但不限于:-环丙基、-环丁基、-环戊基、-环戊二烯基、-环己基、-环己烯基、-1,3-环己二烯基、-1,4-环己二烯基、-环庚基、-1,3-环庚二烯基、-1,3,5-环庚三烯基、-环辛基和-环辛二烯基。
c3-c8碳环可以是未被取代的或被一个或多个基团取代,包括但不限于-c1-c8烷基、-o-(c1-c8烷基)、-芳基、-c(o)r'、-oc(o)r'、-c(o)or'、-c(o)nh2、-c(o)nhr'、-c(o)n(r')2、-nhc(o)r'、-sr'、-s(o)r'、-s(o)2r'、-oh、-卤素、-n3、-nh2、-nh(r')、-n(r')2及-cn;其中每个r'独立地选自-c1-c8烷基和芳基。
“烯基”指含有碳-碳双键的直链或支链脂肪烃基团,链内含有2-8个碳原子。示例性的烯基包括乙烯基、丙烯基、正丁烯基、异丁烯基、3-甲基丁-2-烯基、正戊烯基、己烯基、庚烯基、辛烯基。
“炔基”指含有碳-碳三键的直链或支链脂肪烃基团,链内含有2-8个碳原子。示例性的炔基包括乙炔基、丙炔基、正丁炔基、2-丁炔基、3-甲基丁炔基、5-戊炔基、正戊炔基、己炔基、庚炔基和辛炔基。
“亚烷基”是指含1-18个碳原子的饱和的支炼或直链或环状烃基,并带有两个通过从母体烷烃的相同或两个不同碳原子上除去两个氢原子而产生的一价自由基。典型的亚烷基包括但不限于:亚甲基(-ch2-)、1,2-乙基(-ch2ch2-)、1,3-丙基(-ch2ch2ch2-)、1,4-丁基(-ch2ch2ch2ch2-)等。
“亚烯基”指含2-18个碳原子的不饱和的支炼或直链或环状烃基,并带有两个通过从母体烯烃的相同或两个不同碳原子上除去两个氢原子而产生的一价自由基。典型的亚烯基包括但不限于:1,2-亚乙基(-ch=ch-)。
“亚炔基”指含2-18个碳原子的不饱和的支炼或直链或环状烃基,并带有两个通过从母体炔的相同或两个不同碳原子上除去两个氢原子而产生的一价自由基。典型的亚炔基包括但不限于:乙炔、炔丙基和4-戊炔基。
“芳基”或“芳香基”指由一个或多个环组成的芳香或杂芳香基团,包含三至十四个碳原子,优选六至十个碳原子。术语“杂芳香基团”是指芳香基团上的一个或几个碳,最优是一个、两个、三个或四个碳原子,被氧(o)、氮(n)、硅(si)、硒(se)、磷(p)或(s)所取代,优选被氧、硫和氮所取代而产生的基团。术语“芳基”或“芳香基”也指其中一个或几个氢原子独立地被-r’、卤素、-or’,-sr’、-nr’r”、-n=nr’、-n=r’、-nr’r”、-no2、-s(o)r’、-s(o)2r’、-s(o)2or’、-os(o)2or’、-pr’r”、-p(o)r’r”、-p(or’)(or”)、-p(o)(or’)(or”)或-op(o)(or’)(or”)所取代而产生的芳香基团。其中r’和r”独立地为氢、烷基、烯基、炔基、杂烷基、芳基、芳烷基、羰基或其药用盐。
“杂环”指其中一到四个环碳原子独立地被o、n、s、se、b、si或p等杂原子所取代而产生的的环结构。优选的杂原子是o、n和s。在《化学与物理手册》第78版的225-226页(thehandbookofchemistryandphysics,78thedition,crcpress,inc.1997-1998,第225至226页)上也有杂环化合物的相关描述,在此引作参考。优选的非芳基杂环包括环氧基、氮丙啶基、硫杂丙基、吡咯烷基、吡唑烷基、咪唑烷基、环氧乙烷基、四氢呋喃基、二氧戊环基、四氢吡喃基、二恶烷基、二氧戊环基、呱啶基、呱嗪基、吗啉基、吡喃基、咪唑啉基、吡咯啉基、吡唑啉基、噻唑烷基、四氢噻喃基、二噻烷基、硫代吗啉基、二氢吡喃基、四氢吡喃基、二氢吡喃基、四氢吡啶基、二氢吡啶基、四氢嘧啶基、二氢噻喃基、氮杂环庚烷基,以及上述基团与苯基缩合得到的稠环体系。
“杂芳基”或“芳基杂环”是指含3到14,优选5至10个原子的芳香性杂环、包含单环、双环或多环。示例包括吡咯基、吡啶基、吡唑基、噻吩基、嘧啶基、吡嗪基、四唑基、吲哚基、喹啉基、嘌呤基、咪唑基、噻吩基、噻唑基、苯并噻唑基、呋喃基、苯并呋喃基、1,2,4-噻二唑基、异噻唑基、三唑基、四唑基、异喹啉基、苯并噻吩基、异苯并呋喃基、吡唑基、咔唑基、苯并咪唑基、异恶唑基、吡啶基-n-氧化物,以及上述基团与苯基缩合得到的稠环体系。
“烷基”、“环烷基”、“烯基”、“炔基”、“芳基”、“杂芳基”、“杂环”等,也包含各自对应的“亚烷基”、“亚环烷基”、“亚烯基”、“亚炔基”、“亚芳基”、“亚杂芳基”、“亚杂环”等,为论述方便,本专利申请对它们未做完全区分。
“芳烷基”指一类非环烷基,其中一个与碳原子(通常为末端或sp3碳原子)键合的氢原子被芳基取代。典型的芳烷基包括芐基、2-苯基乙-1-基、2-苯基乙烯-1-基、萘基甲基、2-萘基乙-1-基、2-萘基乙-1-基、萘并芐基、2-萘基苯基-1-基等。
“杂芳烷基”指一类非环烷基,其中一个与碳原子(通常为末端或sp3碳原子)键合的氢原子被杂芳基取代。杂芳烷基的实例有2-苯并咪唑基甲基、2-呋喃基乙基。
“羟基保护基”的实例包括甲氧基甲基醚、2-甲氧基乙氧基甲基醚、四氢吡喃基醚、芐基醚、对甲氧基芐基醚、三甲基甲硅醚、三乙基硅醚、三异丙基硅醚、叔丁基二甲基硅醚、三苯基甲基硅醚、乙酸酯、取代乙酸酯、特戊酸酯、苯甲酸酯、甲磺酸酯和对甲苯磺酸酯。
“离去基团”指可以被另一个官能团取代的官能团。这些离去基团是本领域公知的、实例包括卤化物(如氯化物、溴化物和碘化物)、甲磺酰基、对甲苯磺酰基和三氟甲磺酰基。优选的离去基团选自硝基苯酚基;n-羟基琥珀酰亚胺基(nhs);苯酚基;二硝基苯酚基;五氟苯酚基;四氟苯酚基;二氟苯酚基;一氟苯酚基;五氯苯酚基;三氟甲磺酰基;咪唑基;氯酚基;四氯苯酚基;1-羟基苯并三唑基;甲苯磺酰基;甲磺酰基;2-乙基-5-苯基异恶唑-3'-磺酰基,酸酐或与其它酸酐作用形成的酸酐,例如乙酸酐、甲酸酐;或与多肽缩合试剂、mitsunobu反应试剂作用生成的中间体。
以下缩写为本发明所采用,其定义为:boc,叔丁氧基羰基;brop,溴代十四烷基鏻六氟磷酸盐;cdi,1,1'-羰基二咪唑;dcc,二环己基碳二亚胺;dce,二氯乙烷;dcm,二氯甲烷;dead,偶氮二甲酸二乙酯;diad,偶氮二甲酸二异丙基酯;dibal-h,二异丁基氢化铝;dipea或dea,二异丙基乙胺;depc,二乙基氰基磷酸酯;dma,n,n-二甲基乙酰胺;dmap,4-(n,n-二甲基氨基)吡啶;dmf,n,n-二甲基甲酰胺;dmso,二甲基亚砜;dtpa,二亚乙基三胺五乙酸;dtt,二硫苏糖醇;edc,1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐;esi-ms,电喷雾质谱;etoac,乙酸乙酯;fmoc,n-(9-芴基甲氧基羰基);hatu,o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲六氟磷酸盐;hobt,1-羟基苯并三唑;hplc,高效液相色谱;nhs,n-羟基琥珀酰亚胺;mecn,乙腈;meoh,甲醇;mmp,4-甲基吗啉;pab,对氨基苯甲酸;pbs,磷酸盐缓冲液(ph7.0-7.5);ph,苯基;phe,l-苯丙氨酸;pybrop,溴-三-吡咯烷-鏻六氟磷酸盐;peg,聚乙二醇;sec,尺寸排阻色谱;tcep,三(2-羧乙基)膦;tfa,三氟乙酸;thf,四氢呋喃;val,缬氨酸。
“氨基酸”可以是天然或非天然的,优选α-氨基酸。天然氨基酸可以由遗传密码所编码,它们是丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、酪氨酸、色氨酸和缬氨酸。非天然氨基酸是蛋白质氨基酸的衍生物,包括羟脯氨酸、羊毛硫氨酸、2-氨基异丁酸、脱氢丙氨酸、γ-氨基丁酸(神经递质)、鸟氨酸、瓜氨酸、β-丙氨酸(3-氨基丙酸)、γ-羧基谷氨酸、硒代半胱氨酸(存在于许多非真核以及大多数真核细胞中、但不是由dna直接进行编码)、吡咯赖氨酸(仅在一些古细菌和一种细菌中发现)、n-甲酰基甲硫氨酸(通常是细菌、线粒体和叶绿体中蛋白质中最初的氨基酸)、5-羟色氨酸、l-二羟基苯丙氨酸、三碘甲腺原氨酸、l-3,4-二羟基苯丙氨酸(dopa)和o-磷酸丝氨酸。术语“氨基酸”还包括氨基酸类似物和模拟物。类似物是具有与天然氨基酸相同结构通式h2n(r)chco2h的化合物,其中r在天然氨基酸里。类似物的实例包括高丝氨酸、正亮氨酸、甲硫氨酸-亚砜和甲硫氨酸甲基锍。更优的是氨基酸模拟物,它是具有与α-氨基酸的化学结构不同、但是作用方式类似的化合物。天然氨基酸多为“l”立体化学构型,“非天然氨基酸”也用于代表“d”构型的氨基酸。在本专利申请中使用1至8个氨基酸时、其序列优选为蛋白水解酶可识别的序列。许多水解酶识别序列是本领域已知的,可以参见:matayoshi等.science247954(1990);dunn等.meth.enzymol.241254(1994);seidah等.meth.enzymol.244175(1994);thornberry,meth.enzymol.244615(1994);weber等.meth.enzymol.244595(1994);smith等.meth.enzymol.244412(1994);及bouvier等.meth.enzymol.248614(1995);此处引作参考。特别是选自以下序列:val-cit、ala-val、ala-ala、val-val、val-ala-val、lys-lys、ala-asn-val、val-leu-lys、cit-cit、val-lys、ala-ala-asn、asp-lys、asp-glu、glu-lys、lys、cit、ser及glu。
“糖苷”是糖通过糖苷键在其异头碳上与另一基团键合得到的分子。糖苷可以通过o-(产生o-糖苷)、n-(产生糖基胺)、s-(产生硫代糖苷)或c-(产生c-糖苷)糖苷键连接,其实验式为cm(h2o)n(其中m可以不同于n,m和n<36),本发明中的糖苷包括葡萄糖(右旋糖)、果糖(左旋糖)、阿洛糖、阿卓糖、甘露糖、古洛糖、艾杜糖、半乳糖、塔罗糖、半乳糖胺、氨基葡萄糖、唾液酸、n-乙酰胺基葡萄糖、磺基奎诺糖(6-脱氧-6-磺基-d-吡喃葡萄糖)、核糖、阿拉伯糖、木糖、来苏糖、山梨糖醇、甘露醇、蔗糖、乳糖、麦芽糖、海藻糖、麦芽糖糊精、棉子糖、葡萄糖醛酸(葡糖苷酸)和水苏糖。它可以是d或l的构型、5原子环状呋喃糖的形式、6原子环状吡喃糖的形式,或是非环形式、α-异构体(异头碳的-oh在haworth投影碳原子平面之下)、或β-异构体(异头碳的-oh在haworth投影碳原子平面之上)。本发明中亦称为单糖、二糖、多元醇或含3-6个糖单元的低聚糖。
“药学上”或“药学上可接受的”是指当分子实体和组合物酌情施用于动物或人时,不会产生不利、过敏或其他不良反应。
“药学上可接受的溶剂化物”或“溶剂化物”是指一种或多种溶剂分子与本发明公开的化合物的结合物。形成药学上可接受的溶剂合物,溶剂的实例包括但不限于水、异丙醇、乙醇、甲醇、dmso、乙酸乙酯、乙酸和乙醇胺。
“药学上可接受的赋形剂”包括任何载体、稀释剂、佐剂或其它,例如防腐剂或抗氧化剂、填充剂、崩解剂、润湿剂、乳化剂、悬浮剂、溶剂、分散介质、包衣剂、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。这些介质和药剂用于药物活性物质在本领域内是熟知的。任何传统介质或药剂,除非与活性成分不兼容,也可以考虑将其用于治疗组合物中。补充活性成分也可以加入组合物中,成为合适的治疗组合。
如本文所用,“药用盐”是指所公开化合物的衍生物,通过制备母体化合物的酸盐或碱盐来获得。药学上可接受的盐包括由无毒无机酸或有机酸与母体化合物形成的常规无毒盐或季铵盐。例如,所述常规无毒盐包括衍生自无机酸(例如盐酸、氢溴酸盐、硫酸、氨基磺酸、磷酸、硝酸等)的盐;以及由有机酸(例如乙酸、丙酸、琥珀酸、酒石酸、柠檬酸、甲磺酸、苯磺酸、葡萄糖醛酸、谷氨酸、苯甲酸、水杨酸、甲苯磺酸、草酸、富马酸、马来酸及乳酸等制备的盐。另外的加成盐包括铵盐,如三甲胺、葡甲胺、丙三醇等的盐、金属盐、如钠、钾、钙、锌或镁盐。
本发明的药用盐可由含有碱性或酸性部分的母体化合物,通过常规化学方法合成。通常而言,这些盐可以通过在水或有机溶剂中或两者的混合物中,向母体化合物里,加入等eq.的适当碱或酸来制备。一般来说,乙醚、乙酸乙酯、乙醇、异丙醇或乙腈是非水介质的首选。适用盐的列表见于1985年由麦克出版公司出版的《雷明顿药物科学》(remington'spharmaceuticalsciences),其公开内容纳入本文作参考。
“施用”或“给药”是指以任何方式向受试者转移、递送、引入或运输药物或其他药剂。这些方式包括口服用药、局部接触、静脉内、腹膜内、肌肉内、病灶内、鼻内、皮下或鞘内给药。本发明还考虑使用装置或器械来施用药剂。这种装置可以使用主动或被动型传输,而且可以是缓释或快速释放递送装置。
本文公开的新型偶联物使用了双链连接体。图1至34显示了一些合适的连接体及其合成的实例。
一种双链连接的细胞结合剂和细胞毒性分子的偶联物
双链接偶联物由结构式(i)表示:
其中
“-”代表单键;
“-----”任选为单键,双键或者可缺省;
n和m1独立地为1到20的整数;
方框中与z1和z2连接的细胞结合剂/分子可以是目前已知的,或者即将变为已知的任何种类的分子,与具有治疗意义或生物学修饰的细胞群的片段,结合,复合或反应。优选地,细胞结合剂/分子是免疫治疗蛋白,抗体,单链抗体;与靶细胞结合的抗体片段;单克隆抗体;单链单克隆抗体;或结合靶细胞的单克隆抗体片段;嵌合抗体;与靶细胞结合的嵌合抗体片段;域抗体;与靶细胞结合的域抗体片段;模拟抗体的adnectins;darpins;淋巴因子;激素;维生素;增长因素;集落刺激因子;或营养转运分子(转铁蛋白);含超过四个氨基酸的结合肽,或蛋白质,或抗体,或附着在白蛋白,聚合物,树枝状大分子,脂质体,纳米颗粒,囊泡或(病毒)衣壳上的小的细胞结合分子或配体;
方框中的细胞毒性分子/药剂是治疗药物/分子/试剂,或免疫治疗蛋白质/分子,或用于增强细胞结合或稳定细胞结合剂的功能分子,或细胞表面受体结合配体,或抑制细胞增殖分子;或用于监测,检测或研究细胞结合作用的分子。它也可以是免疫治疗化合物、化学治疗化合物的类似物或前药,或药学上可接受的盐,水合物或水合盐,或晶体,或光学异构体,外消旋体,非对映异构体或对映异构体,抗体(probody)或抗体(probody)片段,或sirna、dna分子,或细胞表面结合配体;
优选地,细胞毒性分子可以是小分子药物中的任何一种,包括但不限于tubulysin,加利车霉素,奥瑞他汀,美登素类,cc-1065类似物,吗啉代多柔比星,紫杉烷,隐藻菌素,鹅膏毒肽(鹅膏毒环肽),埃坡霉素,布林,格尔德霉素,多卡霉素,道诺霉素,甲氨蝶呤,长春地辛,长春新碱和苯并二氮卓二聚体(例如吡咯并苯二氮卓(pbd),托美霉素,吲哚并苯并二氮卓,咪唑并苯并噻二氮卓,或恶唑烷并苯并二氮卓的二聚体);
x和y,独立地为相同或不同的官能团,通过二硫化物,硫醚,硫酯,肽,腙,醚,酯,氨基甲酸酯,碳酸酯,胺(二级,三级或四级),亚胺,环杂烷基,杂芳基,烷氧基或酰胺键连接细胞毒性药物;优选地,x和y独立地选自nh,nhnh,n(r1),n(r1)n(r2),o,s,s-s,o-nh,o-n(r1),ch2-nh,ch2-n(r1),ch=nh,ch=n(r1),s(o),s(o2),p(o)(oh),s(o)nh,s(o2)nh,p(o)(oh)nh,nhs(o)nh,nhs(o2)nh,nhp(o)(oh)nh,n(r1)s(o)n(r2),n(r1)s(o2)n(r2),n(r1)p(o)(oh)n(r2),os(o)nh,os(o2)nh,op(o)(oh)nh,c(o),c(nh),c(nr1),c(o)nh,c(nh)nh,c(nr1)nh,oc(o)nh,oc(nh)nh;oc(nr1)nh,nhc(o)nh;nhc(nh)nh;nhc(nr1)nh,c(o)nh,c(nh)nh,c(nr1)nh,oc(o)n(r1),oc(nh)n(r1),oc(nr1)n(r1),nhc(o)n(r1),nhc(nh)n(r1),nhc(nr1)n(r1),n(r1)c(o)n(r1),n(r1)c(nh)n(r1),n(r1)c(nr1)n(r1);或c1-c6烷基;c2-c8烯基,杂烷基,烷基环烷基或杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,环烷基,杂烷基环烷基,烷基羰基或杂芳基;
z1和z2独立地为相同或不同的官能团,通过二硫化物,醚,酯,硫醚,硫酯,肽,腙,氨基甲酸酯,碳酸酯,胺(二级,三级或四级),亚胺,环杂烷基,杂芳族,烷基肟或酰胺键连接细胞结合分子;优选地,z1和z2独立地具有以下结构c(o)ch,c(o)c,c(o)ch2,arch2,c(o),nh,nhnh,n(r1),n(r1)n(r2),o,s,s-s,o-nh,o-n(r1),ch2-nh.ch2-n(r1),ch=nh.ch=n(r1),s(o),s(o2),p(o)(oh),s(o)nh,s(o2)nh,p(o)(oh)nh,nhs(o)nh,nhs(o2)nh,nhp(o)(oh)nh,n(r1)s(o)n(r2),n(r1)s(o2)n(r2),n(r1)p(o)(oh)n(r2),os(o)nh,os(o2)nh,op(o)(oh)nh,c(o),c(nh),c(nr1),c(o)nh,c(nh)nh,c(nr1)nh,oc(o)nh,oc(nh)nh,oc(nr1)nh,nhc(o)nh,nhc(nh)nh,nhc(nr1)nh,c(o)nh,c(nh)nh,c(nr1)nh,oc(o)n(r1),oc(nh)n(r1),oc(nr1)n(r1),nhc(o)n(r1),nhc(nh)n(r1),nhc(nr1)n(r1),n(r1)c(o)n(r1),n(r1)c(nh)n(r1),n(r1)c(nr1)n(r1);或c1-c8烷基;c2-c8杂烷基,烷基环烷基或杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,环烷基,杂烷基环烷基,烷基羰基或杂芳基;
优选地,z1和z2与细胞结合剂/分子上的巯基对相连接。巯基优选为通过还原剂将细胞结合剂的链间二硫键还原而产生,还原剂包括二硫苏糖醇(dtt),二硫赤藓糖醇(dte),l-谷胱甘肽(gsh),三(2-羧乙基)膦(tcep),2-巯基乙胺(β-mea),或/和β巯基乙醇(β-me,2-me);
l1和l2是包含c,n,o,s,si和p原子的链状结构,最优含0-500个原子,共价连接x和z1,y和z2。l1和l2中的各个原子以所有可能的化学方式结合,比如形成c1-c20亚烷基,亚烯基和亚炔基,醚,聚氧化烯,酯,胺,亚胺,多胺,肼,腙,酰胺,脲,氨基脲,卡巴肼,烷氧胺,氨基甲酸酯,氨基酸,肽,酰氧基胺,异羟肟酸,或上述组合。优选地,l1和l2相同或不同,独立选自o,nh,s,nhnh,n(r3),n(r3)n(r3’);c1-c8烷基、酰胺、胺、亚胺、肼、腙;c2-c8杂烷基、烷基环烷基、醚、酯、腙、脲、氨基脲、卡巴肼、烷氧基胺、氨基甲酸酯、氨基酸、肽、酰氧基胺、羟肟酸或杂环烷基;c3-c8芳基、芳烷基,杂环、碳环、环烷基、异烷基环烷基、烷基羰基或杂芳基;聚氧乙烯单元,如(och2ch2)por3,或(och2ch(ch3))por3,或nh(ch2ch2o)pr3,或nh(ch2ch(ch3)o)pr3,或n[(ch2ch2o)pr3]-[(ch2ch2o)p’r3’],或(och2ch2)pcoor3,或ch2ch2(och2ch2)pcoor3,其中p和p'独立地是选自0至约5000的整数,或上述的组合;其中r3和r3’独立地为h;c1-c8烷基;c2-c8杂烷基,烷基环烷基或杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,杂烷基环烷基,烷基羰基或杂芳基;或c2-c8酯,醚或酰胺;或1-8个氨基酸;或结构式为(och2ch2)p或(och2ch(ch3))p聚氧乙烯基,其中p是0至约5000的整数,或上述组合;
l1或l2可任选地由下列一个或多个连接体组分组成:6-马来酰亚胺基己酰基(“mc”)、马来酰亚胺丙酰基(“mp”)、缬氨酸-瓜氨酸(“val-cit”或“vc”)、丙氨酸-苯丙氨酸(“ala-phe”or“af”)、对氨基芐氧基-羰基(“pab”)、4-硫代戊酰基(“spp”)、4-(n-马来酰亚胺甲基)环己烷-1酰基(“mcc”)、(4-乙酰基)氨基苯酰基(“siab”)、4-硫丁酰基(spdb)、4-硫-2-羟基磺酰基-丁酰基(2-sulfo-spdb),或含有1-8个天然或非天然氨基酸单元的天然或非天然肽。天然氨基酸最好选自天冬氨酸、谷氨酸、精氨酸、组氨酸、赖氨酸、丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、硒代半胱氨酸、酪氨酸、苯丙氨酸、甘氨酸、脯氨酸、色氨酸、丙氨酸;
l1和l2独立地可以含有自我毁灭或非自我毁灭的组分、肽单元、腙键、二硫化物、酯、肟、酰胺或硫醚键。自我毁灭单元包括但不限于,与对氨基芐基氨甲酰基(pab)的电子结构相似的芳香化合物,例如2-氨基咪唑-5-甲醇的衍生物、杂环pab类似物、β-葡糖苷酸、以及邻或对氨基芐基缩醛;
优选的自我毁灭型连接体组分具有以下结构之一:
其中(*)是另外的间隔体或可释放的连接体单元,或细胞毒性分子和/或细胞结合分子的连接点;x1,y1,z2和z3独立地为nh,o,或s;z1独立地为h,nhr1,or1,sr1,cox1r1,其中x1和r1如前文所定义;v是0或1;u1独立地为h,oh,c1-c6烷基,(och2ch2)n,f,cl,br,i,or5,sr5,nr5r5’,n=nr5,n=r5,nr5r5’,no2,sor5r5’,so2r5,so3r5,oso3r5,pr5r5’,por5r5’,po2r5r5’,opo(or5)(or5’)或och2po(or5(or5’),其中r5和r5'独立地选自h,c1-c8烷基;c2-c8烯基,炔基,杂烷基或氨基酸;c3-c8芳基,杂环,碳环,环烷基,杂环烷基,杂芳烷基,烷基羰基或糖苷;或药用阳离子盐;
非自我毁灭型连接体组分具有以下结构之一:
其中(*)是另外的间隔体或可释放的连接体单元,或细胞毒性分子和/或细胞结合分子的连接点;x1,y1,u1,r5,r5’如前文所定义;r是0-100;m和n独立地为0-6;
进一步优选地,l1和l2独立地是可释放的连接体组分。术语“可释放的”是指连接体上包含至少一个可在生理条件下被破坏的键,例如ph、酸、碱、氧化作用、代谢、生化或酶不稳定的键。应当理解,导致键断裂不一定是生物或代谢过程、而可能是一个标准化学反应、例如水解或取代反应,这种生理条件的例子有ph值比细胞浆内ph低的内涵体,恶性细胞内存在的毫摩尔浓度的大量谷胱甘肽,它能够与细胞内硫醇发生二硫键交换反应;
可释放连接体l1或l2的实例包括但不限于:
(cr5r6)m(aa)r(cr7r8)n(och2ch2)t-,(cr5r6)m(cr7r8)n(aa)r(och2ch2)t-,(aa)r-(cr5r6)m(cr7r8)n(och2ch2)t-,(cr5r6)m(cr7r8)n(och2ch2)r(aa)t-,-(cr5r6)m-(cr7=cr8)(cr9r10)n(aa)t(och2ch2)r-,-(cr5r6)m(nr11co)(aa)t(cr9r10)n-(och2ch2)r-,-(cr5r6)m(aa)t(nr11co)(cr9r10)n(och2ch2)r-,-(cr5r6)m(oco)(aa)t(cr9r10)n-(och2ch2)r-,-(cr5r6)m(ocnr7)(aa)t(cr9r10)n(och2ch2)r-,-(cr5r6)m(co)(aa)t-(cr9r10)n(och2ch2)r-,-(cr5r6)m(nr11co)(aa)t(cr9r10)n(och2ch2)r-,-(cr5r6)m-(oco)(aa)t(cr9r10)n-(och2ch2)r-,-(cr5r6)m(ocnr7)(aa)t(cr9r10)n(och2ch2)r-,-(cr5r6)m(co)(aa)t(cr9r10)n-(och2ch2)r-,-(cr5r6)m-苯基co(aa)t(cr7r8)n-,-(cr5r6)m-呋喃co(aa)t(cr7r8)n-,-(cr5r6)m-恶唑co(aa)t(cr7r8)n-,-(cr5r6)m-噻唑基co(aa)t(ccr7r8)n-,-(cr5r6)t-噻吩co(cr7r8)n-,-(cr5r6)t-咪唑co-(cr7r8)n-,-(cr5r6)t-吗啉co(aa)t-(cr7r8)n-,-(cr5r6)t哌嗪-co(aa)t-(cr7r8)n-,-(cr5r6)t-n甲基co(aa)t-(cr7r8)n-,-(cr5r)m-(aa)t苯基-,-(cr5r6)m-(aa)t呋喃,-(cr5r6)m-恶唑(aa)t,-(cr5r6)m-噻唑基(aa)t,-(cr5r6)m-噻吩-(aa)t-,-(cr5r6)m-咪唑(aa)t-,-(cr5r6)m-吗啉(aa)t-,-(cr5r6)m-哌嗪(aa)t-,-(cr5r6)m-n甲基哌嗪(aa)t-,k(cr5r6)m(aa)r(cr7r8)n(och2ch2)t-,k(cr5r6)m(cr7r8)n(aa)r(och2ch2)t-,k(aa)r-(cr5r6)m(cr7r8)n(och2ch2)t-,k(cr5r6)m(cr7r8)n(och2ch2)r(aa)t-,k(cr5r6)m-(cr7=cr8)(cr9r10)n(aa)t(och2ch2)r-,k(cr5r6)m(nr11co)(aa)t(cr9r10)n(och2ch2)r-,k(cr5r6)m(aa)t(nr11co)(cr9r10)n(och2ch2)r-,k(cr5r6)m(oco)(aa)t(cr9r10)n-(och2ch2)r-,k(cr5r6)m(ocnr7)(aa)t(cr9r10)n(och2ch2)r-,k(cr5r6)m(co)(aa)t-(cr9r10)n(och2ch2)r-,k(cr5r6)m(nr11co)(aa)t(cr9r10)n(och2ch2)r-,k(cr5r6)m-(oco)(aa)t(cr9r10)n(och2ch2)r-,k(cr5r6)m(ocnr7)(aa)t(cr9r10)n(och2ch2)r-,k-(cr5r6)m(co)(aa)t(cr9r10)n(och2ch2)r-,k(cr5r6)m-苯基co(aa)t(cr7r8)n-,k-(cr5r6)m-呋喃co(aa)t-(cr7r8)n-,k(cr5r6)m-恶唑co(aa)t(cr7r8)n-,k(cr5r6)m-噻唑基co(aa)t-(cr7r8)n-,k(cr5r6)t-噻吩co(cr7r8)n-,k(cr5r6)t咪唑-co-(cr7r8)n-,k(cr5r6)t吗啉co(aa)t(cr7r8)n-,k(cr5r6)t哌嗪-co(aa)t-(cr7r8)n-,k(cr5r6)t-n甲基co(aa)t(cr7r8)n-,k(cr5r)m(aa)t苯基,k-(cr5r6)m-(aa)t呋喃-,-k(cr5r6)m-恶唑(aa)t-,k(cr5r6)m-噻唑基(aa)t-,k(cr5r6)m-噻吩-(aa)t-,k(cr5r6)m-咪唑(aa)t-,k(cr5r6)m-吗啉(aa)t-,k(cr5r6)m-哌嗪(aa)t-,k(cr5r6)mn甲基哌嗪(aa)t-;其中m,aa,m和n定义如前文所描述;t和r独立地为0-100;r3,r4,r5,r6,r7,和r8独立地选自h;卤化物;c1-c8烷基;c2-c8芳基,烯基,炔基,醚,酯,胺或酰胺,这些基团均可以被以下基团所取代:一个或多个卤素、cn、nr1r2、cf3、or1、芳基、杂环、s(o)r1、so2r1、-co2h、-so3h、-or1、-co2r1、-conr1、-po2r1r2、-po3h或p(o)r1r2r3;k是nr1、-ss-、-c(=o)-、-c(=o)nh-、-c(=o)o-、-c=nh-o-、-c=n-nh-、-c(=o)nh-nh-、o、s、se、b、het(具有c3-c8的杂环或杂芳环),或含有1-20个氨基酸的肽;
此外,l1和l2独立地可以含有以下亲水结构之一:
更优选地,r1,l1或l2独立地为具有1-6个碳原子的直链烷基,或具有式(och2ch2)p,p=1-5000的聚氧乙烯单元,或含有1-4个氨基酸单元(l或d形式)的肽,或上述组合。
另外,x,y,l1,l2,z1或z2独立地可以由以下一种或多种下列组分组成:
或者,x,y,l1,l2,z1或z2独立地可以缺省,但是l1和z1,或l2和z2不可以同时缺省。
优选地,双链连接的偶联物由如下结构式(i-a),(i-b),(i-c),(i-d),(i-e),(i-f),(i-g),(i-h),(i-i),(i-j),(i-k),(i-m),(i-n),(i-o),(i-p),(i-q),(i-r),(i-s),(i-t),(i-u),(i-v),和(i-w)表示:
其中x7和y7独立地为ch,ch2,nh,o,s,nhnh,n(r1)和n;交叉的化学键意味着可以与两端任一原子连接;“-----”,x,y,r1,n,l1和l2与前文定义相同;细胞毒性分子是与前文相同的细胞毒性分子。
更优选地,x和y独立地是芳环上的氨基,羟基,二氨基,氨基-羟基,二羟基,羧基,醛,肼,巯基,磷酸酯或磺酰基。
以双链连接药物和细胞结合分子的偶联物的制备
本发明中的药物和细胞结合分子的偶联和通过双链连接合成偶联物的途径示意于图1-46中。
一方面,本发明提供了如结构式(ii)的含有细胞毒性分子的易反应双链连接体,与细胞结合分子上的两个或多个残基可以同时或依次反应形成结构式(i)。
其中:
“-”代表单键;
“-----”任选为单键,或双键,或三键,或者缺省;
如果“-----”为三键,lv1和lv2均缺省;
方框中的细胞毒性分子,m1,x,y,l1,l2,z1,和z2与结构式(i)中定义相同;
lv1和lv2代表相同或不同的离去基团,可与细胞结合分子上的巯基,胺,羧酸,硒醇,酚或羟基反应。lv1和lv2独立地选自oh;f;cl;br;i;硝基苯酚基;n-羟基琥珀酰亚胺(nhs)基;苯酚基;二硝基苯酚基;五氟苯酚基;四氟苯酚基;单氟苯酚基;五氯苯酚基;三氟甲磺酸酯;咪唑基;氯酚基;四氯苯酚基;n-(苯并三唑基)氧基;甲苯磺酰基;甲磺酰基;2-乙基-5-苯基异恶唑鎓-3'-磺酰基;或与多肽偶联反应或mitsunobu反应缩合试剂产生的中间分子。缩合试剂的例子包括1-乙基-(3-二甲基氨基丙基)碳二亚胺(edc)、二环己基碳二亚胺(dcc)、n,n'-二异丙基碳二亚胺(dic)、n-环己基-n'-(2-吗啉代-乙基)碳二亚胺甲基对甲苯磺酸盐(cmc或cme-cdi)、1,1'-羰基二咪唑(cdi)、氧-(苯并三唑-1-)基)-n,n,n’,n’-四甲基脲四氟硼酸盐(tbtu)、n,n,n',n'-四甲基-氧-(1h-苯并三唑-1-基)-六氟磷酸铵(hbtu)、(苯并三唑-1-基氧基)三(二甲基氨基)-六氟磷酸盐(bop)、(苯并三唑-1-基氧基)三吡咯烷基六氟磷酸盐(pybop)、氰基膦酸二乙酯(depc)、氯-n,n,n',n'-四甲基甲脒六氟磷酸盐、1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶3-氧六氟磷酸盐(hatu)、1-[(二甲氨基)(吗啉代)亚甲基]-1h-[1,2,3]三唑并[4,5-b]吡啶-1-鎓3-氧六氟磷酸盐(hdma)、2-氯-1,3-二甲基-咪唑六氟磷酸盐(cip)、六氟磷酸氯代吡咯烷酮鎓(pyclop)、氟-n,n,n',n'-双(四亚甲基)甲脒六氟磷酸盐(btffh)、n,n,n',n'-四甲基-s-(1-氧代-2-吡啶基)硫脲六氟磷酸盐、氧-(2-氧代-1(2h)吡啶基)-n,n,n',n'-四甲基脲四氟硼酸盐(tptu)、s-(1-氧代-2-吡啶基)n,n,n',n'-四甲基硫脲四氟硼酸盐、氧-[(乙氧基羰基)-氰基甲基氨基]-n,n,n',n'-六氟磷酸四甲基脲(hotu)、(1-氰基-2-乙氧基-2-氧代乙基氨基氧基)二甲氨基-吗啉代-六氟磷酸盐(comu)、氧-(苯并三唑-1-基)-n,n,n',n'-双(四亚甲基)六氟磷酸盐(hbpyu)、n-芐基-n'-环己基-碳二亚胺(有或没有聚合物结合)、二吡咯烷基(n-琥珀酰亚胺基氧基)碳鎓六氟磷酸盐(hspyu)、氯二吡咯烷基六氟磷酸盐(pyclu)、2-氯-1,3-二甲基咪唑四氟硼酸盐(cib)、(苯并三唑-1-基氧基)二呱啶碳六氟磷酸盐(hbpipu)、氧-(6-氯苯并三唑-1-基)-n,n,n',n'-四甲基脲四氟硼酸盐(tctu)、溴代(二甲基氨基)-六氟磷酸盐(brop)、丙基膦酸酐(ppaca、
优选地,lv1和lv2独立地可选自以下物质:卤化物(如氟化物、氯化物、溴化物和碘化物)、甲磺酰基(mesyl)、甲苯磺酰基(tosyl)、三氟甲基磺酰基(triflate)、三氟甲基磺酸盐、硝基苯酚基、n-琥珀酰亚胺基(nhs)、苯酚基;二硝基苯酚基;五氟苯酚基、四氟苯酚基、三氟苯酚基、二氟苯酚基、一氟苯酚基、五氯苯酚基、1h-咪唑-1-基、一氯苯酚基、二氯苯酚基、三氯苯酚基、四氯苯酚基、n-(苯并三唑基)氧基、2-乙基-5-苯基异恶唑-3′-磺酰基、苯基恶二唑-磺酰基、2-乙基-5-苯基异恶唑基、苯基恶二唑基、恶二唑基、不饱和碳(碳-碳、碳-氮、碳-硫、碳-磷、硫-氮、磷-氮、氧-氮或碳-氧之间的双键或三键),或以下结构之一:
单取代琥珀酰亚胺;
其中r1,r2,r3,r4和r3’独立地为h;c1-c8烷基;c2-c8杂烷基,烷基环烷基或杂环烷基;c3-c8芳基,芳烷基,杂环,碳环,杂烷基环烷基,烷基羰基或杂芳基;或c1-c8酯,醚或酰胺;或1-8个氨基酸;或结构式为(och2ch2)p或(och2ch(ch3))p的聚氧乙烯基,其中p是0至约100的整数,或上述组合;
此外,能够连接药物或细胞毒性分子的官能团x或y,优选为能够形成二硫化物,硫醚,硫酯,肽,腙,酯,氨基甲酸酯,碳酸酯,烷氧肟或酰胺键的基团。这样的官能团包括但不限于巯基,二硫化物,氨基,羧基,醛,酮,马来酰亚胺基,卤代乙酰基,肼,烷氧基氨基和/或羟基;
优选地,双链连接体由如下结构式表示(ii-a),(ii-b),(ii-c),(ii-d),(ii-e),(ii-f),(ii-g),(ii-h),(ii-i),(ii-j),(ii-k),(ii-m),(ii-n),(ii-o),(ii-q),(ii-r),(ii-s),(ii-t),(ii-u),(ii-v),(ii-w),(ii-x),(ii-y),(ii-z),(ii-a1),(ii-a2),(ii-a3)和(ii-a4)
其中x7和y7独立地为ch,ch2,nh,o,s,nhnh,n(r1)和n;x,y,r1,n,“-----”,l1和l2与前文相同;交叉的化学键意味着可以与两端任一原子连接;r1,x,y,n,l1,l2,lv1和lv2与前文相同。优选lv1和lv2独立地选自cl,br,i,甲磺酰基,甲苯磺酰基,三氟甲磺酰基,三氟甲基磺酸酯和硝基苯酚基。
另一方面,本发明提供了如结构式(iii)的易反应双链连接体,细胞毒性分子的两个或多个官能团可以同时或依次与之反应形成结构式(i):
其中:
m1,n,“-----”,细胞结合剂/分子,l1,l2,z1,和z2如结构式(i)所定义;
x’和y’独立地为可以同时或依次与细胞毒性分子反应形成x和y的官能团,其中x和y如式(i)中所定义;
优选x'和y'独立地为二硫化物,马来酰亚胺基,卤代乙酰基,烷氧基胺,叠氮基,酮,醛,肼,氨基,羟基,羧基,咪唑基,巯基或炔烃;或n-羟基琥珀酰亚胺酯,对硝基苯基酯,二硝基苯基酯,五氟苯基酯,五氯苯基酯;四氟苯基酯;二氟苯基酯;单氟苯基酯;或五氯苯基酯,二氯苯基酯,四氯苯基酯或1-羟基苯并三唑酯;三氟甲磺酸酯,甲磺酸酯或甲苯磺酸酯;2-乙基-5-苯基异恶唑-3′-磺酸酯;吡啶基二硫化物,或硝基吡啶基二硫化物;马来酰亚胺基,卤代乙酸酯,乙炔二羧基或酰卤化合物(氟化物,氯化物,溴化物或碘化物)。优选地,x和y具有以下结构之一:
优选地,用于制备偶联物的双链接化合物由结构式(iii-a),(iii-b),(iii-c),(iii-d),(iii-e),(iii-f),(iii-g),(iii-h),(iii-i),(iii-j),(iii-k),(iii-l),(iii-m),(iii-n),(iii-o),(iii-p),(iii-r),(iii-s),(iii-t),(iii-u),(iii-v),和(iii-w)表示:
其中x7和y7独立地为ch,ch2,nh,o,s,nhnh,n(r1)和n;交叉的化学键意味着可以与两端任一原子连接;r1,x,y,r1,n,l1和l2与前文定义相同。
另一方面,本发明提供了如下面结构式(iv)的易反应双链连接体,细胞毒性分子和细胞结合分子可以独立地,与之同时或依次反应形成结构式(i)。
其中“-----”,m1,l1,l2,z1和z2与结构式(i)中定义相同;lv1和lv2与结构式(ii)中相同,x’和y’与结构式(iii)中相同;
优选地,用于制备偶联物的双链连接体进一步由结构式(iv-a),(iv-b),(iv-c),(iv-d),(iv-e),(iv-f),(iv-g),(iv-h),(iv-i),(iv-j),(iv-k),(iv-m),(iv-n),(iv-o),(iv-p),(iv-q),(iv-r),和(iv-s)表示:
其中x7和y7独立地为ch,ch2,nh,o,s,nhnh,n(r1)和n;交叉的化学键意味着可以与两端任一原子连接;“-----”,r1,x’,y’,n,l1和l2与前文相同。
能与药物/细胞毒性剂的末端胺或羟基反应的官能团x’或y’包括,但不限于n-羟基琥珀酰亚胺酯,对硝基苯基酯,二硝基苯基酯,五氟苯基酯,酰氯或羧酸酐;能和细胞毒性剂的末端巯基反应的官能团可以是吡啶二硫化物,硝基吡啶二硫化物,马来酰亚胺基,卤代乙酸酯,甲基砜基苯基恶二唑(oda),酰氯或羧酸酐;能和末端酮或醛反应的官能团可以是,也不限于胺,烷氧基胺,肼,酰氧基胺或酰肼;和末端叠氮基反应的官能可以是,也不限于炔基。
偶联物的制备
结构式(i)的偶联物可分别通过结构式(ii),(iii)或(iv)的中间体化合物制备。部分结构式(ii)分子的制备显示在图1-40中。为了合成式(i)的偶联物,通常,药物上或细胞毒性分子上的两个官能团首先依次或同时与结构式(iv)连接体上的x'基团和y'基团,在化学溶剂中或在含有0.1%-99.5%有机溶剂的水性介质中或在100%水性介质中反应,形成结构式(ii)的化合物。可首先分离结构式(ii)的化合物,或者可以立即,同时或依次与细胞结合分子的两个或更多个残基,优选为还原细胞结合分子的二硫键而产生的一对游离巯基,在0-60℃,ph5-9的水性介质中,添加或不添加0-30%的可与水混合(混溶的)有机溶剂,例如dma,dmf,乙醇,甲醇,丙酮,乙腈,thf,异丙醇,二恶烷,丙二醇或乙二醇,反应形成结构式(i)的偶联化合物。
或者,结构式(i)的偶联物也可以通过结构式(iv)的连接体与细胞结合分子的两个或更多个残基,优选为还原细胞结合分子的二硫键而产生的一对游离巯基,在0-60℃,ph5-9的水性介质中,添加或不添加0-30%的可与水混合(混溶的)有机溶剂,反应形成结构式(iii)的修饰的细胞结合分子。成对的巯基优选是通过还原细胞结合剂的链间二硫键所得,还原剂可选自二硫苏糖醇(dtt),二硫赤藓糖醇(dte),l-谷胱甘肽(gsh),三(2-羟乙基)膦(tcep),2-巯基乙胺(β-mea),或/和β-巯基乙醇(β-me,2-me)。结构式(iii)中x'和y'的反应性基团,独立地可以为二硫化物,巯基,硫酯,马来酰亚胺基,卤代乙酰基,叠氮化物,1-炔,酮,醛,烷氧基氨基,三氟甲磺酸酯,羰基咪唑,甲苯磺酸酯,甲磺酸酯,2-乙基-5-苯基异恶唑-3'-磺酸酯,或硝基苯酚基,n-羟基琥珀酰亚胺(nhs)基,苯酚基;二硝基苯酚基,五氟苯酚基,四氟苯酚基,二氟苯酚基,单氟苯酚基,五氯苯酚基,二氯苯酚基,四氯苯酚基,苯并三唑-1-氧基,酸酐或肼,或其他羧酸衍生物,它们可以同时或依次在0-60℃,ph4-9.5水介质中,加入或不加入0-30%可与水混合(混溶)的有机溶剂,和药物/细胞毒性剂上的两个基团反应,柱纯化或透析后得到结构式(i)的偶联物。因此,药物/细胞毒性分子的反应性基团以不同的方式与结构式(iii)的修饰的细胞结合分子反应。例如,通过结构式(iii)的修饰细胞结合分子中的二硫键,与药物分子上的游离巯基进行二硫键交换,生成结构式(i)的细胞结合分子-药物偶联物中的二硫键;通过结构式(iii)的马来酰亚胺基或卤代乙酰基或乙基磺酰基修饰的细胞结合分子,与药物分子上的游离巯基反应,生成结构式(i)的细胞结合分子-药物偶联物的硫醚键;通过使用本领域已知的方法,让药物或结构式(iii)化合物上的羰基与结构式(iii)化合物或药物上的酰肼反应,生成偶联物中酸不稳定的腙键(参见p.hamann等,cancerres.53,3336-34,1993;b.laguzza等,j.med.chem.32;548-55,1959;p.trail等,cancerres.57;100-5,1997);使用点击化学(huisgen环加成)的方法,通过药物或结构式(iii)化合物上的炔基与另一对应物上的叠氮基反应,生成偶联物中的三唑键(lutz,j-f.等,2008,adv.drugdel.rev.60,958–70;sletten,e.m.等2011,acc.chem.research44,666–76)。通过结构式(iii)的修饰的细胞结合剂或药物上一组酮或醛与药物或细胞结合剂上的一组氧胺的反应,生成肟连接的细胞结合分子-药物偶联物的肟键。含巯基的药物可与结构式(iii)的修饰的细胞结合分子上的马来酰亚胺基,或卤代乙酰基或乙基磺酰基在ph5.5-9.0的水性缓冲液中反应,生成结构式(i)的细胞结合分子-药物偶联物中的硫醚键。含巯基的药物可以与结构式(iii)的修饰连接体上的吡啶二硫基进行二硫键交换,得到二硫键连接的偶联物。带有羟基或巯基的药物可以与结构式(iii)的带有卤素修饰的连接体,特别是羧酸酯的α位卤化物,在温和的碱环境下,例如ph8.0-9.5,反应得到带有醚或硫醚键的药物。在脱水缩合剂如edc或dcc存在下,药物上的羟基可与带有羧基的如式(iv)的连接体缩合,生成酯键,得到如结构式(iii)的经药物修饰的连接体,再与细胞结合分子偶联。含有氨基的药物可以与如结构式(iii)的细胞结合分子-连接体上含下列活性酯反应,包括nhs酯,咪唑酯,硝基苯酚酯;n-羟基琥珀酰亚胺(nhs)基酯;苯酚酯;二硝基苯酚酯;五氟苯酚酯;四氟苯酚酯;二氟苯酚酯;单氟苯酚酯;五氯苯酚酯;三氟甲磺酸酯;咪唑酯;二氯苯酚酯;四氯苯酚酯;1-羟基苯并三唑酯;甲苯磺酸酯;甲磺酸酯;2-乙基-5-苯基异恶唑-3'-磺酸酯,得到通过酰胺键连接的偶联物。
合成的偶联物可以通过标准生物化学方法纯化,例如在sephadexg25或sephacryls300柱上进行凝胶过滤,吸附色谱,离子交换,或透析。在一些情况下,细胞结合剂为小分子化合物(例如叶酸、黑素细胞刺激激素、egf等),与小分子药物偶联后,可以通过色谱法纯化,例如hplc、中压柱层析法或离子交换色谱法。
为了使如结构式(ii)的细胞毒性分子-双链接连接体与细胞结合分子,优选抗体,上的一对游离巯基的偶联反应有更高产率,可能需要在反应混合物中加入少量水溶性有机溶剂或相转移剂。可将式(ii)上的交联剂(连接体),以高浓度如1-500mm溶解于可与水混溶的极性有机溶剂中,例如不同的醇(如甲醇、乙醇和丙醇)、丙酮、乙腈、四氢呋喃(thf)、1,4-二恶烷、二甲基甲酰胺(dmf)、二甲基乙酰胺(dma)或二甲基亚砜(dmso)。同时,将细胞结合分子,如抗体以1~50mg/ml浓度溶解在ph4~9.5,最优ph6~8.5的缓冲液中,再用0.5~20eq.的tcep或dtt处理20分钟至48小时。还原后,dtt可通过sec色谱纯化去除。tcep也可以通过sec色谱法去除,或者留在反应混合物中,无需进一步纯化。此外,以tcep还原抗体或其他细胞结合剂,可以在式(ii)的药物-连接体分子共存时进行,此时药物与细胞结合分子的偶联,可以与tcep还原同时实现。
进行修饰细胞结合剂反应的水溶液为ph4至9之间缓冲液,优选在6.0至7.5之间,并且可以含有适合用于这个ph范围的任何非亲核性缓冲盐。典型的缓冲液包括磷酸盐、乙酸盐、三乙醇胺盐酸盐、hepes和mops缓冲液,也可含有其它组分,例如环糊精、羟丙基-β-环糊精、聚乙二醇、蔗糖和其它盐,如nacl和kcl。在将式(ii)中的药物-连接体加入到含有还原的细胞结合分子的溶液中后,反应混合物在4℃至45℃,优选15℃的温度下保温。对反应进程的监测,可以测量在某一特定紫外线波长(例如252nm)吸亮度的减少,或某一特定紫外线波长(例如280nm)吸亮度的增加,或选择其它适当波长。反应完成后,被修饰的细胞结合剂可以以常规方式被分离,例如使用凝胶过滤色谱、离子交换色谱、吸附色谱,硅胶或氧化铝柱层析色谱,结晶、制备薄层色谱或hplc方法。
可以通过测量反应生成的硝基吡啶硫酮、二硝基吡啶二硫酮、吡啶硫酮、羧基酰胺基吡啶二硫酮和二羧基酰胺基吡啶二硫酮基团的紫外吸亮度,对修饰程度进行评估。对于没有发色基团分子的偶联反应、修饰或偶联反应可以通过lc-ms监测、优选uplc-qtof质谱或毛细管电泳质谱法(ce-ms)监测。本发明所述的连接体含有多种官能团,可与细胞结合分子,尤其是具有合适取代基的修饰的细胞结合分子反应。例如,带有氨基或羟基的修饰的细胞结合分子,可以与带有n-羟基琥珀酰亚胺(nhs)酯的药物反应,带有巯基的修饰的细胞结合分子,可以与带有马来酰亚胺基或卤代乙酰基的药物反应。另外,带有羰基(酮或醛)基团的细胞结合分子,可以与带有酰肼或烷氧基胺的药物反应。基于连接体上官能团的反应活性,本领域技术人员可以很容易地确定使用哪种连接体分子。
细胞结合剂
本发明中的细胞结合剂,包括偶联物内和被修饰的细胞结合剂,可以是目前已知的或即将公开的,能够与细胞片段结合,复合或反应的,具有治疗意义或者被生物学修饰的任何种类分子。
细胞结合剂包括,但不仅限于大分子量蛋白质,例如抗体;类抗体蛋白;完整抗体(多克隆抗体,单克隆抗体,二聚体,多聚体,多特异性抗体,例如双特异性抗体,三特异性抗体,四特异性抗体);单链抗体;抗体片段如fab,fab',f(ab')2,fv(parham,j.immunol.1983,131,2895-2902);由fab表达库产生的片段,抗独特型(抗-id)抗体;cdr;双价抗体;三价抗体;四价抗体;微型抗体;probody;probody片段;小免疫蛋白;上述任何抗体的表位结合片段,能免疫特异性结合癌细胞抗原,病毒抗原,微生物抗原;由免疫系统产生的蛋白质,能够识别、结合特定抗原或具有期望的生物学活性(milleretalj.ofimmunology2003,170,4854-4861);干扰素(如i,ii,iii型);多肽;淋巴因子如il-2,il-3,il-4,il-5,il-6,il-10,gm-csf,干扰素-γ(ifn-γ);激素例如胰岛素,trh(促甲状腺激素释放激素),msh(促黑素细胞激素),类固醇激素如雄激素和雌激素;生长因子和集落刺激因子,如表皮生长因子(egf),粒细胞巨噬细胞集落刺激因子(gm-csf),转化生长因子(tgf)如tgfα,tgfβ,胰岛素和胰岛素样生长因子(igf-i,igf-ii),g-csf,m-csf和gm-csf(burgess,immunologytoday1984,5,155-158);牛痘生长因子(vgf);成纤维细胞生长因子(fgf);小分子量的蛋白质;多肽;肽和肽激素,如铃蟾肽,胃泌素,胃泌素释放肽;血小板衍生的生长因子;白细胞介素和细胞因子,例如,白细胞介素-2(il-2),白细胞介素-6(il-6),白血病抑制因子,粒细胞巨噬细胞集落刺激因子(gm-csf);维生素,如叶酸;脱辅基蛋白和糖蛋白,如转铁蛋白(o'keefeetal,j.biol.chem.1985260932-937);糖结合蛋白或脂蛋白,如凝集素;细胞营养传递分子;小分子抑制剂,如前列腺特异性膜抗原(psma)抑制剂和小分子酪氨酸激酶抑制剂(tki),非肽或任何其它细胞结合分子或物质,如生物活性聚合物(dhar,etal,proc.natl.acad.sci.2008,105,17356-61),生物活性树枝状大分子(lee,etal,nat.biotechnol.2005,23,1517-26;almutairi,etal;proc.natl.acad.sci.2009,106,685-90),纳米粒子(liong,etal,acsnano,2008,19,1309-12;medarova,etal,nat.med.2007,13,372-7;javier,etal,bioconjugatechem.2008,19,1309-12),脂质体(medinai,etal,curr.phar.des.2004,10,2981-9)和病毒外壳(flenniken,etal,virusesnanotechnol.2009,327,71-93)。
一般而言,如果适当的单克隆抗体是可用的,则优选单克隆抗体作为细胞表面结合剂。抗体可以是鼠源,人源,人源化,嵌合或源于其他物种。
用于本发明中的抗体的生产包括体内或体外方法或其组合。生产多克隆抗受体肽抗体的方法在本领域是公知的,例如美国专利4,493,795中所述。通常是通过将骨髓瘤细胞,与已经用所需抗原免疫的小鼠的脾细胞融合,来制备单克隆抗体(
用于本发明中的单克隆抗体的生产在单克隆杂交瘤培养物里进行,其中包含营养培养基和能分泌具有合适抗原特异性的抗体分子的杂交瘤。培养物在合适的条件下保持足够长的一段时间,以使杂交瘤将抗体分子分泌到培养基。然后收集含有抗体的培养基。使用通过公知的技术进一步分离抗体分子,如蛋白质a亲和层析,阴离子、阳离子、疏水或体积排阻色谱法(特别是通过蛋白质a亲和层析和体积排阻色谱法),离心,差异溶解度或任何其他纯化蛋白质的标准技术。
可用于制备这些组合物的培养基在本领域中是公知的,并且可商业获得,也包括合成培养基。一个合成的培养基的例子是dulbecco最少必需培养基(dmem;dulbecco等,virol.1959,8,396)补充有4.5g/ml葡萄糖,0-20mm谷氨酰胺,0-20%胎牛血清,几个ppm的cu,mn,fe或zn等重金属或/和重金属盐,以及消泡剂如聚氧乙烯-聚氧丙烯嵌段共聚物。
另外,生产抗体的细胞系也可以通过融合以外的技术来获得,例如将成瘤dna移植至b淋巴细胞,或成瘤病毒转染,如爱泼斯坦-巴尔病毒(ebv,也称为人类疱疹病毒4(hhv-4))或卡波西肉瘤相关疱疹病毒(kshv),见于美国专利4,341,761;4,399,121;4,427,783;4,444,887;4,451,570;4,466,917;4,472,500;4,491,632;4,493,890。单克隆抗体也可以通过含末端羧基的抗受体肽或肽制备,这些都为如本领域所公知,可参考文献niman等,proc.natl.acad.sci.usa,1983,804949-4953;geysen等,proc.natl.acad.sci.usa,1985,82178-182;lei等biochemistry1995,34(20)6675-6688。通常,作为产生抗受体肽单克隆抗体免疫原,抗受体肽或肽类似物可以单独使用或连接至免疫原性载体。
用作本发明中结合分子的单克隆抗体也可以通过其他本领域已知的技术获得。特别有用的是制造完整人源抗体的方法。一种方法是噬菌体显示技术,它使用亲和富集的方式,可用于选择能与抗原特异性结合的人源抗体。噬菌体展示技术在文献中也有详细描述,噬菌体展示库的构建和筛选在本领域也是众所周知的,可参考文献denteetal,gene.1994,148(1):7-13;littleetal,biotechnoladv.1994,12(3):539-55;clackson等,nature1991,352:264-628;huse等,science1989,246:1275-1281。
通过与非人如小鼠细胞融合的杂交瘤产生的单克隆抗体,可以被人源化以避免产生人类抗小鼠抗体。常见的抗体人源化方法是互补决定区移植技术,这些方法也已被详细地描述,如美国专利5,859,205和6,797,492;liuetal,immunolrev.2008,222:9-27;almagroetal,frontbiosci.2008,131619-33;lazaretal,molimmunol.2007,44(8):1986-98;lietal,proc.natl.acad.sci.usa.2006,103(10):3557-62,此处引为参考。完整人抗体也可以通过用免疫原免疫携带大部分的人类球蛋白重轻链的转基因小鼠、兔子、猴子或其他哺乳动物来制备。这些老鼠的例子有:xenomouse(abgenix/amgen),humab-mouse(medarex/bms)和velocimouse(regeneron),参考美国专利6,596,541,6,207,418,6,150,584,6,111,166,6,075,181,5,922,545,5,661,016,5,545,806,5,436,149和5,569,825。用于人类治疗时,小鼠的可变区域和人的恒定区域也可以被融合,成为“嵌合抗体”,它在人类身上的免疫原性显著低于小鼠单抗(kipriyanovetal,molbiotechnol.2004,26:39-60;houdebine,curropinbiotechnol.2002,13:625-9)。另外,在抗体可变区域的定点诱变能导致抗体具有较高的亲和性和特异性(branniganetal,natrevmolcellbiol.2002,3:964-70;adamsetal,jimmunolmethods.1999,231:249-60),抗体恒定区域的改变可以提高其介导结合和细胞毒性的效应功能。
恶性肿瘤细胞抗原的免疫特异性抗体也可以从商业途径获得或通过任何已知方法生产,例如化学合成或重组表达技术。对恶性肿瘤细胞抗原具有免疫特异性的抗体的核苷酸序列编码可以商业获得,例如从genbank数据库或类似数据库,文献出版物获得,或从常规克隆和测序得到。
除了抗体之外,与目标细胞上的表位或相应的受体相互作用(结合、阻断、靶向或其他类型作用)的一种肽或蛋白质也可以作为结合分子。这些肽或蛋白质可能是任何随机的肽或蛋白质,它们对表位或相应的受体有亲和力,不一定非得是免疫球蛋白家族成员。这些肽可以通过类似噬菌体显示抗体的技术分离出来(szardenings,jreceptsignaltransductres.2003;23(4):307-49)。从随机肽库中获得的肽可以同抗体和抗体片段类似地被使用。肽或蛋白质结合分子可以偶联或连接至大分子或其他物质,包括但不限于白蛋白、聚合物、脂质体、纳米粒子、树形分子,只要这样的连接能保留肽或蛋白质的抗原结合特异性。
在治疗癌症、自身免疫性疾病和/或传染性疾病的偶联物上,和药物分子通过本发明的连接体连接的抗体的例子包括,但不限于3f8(抗gd2),阿巴单抗(抗ca-125),阿昔单抗(抗cd41(整联蛋白α-iib)),阿达木单抗(抗tnf-α),adecatumumab(抗epcam,cd326),阿非莫单抗(抗tnf-α),afutuzumab(抗cd20),alacizumab单抗(抗vegfr2),ald518(抗il-6),alemtuzumab(campath,mabcampath,抗cd52),altumomab(抗cea),anatumomab(抗tag-72),anrukinzumab(ima-638,抗-il-13),apolizumab(抗-hla-dr),阿奇单抗(抗-cea),阿塞珠单抗(抗-l-选择蛋白cd62l),atlizumab(tocilizumab,actemra,roactemra,抗-il-6受体),atorolimumab(抗-rhesus因子),bapineuzumab(抗-β淀粉样蛋白),basiliximab(simulect,抗cd25(il-2受体的α链)),bavituximab(抗磷脂酰丝氨酸),bectumomab(lymphoscan,抗-cd22),贝利单抗(benlysta,lymphostat-b,抗baff),benralizumab(抗cd125),bertilimumab(抗ccl11(eotaxin-1)),besilesomab(scintimun,抗cea相关抗原),贝伐单抗(avastin,抗vegf-a),biciromab(fibriscint,抗纤维蛋白iiβ链),bivatuzumab(抗-cd44v6),blinatumomab(bite,抗cd19),brentuximab(cac10,抗-cd30tnrsf8),briakinumab(抗il-12,il-23),canakinumab(ilaris,抗il-1),cantuzumab(c242,抗canag),capromab,catumaxomab(removab,抗epcam,抗cd3),cc49(抗tag-72),cedelizumab(抗cd4),certolizumab单抗(cimzia抗tnf-α),西妥昔单抗(爱必妥,imc-c225,抗egfr),citatuzumabbogatox(抗epcam),cixutumumab(抗igf-1),clenoliximab(抗cd4),clivatuzu-mab(抗muc1),conatumumab(抗trail-r2),cr6261(抗流感a血凝素),dacetuzumab(抗cd40),daclizumab(zenapax,抗cd25(il-2受体α链)),daratumumab(抗cd38(环adp核糖水解酶),denosumab(prolia,抗rankl),detumomab(抗b淋巴瘤细胞),dorlimomab,dorlixizumab,ecromeximab(抗gd3神经节苷脂),eculizumab(soliris,抗-c5),edobacomab(抗内毒素),edrecolomab(panorex,mab17-1a,抗-epcam),efalizumab(raptiva,抗lfa-1(cd11a)),efungumab(mycograb,抗hsp90),elotuzumab(抗slamf7),elsilimomab(抗il-6),enlimomab单抗(抗icam-1(cd54)),epitumomab(抗episialin),依他珠单抗(抗-cd22),erlizumab(抗-itgb2(cd18)),ertumaxomab(rexomun,抗her2/neu,cd3),依他拉单抗(abegrin,抗整联蛋白αvβ3),exbivirumab(抗乙肝表面抗原),fanolesomab(neutrospec,抗cd15),faralimomab(抗干扰素受体),farletuzumab(抗叶酸受体1),felvizumab(抗呼吸道合胞病毒),fezakinumab(抗-il-22),figitumumab(抗-igf-1受体),fontolizumab(抗-ifn-γ),foravirumab(抗狂犬病病毒糖蛋白),fresolimumab(抗tgf-β),galiximab(抗cd80),gantenerumab(抗β淀粉样蛋白),gavilimomab(抗cd147(basigin)),gemtuzumab(抗cd33),girentuximab(抗碳酸酐酶9),glembatumumab(cr011,抗gpnmb),golimumab(simponi,抗-tnf-α),gomiliximab(抗-cd23(ige受体)),ibalizumab(抗-cd4),ibritumomab(抗cd20),igovomab(indimacis-125,抗ca-125),imciromab(myoscint,抗心肌肌凝蛋白),infliximab(remicade,抗tnf-α),intetumumab(抗cd51),inolimomab(抗cd25(il-2受体α链),伊珠单抗(抗-cd22),ipilimumab(抗cd152),iratumumab(抗cd30(tnfrsf8)),keliximab(抗-cd4),labetuzumab(cea-cide,抗cea),lebrikizumab(抗il-13),lemalesomab(抗nca-90(粒细胞抗原)),lerdelimumab(抗tgfβ2),lexatumumab(抗trail-r2),libivirumab(抗乙肝表面抗原),lintuzumab(抗cd33),鲁米木单抗(抗cd40),鲁米单抗(抗cd23(ige受体),mapatumumab(抗trail-r1),马西莫单抗(抗t-细胞受体),马妥珠单抗(抗egfr),mepolizumab(bosatria,抗il-5),metelimumab(抗tgfβ1),milatuzumab(抗cd74),minretumomab(抗tag-72),mitumomab(bec-2,抗gd3神经节苷脂),morolimumab(抗恒河猴因子),motavizumab(numax,抗呼吸道合胞病毒),muromonab-cd3(orthocloneokt3,抗cd3),nacolomab(抗c242),naptumomab(抗5t4),那他珠单抗(tysabri,抗整联蛋白α4),奈巴单抗(抗内毒素),necitumumab(抗egfr),nerelimomab(抗-tnf-α),nimotuzumab(theracim,theraloc,抗-egfr),nofetumomab,ocrelizumab(抗cd20),奥利木单抗(afolimomab,抗lfa-1(cd11a)),ofatumumab(arzerra,抗cd20),olaratumab(抗pdgf-rα),omalizumab(xolair,抗igefc区)oportuzumab(抗epcam),oregovomab(ovarex,抗ca-125),otelixizumab(抗cd3),pagibaximab(抗脂磷壁酸),palivizumab(synagis,abbosynagis,抗呼吸道合胞病毒),帕尼单抗(vectibix,abx-egf,抗egfr),panobacumab(抗铜绿假单胞菌(pseudomonasaeruginosa)),帕考珠单抗(抗il-4),pemtumomab(theragyn,抗muc1),pertuzumab(omnitarg,2c4,抗her2/neu),pexelizumab(抗c5),pintumomab(抗腺癌抗原),priliximab(抗-d4),pritumumab(抗波形蛋白),pro140(抗-ccr5)racotumomab(1e10,抗-n-羟乙酰神经氨酸(neugc,ngna)-神经节苷脂gm3)),rafivirumab(抗狂犬病病毒糖蛋白),ramucirumab(抗vegfr2),ranibizumab(lucentis,抗vegf-a),raxibacumab(抗炭疽毒素,保护性抗原),regavirumab(抗巨细胞病毒糖蛋白b),reslizumab(抗-il-5),rilotumumab(抗-hgf),rituximab(mabthera,rituxanmab,抗-cd20),robatumumab(抗-igf-1受体),rontalizumab(抗ifn-α),rovelizumab(leukar-rest,抗cd11,cd18),ruplizumab(antova,抗cd154(cd40l)),satumomab(抗tag-72),sevirumab(抗巨细胞病毒),sibrotuzumab(抗fap),西法木单抗(抗ifn-α),siltuximab(抗il-6),siplizumab(抗cd2),smartmi95(抗cd33),solanezumab(抗β淀粉状蛋白),sonepcizumab(抗鞘氨醇-1-磷酸),sontuzumab(抗-episialin),stamulumab(抗-myostatin),sulesomab(leukoscan,抗nca-90(粒细胞抗原)),tacatuzumab(抗α甲胎蛋白),tadocizumab(抗整联蛋白αiibβ3),talizumab(抗ige),tanezumab(anti-ngf),taplitumomab(抗cd19),tefibazumab(aurexis,(抗凝聚因子a)),telimomab,tenatumomab(抗腱生蛋白c),teneliximab(抗cd40),teplizumab(抗cd3),tgn1412(抗cd28),ticilimumab(tremelimumab,抗-ctla-4),tigatuzumab(抗trail-r2),tnx-650(抗il-13),tocilizumab(atlizumab,actemra,roactemra,il-6受体),toralizumab(抗cd154(cd40l)),tositumomab(抗cd20),曲妥珠单抗(赫赛汀,抗her2/neu),tremelimumab(抗ctla-4),tucotuzumabcelmoleukin(抗epcam),tuvirumab(抗乙型肝炎病毒),urtoxazumab(抗大肠杆菌),ustekinumab(stelara,抗-il-12,il-23),vapaliximab(抗-aoc3(vap-1)),维多珠单抗(抗整联蛋白α4β7),维妥珠单抗(抗cd20),vepalimomab(抗aoc3(vap-1)),visilizumab(nuvion,抗cd3),vitaxin(抗血管整合素avb3),volociximab(抗整联蛋白α5β1),votumumab(humaspect,抗肿瘤抗原ctaa16.88),zalutumumab(humax-egfr,zanolimumab(humax-cd4,抗-cd4),ziralimumab(抗-cd147(basigin)),zolimomab(抗-cd5),依那西普
其他可作为细胞结合分子/配体的抗体,包括但不限于,以下抗原的抗体:氨肽酶n(cd13),膜联蛋白a1,b7-h3(cd276,各种癌症),ca125(卵巢癌),ca15-3(各种癌症),ca19-9(各种癌症),l6(各种癌症),路易斯y(各种癌症),路易斯x(各种癌症),甲胎蛋白(各种癌症),ca242(结直肠癌),胎盘碱性磷酸酶(各种癌症),前列腺特异抗原(前列腺癌),前列腺酸磷酸酶(前列腺癌),表皮生长因子(各种癌症),cd2(霍奇金症,nhl淋巴瘤,多发性骨髓瘤),cd3ε(t细胞淋巴瘤,肺癌,乳腺癌,胃癌,卵巢癌,自身免疫性疾病,恶性腹水),cd19(b细胞恶性肿瘤),cd20(非霍奇金淋巴瘤),cd22(白血病,淋巴瘤,多发性骨髓瘤,sle),cd30(霍奇金淋巴瘤),cd33(白血病,自身免疫性疾病),cd38(多发性骨髓瘤),cd40(淋巴瘤,多发性骨髓瘤,白血病(cll)),cd51(转移性黑色素瘤,肉瘤),cd52(白血病),cd56(小细胞肺癌,卵巢癌,梅克细胞癌,以及液体肿瘤,多发性骨髓瘤),cd66e(各种癌症),cd70(转移性肾细胞癌和非霍奇金淋巴瘤),cd74(多发性骨髓瘤),cd80(淋巴瘤),cd98(各种癌症),粘液素(各种癌症),cd221(实体肿瘤)、cd227(乳腺癌、卵巢癌)、cd262(非小细胞肺癌及其他癌症)、cd309(卵巢癌)、cd326(实体肿瘤)、ceacam3(结肠直肠癌、胃癌)、ceacam5(癌胚抗原,cea,cd66e)(乳腺,结直肠癌和肺癌),dll4,egfr(表皮生长因子受体,各种癌症),ctla4(黑色素瘤),cxcr4(cd184,血液肿瘤,实体肿瘤),endoglin(cd105,实体瘤),epcam(上皮细胞粘附分子,膀胱癌,头颈癌,结肠癌,nhl前列腺癌,卵巢癌),erbb2(表皮生长因子受体2,肺癌,乳腺癌,前列腺癌),fcgr1(自身免疫性疾病),folr(叶酸受体,卵巢癌),gd2神经节苷(各种癌症),g-28(细胞表面抗原糖脂质,黑色素瘤),gd3独特型(各自癌症),热休克蛋白(各种癌症),her1(肺癌,胃癌),her2(乳腺癌,肺癌和卵巢癌),hla-dr10(nhl),hla-drb(nhl,b细胞白血病),人绒毛膜促性腺激素(各种癌症),igf1r(类胰岛素生长因子1受体,实体瘤,血癌),il-2受体(白介素2受体,t细胞白血病和淋巴瘤),il-6r(白介素6受体,多发性骨髓瘤,风湿性关节炎,castleman病,白细胞介素6依赖肿瘤),整合蛋白(αvβ3、α5β1、α6β4、αllβ3、α5β5、αvβ5,各种癌症),mage-1(各种癌症),mage-2(各种癌症),mage-3(各种癌症),mage4(各种癌症),抗转铁蛋白受体(各种癌症),p97(黑色素瘤),ms4a1(跨膜4结构域亚家族a成员1,非霍奇金b细胞淋巴瘤,白血病),muc1或muc1-klh(乳腺癌、卵巢癌、子宫颈癌、支气管癌和α胃肠道癌),muc16(ca125)(卵巢癌),cea(结直肠癌),gp100(黑色素瘤),mart1(黑色素瘤),mpg(黑素瘤),ms4a1(跨膜4结构域亚家族a成员1,小细胞肺癌,nhl),nucleolin,neu癌基因产物(各自癌症),p21(各种癌),抗(n-羟乙酰神经氨酸)抗体结合部位(乳腺癌,黑色素瘤),类plap睾丸碱性磷酸酶(卵巢癌、睾丸癌),psma(前列腺瘤),psa(前列腺癌),robo4,tag72(肿瘤相关糖蛋白72,aml,胃癌、结肠直肠癌、卵巢癌),t细胞跨膜蛋白(各种癌症),tie(cd202b),tnfrsf10b(肿瘤坏死因子受体超家族成员10b,各种癌症),tnfrsf13b(肿瘤坏死因子受体超家族成员13b,多发性骨髓瘤,nhl,其他癌症,ra和sle),tpbg(滋养细胞糖蛋白,肾细胞癌),trail-r1(tnf相关坏死诱导配体受体1,淋巴瘤,nhl,结直肠癌,肺癌),vcam-1(cd106,黑色素瘤),vegf,vegf-a,vegf-2(cd309)(各种癌症)。其它可被抗体识别的,肿瘤相关抗原已被总结和评述(gerber,etal,mabs2009,1:3,247-253;novellinoetal,cancerimmunolimmunother.2005,54(3),187-207;franke,etal,cancerbiotherradiopharm.2000,15,459-76)。
细胞结合剂,优选为抗体,能够抗以下细胞:肿瘤细胞,病毒感染细胞,微生物感染细胞,寄生虫感染细胞,自身免疫细胞,活化的细胞,骨髓细胞,活化的t细胞,b细胞,或黑色素细胞。更具体地,细胞结合剂可以是任何能够抗下列抗原或受体之一的试剂/分子:cd2,cd2r,cd3,cd3gd,cd3e,cd4,cd5,cd6,cd7,cd8,cd8a,cd8b,cd9,cd10,cd11a,cd11b,cd11c,cd12,cd12w,cd13,cd14,cd15,cd15s,cd15u,cd16,cd16a,cd16b,cd17,cdw17,cd18,cd19,cd20,cd21,cd22,cd23,cd24,cd25,cd26,cd27,cd28,cd29,cd30,cd31,cd32,cd33,cd34,cd35,cd36,cd37,cd38,cd39,cd40,cd41,cd42,cd42a,cd42b,cd42c,cd42d,cd43,cd44,cd44r,cd45,cd45ra,cd45rb,cd45ro,cd46,cd47,cd47r,cd48,cd49a,cd49b,cd49c,cd49e,cd49f,cd50,cd51,cd52,cd53,cd54,cd55,cd56,cd57,cd58,cd59,cd60,cd60a,cd60b,cd60c,cd61,cd62e,cd62l,cd62p,cd63,cd64,cd65,cd65s,cd66,cd66a,cd66b,cd66c,cd66d,cd66e,cd66f,cd67,cd68,cd69,cd70,cd71,cd72,cd73,cd74,cd74,cd75,cd75s,cd76,cd77,cd78,cd79,cd79a,cd79b,cd80,cd81,cd82,cd83,cd84,cdw84,cd85,cd86,cd87,cd88,cd89,cd90,cd91,cd92,cdw92,cd93,cd94,cd95,cd96,cd97,cd98,cd99,cd99r,cd100,cd101,cd102,cd103,cd104,cd105,cd106,cd107,cd107a,cd107b,cd108,cd109,cd110,cd111,cd112,cd113,cdw113,cd114,cd115,cd116,cd117,cd118,cd119,cdw119,cd120a,cd120b,cd121a,cd121b,cdw121b,cd122,cd123,cdw123,cd124,cd125,cdw125,cd126,cd127,cd128,cdw128,cd129,cd130,cd131,cdw131,cd132,cd133,cd134,cd135,cd136,cdw136,cd137,cdw137,cd138,cd139,cd140a,cd140b,cd141,cd142,cd143,cd144,cd145,cdw145,cd146,cd147,cd148,cd149,cd150,cd151,cd152,cd153,cd154,cd155,cd156a,cd156b,cdw156c,cd157,cd158a,cd158b,cd159a,cd159b,cd159c,cd160,cd161,cd162,cd162r,cd163,cd164,cd165,cd166,cd167,cd167a,cd168,cd169,cd170,cd171,cd172a,cd172b,cd172g,cd173,cd174,cd175,cd175s,cd176,cd177,cd178,cd179,cd180,cd181,cd182,cd183,cd184,cd185,cd186,cdw186,cd187,cd188,cd189,cd190,cd191,cd192,cd193,cd194,cd195,cd196,cd197,cd198,cdw198,cd199,cdw199,cd200,cd200a,cd200b,cd201,cd202,cd202b,cd203,cd203c,cd204,cd205,cd206,cd207,cd208,cd209,cd210,cdw210,cd212,cd213a1,cd213a2,cdw217,cdw218a,cdw218b,cd220,cd221,cd222,cd223,cd224,cd225,cd226,cd227,cd228,cd229,cd230,cd231,cd232,cd233,cd234,cd235a,cd235ab,cd235b,cd236,cd236r,cd238,cd239,cd240,cd240ce,cd240d,cd241,cd242,cd243,cd244,cd245,cd246,cd247,cd248,cd249,cd252,cd253,cd254,cd256,cd257,cd258,cd261,cd262,cd263,cd265,cd266,cd267,cd268,cd269,cd271,cd273,cd274,cd275,cd276(b7-h3),cd277,cd278,cd279,cd280,cd281,cd282,cd283,cd284,cd289,cd292,cdw293,cd294,cd295,cd296,cd297,cd298,cd299,cd300a,cd300c,cd300e,cd301,cd302,cd303,cd304,cd305,cd306,cd309,cd312,cd314,cd315,cd316,cd317,cd318,cd319,cd320,cd321,cd322,cd324,cdw325,cd326,cdw327,cdw328,cdw329,cd331,cd332,cd333,cd334,cd335,cd336,cd337,cdw338,cd339,4-1bb,5ac,5t4(trophoblast糖蛋白,tpbg,wnt-活化抑制因子1或waif1),腺癌抗原,ags-5,ags-22m6,启动素受体激酶1,afp,akap-4,alk,α整合素,αvβ6,氨基肽酶n,淀粉样蛋白β,雄激素受体,促血管新生蛋白因子2,促血管新生蛋白因子3,膜联蛋白a1,炭疽毒素保护性抗原,抗转移蛋白受体,aoc3(vap-1),b7-h3,炭疽杆菌,baff(b细胞启动因子),b淋巴瘤细胞,bcr-abl,蛙皮素,boris,c5,c242抗原,ca125(糖抗原125,muc16),ca-ix(或caix,碳酸酐酶9),calla,canag,犬红斑狼疮il31,碳酸酐酶ix,心肌肌凝蛋白,ccl11(c-c片段趋化因子11),ccr4(c-c趋化因子受体4,cd194),ccr5,cd3e(ε),cea(癌胚抗原),ceacam3,ceacam5(癌胚抗原),cfd(因子d),ch4d5,胆囊收缩素2(cck2r),cldn18(claudin-18),丛生因子a,cripto,fcsf1r(集落刺激因子1受体,cd115),csf2(集落刺激因子2,粒细胞-巨噬细胞集落刺激因子(gm-csf)),ctla4(细胞毒性t淋巴细胞相关蛋白4),ctaa肿瘤抗原,cxcr4(cd184),c-x-c趋化因子受体4,环状adp核糖核酸酶,细胞周期蛋白b1,cyp1b1,巨细胞病毒,巨细胞病毒糖蛋白b,dabigatran,dll3(类δ配体3),dll4(类δ配体4),dpp4(双肽-肽酶4),dr5(死亡受体5),大肠杆菌shiga毒素类型-1,大肠杆菌shiga毒素类型-2,ed-b,egfl7(类egf结构域蛋白7),egfr,egfrii,egfrviii,内皮因子(cd105),内皮素b受体,内毒素,epcam(上皮细胞粘附分子),epha2,episialin,erbb2(表皮生长因子受体2),erbb3,erg(tmprss2ets融合基因),大肠杆菌,etv6-aml,fap(成纤维细胞活化蛋白α),fcgr1,甲胎蛋白,纤维蛋白iiβ链,纤连蛋白额外结构域-b,folr(叶酸受体),叶酸受体α,叶酸水解酶,fos相关抗原1,呼吸道合胞病毒的f蛋白,卷曲的受体,岩藻糖gm1,gd2神经节苷脂,g-28(细胞表面抗原糖脂),gd3独特型,globoh,glypican3,n-羟乙酰神经氨酸,gm3,gmcsf受体α链,生长分化因子8,gp100,gpnmb(跨膜糖蛋白nmb),gucy2c(鸟苷酸环化酶2c),鸟苷酸环化酶c(gc-c),肠鸟苷酸环化酶,鸟苷酸环化酶c受体,热稳定肠毒素受体(hstar),热休克蛋白,血凝素,乙肝表面抗原,乙型肝炎病毒,her1(人类表皮生长因子受体1),her2,her2/neu,her3(erbb-3),igg4,hgf/sf(肝细胞生长因子/分散因子),hhgfr,hiv-1,组蛋白复合物,hla-dr(人类白细胞抗原),hla-dr10,hla-drb,hmwmaa,人类绒毛膜促性腺激素,hngf,人类分散因子受体激酶,hpve6/e7,hsp90,htert,icam-1(细胞间粘附分子1),idiotype,igf1r(igf–1,类胰岛素生长因子1受体),ighe,ifn-γ,流感血凝素,ige,igefc区,ighe,白介素(如il–1,il-2,il-3,il–4,il-5,il–6,il-7,il-8,il-9,il-10,il-11,il-12,il-13,il-14,il-15,il-16,il-17,il-18,il-19,il-20,il-21,il-22,il-23,il-27,il-28),il31ra,ilgf2(类胰岛素生长因子2),整合蛋白(α4、αiibβ3、αvβ3、α4β7、α5β1、α6β4、α7β7、αllβ3、α5β5、αvβ5),干扰素γ诱导蛋白质,itga2,itgb2,kir2d,lck,le,legumain,lewis-y抗原,lfa-1(淋巴细胞功能相关抗原1,cd11a),lhrh,lingo-1,脂磷壁酸,liv1a,lmp2,lta,mad-ct-1,mad-ct-2,mage-1,mage-2,mage-3,magea1,magea3,mage4,mart1,mcp-1,mif(巨噬细胞迁移抑制因子,或糖基抑制因子(gif)),ms4a1(跨膜4结构域亚家族a成员1),msln(间皮素),muc1(粘蛋白1,细胞表面相关(muc1)或多态性上皮粘蛋白(pem)),muc1-klh,muc16(ca125),mcp1(单核细胞趋化蛋白1),melana/mart1,ml-iap,mpg,ms4a1,mycn,髓磷脂相关糖蛋白,myostatin,na17,narp-1,nca-90(粒细胞抗原),nectin-4(asg-22me),ngf,神经细胞凋亡调控蛋白酶1,nogo-a,notch受体,核仁素,neu致癌基因产物,ny-br-1,ny-eso-1,ox-40,oxldl(氧化低密度脂蛋白),oy-tes1,p21,p53非突变体,p97,pap,抗(n-羟乙酰神经氨酸)抗体结合部位,pax3,pax5,pcsk9,pdcd1(pd-1、程序性细胞死亡蛋白1,cd279),pdgf-rα(α血小板源生长因子受体),pdgfr-β,pdl-1,plac1,类plap睾丸碱性磷酸酶,血小板衍生生长因子受体β,磷酸钠联合转运体,pmel17,聚唾液酸,蛋白酶3(pr1),前列腺癌,ps(磷脂酰丝氨酸),前列腺癌细胞,铜绿假单胞菌,psma,psa,psca,狂犬病病毒糖蛋白,rhd(rh多肽1(rhpi),cd240),rhesus因子,rankl,rhoc,ras突变,rgs5,robo4,呼吸道合胞病毒,ron,肉瘤易位断点,sart3,sclerostin,slamf7(slam成员7),selectinp,sdc1(多配体蛋白聚糖1),系统性红斑狼疮(a),生长调节素c,sip(1-磷酸鞘氨醇),生长激素抑制素,精子蛋白17,ssx2,steap1(6-跨膜上皮前列腺抗原1),steap2,stn,tag-72(肿瘤相关糖蛋白),存活素,t细胞受体,t细胞跨膜蛋白,tem1(肿瘤血管内皮标记1),tenb2,tenascinc(tn-c),tgf-α,tgf-β(转化生长因子β),tgf-β1,tgf-β2(转化生长因子2),tie(cd202b),tie2,tim-1(cdx-014),tn,tnf,tnf-α,tnfrsf8,tnfrsf10b(肿瘤坏死因子受体超家族成员10b),tnfrsf13b(肿瘤坏死因子受体超家族成员13b),tpbg(滋养细胞糖蛋白),trail-r1(tnf相关坏死诱导配体受体1),trailr2(死亡受体5(dr5)),肿瘤相关的钙信号传感子2,肿瘤特异糖基化的muc1,tweak受体,tyrp1(糖蛋白75),trp-2,酪氨酸酶,vcam-1(cd106),vegf,vegf-a,vegf-2(cd309),vegfr-1,vegfr-2,vimentin,wt1,xage1,表达胰岛素生长因子受体的细胞,或表达表皮生长因子受体的细胞。
在一个具体实施例中,通过本专利的连接体连接的细胞结合剂-药物偶联物,可用作治疗或预防癌症。目标癌症包括但不限于,肾上腺皮质癌、肛门癌、膀胱癌、大脑肿瘤(脑干神经胶质瘤、小脑星形细胞瘤、脑星形细胞瘤、室管膜瘤、成神经管细胞瘤、幕上原始神经外胚层和松果体肿瘤、视觉通路和下丘脑胶质瘤)、乳腺癌、类癌肿瘤、胃肠道癌症、未知小细胞癌、宫颈癌、结肠癌、子宫内膜癌、食道癌、肝外胆管癌、尤因家族肿瘤(pnet)、颅内生殖细胞肿瘤、眼癌、眼内黑色素瘤、胆囊癌、胃癌(胃癌)、性腺外生殖细胞瘤、孕周滋养细胞瘤、头颈癌、下咽癌、胰岛细胞癌、肾癌(肾细胞癌)、喉癌、白血病(急性淋巴细胞,急性髓系,慢性淋巴细胞,慢性粒细胞,毛细胞)、嘴唇和口腔癌症、肝癌、肺癌(非小细胞,小细胞)、淋巴瘤(艾滋病相关,中枢神经系统,皮肤t细胞,霍奇金病,非霍奇金病)、恶性间皮瘤、黑色素瘤、梅克尔细胞癌、转移性鳞状颈癌与隐匿性原发性癌、多发性骨髓瘤和其他浆细胞肿瘤、蕈样肉芽肿、骨髓增生异常综合征、骨髓增生异常、鼻咽癌、神经母细胞瘤、口腔癌、口咽癌、骨肉瘤、卵巢癌(上皮、生殖细胞瘤、低恶性肿瘤)、胰腺癌(外分泌,胰岛细胞癌)、副鼻窦和鼻腔癌、甲状旁腺癌、阴茎癌、嗜铬细胞瘤、垂体肿瘤、浆细胞肿瘤、前列腺癌横纹肌肉瘤、直肠癌、肾细胞癌(肾癌)、肾盂和输尿管(移行细胞)、唾腺癌、赛塞里综合症、皮肤癌(皮肤t细胞淋巴瘤,卡波西氏肉瘤,黑色素瘤)、小肠肿瘤、软组织肉瘤、胃癌、睾丸癌、胸腺瘤(恶性)、甲状腺癌、尿道癌症、子宫癌、不寻常的少年癌症、阴道肿瘤、外阴肿瘤和维尔姆斯瘤。
在另一个具体的实施例中,通过本专利的细胞结合剂-药物偶联物,可用作治疗或预防自身免疫疾病的成分和方法。自身免疫性疾病包括但不限于,achlorhydra自身免疫性活动性慢性肝炎,急性播散性脑脊髓炎,急性出血性脑白质炎,艾迪生病,无精症,斑秃,肌萎缩侧索硬化症,强直性脊柱炎,抗gbm/tbm肾炎,抗磷脂综合征,抗异常酶综合征,关节炎,特应性过敏,特应性皮炎,自身免疫性再生障碍性贫血,自身免疫性心肌病,自身免疫性溶血性贫血,自身免疫性肝炎,自身免疫性内耳疾病,自身免疫性淋巴组织增生综合征,自身免疫性周围神经病,自身免疫性胰腺炎,自身免疫性多内分泌综合征i,ii和iii型,自身免疫性黄体酮皮炎,自身免疫性血小板减少性紫癜,自身免疫性葡萄膜炎,balo病/balo同心硬化症,bechets综合征,berger氏病,bickerstaff脑炎,blau综合征,大疱性类天疱疮,castleman病,chagas病,慢性疲劳免疫功能障碍综合征,慢性炎性脱髓鞘性多发性神经病,慢性复发性多灶性骨髓炎,慢性莱姆病,慢性阻塞性肺病,churg-strauss综合征,瘢痕性类天疱疮,乳糜泄,cogan综合征,冷凝集素病,补体成分2缺乏症,颅骨动脉炎,crest综合征,crohns病(特发性炎症性肠病),库欣综合征,皮肤白细胞增多性血管炎,德戈氏病,dercum氏病,疱疹样皮炎,皮肌炎,1型糖尿病,弥漫性皮肤系统性硬化症,dressler综合征,盘状红斑狼疮,湿疹,子宫内膜异位症,附着点炎相关的关节炎,eosinophilic筋膜炎,大疱性表皮松解症,结节性红斑,特发性混合性冷球蛋白血症,伊文氏综合征,纤维发育不良性骨化症,纤维肌痛,纤维化性肌炎,纤维性肺泡炎,胃炎,胃肠类天疱疮,巨细胞动脉炎,肾小球肾炎,古德帕斯丘尔综合征,格雷夫斯病,格林-巴利综合征,桥本氏脑炎,桥本氏甲状腺炎,溶血性贫血,过敏性紫癜,妊娠性肝炎,化脓性汗腺炎,休斯综合征(抗磷脂综合征),低丙球蛋白血症,特发性炎性脱髓鞘疾病,特发性肺纤维化,特发性血小板减少性紫癜(自身免疫性血小板减少性紫癜),iga肾病(伯杰氏病),包涵体肌炎,炎性脱髓鞘性多神经炎,间质性膀胱炎,过敏性肠综合征,少年特发性关节炎,青少年类风湿性关节炎,川崎氏病,朗伯-伊顿重症肌无力综合征,白细胞碎屑性血管炎,扁平苔癣,硬化性硬化症,线状iga疾病(lad),lougehrig病(也称肌萎缩侧索硬化症),狼疮性肝炎,红斑狼疮,majeed综合征,美尼尔氏病,显微镜下多动脉炎,米勒-费希尔综合征,混合性结缔组织病,硬斑病,穆罕默德-哈贝曼病,麦考利综合征,多发性骨髓瘤,多发性硬化症,重症肌无力,肌炎,嗜睡症,视神经脊髓炎(devic病),神经性肌强直,眼睑瘢痕性类天疱疮,opsoclonusmyoclonus综合征,ord甲状腺炎,回文风湿病,pandas(与链球菌相关的小儿自身免疫性神经精神病),paraneoplastic小脑变性,阵发性睡眠性血红蛋白尿症,parryromberg综合征,parsonnage-turner综合征,睫状体平部炎,天疱疮,寻常型天疱疮,贫血,周围脑脊髓炎,poems综合征,结节性多动脉炎,风湿性多肌痛,多发性肌炎,原发性胆汁性肝硬化,原发性硬化性胆管炎,进行性炎症性神经病变,牛皮癣,牛皮癣性关节炎,坏疽性皮肤炎,纯红细胞再生障碍,rasmussen脑炎,雷诺现象,复发性多软骨炎,赖特综合征,不宁腿综合症,后神经纤维化,类风湿性关节炎,类风湿热,结节病,精神分裂症,施密特综合征,schnitzler综合征,施尼茨勒综合征,巩膜炎,硬皮病,干燥综合征,脊椎关节病,粘稠血症,still病,僵人综合征,亚急性细菌性心内膜炎,苏萨克综合征,sweet综合征,小舞蹈病,交感神经性贫血,takayasu动脉炎,颞动脉炎(巨细胞动脉炎),tolosa-hunt综合征,横贯性脊髓炎,溃疡性结肠炎(特发性炎性肠病),未分化结缔组织病,未分化脊柱关节病,血管炎,白癜风,韦格纳肉芽肿病,威尔逊氏综合征,威斯科特-奥尔德里奇综合征。
在另一个具体的实施例中,在用于治疗或预防自身免疫性疾病的偶联物上,和药物分子通过本专利的双链连接体连接的结合分子,包括但不限于,抗弹性蛋白抗体,abys抗上皮细胞抗体,抗地下室膜iv型胶原蛋白抗体,抗核抗体,抗dsdna,抗ssdna,抗心磷脂抗体igm,igg,抗乳糜泻抗体,抗磷脂抗体igk,igg,抗sm抗体,抗线粒体抗体,甲状腺抗体,微粒体抗体,t细胞抗体,甲状腺球蛋白抗体,抗scl-70,抗jo,抗u.sub.1rnp,抗la/ssb,抗ssa,抗ssb,抗壁细胞抗体,抗组蛋白,抗rnp,c-anca,p-anca,抗着丝粒,抗纤维蛋白原,抗gbm抗体,抗神经节苷脂抗体,抗desmogein3抗体,抗p62抗体,抗sp100抗体,抗线粒体(m2)抗体,类风湿因子抗体,抗mcv抗体,抗拓扑异构酶抗体,抗中性粒细胞胞质(canca)抗体。
在某些优选的实施例中,本专利中偶联物上的结合分子,可以与自身免疫性疾病相关的启动淋巴细胞上表达的受体或受体复合物相结合。受体或受体复合物包含,免疫球蛋白基因超家族成员(例如cd2,cd3,cd4,cd8,cd19,cd20,cd22,cd28,cd30,cd33,cd37,cd38,cd56,cd70,cd79,cd79b,cd90,cd125,cd147,cd152/ctla-4,pd-1或icos),tnf受体超家族成员(例如cd27,cd40,cd95/fas,cd134/ox40,cd137/4-1bb,inf-r1,tnfr-2,rank,taci,bcma,骨保护素,apo2/trail-r1,trail-r2,trail-r3,trail-r4和apo-3),整合蛋白,细胞因子受体,趋化因子受体,主要组织兼容性蛋白,凝集素(c型,s型或i型)或补体控制蛋白。
在另一个具体实施例中,可用的对病毒或微生物抗原具有免疫特异性的细胞结合配体是人源化或人单克隆抗体。“病毒抗原”包括但不限于,任何能够引发免疫应答的病毒肽,多肽蛋白(例如hivgp120,hivnef,rsvf糖蛋白,流感病毒神经氨酸苷酶,流感病毒血凝素,htlvtax,疱疹单纯疱疹病毒糖蛋白(例如gb,gc,gd和ge)和乙型肝炎表面抗原)。“微生物抗原”包括但不限于,任何能够引发免疫应答的微生物肽,多肽,蛋白质,糖,多糖或脂质分子(例如细菌,真菌,致病原生动物或酵母多肽,包括如lps和荚膜多糖)。可用于治疗病毒或微生物感染的抗体的实例,包括但不限于:帕利珠单抗,它是用于治疗rsv感染的,人源化抗呼吸道合胞病毒单克隆抗体;pro542,是一种cd4融合抗体,用于治疗hiv感染;奥斯他韦,是一种用于治疗乙型肝炎病毒的人抗体;protvir,是一种人源化igg1抗体,用于治疗巨细胞病毒,和抗lps抗体。
通过本专利的双键连接体制得的细胞结合分子-药物偶联物可用于治疗感染性疾病。这些感染性疾病包括但不限于,不动杆菌属感染,放线菌病,非洲昏睡病(非洲锥虫病),艾滋病(获得性免疫缺陷综合症),阿米巴病,无形体病,炭疽,溶血性耶尔森菌感染,阿根廷出血热,蛔虫病,曲霉病,星状病毒感染,巴贝斯虫病,蜡状芽孢杆菌感染,细菌性肺炎,细菌性阴道炎,类杆菌感染,小袋虫病,蛔虫感染,bk病毒感染,黑色发结节病,人芽囊原虫感染,芽生菌病,玻利维亚出血热,疏螺旋体感染,肉毒中毒(和婴儿肉毒中毒),巴西出血热,布鲁氏杆菌病,伯克霍尔德氏菌感染,布鲁里溃疡,杯状病毒感染(诺如病毒和沙波病毒),弯曲杆菌病,念珠菌病(念珠菌病,鹅口疮),猫抓病,蜂窝组织炎,chagas病(美洲锥虫病),子囊,水痘,衣原体,肺炎衣原体感染,霍乱,色素母细胞瘤,华支睾吸虫,艰难梭状芽孢杆菌感染,球孢子菌病,科罗拉多蜱热病,普通感冒(急性病毒性鼻咽炎,急性鼻炎),克雅氏病,克里米亚-刚果出血热,隐球菌病,隐孢子虫病,皮肤幼虫迁徙,环孢子虫病,肠杆菌感染,肠道病毒感染,流行性斑疹伤寒,传染性红斑(第五种疾病),急疹,姜片虫病,肝片吸虫病,致命性家族性失眠,丝虫病,产气荚膜梭菌食物中毒,自由活体阿米巴感染,梭杆菌感染,气性坏疽(梭菌性肌坏死),地丝菌病,格斯特曼-斯特拉斯勒-谢克尔病综合征,贾第鞭毛虫病,马鼻疽,淋病,肉芽肿性腹泻(第五性病),a群链球菌感染,b群链球菌感染,流感嗜血杆菌感染,手足口病(hfmd),汉坦病毒肺综合征,幽门螺杆菌感染,溶血性尿毒综合征,肾综合征出血热,甲型肝炎,乙型肝炎,丙型肝炎,丁型肝炎,戊型肝炎,单纯性疱疹,组织胞浆菌病,钩虫感染,人类博卡病毒感染,人类ewingii埃里希体病,人类粒细胞无形体病,人类偏肺病毒感染,人类单核细胞埃里希体病,人乳头瘤病毒感染,人副流感病毒感染,膜壳绦虫病,艾巴氏病毒传染性单核细胞增多症(单),流行性感冒,等孢子虫病,川崎病,角膜炎,金格杆菌感染,库鲁病,拉沙热,军团病(退伍军人症),军团病(庞蒂亚克热),利什曼病,莱姆病,淋巴丝虫病(象皮病),淋巴细胞性脉络丛脑膜炎,疟疾,马尔堡出血热,麻疹,类鼻疽病(惠氏病),脑膜炎,脑膜炎球菌病,后殖吸虫病,微孢子虫病,传染性软疣,腮腺炎,小鼠斑疹伤寒(地方性斑疹伤寒),支原体肺炎,足菌肿,蝇蛆病,新生儿结膜炎(新生儿眼病),变异型克雅氏病(vcjd,nvcjd),诺卡氏菌病,盘尾丝虫病(河盲症),副球孢子菌病(南美芽生菌病),肺吸虫病,巴斯德氏菌病,头虱,体虱,阴虱,盆腔炎,百日咳,鼠疫,肺炎球菌感染,肺孢子虫肺炎,肺炎,脊髓灰质炎,普氏菌感染,原发性阿米巴脑膜脑炎,进行性多灶性白质脑病,鹦鹉热,q热,狂犬病,鼠咬热,呼吸道合胞病毒感染,鼻孢子虫病,鼻病毒感染,立克次体感染,立克次体痘,裂谷热,落基山斑疹热,轮状病毒感染,风疹,沙门氏菌病,sars(严重急性呼吸综合征),疥疮,血吸虫病,败血症,志贺氏菌病(bacillary痢疾),带状疱疹(带状疱疹),天花(天花),孢子丝菌,葡萄球菌食物中毒,感染金黄色葡萄球菌,粪类圆线虫病,梅毒,绦虫病,破伤风,须癣(barber痒),头皮癣,体癣,股癣,手癣,掌黑癣,足癣(香港脚),甲癣(灰指甲),花斑癣,弓蛔虫病(眼幼虫移行症),弓蛔虫病(内脏幼虫移行症),弓形体病,旋毛虫病,滴虫病,鞭虫病(鞭虫感染),肺结核,兔热病,解脲脲原体感染,委内瑞拉马脑炎,委内瑞拉出血热,病毒性肺炎,西尼罗河热,白毛结节病(白癣),假结核耶尔森氏菌,耶尔森氏鼠疫杆菌肠道病,黄热病,接合菌病。
本发明的细胞结合分子,更优选为抗体,对抗的病原菌株包括但不限于,鲍氏不动杆菌,以色列放线菌,放线菌和丙酸杆菌,布氏锥虫,hiv(人免疫缺陷病毒病毒),溶组织内阿米巴,无形体属,炭疽芽孢杆菌,溶血弧菌,胡宁病毒,蛔虫属,曲霉属,星状病毒科,巴贝虫属,蜡状芽孢杆菌,多种细菌,拟杆菌属,大肠杆菌,蛔虫属,bk病毒,结节菌,人芽囊原虫,皮炎芽生菌,马丘波病毒,疏螺旋体属,肉毒梭菌,清风藤属,布鲁氏菌属,通常为洋葱伯克霍尔德菌和其他伯克霍尔德氏菌种,溃疡分枝杆菌,杯状病毒科,弯曲杆菌属,通常为白色假丝酵母和其他假丝酵母属,汉赛巴尔通体,a群链球菌和葡萄球菌,克氏锥虫,杜克雷嗜血杆菌,vzv,沙眼衣原体,科罗拉多蜱热病毒,鼻病毒,冠状病毒,cjd朊病毒,克里米亚-刚果出血热病毒,新型隐球菌,隐孢子虫属,巴西钩虫,多种寄生虫,环孢子虫,带状绦虫,巨细胞病毒,登革热病毒(den-1,den-2,den-3和den-4)-黄病毒,脆弱双歧杆菌,白喉棒状杆菌,裂头绦虫,麦地那龙线虫,埃博拉病毒,棘球绦虫属,埃立克体肠球菌属,肠道病毒属,普氏立克次体,细小病毒b19,人疱疹病毒6和人疱疹病毒7,布氏姜片虫,肝片吸虫和巨大片吸虫,ffi朊病毒,丝虫目超家族,产气荚膜梭菌,梭杆菌属,其他梭状芽孢杆菌,白地霉,gss朊病毒,肠道贾第虫,伯克霍尔德氏菌,刺孢小芽孢杆菌和革兰氏假丝酵母,淋球菌,肉芽肿克雷伯氏菌,化脓性链球菌,无乳链球菌,流感嗜血杆菌,肠道病毒,主要是柯萨奇a病毒和肠道病毒71,无名病毒,幽门螺旋杆菌,大肠杆菌o157:h7,布尼亚病毒科,甲型肝炎病毒,乙型肝炎病毒,丙型肝炎病毒,丁型肝炎病毒,戊型肝炎病毒,单纯疱疹病毒1,单纯疱疹病毒2,荚膜组织胞浆菌,十二指肠腺瘤和壶腹癌流感嗜血杆菌,人博卡病毒,埃里希体,嗜吞噬细胞无嗜血杆菌,人偏肺病毒,查菲埃里希体,人乳头瘤病毒,人副流感病毒,微小膜壳绦虫和缩小膜壳绦虫,艾巴氏病毒,正粘病毒科家族,贝氏等孢球虫,金格杆菌,肺炎克雷伯菌,克雷伯氏菌,嗜肺军团菌,嗜肺军团菌,嗜肺军团菌,利什曼原虫属,麻风分枝杆菌和结核分枝杆菌,钩端螺旋体属,单核细胞增多性李斯特氏菌,伯氏疏螺旋体和其他疏螺旋体属物种,班氏旋毛虫和马来丝虫,淋巴细胞脉络丛脑膜炎病毒(lcmv)疟原虫属,马尔堡病毒,麻疹病毒,类鼻疽伯克霍尔德氏菌,脑膜炎奈瑟氏球菌,横川后殖吸虫,小孢子虫目门,传染性软疣病毒(mcv),腮腺炎病毒,伤寒立克次氏体,肺炎支原体,多种细菌和真菌寄生双翅蝇幼虫,沙眼衣原体和淋病奈瑟菌,vcjd朊病毒,诺卡氏菌和其他诺卡氏菌属,盘尾丝虫属,盘鲍拟亚科,副龙属西马尼和其他副属,巴斯德氏菌属,头虱,人体虱,百日咳博德特氏菌鼠疫耶尔森氏菌,肺炎链球菌,肺炎球菌,脊髓灰质炎病毒,普雷沃氏菌属,奈氏格氏杆菌,jc病毒,鹦鹉热衣原体,伯氏考克斯体,狂犬病病毒,单链球菌和螺旋菌,呼吸道合胞病毒,鼻孢子菌,鼻病毒,立克次体属,由小株立克次体,裂谷热病毒,立克次体立克次体,轮状病毒,风疹,沙门氏菌属,sars冠状病毒,人疥螨,血吸虫属,体细胞属,志贺菌属,水痘带状疱疹病毒,天花少校或天花小,申克孢子丝菌,金黄色葡萄球菌属,金黄色葡萄球菌,链球菌化脓,圆线虫,梅毒螺旋体,绦虫属,破伤风,癣属癣音铀,癣属,絮状表皮癣菌,红色毛癣菌,须毛癣菌,红色毛癣菌,威尼克外瓶霉,毛癣菌属属,细胞死亡属,弓箭毒或弓箭毒,刚地弓形虫、旋毛虫,阴道毛滴虫,三丘里三种,结核分枝杆菌,弗朗西拉图拉菌,尿素和马脑炎病毒,委内瑞拉马脑炎病毒,霍乱弧菌,瓜纳里托病毒,西尼罗河病毒,beigelii丝孢,假结核耶尔森氏菌,小肠结肠炎耶尔森氏菌,黄热病病毒,毛霉菌目阶(毛霉菌病)和虫霉目阶(虫霉属真菌病),毛霉菌目绿脓杆菌,弯曲杆菌(弧菌),气单胞菌,艾氏菌,耶尔森氏菌,志贺痢疾杆菌,志贺氏杆菌,志贺氏菌,沙门氏菌,伤寒沙门氏菌,雅司螺旋体,奋森氏螺旋体,伯氏疏螺旋体,细螺旋体,卡氏肺孢子虫,流产布鲁氏菌,布鲁杆菌,布鲁氏菌,支原体属,普氏立克次体,恙虫病立克次氏体,衣原体属,致病性真菌(烟曲霉,白色念珠菌,荚膜组织胞浆菌),原生动物(溶组织内阿米巴,tenas毛滴虫,hominis毛滴虫,冈比亚锥虫,罗得西亚锥虫,罗氏利什曼原虫,热带利什曼原虫,巴西利什曼原虫,肺孢子虫肺炎,间日疟原虫,恶性疟原虫,疟原虫疟疾)或helminiths(日本血吸虫,曼氏血吸虫,埃及血吸虫和钩虫)。
其他用作治疗病毒性疾病的偶联物上的抗体,包括但不限于,抗下列致病性病毒抗原的抗体:痘病毒;疱疹病毒;腺病毒;小黄病毒;肠病毒;小核糖核酸病毒;细小病毒;呼肠病毒;逆转录病毒;流感病毒;副流感病毒;腮腺炎;麻疹;呼吸道合胞病毒;风疹;虫媒病毒;弹状病毒;沙门氏菌;非a/非b型肝炎病毒;鼻病毒;冠状病毒;罗托病毒;致癌病毒,如hbv(肝细胞癌),人乳头状瘤病毒(宫颈癌,肛门癌),卡波济氏肉瘤相关的疱疹病毒(卡波济氏肉瘤肉瘤)、人类疱疹病毒第四型(鼻咽癌、伯基特淋巴瘤、原发性中枢神经系统淋巴瘤)、瘤病毒(默克尔细胞癌)、sv40(猿猴病毒40)、hcv(肝细胞癌),htlv-1(成人t细胞白血病/淋巴瘤);免疫紊乱导致病毒,如人类免疫缺陷病毒(艾滋病);中枢神经系统病毒,如jcv(进行性多灶性脑白质病),丙型肝炎病毒(亚急性硬化性全脑炎),lcv(淋巴细胞性脉络丛脑膜炎),亚博病毒脑炎,正粘病毒(脑炎性脑炎),rv(狂犬病),长鼻病毒,疱疹病毒脑膜炎,拉姆齐亨特综合征ii型,脊髓灰质炎病毒(脊髓灰质炎病毒,后脊髓灰质炎综合征),htlv-1(热带麻痹性麻痹));巨细胞病毒(巨细胞病毒视网膜炎,hsv(疱疹性角膜炎);心血管病毒,如cbv(心包炎,心肌炎);呼吸系统/急性病毒性鼻内炎/病毒性肺炎,如爱泼斯坦-巴尔病毒(ebv感染/传染性单核病),巨细胞病毒,非典冠状病毒(严重急性呼吸综合征)或正黏液病毒,流感病毒a/b/c(流感/禽流感),副粘病毒,人类副流感病毒,rsv(人类呼吸道合胞病毒),hmpv;消化系统病毒(腮腺炎病毒,巨细胞病毒(巨细胞病毒食管炎),腺病毒(腺病毒感染),轮状病毒,诺瓦克病毒,星状病毒,冠状病毒,乙型肝炎病毒,cbv,甲型肝炎病毒,丙型肝炎病毒,丁型肝炎病毒,戊型肝炎病毒,hgv);泌尿生殖病毒,如bk病毒,muv(腮腺炎)。
更进一步,本发明也包括用本发明中偶联物和可接受的载体,稀释剂或辅料构成的组合物,以治疗癌症、感染或自身免疫性疾病。治疗癌症、感染和自身免疫性疾病的方法可以在体外,体内或离体实施。体外用途的实例包括用它处理细胞培养物,以杀死除了不表达靶抗原的变体以外的所有细胞;或者杀死表达不需要的抗原的变体。离体使用的例子包括在进行移植(hsct)之前对造血干细胞(hsc)进行处理,以杀死患病或恶性肿瘤细胞。例如,在癌症治疗中的自体移植之前或在自身免疫性疾病的治疗中从骨髓中去除肿瘤细胞或淋巴细胞,或在移植之前为了防止移植物抗宿主疾病从同种异体骨髓或组织中除去t细胞和其他淋巴细胞。这样的临床离体治疗可以按如下步骤进行:从患者或其他个体收获骨髓,然后在含有血清的培养基中约37℃下孵育约30分钟至约48小时,在该培养基中加入本发明的偶联物,浓度范围从约1pm至0.1mm。具体的药物浓度和孵育时间应当由专业临床医师决定。孵育后,用含血清的培养基洗涤骨髓细胞,并按照已知的方法通过静脉注射给患者。若患者在骨髓采集和再输注治疗细胞之间,还接受其它治疗(例如消融化疗或全身辐射疗程),应使用标准医疗设备将处理后的骨髓细胞在液氮中冷冻储存。
用于偶联的小分子药物/细胞毒性剂
本发明中可以与细胞结合剂偶联的药物是包括细胞毒性剂在内的小分子药物,它们连接至或经修饰后连接至细胞结合剂。本发明中的“小分子药物”泛指分子量为100至2500,更优200至2000的有机、无机或金属有机化合物。这些小分子药物在本领域文献中已被充分描述,如wo05058367a2和美国专利4,956,303等,此处引作参考。小分子药物包括已知的药物和即将被公开的药物。
已知的药物包括但不限于:
1)化疗药物:a)烷基化剂,如氮芥:氯苯那普,氯普那嗪,环磷酰胺,达喀尔巴嗪,雌二醇氮芥,异环磷酰胺,氮芥,盐酸二甲氧胺,氧化二氮芥,盐酸氨氯地平,麦考酚酸,卫矛醇,呱泊溴烷,新氮芥,苯芥胆甾醇,松龙苯芥,噻替呱,曲磷胺对,尿嘧啶氮芥;cc-1065(包括其阿多来新、卡折来新、比折来新及其合成类似物);多卡霉素(包括kw-2189和cbi-tmi、及其合成类似物);苯并二氮卓二聚体(例如吡咯并苯二氮卓(pbd)或托美霉素,吲哚并苯并二氮卓,咪唑并苯并噻二氮卓或恶唑烷并苯并二氮卓的二聚体);亚硝基脲(卡莫司汀,洛莫司汀,氯化梭菌素,福莫司汀,尼莫司汀,拉莫司汀);烷基磺酸盐(白苏芬、树苏芬、磺胺异丙磺胺和皮苏芬);三氮烯(达喀尔巴嗪);含铂化合物(卡铂,顺铂,奥沙利铂);吖丙啶类,如苯并二氢吡喃酮,卡洛酮,美妥替派和乌雷多巴;乙烯亚胺和甲基三聚氰胺,包括六甲蜜胺,三亚乙基三胺,三乙基磷酰胺,三亚乙基硫代磷酰胺和三羟甲基甲基胺;b)植物生物碱:如长春花生物碱(长春新碱,长春碱,长春地辛,长春瑞滨,去甲长春碱);紫杉醇类(紫杉醇,多西紫杉醇及其类似物);美登素类(dm1、dm2、dm3、dm4、美登素、安沙霉素及其类似物);cryptophycin(特别是cryptophycin1和cryptophycin8);埃博霉素,软珊瑚醇,迪莫利德,草苔虫内酯,海兔毒素,奥瑞他汀,tubulysin,cephalostatin,pancratistatin,sarcodictyin,海绵抑制素;c)dna拓扑异构酶抑制剂,例如依托泊苷替尼(9-氨基喜树碱,喜树碱,克立那托,多拉霉素,依托泊苷,磷酸依托泊苷,伊立替康,米托蒽醌,诺消灵,视黄酸(视黄醇),替尼泊苷,拓扑替康,9-硝基喜树碱(rfs2000));丝裂霉素(丝裂霉素c);d)抗代谢物,例如抗叶酸剂,dhfr抑制剂(甲氨蝶呤,曲麦克特,二甲叶酸,蝶罗呤,氨喋呤(4-氨基苯甲酸)或其他叶酸类似物);imp脱氢酶抑制剂(麦考酚酸,噻唑呋林,利巴韦林,eicar);核糖核苷酸还原酶抑制剂(羟基脲,去铁胺);嘧啶类似物,尿嘧啶类似物(安西他滨,阿扎胞苷,6-氮尿嘧啶,卡培他滨(希罗达),卡莫氟,阿糖胞苷,双脱氧尿苷,脱氧氟尿苷,依诺他滨,5-氟尿嘧啶,氟尿苷,ratitrexed(tomudex);胞嘧啶类似物(阿糖胞苷,胞嘧啶阿拉伯糖苷,氟达拉滨);嘌呤类似物(硫唑嘌呤,氟达拉滨,巯嘌呤,硫胺素,硫鸟嘌呤);叶酸补充剂,如弗洛林酸;e)激素疗法剂,如受体拮抗剂,抗雌激素(甲地孕酮,雷洛昔芬,他莫昔芬),lhrh兴奋剂(戈斯他林,醋酸亮丙瑞林);抗雄激素药(比卡鲁胺,氟他胺,卡鲁司酮,丙酸倍他雄酮,表雄甾醇,戈舍瑞林,亮丙瑞林,美替利定,尼鲁米特,睾内酯,曲洛司坦及其他雄激素抑制剂);维甲类化合物,维生素d3类似物(cb1093,eb1089,kh1060,胆钙化醇,麦角钙化甾醇);光动力疗法剂(维替泊芬,酞菁,光敏剂pc4,去甲氧基-竹红菌素a);细胞因子(干扰素-α,干扰素-γ,肿瘤坏死因子(tnf),含tnf的人蛋白);f)激酶抑制剂,如bibw2992(抗-egfr/erb2),伊马替尼,吉非替尼,呱加他尼,索拉非尼,达沙替尼,舒尼替尼,厄洛替尼,尼洛替尼,拉帕替尼,阿西替尼,帕唑帕尼,凡德他尼,e7080(抗vegfr2),mubritinib,普纳替尼(ap24534),bafetinib(inno-406),bosutinib(ski-606),卡博替尼,维莫德吉,iniparib,鲁索利替尼,cyt387,阿西替尼,tivozanib,索拉非尼,贝伐单抗,西妥昔单抗,曲妥珠单抗,雷珠单抗,帕尼单抗,伊斯平斯;g)聚(adp-核糖)聚合酶(parp)抑制剂,如奥拉帕里、尼拉帕里、依尼帕里、塔拉佐帕里、维利帕里、维利帕里、cep9722(cephalon)、e7016(eisai)、bgb-290(beigene)、3-氨基苯甲酰酰胺;h)抗生素,如烯二炔类抗生素(加利车霉素,特别是加利车霉素γ1,δ1,α1和β1(参考j.med.chem.1996,39(11),2103-2117;angewchemintl.ed.engl.1994,33:183-186),达因霉素,包括达因霉素a和脱氧米霉素,埃斯培拉霉素,卡塔尔霉素,c-1027,maduropeptin,新卡嗪奥斯汀和相关色蛋白烯二炔抗生素),aclacinomysins,放线菌素,安曲霉素,重氮丝氨酸,博来霉素,卡诺霉素,卡拉霉素,洋红霉素,嗜癌素,色霉素,达金霉素,柔红霉素,去柔红霉素,6-重氮-5-氧代-l-去甲亮氨酸,多柔比星,吗啉-多柔比星,氰基吗啉-多柔比星,2-吡咯啉多柔比星和脱氧柔红霉素,表柔比星,阿柔比星,伊达比星,马可霉素,nitomycin,霉酚酸,诺加霉素,橄榄霉素,peplomycin,potfiromycin,嘌呤霉素,奎拉霉素,罗道霉素,链黑霉素,链脲霉素,杀结核菌素,乌苯美司,净司他丁,佐柔比星;i)其他,如聚酮化合物(番荔素),特别是bullatacin和bullatacinone;吉西他滨,环氧酶素(如卡菲偌米布),硼替佐米,沙利度胺,来那度胺,pomalidomide,tosedostat,zybrestat,plx4032,sta-9090,stimuvax,allovectin-7,xegeva,provenge,yervoy,异戊二烯化抑制剂(如洛伐他汀),多巴胺能神经毒素(如星形孢菌素),放线菌素(如放线菌素d,更生霉素),博莱霉素(如博来霉素a2,博莱霉素b2,培洛霉素),蒽环类抗生素(如柔红霉素),鹅膏毒素,多柔比星(亚德里亚霉素),伊达比星,表柔比星,吡柔比星,佐柔比星,米托蒽醌,mdr抑制剂(如维拉帕米),ca2+atp酶抑制剂(如毒胡萝卜素),组蛋白去乙酰酶抑制剂(伏立诺他,罗米地辛,帕比司他,丙戊酸,mocetinostat(mgcd0103),belinostat,pci-24781,恩替诺特,sb939,resminostat,givinostat,ar-42,cudc-101,萝卜硫素,曲古抑菌素a);塞来昔布,格列酮类,表没食子儿茶素没食子酸酯,双硫仑,salinosporamidea;抗肾上腺药物,如氨鲁米特,米托坦,曲洛司坦,醋葡醛内酯,醛磷酰胺,氨基乙酰丙酸,安吖啶,阿拉伯糖苷,bestrabucil,比生群,edatraxate,defofamine,美可辛,地吖醌,依氟鸟氨酸(dfmo),elfomithine,依利醋铵,依托格鲁,硝酸镓,胞嘧啶,羟基脲,伊班膦酸盐,香菇多糖,氯尼达明,米托胍腙,米托蒽醌,莫呱达醇,二胺硝吖啶,喷司他丁,蛋氨氮芥,吡柔比星,鬼臼酸,2-乙肼,甲基苄肼;
2)自身免疫疾病药物,包括但不限于,环孢菌素,环孢菌素a,氨基己酸,硫唑嘌呤,溴隐亭,苯丁酸氮芥,氯喹,环磷酰胺,皮质类固醇(例如安西奈德,倍他米松,布地奈德,氢化可的松,氟尼缩松,丙酸氟替卡松,氟可龙达那唑,地塞米松,曲安奈德,二丙酸倍氯米松),dhea,依那西普,羟基氯喹,英夫利昔单抗,美洛昔康,甲氨蝶呤,麦考酚酸酯,泼尼松,西罗莫司,他克莫司。
3)抗感染性疾病药物,包括但不限于a)氨基糖苷类:阿米卡星,阿司米星,庆大霉素(奈替米星,西索米星,异帕米星),潮霉素b,卡那霉素(阿米卡星,阿贝卡星,氨基脱氧卡那霉素,地贝卡星,妥布霉素),新霉素(framycetin,巴龙霉素,核糖霉素),奈替米星,壮观霉素,链霉素,妥布霉素,甲基姿苏霉素;b)酰胺醇类:迭氮氯霉素,氯霉素,氟苯尼考,甲砜霉素;c)安沙霉素:格尔德霉素,除莠霉素;d)碳青霉烯类:比阿培南,多利培南,厄他培南,亚胺培南/西司他丁,美罗培南,帕尼培南;e)头孢烯:碳头孢烯(洛拉卡比),头孢乙腈,氯氨苄青霉素,头孢拉定,头孢羟氨,头孢洛宁,头孢噻啶,头孢噻吩或头孢金素,头孢氨苄,头孢来星,头孢孟多,头孢匹林,羟胺唑头孢菌素,氟唑头孢菌素,孢西酮,唑啉头孢菌素,头孢拉宗,头孢卡品,头孢达肟,头孢吡,头孢克肟,头孢西丁,头孢罗齐,头孢甲氧环烯胺,头孢替唑,头孢呋辛,头孢克肟,头孢地尼,头孢托仑,头孢吡,头孢他美,头孢甲肟,头孢地嗪,头孢尼西,头孢呱酮,头孢雷特,头孢噻肟,噻乙胺唑头孢菌素,头孢唑兰,头孢氨苄,头孢咪唑,头孢匹胺,头孢匹罗,头孢泊肟,头孢罗齐,头孢喹诺,头孢磺啶,头孢他啶,头孢特仑,头孢布腾,头孢噻林,头孢唑肟,头孢吡普,头孢曲松,头孢呋辛,头孢唑南,头霉素(头孢西丁,头孢替坦,头孢氰唑),氧(碳)头孢烯(氟氧头孢,拉氧头孢);f)糖肽:博来霉素,万古霉素(奥利万星,特拉万星),替考拉宁(达巴万星),雷莫拉宁;g)甘氨酰环素:如替加环素;h)β-内酰胺酶抑制剂:青霉烷(舒巴坦,他唑巴坦),氧青霉烷(克拉维酸);i)林可酰胺:克林霉素,林可霉素;j)脂肽:达托霉素,a54145,钙依赖性抗生素(cda);k)大环内酯类:阿奇霉素,克霉素,克拉霉素,地红霉素,红霉素,氟雷霉素,交沙霉素,酮内酯(泰利霉素,塞红霉素),麦迪霉素,米卡霉素,竹桃霉素,利福霉素(异烟肼、利福平,利福布丁,利福喷汀),罗匹霉素,罗红霉素,大观霉素,螺旋霉素,他克莫司(fk506),醋竹桃霉素,泰利霉素;l)单环胺:氨曲南,替吉莫南;m)恶唑烷酮类:利奈唑胺;n)青霉素类:阿莫西林,氨苄青霉素(匹氨西林,海洛西林,巴氨西林,氨苄青霉素,多柔比星),阿替代西林,阿洛西林,苄青霉素,苄星青霉素苄青霉素,苄星青霉素苯氧甲基青霉素,克洛西林,普鲁卡因青霉素(美替西林),美洛西林,甲氧西林,萘夫西林,苯唑西林,醋甲西林,青霉素,非奈西林,苯氧基甲基青霉素,呱拉西林,氨苄西林,磺苯西林,替莫西林,替卡西林;o)多肽:杆菌肽,粘菌素,多粘菌素b;p)喹诺酮类:阿拉曲沙星,巴洛沙星,环丙沙星,克林沙,达氟沙星,二氟沙星,依诺沙星,恩诺沙星,加雷沙星,加替沙星,吉米沙星,格帕沙星,卡诺曲伐沙星,左氧氟沙星,洛美沙星,麻保沙星,莫西沙星,那氟沙星,诺氟沙星,奥比沙星,氧氟沙星,培氟沙星,曲伐沙星,格帕沙星,西他沙星,司帕沙星,替马沙星,托沙星,曲伐沙星;q)链阳性菌素:普那霉素,奎奴普丁/达福普汀;r)磺胺类:氨芐磺胺,偶氮磺胺,磺胺嘧啶,磺胺甲异唑、磺胺酰亚胺、磺胺吡啶、磺胺异恶唑、甲氧苄啶、磺胺甲恶唑(复方磺胺甲恶唑);s)类固醇抗菌药物:如夫西地酸;t)四环素类:强力霉素,金霉素,氯米西环素,地美环素,雷莫昔林,美西环素,美他环素,米诺环素,土霉素,潘美环素,吡咯烷甲基四环素,四环素,甘氨酰环素(如替加环素);u)其他类型的抗生素:番荔枝素,胂凡纳明,细菌萜醇抑制剂(杆菌肽),danal/ar抑制剂(环丝氨酸),dictyostatin,圆皮海绵内酯,软珊瑚醇,埃博霉素,乙胺丁醇,依托泊苷,法罗培南,夫西地酸,呋喃唑酮,异烟肼,laulimalide,甲硝唑,莫匹罗星,nam合成抑制剂(例如磷霉素),呋喃妥因,紫杉醇,普兰西霉素,吡嗪酰胺,奎奴普丁/达福普汀,利福平,他唑巴坦替硝唑,乌菊花素。
4)抗病毒药物:a)侵入/融合抑制剂:阿帕韦洛,马拉韦罗,vicriviroc,gp41(恩夫韦肽),pro140,cd4(艾巴利珠单抗);b)整合酶抑制剂:雷特格韦,elvite-gravir,globoidnana;c)成熟抑制剂:bevirimat,vivecon;d)神经氨酸酶抑制剂:奥司他韦,扎那米韦,帕拉米韦;e)核苷和核苷酸:阿巴卡韦,阿昔单韦,阿德福韦,阿莫西韦,阿昔单抗,溴夫定,西多福韦,克拉夫定,地塞米松,去羟肌苷(ddi),elvucitabine,恩曲他滨(ftc),恩替卡韦,泛昔洛韦,氟拉西林(5-fu),3’-氟取代的2’,3’-脱氧核苷类似物,如3’-氟-2’,3’-双脱氧胸苷(flt)和3’-氟-2’,3’-双脱氧鸟苷(flg),福米韦生,9-鸟嘌呤,碘苷,拉米夫定(3tc),1-核苷(例如β-1-胸苷和β-1-2'-脱氧胞苷),喷昔洛韦,racivir,利巴韦林,迪替丁,司他夫定(d4t),塔利巴韦林(viramidine),替比夫定,替诺福韦,三氟尿苷伐昔洛韦,缬更昔洛韦,扎西他滨(ddc),齐多夫定(azt);f)非核苷类:金刚烷胺,阿替吡啶,卡普韦林,二芳基嘧啶(依曲韦林,rilpivirine),地拉夫定,二十二烷醇,乙米韦林,依法韦仑,膦甲酸(磷酰基甲酸),咪喹莫特,聚乙二醇干扰素,洛韦胺,洛德腺苷,甲吲噻腙,奈韦拉平,nov-205,长效干扰素α,鬼臼毒素,利福平,金刚乙胺,瑞喹莫德(r-848),醋胺金刚烷;g)蛋白酶抑制剂:安普那韦,阿扎那韦,boceprevir,darunavir,福萨那韦,印地那韦,洛匹那韦,奈非那韦,普来可那立,利托那韦,沙奎那韦,telaprevir(vx-950),替拉那韦;h)其它类型的抗病毒药物:抗体酶,阿比朵尔,calanolidea,ceragenin,氰维林-n,二芳基嘧啶,表没食子儿茶素没食子酸酯(egcg),膦甲酸,格里菲辛,taribavirin(viramidine),羟基脲,kp-1461,米替福新,普来可那立,混成抑制剂,利巴韦林,seliciclib。
5)双链接连接体偶联的药物还包括放射性同位素。放射性同位素(放射性核素)的实例有3h,11c,14c,18f,32p,35s,64cu,68ga,86y,99tc,111in,123i,124i,125i,131i,133xe,177lu,211at或213bi。放射性同位素标记的抗体可用于受体靶向成像实验,或者可用于如本发明的抗体-药物偶联物的靶向治疗(wuetalnaturebiotechnology2005,23(9)1137-1146)。细胞结合分子,例如抗体可以通过本专利的连接体连结配体试剂,进行标记。配体可以用文献(currentprotocolsinimmunology,volumes1和2,coligenetal,ed.wiley-interscience,newyork,n.y.pubs.(1991))所述的方法与放射性金属结合、螯合或生成复合物。可以络合金属离子的螯合配体包括dota,dotp,dotma,dtpa和teta(macrocyclics,dallas,tx)等。
6)上述任何药物的药学上可接受的盐,酸或其衍生物,水合物或水合盐;或晶体结构;或任何上述药物的旋光异构体,外消旋物,非对映异构体或对映异构体。
在另一个实施例中,结构式(i)和(ii)中的药物/细胞毒性剂可以是发色分子,得到的偶联物可用于检测,监测或研究细胞结合分子与靶细胞的相互作用。发色分子可以吸收一种光,如紫外光,荧光,红外光,近红外光或可见光;发色分子包括黄色素,红细胞,虹彩色素,白细胞,黑色素和蓝绿色素的一类或一个亚类,荧光分子(吸收光后再发光的荧光化学物质)的一类或一个亚类,视觉光转导分子的一类或一个亚类,光子分子的一类或一个亚类,冷光分子的一类或一个亚类和荧光素化合物的一类或一个亚类。
发色分子可选自,但不限于,非蛋白质有机荧光团,例如氧杂蒽衍生物(荧光素,罗丹明,俄勒冈绿,伊红和德克萨斯红);花青衍生物(花青,吲哚羰花青,氧杂花青,硫代花青和部花青);方酸衍生物和环取代的方酸,包括seta,setau和square染料;萘衍生物(丹酰和氟硅酸钠衍生物);香豆素衍生物;恶二唑衍生物(吡啶基恶唑,硝基苯并恶唑和苯并恶二唑);蒽衍生物(蒽醌类,包括draq5,draq7和cytrak橙);芘衍生物(级联蓝等);恶嗪衍生物(尼罗红,尼罗蓝,甲酚紫,恶嗪170等);吖啶衍生物(黄醇黄素,吖啶橙,吖啶黄等);芳基甲胺衍生物(金胺,结晶紫,孔雀石绿)和四吡咯衍生物(卟吩,酞菁,胆红素)。
生色分子选自以下荧光化合物的任何类似物和衍生物:cf染料(biotium),draq和cytrak探针(bios-tatus),bodipy(invitrogen),alexafluor(invitrogen),dylightfluor(thermoscientific,pierce),atto和tracy(sigmaaldrich),fluoprobes(interchim),abberior染料(abberior),dy和megastokes染料(dyomics),sulfocy染料(cyandye),hilytefluor(anaspec),seta,setau和square染料(biosearchtechnologies),surelight染料(apc,rpepercp,phycobilisomes)(columbiabiosciences),apc,apcxl,rpe,bpe(phyco-biotech)。
广泛使用的可与本发明连接体反应或偶联的荧光化合物的实例有:别藻蓝蛋白(apc),氨基胭脂蛋白,apc-cy7偶联物,bodipy-fl,cascadeblue,cy2,cy3,cy3.5,cy3b,cy5,cy5.5,cy7,荧光素,fluorx,羟基香豆素,丽丝胺罗丹明b,萤光黄,me-甲氧基香豆素,nbd,pacificblue,pacificorange,pe-cy5偶联物,pe-r-藻红蛋白(pe),red613,seta-555-azide,seta-555-dbco,seta-555-nhs,seta-580-nhs,seta-680-nhs,seta-apc-780,seta-percp-680,seta-r-pe-670,setau-380-nhs,setau-405-马来酰亚胺,setau-405-nhs,setau-425-nhs,setau-647-nhs,texasred,tritc,trured,x-rhodamine。
可以与本发明的连接体相连,用于研究核酸或蛋白质的荧光化合物,选自下列化合物或其衍生物:7-aad(7-氨基放线菌素d,cg-选择性的),吖啶橙,色霉素a3,cytrak橙(biostatus),dapi,draq5,draq7,溴化乙锭,hoechst33258,hoechst33342,lds751,光辉霉素,碘化丙啶(pi),sytox蓝,sytox绿,sytox橙,噻唑橙,to-pro,菁染料单体,toto-1,to-pro-1,toto-3,to-pro-3,yoseta-1,yoyo-1。可以与本发明的连接体相连,用于研究细胞的荧光化合物,选自下列化合物或其衍生物:dcfh(2',7'-二氯二氢荧光素,氧化形式),dhr(二氢罗丹明123,氧化形式,光催化氧化),fluo-3(am酯,ph>6),fluo-4(am酯,ph7.2),indo-1(am酯,低/高钙(ca2+)),snarf(ph6/9)。优选的荧光化合物选自:别藻蓝蛋白(apc),amcyan1(四聚体,clontech),asred2(四聚体,clontech),蓟绿(单体,mbl),azurite,b-藻红蛋白(bpe),cerulean,cypet,dsred单体(clontech),dsred2(“rfp”,clontech),ebfp,ebfp2,ecfp,egfp(弱二聚体,clontech),emerald(弱二聚体,invitrogen),eyfp(弱二聚体,clontech),gfp(s65a突变),gfp(s65c突变),gfp(s65l突变),gfp(y66h突变),gfp(y66w突变),gfpuv,hcred1,j-red,katusha,kusabiraorange(单聚体,mbl),mcfp,mcherry(单体,mbl),mkate(tagfp635,单体,evrogen),mkeima-red(单体,mbl),mko,morange,mplum,mraspberry,mrfp1(单体,tsien实验室),mstrawberry,mtfp1,mturquoise2,p3(藻胆体复合物),多甲藻黄素-叶绿素-蛋白质复合物(percp),r-phycoerythrin(rpe),t-sapphire,tagcfp(二聚体,evrogen),taggfp(二聚体,evrogen),tagrfp(二聚体,evrogen),tagyfp(二聚体,evrogen),tdtomato(串联二聚体),topaz,turbofp602(二聚体,evrogen),turbofpp635(二聚体,evrogen),turbogfp(二聚体,evrogen),turborfp(二聚体,evrogen),turboyfp(二聚体,evrogen),venus,野生型gfp型,ypet,zsgreen1(四聚体,clontech),zsyellow1(四聚体,clontech)。
通过双键连接体连接的抗体—发色团分子偶联物的结构实例如ac01,ac02,ac03,ac04,ac05,ac06,和ac07:
其中“-----”任选地是单键或双键,或者可以缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;r12和r12'独立地为oh,nh2,nhr1,nhnh2,nhnhcooh,o-r1-cooh,nh-r1-cooh,nh-(aa)ncooh,o(ch2ch2o)pch2ch2oh,o(ch2ch2o)pch2ch2nh2,nh(ch2ch2o)pch2ch2nh2,o(ch2ch2o)pch2ch2cooh,nh(ch2ch2o)pch2ch2cooh,o(ch2ch2o)pch2ch2nhso3h,nh(ch2ch2o)pch2ch2nhso3h,r1-nhso3h,nh-r1-nhso3h,o(ch2ch2o)pch2ch2nhpo3h2,nh(ch2ch2o)pch2ch2nhpo3h2,r1-nhpo3h2,r1-opo3h2,o(ch2ch2o)pch2ch2opo3h2,nh(ch2ch2o)pch2ch2nhpo3h2,or1-nhpo3h2,nh-r1-nhpo3h2,nh-ar-cooh,nh-ar-nh2,其中p=0-5000,aa是氨基酸;r1,m1,n,l1和l2与结构式(i)中定义的相同。
在另一个实施方案中,结构式(i)和(ii)中的药物可以是聚亚烷基二醇,哺乳动物给药时,用于延长细胞结合分子的半衰期。聚亚烷基二醇包括但不限于聚乙二醇(peg),聚丙二醇以及环氧乙烷和环氧丙烷的共聚物;优选的是peg,更优选的是单官能活化的羟基peg(例如,单个末端活化的羟基peg,包括羟基peg-活性酯,羟基peg-单醛,羟基peg-单胺,羟基peg-单酰肼,羟基peg-单肼基甲酸酯,羟基peg-单碘乙酰胺,羟基peg-单马来酰亚胺,羟基peg-邻二硫吡啶,羟基peg-单肟,羟基peg-单苯基碳酸酯,羟基peg-单苯基乙二醛,羟基peg-单噻唑烷-2-硫酮,羟基peg-单硫代酯,羟基peg-单巯基,羟基peg-单三嗪和羟基peg-单乙烯基砜)。
在某些实施例中,聚亚烷基二醇分子量为约10da至约200kda,优选约88da至约40kda的分子量;具有两个分支,每个分支分子量为约88da至约40kda;更优选的具有两个分支,每个分支约88da至约20kda。在一个具体实施例中,聚亚烷基二醇是聚乙二醇,分子量为约10kda,20kda,或40kda。在具体的实施例中,peg是peg10kda(直链或支链),peg20kda(直链或支链)或peg40kda(直链或支链)。许多美国专利公开了直链或支链“非抗原性”peg聚合物及其衍生物或偶联物的制备,见美国专利号5,428,128;5621039;5622986;5643575;5728560;5730990;5738846;5811076;5824701;5840900;5880131;5900402;5902588;5919455;5951974;5965119;5965566;5969040;5981709;6011042;6042822;6113906;6127355;6132713;6,177,087和6,180,095。通过双链连接体连接的抗体-聚亚烷基二醇偶联物的结构如pg01,pg02和pg03:
其中“-----”任选地是单键或双键,或者缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;p是1-5000;r1,l1和l2与式(i)中定义的相同。优选r1和r3独立地为h,oh,och3,ch3,或oc2h5。
在另一个实施方案中,优选的通过本专利的连接体连接至细胞结合分子的细胞毒剂是tubulysin,美登素,紫杉烷类,cc-1065类似物,柔红霉素和多柔比星化合物,苯并二氮卓二聚体(例如吡咯并苯二氮卓(pbd),托美霉素,氨茴霉素,吲哚并苯并二氮卓,咪唑并苯并噻二氮卓或恶唑烷并苯并二氮卓的二聚体),加利车霉素类和烯二炔类抗生素,放线菌素,氮丝菌素,博来霉素,表柔比星,他莫昔芬,伊达比星,多拉司他汀,澳瑞他汀(例如mmae,mmaf,澳瑞他汀pye,澳瑞他汀tp,澳瑞他汀2-aq,6-aq,eb(aeb)和efp(aefp)),多卡霉素,格尔德霉素,甲氨喋呤,噻替派,长春地辛,长春新碱,半米塔林,nazumamides,微晶蛋白,放射敏素,alterobactin,microsclerodermins,theonellamides,esperamicin,pnu-159682及其类似物和衍生物,药学上可接受的盐,酸,衍生物,水合物或水合盐;或晶体结构;或任何上述药物的旋光异构体,外消旋物,非对映异构体或对映异构体。
本领域公知tubulysin是优选的用于共轭偶联的细胞毒性剂,并可以根据已知方法从天然来源分离或者根据已知方法合成制备,如balasubramanian,r.等j.med.chem.2009,52,238–240;wipf,p.;等org.lett.2004,6,4057–4060;pando,o.等j.am.chem.soc.2011,133,7692–7695;reddy,j.a.等mol.pharmaceutics,2009,6,1518–1525;raghavan,b.等j.med.chem.2008,51,1530–1533;patterson,a.w.等j.org.chem.2008,73,4362–4369;pando,o.等org.lett.2009,11(24),pp5567–5569;wipf,p.等org.lett.2007,9(8),1605–1607;friestad,g.k.org.lett.2004,6,pp3249–3252;hillarym.peltier,h.m.等j.am.chem.soc.2006,128,16018–16019;chandrasekhar,s.等j.org.chem.2009,74,9531–9534;liu,y.等mol.pharmaceutics,2012,9,168–175;friestad,g.k.等org.lett.2009,11,1095–1098;kubicek,k.等,angewchemintedengl,2010.49,4809-12;chai,y.等,chembiol,2010,17296-309;ullrich,a.等,angewchemintedengl,2009,48,4422-5;sani,m.等angewchemintedengl,2007,46,3526-9;domling,a.等,angewchemintedengl,2006.45,7235-9;专利zanda,m.等,加拿大专利ca2710693(2011);chai,y.等,欧盟专利2174947(2010),pctwo2010034724;leamon,c.等,pctwo2010033733,wo2009002993;ellman,j.等pctwo2009134279,pctwo2009012958,美国专利20110263650,20110021568;matschiner,g.等pctwo2009095447;vlahov,i.等pctwo2009055562,wo2008112873;low,p.等pctwo2009026177;richter,w.pctwo2008138561;kjems,j.等pctwo2008125116;davis,m.等pctwo2008076333;diener,j.等美国专利申请20070041901,wo2006096754;matschiner,g.等pctwo2006056464;vaghefi,f.等pctwo2006033913;doemling,a.德国专利102004030227,pctwo2004005327,wo2004005326,wo2004005269;stanton,m.等美国专利申请20040249130;hoefle,g.等,德国专利10254439,10241152,10008089;leung,d.等wo2002077036;reichenbach,h.等,德国专利19638870;wolfgang,r.美国专利20120129779;chen,h.美国专利申请20110027274。在专利pct/ib2012/053554中描述了与细胞结合分子偶联的tubulysin的优选结构。
通过双链连接体连接的抗体-tubulysin偶联物结构的例子如t01,t02,t03,t04,t05,t06,t07,t08,t09,t10和t11:
其中“-----”任选地是单键或双键,或者缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;mab是抗体,优选单克隆抗体;r12是oh,nh2,nhr1,nhnh2,nhnhcooh,o-r1-cooh,nh-r1-cooh,nh(aa)ncooh,o(ch2ch2o)pch2ch2oh,o(ch2ch2o)pch2ch2nh2,nh(ch2ch2o)pch2ch2nh2,nr1r1’,nhoh,nhor1,o(ch2ch2o)pch2ch2cooh,nh(ch2ch2o)pch2ch2cooh,nh-ar-cooh,nh-ar-nh2,o(ch2ch2o)pch2ch2nhso3h,nh(ch2ch2o)pch2ch2nh-so3h,r1-nhso3h,nh-r1-nhso3h,o(ch2ch2o)pch2ch2nhpo3h2,nh(ch2ch2o)pch2-ch2nhpo3h2,or1,r1-nhpo3h2,r1-opo3h2,o(ch2ch2o)pch2ch2opo3h2,or1-nhpo3h2,nh-r1-nhpo3h2,nh(ch2ch2nh)pch2ch2nh2,nh(ch2ch2s)pch2ch2nh2,nh(ch2ch2nh)pch2ch2oh,nh(ch2ch2s)pch2ch2oh,nh-r1-nh2,或nh(ch2ch2o)pch2ch2nhpo3h2,其中aa是1-8氨基酸;n和m1独立地为1-20;p是1-5000;优选地,r1,r1’,r2,r3和r4独立地为h;c1-c8直链或支链烷基,酰胺,或胺;c2-c8芳基,烯基,炔基,杂芳基,杂烷基,烷基环烷基,酯,醚,杂环烷基或酰氧基胺;或含有1-8个氨基酸的肽,或具有式(och2ch2)p或(och2ch(ch3))p的聚氧乙烯基单元,其中p是1至约5000的整数;两个r基团:r1r2,r2r3,r1r3或r3r4可以形成烷基,芳基,杂芳基,杂烷基或烷基环烷基的3-8元环状结构;x3为h,ch3,ch2ch3,c3h7或x1'r1',其中x1'为nh,n(ch3),nhnh,o或s;r1'是h或c1-c8直链或支链烷基,芳基,杂芳基,杂烷基,烷基环烷基或酰氧基胺;r3'是h或c1-c6直链或支链烷基;z3为h,coor1,nh2,nhr1,or1,conhr1,nhcor1,ocor1,op(o)(om1)(om2),och2op(o)(om1)(om2),oso3m1,r1,o-糖苷(葡萄糖苷,半乳糖苷,甘露糖苷,葡萄糖醛酸苷/葡糖苷酸,糖苷,果糖苷等),nh-糖苷,s-糖苷或ch2-糖苷;m1和m2独立地为h,na,k,ca,mg,nh4,nr1r2r3;l1和l2与结构式(i)中定义相同。
在本发明的细胞结合分子-药物偶联物中,优选的加利车霉素及其相关的烯二炔抗生素,可参考文献:nicolaou,k.c.等,science1992,256,1172-1178;proc.natl.acad.sciusa.1993,90,5881-8;美国专利4,970,198;5,053,394;5,108,912;5,264,586;5,384,412;5,606,040;5,712,374;5,714,586;5,739,116;5,770,701;5,770,710;5,773,001;5,877,296;6,015,562;6,124,310;8,153,768。通过连接体连接的抗体-加利车霉素类似物的偶联物的结构实例是如下c01和co2:
其中“-----”任选地是单键或双键,或者可以缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;p是1-5000;r1,l1和l2与式(i)中定义的相同。
优选用于本发明的美登木素生物碱包括美登醇及其类似物,可参考美国专利4,256,746;4,361,650;4,307,016;4,294,757;4,294,757;4,371,533;4,424,219;4,331,598;4,450,254;4,364,866;4,313,946;4,315,929;4,362,663;4,322,348;4,371,533;4,424,219;5,208,020;5,416,064;5,208,020;5,416,064;6,333.410;6,441,163;6,716,821;7,276,497;7,301,019;7,303,749;7,368,565;7,411,063;7,851,432和8,163,888。通过本专利连接体连接的抗体-美登木素生物碱偶联物的结构实例如下:my01,my02,my03,my04,my05和my06:
其中“-----”任选地是单键或双键,或者缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;p是1-5000;r1,l1和l2与式(i)中定义的相同。
紫杉烷,包括紫杉醇(一种细胞毒性天然产物)和多西紫杉醇(一种半合成衍生物)及其类似物,是本发明优选的细胞毒性分子,在如下文献中有描述kc.nicolaou等,j.am.chem.soc.117,2409-20,(1995);ojima等,j.med.chem.39:3889-3896(1996);40:267-78(1997);45,5620-3(2002);ojima等,proc.natl.acad.sci.96:4256-61(1999);kim等,bull.koreanchem.soc.20,1389-90(1999);miller等,j.med.chem.47,4802-5(2004);美国专利5,475,0115,728,849,5,811,452;6,340,701;6,372,738;6,391,913,6.436,931;6,589,979;6,596,757;6,706,708;7,008,942;7,186,851;7,217,819;7,276,499;7,598,290;和7,667,054。
经本专利的连接体连接的抗体-紫杉烷偶联物的结构实例如tx01,tx02和tx03:
其中“-----”任选地是单键或双键,或者缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;
mab是抗体,优选单克隆抗体;n和m1独立地为1-20;r1,l1和l2与式(i)中定义的相同。
cc-1065类似物和多卡霉素类似物也是与本专利的双键连接体连接,优选的细胞毒性剂。cc-1065类似物和多卡霉素类似物的实例及其合成可见于warpehoski等,j.med.chem.31:590603(1988);d.boger等,j.org.chem66,6654-61,2001;美国专利4169888,4391904,4671958,4816567,4912227,4923990,4952394,4975278,4978757,4994578,5037993,5070092,5084468,5101038,5117006,5137877,5138059,5147786,5187186,5223409,5225539,5288514,5324483,5332740,5332837,5334528,5403484,5427908,5475092,5495009,5530101,5545806,5547667,5569825,5571698,5573922,5580717,5585089,5585499,5587161,5595499,5606017,5622929,5625126,5629430,5633425,5641780,5660829,5661016,5686237,5693762,5703080,5712374,5714586,5739116,5739350,5770429,5773001,5773435,57863775786486,5789650,5814318,5846545,5874299,5877296,5877397,5885793,5939598,5962216,5969108,5985908,6060608,6066742,6075181,6103236,6114598,6130237,6132722,6143901,6150584,6162963,6172197,6180370,6194612,6214345,6262271,6281354,6310209,6329497,6342480,6486326,6512101,6521404,6534660,6544731,6548530,6555313,6555693,6566336,6586618,6593081,6630579,6756397,6759509,6762179,6884869,6897034,6946455,7049316,7087600,7091186,7115573,7129261,7214663,7223837,7304032,7329507,7329760,7388026,7655660,7655661,7906545,和8012978。由本发明的连接体连接的抗体-cc1065类似物偶联物的结构实例如cc01,cc02,cc03和cc04:
其中mab是抗体;z3为h,po(om1)(om2),so3m1,ch2po(om1)(om2),ch3n(ch2ch2)2nc(o)-,o(ch2ch2)2nc(o)-,r1或糖苷;其中“-----”任选地是单键或双键,或者缺省;x1,x5,y1和y5独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;r1,l1和l2与式(i)中定义的相同。
柔红霉素/多柔比星同系物也是与本专利的双链连接体连接,优选的细胞毒性剂。优选的结构及其合成可参考:hurwitz,e.等,cancerres.35,1175-81(1975);yang,h.m.reisfeld,r.a.proc.natl.acad.sci.85,1189-93(1988);pietersz,c.a.e.等,cancerres.48,926-311(1988);trouet等,79,626-29(1982);z.brich等,j.controlledrelease,19,245-58(1992);chen等,syn.comm.33,2377-90,2003;king等,bioconj.chem.10,279-88,1999;king等,j.med.chem.45,4336-43,2002;kratz等,jmedchem.45,5523-33,2002;kratz等,biolpharmbull.jan.21,56-61,1998;lau等,bioorg.med.chem.3,1305-12,1995;scott等,bioorg.med.chem.lett.6,1491-6,1996;watanabe等,tokaij.experimentalclin.med.15,327-34,1990;zhou等,j.am.chem.soc.126,15656-7,2004;wo01/38318;美国专利5,106,951;5,122,368;5,146,064;5,177,016;5,208,323;5,824,805;6,146,658;6,214,345;7569358;7,803,903;8,084,586;8,053,205。经由本发明的连接体连接的抗体-多柔比星类似物偶联物的结构实例如da01,da02,da03,da04,da05,da06,da07和da08:
其中“-----”任选地是单键或双键,或者缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;r12是oh,nh2,nhr1,nhnh2,nhnhcooh,o-r1-cooh,nh-r1-cooh,nh(aa)ncooh,o(ch2ch2o)pch2ch2oh,o(ch2ch2o)pch2ch2nh2,nh(ch2ch2o)pch2ch2nh2,nr1r1’,nhoh,nhor1,o(ch2ch2o)pch2ch2cooh,nh((ch2ch2o)pch2ch2cooh,nh-ar-cooh,nh-ar-nh2,o(ch2ch2o)pch2ch2nhso3h,nh(ch2ch2o)pch2ch2nh-so3h,r1-nhso3h,nh-r1-nhso3h,o(ch2ch2o)pch2ch2nhpo3h2,nh((ch2ch2o)pch2ch2nhpo3h2,or1,r1-nhpo3h2,r1-opo3h2,o(ch2ch2o)pch2ch2opo3h2,or1-nhpo3h2,nh-r1-nhpo3h2,nh(ch2ch2o)pch2ch2nh2,nh(ch2ch2s)pch2ch2nh2,nh(ch2ch2nh)pch2ch2oh,nh(ch2ch2s)pch2ch2oh,nh-r1-nh2,或nh(ch2ch2o)pch2ch2nhpo3h2,其中aa是1-8氨基酸;p是1-5000;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;r1,l1和l2与结构式(i)中定义相同。
澳瑞他汀和多拉司他汀是优选的和双链连接体连接的细胞毒性剂。澳瑞他汀,如多澳瑞他汀e(ae),澳瑞他汀eb(aeb),澳瑞他汀efp(aefp),单甲基澳瑞他汀e(mmae),单甲基澳瑞他汀f(mmaf),澳瑞他汀f苯二胺(afp)和mmae的苯丙氨酸变体,是多拉司他汀的同系物,在如下文献中有描述:int.j.oncol.15367-72(1999);molecularcancertherapeutics,vol.3,no.8,pp.921-32(2004);美国专利申请11134826,20060074008,2006022925;美国专利4414205,4753894,4764368,4816444,4879278,4943628,4978744,5122368,5165923,5169774,5286637,5410024,5521284,5530097,5554725,5585089,5599902,5629197,5635483,5654399,5663149,5665860,5708146,5714586,5741892,5767236,5767237,5780588,5821337,5840699,5965537,6004934,6033876,6034065,6048720,6054297,6054561,6124431,6143721,6162930,6214345,6239104,6323315,6342219,6342221,6407213,6569834,6620911,6639055,6884869,6913748,7090843,7091186,7097840,7098305,7098308,7498298,7375078,7462352,7553816,7659241,7662387,7745394,7754681,7829531,7837980,7837995,7902338,7964566,7964567,7851437,7994135。抗体-澳瑞他汀通过本发明的连接体连接的偶联物的结构实例如au01,au02,au03,au04,au05,au06,au07,au08,au09,au10,au11,au12和au13:
其中“-----”任选地是单键或双键,或者缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;r12是oh,nh2,nhr1,nhnh2,nhnhcooh,o-r1-cooh,nh-r1-cooh,nh(aa)ncooh,o(ch2ch2o)pch2ch2oh,o(ch2ch2o)pch2ch2nh2,nh(ch2ch2o)pch2ch2nh2,nr1r1’,nhoh,nhor1,o(ch2ch2o)pch2ch2cooh,nh(ch2ch2o)pch2ch2cooh,nh-ar-cooh,nh-ar-nh2,o(ch2ch2o)pch2ch2nhso3h,nh(ch2ch2o)pch2ch2nh-so3h,r1-nhso3h,nh-r1-nhso3h,o(ch2ch2o)pch2ch2nhpo3h2,nh(ch2ch2o)pch2-ch2nhpo3h2,or1,r1-nhpo3h2,r1-opo3h2,o(ch2ch2o)pch2ch2opo3h2,or1-nhpo3h2,nh-r1-nhpo3h2,nh(ch2ch2nh)pch2ch2nh2,nh(ch2ch2s)pch2ch2nh2,nh(ch2ch2nh)pch2ch2oh,nh(ch2ch2s)pch2ch2oh,nh-r1-nh2,或nh(ch2ch2o)pch2ch2nhpo3h2,其中aa是1-8氨基酸;p是1-5000;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;p是1-5000;优选地,r1,r2,r3和r4独立地为h;c1-c8直链或支链烷基,芳基,杂芳基,杂烷基,烷基环烷基,酯,醚,酰胺,胺,杂环烷基或酰氧基胺;或含有1-8个氨基酸的肽,或具有式(och2ch2)p或(och2ch(ch3))p的聚氧乙烯基单元,其中p是1至约5000的整数。两个r,r1r2,r2r3,r1r3或r3r4可以形成烷基,芳基,杂芳基,杂烷基或烷基环烷基的3-8元环;x3为h,ch3,或x1'r1',其中x1'为nh,n(ch3),nhnh,o或s;r1'是h或c1-c8直链或支链烷基,芳基,杂芳基,杂烷基,烷基环烷基,酰氧基胺;r3'是h或c1-c6直链或支链烷基;z3为h,coor1,nh2,nhr1,or1,conhr1,nhcor1,ocor1,op(o)(om1)(om2),och2op(o)(om1)(om2),oso3m1,r1,o-糖苷(葡萄糖苷,半乳糖苷,甘露糖苷,葡萄糖醛酸苷/葡糖苷酸,阿洛糖苷,果糖苷等),nh-糖苷,s-糖苷或ch2-糖苷;m1和m2独立地为h,na,k,ca,mg,nh4,nr1r2r3;z1,z2,l1和l2与结构式(i)中定义相同。
苯并二氮卓二聚体(例如吡咯并苯二氮卓(pbd),托美霉素,吲哚并苯并二氮卓,咪唑并苯并噻二氮卓或恶唑烷并苯并二氮卓的二聚体)是本发明中优选的细胞毒性分子,在本领域的文献中也有描述:美国专利8,163,736;8,153,627;8,034,808;7,834,005;7,741,319;7,704,924;7,691,848;7,678,787;7,612,062;7,608,615;7,557,099;7,528,128;7,528,126;7,511,032;7,429,658;7,407,951;7,326,700;7,312,210;7,265,105;7,202,239;7,189,710;7,173,026;7,109,193;7,067,511;7,064,120;7,056,913;7,049,311;7,022,699;7,015,215;6,979,684;6,951,853;6,884,799;6,800,622;6,747,144;6,660,856;6,608,192;6,562,806;6,977,254;6,951,853;6,909,006;6,344,451;5,880,122;4,935,362;4,764,616;4,761,412;4,723,007;4,723,003;4,683,230;4,663,453;4,508,647;4,464,467;4,427,587;4,000,304;美国专利申请20100203007,20100316656,20030195196,20100203007,20100316656,20030195196。以双链连接体连接的抗体-苯并二氮卓二聚体偶联物结构的实例如pb01,pb02,pb03,pb04,pb05,pb06,pb07,pb08,pb09,pb10,pb11,pb12,pb13,pb14,pb15,pb16,pb17,pb18,pb19,pb20,pb21和pb22。
其中“-----”任选地是单键或双键,或者缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;l1,l2,z1和z2与结构式(i)中定义的相同。r1,r2,r3,r1',r2'和r3'独立地为h;f;cl;=o;=s;oh;sh;c1-c8直链或支链烷基,芳基,烯基,杂芳基,杂烷基,烷基环烷基,酯(coor5或-oc(o)r5),醚(or5),酰胺(conr5),氨基甲酸酯(oconr5),胺(nhr5,nr5r5'),杂环烷基或酰氧基胺(-c(o)nhoh,-onhc(o)r5);或含有1-8个天然或非天然氨基酸的肽,或结构式为(och2ch2)p或(och2ch(ch3))p的聚氧乙烯单元,其中p是1至约5000的整数。两个r,r1r2,r2r3,r1r3。r1'r2',r2'r3'或r1'r3'可独立地形成烷基,芳基,杂芳基,杂烷基或烷基环烷基的3-8元环;x2和y2独立地为n,ch2或cr5,其中r5为h,oh,nh2,nh(ch3),nhnh2,cooh,sh,oz3,sz3或c1-c8直链或支链烷基,芳基,杂芳基,杂烷基,烷基环烷基,酰氧基胺;z3为h,op(o)(om1)(om2),och2op(o)(om1)(om2),oso3m1或o-糖苷(葡萄糖苷,半乳糖苷,甘露糖苷,葡萄糖醛酸苷/葡糖苷酸,阿洛糖苷,果糖苷等),nh-糖苷,s-糖苷或ch2-糖苷;m1和m2独立地为h,na,k,ca,mg,nh4,nr1r2r3。
鹅膏毒肽包括至少有十种有毒化合物,它们最初在几个属的有毒蘑菇中被发现,尤其是伞形毒菌和其他几个蘑菇种类。鹅膏毒肽也是优选的通过本发明桥连接体进行偶联的细胞毒性分子。目前,十种已知的鹅膏毒肽,α-鹅膏蕈碱,β-鹅膏蕈碱,γ-鹅膏蕈碱,ε-鹅膏蕈碱,鹅膏无毒环肽,一羟基鹅膏毒肽羧酸,鹅膏毒肽酰胺,三羟基鹅膏毒肽和鹅膏毒肽酰胺原均是双环多肽,在合成时经历了一个35个氨基酸的前蛋白,而后被脯氨酰寡肽酶切断,得到最终的八个氨基酸肽(litten,w.scientificamerican1975,232(3)90–101;h.e.hallen,etalproc.nat.aca.sci.usa2007,104,19097–101;k.baumann等biochemistry1993,32(15)4043–50;karlson-stiberc,perssonh.toxicon2003,42(4)339–49;horgen,p.a.etal.arch.microbio.1978,118(3):317-9)。鹅膏毒肽通过抑制rna聚合酶ii(polii),阻断基因转录和蛋白质生物合成,来杀死细胞(brodner,o.g.和wieland,t.biochemistry1976,15(16)3480–4;fiume,l.,currproblclinbiochem,1977,723-8;karlson-stiberc,perssonh.toxicon2003,42(4)339–49;chafin,d.r.,guo,h.&price,d.h.j.biol.chem.1995,270(32)19114–19;wieland,int.j.pept.proteinres.1983,22(3)257-76.)。鹅膏毒肽可以从采集的伞形毒菌蘑菇中制得(yocum,r.r.biochemistry1978,17(18)3786-9;zhang,p.等femsmicrobiol.lett.2005,252(2),223-8),或用担子菌发酵(muraoka,s.和shinozawat.,j.bioscibioeng.2000,89(1)73-6,美国专利20100267019)或用a.fissa进行发酵,或通过培养簇生盔孢菌或黄褐盔孢菌产生(wo/1990/009799,日本专利11137291)。然而,些分离和发酵的方式的产量非常低(低于5mg/l培养物)。在过去的三十年中,有文献报道了鹅膏毒肽及其类似物的几种合成方法(w.e.savige,a.fontana,chem.commun.1976,600–1;zanotti,g.等intjpeptproteinres,1981.18(2)162-8;wieland,t.等eur.j.biochem.1981,117,161–4;p.a.bartlett等tetrahedronlett.1982,23,619–22;zanotti,g.等biochimbiophysacta,1986.870(3)454-62;zanotti,g.等int.j.peptideproteinres.1987,30,323–9;zanotti,g.等int.j.peptideproteinres.1987,30,450–9;zanotti,g.等intjpeptproteinres,1988.32(1)9-20;g.zanotti,t.等int.j.peptideproteinres.1989,34,222–8;zanotti,g.等intjpeptproteinres,1990.35(3)263-70;mullersman,j.e.和j.f.preston,3rd,intjpeptproteinres,1991.37(6)544-51;mullersman,j.e.等intjpeptproteinres,1991.38(5)409-16;zanotti,g.等intjpeptproteinres,1992.40(6)551-8;schmitt,w.等j.am.chem.soc.1996,118,4380–7;anderson,m.o.等j.org.chem.,2005,70(12)4578-84;j.p.may等j.org.chem.2005,70,8424–30;f.brueckner,p.cramer,nat.struct.mol.biol.2008,15,811–8;j.p.may,d.m.perrin,chem.eur.j.2008,14,3404–9;j.p.may等chem.eur.j.2008,14,3410–17;q.wang等eur.j.org.chem.2002,834–9;may,j.p.和d.m.perrin,biopolymers,2007.88(5)714-24;may,j.p.等chemistry,2008.14(11)3410-7;s.delamomarin等eur.j.org.chem.2010,3985–9;pousse,g.等orglett,2010.12(16)3582-5;luo,h.等chembiol,2014.21(12)1610-7;zhao,l.等chembiochem,2015.16(10)1420-5),其中大部分是通过部分合成实现的。由于其极高的效力和独特的细胞毒性机制,鹅膏毒肽已被用作偶联物的有效载荷(fiume,l.,lancet,1969.2(7625)853-4;barbanti-brodano,g.和l.fiume,natnewbiol,1973.243(130)281-3;bonetti,e.,m.等archtoxicol,1976.35(1)p.69-73;davis,m.t.,preston,j.f.science1981,213,1385–1388;preston,j.f.等archbiochembiophys,1981.209(1)63-71;h.faulstich等biochemistry1981,20,6498–504;barak,l.s.等procnatlacadsciusa,1981.78(5)3034-8;faulstich,h.和l.fiume,methodsenzymol,1985.112225-37;zhelev,z.,a.等toxicon,1987.25(9)981-7;khalacheva,k.等ekspmedmorfol,1990.29(3)26-30;u.bermbach,h.faulstich,biochemistry1990,29,6839–45;mullersman,j.e.和j.f.preston,int.j.peptideproteinres.1991,37,544–51;mullersman,j.e.和j.f.preston,biochemcellbiol,1991.69(7)418-27;j.anderl,h.echner,h.faulstich,beilsteinj.org.chem.2012,8,2072–84;moldenhauer,g.等j.natl.cancerinst.2012,104,622–34;a.moshnikova,etal;biochemistry2013,52,1171–8;zhao,l.等chembiochem,2015.16(10)1420-5;zhou,b.等biosensbioelectron,2015.68189-96;wo2014/043403,us20150218220,ep1661584)。我们也一直在研究鹅膏毒肽的共轭偶联。通过双链连接体连接的抗体—鹅膏毒肽偶联物的实例如am01,am02,am03和am04:
其中“-----”任选地是单键或双键,或者缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;r7,r8和r9独立地为h,oh,or1,nh2,nhr1,c1-c6烷基或缺省;y2是o,o2,nr1,nh或缺省;r10是ch2,o,nh,nr1,nhc(o),nhc(o)nh,nhc(o)o,oc(o)o,c(o),oc(o),oc(o)(nr1),(nr1)c(o)(nr1),c(o)r1或缺省;r11是oh,nh2,nhr1,nhnh2,nhnhcooh,o-r1-cooh,nh-r1-cooh,nh(aa)ncooh,o(ch2ch2o)pch2ch2oh,o(ch2ch2o)pch2ch2nh2,nh(ch2ch2o)pch2ch2nh2,nr1r1’,o(ch2ch2o)pch2ch2cooh,nh(ch2ch2o)pch2ch2cooh,nh-ar-cooh,nh-ar-nh2,o(ch2ch2o)pch2ch2nhso3h,nh(ch2ch2o)pch2ch2nh-so3h,r1-nhso3h,nh-r1-nhso3h,o(ch2ch2o)pch2ch2nhpo3h2,nh(ch2ch2o)pch2-ch2nhpo3h2,or1,r1-nhpo3h2,r1-opo3h2,o(ch2ch2o)pch2ch2opo3h2,or1-nhpo3h2,nh-r1-nhpo3h2,或nh(ch2ch2o)pch2ch2nhpo3h2,其中aa是1-8氨基酸;n和m1独立地为1-20;p是1-5000;r1,l1和l2与结构式(i)中定义相同。l1,l2,r1,z1和z2与结构式(i)中定义的相同。
在另一个实施方案中,可以通过本专利的双链连接体将免疫毒素与细胞结合分子偶联。本文的免疫毒素是大分子药物,其通常是源自细菌或植物蛋白的细胞毒性蛋白,例如白喉毒素(dt),霍乱毒素(ct),天花粉蛋白(tcs),dianthin,假单胞菌外毒素a(eta'),红细胞毒素,白喉毒素,ab毒素,iii型外毒素等,也可以是一种剧毒的细菌成孔原毒素,在蛋白水解后被激活。这种原毒素的一个例子是proaerolysin及其基因修饰形式topsalysin。topsalysin是一种经过修饰的重组蛋白,经过改造后可被前列腺中的酶选择性激活,导致局部细胞死亡和组织破坏而不损伤邻近组织和神经。
在又一个实施方案中,细胞结合配体或细胞受体激动剂可以通过本专利的双链连接体偶联至细胞结合分子。这些偶联的细胞结合配体或细胞受体激动剂,特别是抗体-受体偶联物,不仅可以用作靶向导体/导向器以将偶联物递送至恶性细胞,而且还可以用于调节或共刺激期望的免疫应答或改变信号传导途径。
在免疫治疗中,细胞结合配体或受体激动剂优选与tcr(t细胞受体)t细胞的抗体缀合,或car(嵌合抗原受体)t细胞或b细胞受体(bcr),自然杀伤(nk)细胞,或细胞毒性细胞。这种抗体优选是抗cd3,cd4,cd8,cd16(fcγriii),cd27,cd40,cd40l,cd45ra,cd45ro,cd56,cd57,cd57bright,tnfβ,fas配体,mhci类分子(hla-a,b,c),或nkr-p1.细胞结合配体或受体激动剂选自但不限于:叶酸衍生物(结合叶酸受体,在卵巢癌和其他恶性肿瘤中过表达的蛋白质)(low,p.s.等2008,acc.chem.res.41,120-9);谷氨酸尿素衍生物(与前列腺特异性膜抗原结合,前列腺癌细胞的表面标志物)(hillier,s.m.等,2009,cancerres.69,6932-40);生长抑素(也称为生长激素抑制激素(ghih)或生长激素释放抑制因子(srif))或生长激素释放抑制激素)及其类似物如奥曲肽(sandostatin)和兰瑞肽(somatuline)(特别用于神经内分泌肿瘤,gh产生性垂体腺瘤,副神经节瘤,无功能性垂体腺瘤,嗜铬细胞瘤)(ginj,m.等,2006,proc.natl.acad.sci.u.s.a.103,16436-41)。一般而言,生长抑素及其受体亚型(sst1,sst2,sst3,sst4和sst5)已在许多类型的肿瘤中被发现,如神经内分泌肿瘤,特别是在分泌gh的垂体腺瘤中(reubij.c.landolt,a.m.1984j.clin.endocrinolmetab591148–51;reubij.c.landolta.m.1987jclinendocrinolmetab6565–73;moysee,等,jclinendocrinolmetab6198–103)和胃肠胰腺肿瘤(reubij.c.等,1987jclinendocrinolmetab651127–34;reubi,j.c,等,1990cancerres505969–77),嗜铬细胞瘤(epel-baumj,等1995jclinendocrinolmetab80:1837–44;reubij.c.等,1992jclinendocrinolmetab741082–9),成神经细胞瘤(prevostg,1996neuroendocrinology63:188–197;moertel,c.l,等1994amjclinpath102:752–756),甲状腺髓样癌(reubi,j.c,等1991labinvest64:567–573)小细胞肺癌(sagmanu,等,1990cancer66:2129–2133),非神经内分泌肿瘤包括脑肿瘤如脑膜瘤,成神经管细胞瘤或神经胶质瘤(reubij.c.等1986jclinendocrinolmetab63433–8;reubij.c.等1987cancerres475758–64;fruhwald,m.c,等1999pediatrres45697–708),乳腺癌(reubij.c.等1990intjcancer46416–20;srkalovicg,等1990jclinendocrinolmetab70661–669),淋巴瘤(reubij.c.等1992,intjcancer50895–900),肾细胞癌(reubij.c.等1992,cancerres526074–6078),间叶组织肿瘤(reubij.c.等1996cancerres561922–31),前列腺癌(reubij.c.等1995,j.clin.endocrinolmetab802806–14;等1989,prostate14:191–208;halmosg,等j.clin.endo-crinolmetab852564–71),卵巢癌(halmos,g,等,2000jclinendocrinolmetab853509–12;reubij.c.等1991amjpathol138:1267–72),胃癌(reubij.c.等1999,intjcancer81376–86;miller,g.v,1992brjcancer66391–95),肝细胞癌(kouroumalise,等1998gut42442–7;reubij.c.等1999gut4566–774)和鼻咽癌(lohk.s,等,2002virchowsarch441444–8);某些芳香磺酰胺类化合物,尤其是碳酸酐酶ix(缺氧和肾细胞癌标志物)(neri,d.等,nat.rev.drugdiscov.2011,10,767-7);垂体腺苷酸环化酶激活肽(pacap)(pac1)用于嗜铬细胞瘤和副神经节瘤;血管活性肠肽(vip)及其受体亚型(vpac1,vpac2)用于肺癌,胃癌,结肠癌,直肠癌,乳腺癌,前列腺癌,胰腺导管癌,肝癌,膀胱癌和上皮肿瘤的癌症;各种肿瘤的α-黑素细胞刺激激素(α-msh)受体;胆囊收缩素(cck)/胃泌素受体及其受体亚型(cck1(以前称为cck-a)和cck2),用于小细胞肺癌,甲状腺髓样癌,星形细胞瘤,胰岛素瘤和卵巢癌;蛙皮素(pyr-gln-arg-leu-gly-asn-gln-trp-ala-val-gly-his-leu-met-nh2)/胃泌素释放肽(grp)及其受体亚型(bb1,grp受体亚型(bb2),bb3和bb4)用于肾细胞癌,乳腺癌,肺癌,胃癌和前列腺癌以及神经母细胞瘤(和神经母细胞瘤(ohlsson,b.等,1999,scand.j.gastroenterology34(12)1224–9;weber,h.c.2009,cur.opin.endocri.diab.obesity16(1)66–71,gonzalezn,等,2008,cur.opin.endocri.diab.obesity15(1),58-64);神经降压素受体及其受体亚型(ntr1,ntr2,ntr3),用于小细胞肺癌,成神经细胞瘤,胰腺癌,结肠癌和尤因肉瘤;物质p受体及其受体亚型(例如神经胶质肿瘤的nk1受体,hennigi.m.等1995int.j.cancer61,786–792);神经肽y(npy)受体及其受体亚型(y1-y6)用于乳腺癌;归巢肽包括rgd(arg-gly-asp),ngr(asn-gly-arg),二聚和多聚环状rgd肽(例crgdfv)其识别肿瘤表面上的受体(整联蛋白)(laakkonenp,vuorinenk.2010,integrbiol(camb),2(7–8)326–337;chenk,chenx.2011,theranostics.1:189–200;garangere,等,anti-canceragentsmedchem.7(5)552–558;kerr,j.s.等,anticancerresearch,19(2a),959-968;thumshirn,g,等,2003chem.eur.j.9,2717-2725),和taasgvrsmh或ltlrwvglms(硫酸软骨素蛋白多糖ng2受体)和f3肽(结合细胞表面表达的核素受体的31个氨基酸的肽)(zitzmann,s.2002cancerres.62,18,pp.5139–5143,temminga,k.2005,drugresistanceupdates,8,381–402;p.laakkonen和k.vuorinen,2010integrativebiol,2(7-8),326–337;m.a.burg,1999cancerres.59(12),2869–2874;k.porkka,等2002,proc.nat.acad.sci.usa99(11),7444-9);细胞穿透肽(nakasei,等,2012,j.controlrelease.159(2),181–188);肽激素,如促黄体激素释放激素(lhrh)激动剂和拮抗剂,和促性腺激素释放激素(gnrh)激动剂,通过靶向卵泡刺激素(fsh)和黄体生成素(lh)起作用,以及睾酮产物,例如布舍瑞林(pyr-his-trp-ser-tyr-d-ser(otbu)-leu-arg-pro-nhet),戈那瑞林(pyr-his-trp-ser-tyr-gly-leu-arg-pro-gly-nh2),戈舍瑞林(pyr-his-trp-ser-tyr-d-ser(otbu)-leu-arg-pro-azgly-nh2),组氨瑞林(pyr-his-trp-ser-tyr-d-his(n-benzyl)-leu-arg-pro-nhet),醋酸亮丙瑞林(pyr-his-trp-ser-tyr-d-leu-leu-arg-pro-nhet),那法瑞林(pyr-his-trp-ser-tyr-2nal-leu-arg-pro-gly-nh2),曲普瑞林(pyr-his-trp-ser-tyr-d-trp-leu-arg-pro-gly-nh2),德舍瑞林,阿巴瑞克(ac-d-2nal-d-4-chlorophe-d-3-(3-pyridyl)ala-ser-(n-me)tyr-d-asn-leu-isopropyl-lys-pro-d-ala-nh2),西曲瑞克(ac-d-2nal-d-4-chloro-phe-d-3-(3-pyridyl)ala-ser-tyr-d-cit-leu-arg-pro-d-ala-nh2),地加瑞克(ac-d-2nal-d-4-chlorophe-d-3-(3-pyridyl)ala-ser-4-aminophe(l-hydroorotyl)-d-4-aminophe(carbamoyl)-leu-isopropyllys-pro-d-ala-nh2)和加尼瑞克(ac-d-2nal-d-4-chlorophe-d-3-(3-pyridyl)ala-ser-tyr-d-(n9,n10-diethyl)-homoarg-leu-(n9,n10-diethyl)-homoarg-pro-d-ala-nh2)(thundimadathil,j.j.aminoacids,2012,967347,doi:10.1155/2012/967347;boccon-gibod,l.;等,2011,therapeuticadvancesinurology3(3)127–140;debruyne,f.2006,futureoncology,2(6),677–696;schallya.v;nagy,a.1999eurjendocrinol141:1–14;koppanm,等1999prostate38:151–158);和模式识别受体(prr),如类toll受体(tlr),c型凝集素和nodlike受体(nlrs)(fukata,m.等,2009,semin.immunol.21,242–253;maisonneuve,c.等,2014,proc.natl.acad.sci.u.s.a.111,1–6;botos,i.等,2011,structure19,447–459;means,t.k.等,2000,lifesci.68,241–258)范围为小分子(咪喹莫特,鸟嘌呤和腺苷类似物)到大而复杂的生物大分子如脂多糖(lps),核酸(cpgdna,polyi:c)和脂肽(pam3csk4)(kasturi,s.p.等,2011,nature470,543–547;lane,t.2001,j.r.soc.med.94,316;hotz,c.和bourquin,c.2012,oncoimmunology1,227-228;dudek,a.z.等,2007,clin.cancerres.13,7119–25);降钙素受体是一种32-氨基酸神经肽,在很大程度上通过其对破骨细胞和肾脏的作用来调节钙水平(zaidim,等,1990critrevclinlabsci28,109–174;gorn,a.h.等1995jclininvest95:2680–91);整联蛋白受体及其受体亚型(例如αvβ1,αvβ3,αvβ5,αvβ6,α6β4,α7β1,αlβ2,αiibβ3,等)其通常在血管发生中起重要作用,表现在各种细胞的表面上,特别是破骨细胞,内皮细胞和肿瘤细胞(ruoslahti,e.等,1994cell77,477-8;albelda,s.m.等,1990cancerres.50,6757-64)。短肽,grgdspk和环状rgd五肽,如环(rgdfv)(l1)及其衍生物[cyclo(-n(me)r-gdfv),cyclo(r-sar-dfv),cyclo-(rg-n(me)d-fv),cyclo(rgd-n(me)f-v),cyclo(rgdf-n(me)v)(西仑吉肽)]已显示整联蛋白受体的高结合亲和力(dechantsreiter,m.a.等,1999j.med.chem.,42,3033-40,goodman,s.l.等,2002j.med.chem.45,1045-51)。
细胞结合配体或细胞受体激动剂可以是基于ig的和基于非ig的蛋白质支架分子。基于ig的支架可以选自但不限于纳米抗体(vhh的衍生物(骆驼ig))(muyldermanss.2013annurevbiochem。82,775–97);域抗体(dab,vh或vl域的衍生物)(holt,l.j,等,2003,trendsbiotechnol.21,484–90);双特异性t细胞engager(bite,双特异性双抗体)(baeuerle,p.a,等,2009,curr.opin.mol.ther.11,22–30);双亲和重新定位(dart,双特异性双抗体)(moorep.a.p,等2011,blood117(17),4542–51);四价串联抗体(tandab,二聚双特异双抗体)(cochlovius,b,等2000,cancerres.60(16):4336–4341);非ig支架,可以选自但不限于anticalin(lipocalins的衍生物)(skerraa.2008,febsj.275(11)2677–83;besteg,等,1999proc.nat.acad.usa.96(5):1898–903;skerra,a.2000biochimbiophysacta,1482(1-2)337–50;skerra,a.2007,curropinbiotechnol.18(4)295–304;skerra,a.2008,febsj.275(11):2677–83);adnectins(10thfn3(fibronectin))(koide,a,等,1998j.mol.biol.284(4):1141–51;batoriv,2002,proteineng.15(12)1015–20;tolcher,a.w,2011,clin.cancerres.17(2)363–71;hackel,b.j,2010,proteineng.des.sel.23(4)211–19);设计的锚蛋白重复蛋白(darpins)(ankrin重复蛋白的衍生物)(boersma,y.l,等,2011curropinbiotechnol.22(6)849–57),如darpinc9,darpinec4和darpine69_lz3_e01(winklerj,等,2009molcancerther.8(9),2674–83;patriciam-k.m.等,clincancerres.2011;17(1):100–10;boersmay.l,等,2011j.biol.chem.286(48),41273–85);avimers(域a/低密度脂蛋白(ldl)受体)(boersmay.l,2011j.biol.chem.286(48)41273–41285;silvermanj,等,2005nat.biotechnol.23(12):1556–61)。
通过本专利申请的双链连接体的抗体-细胞结合配体或抗体-细胞受体激动剂或抗体-药物偶联物的结构实例如下:lb01(叶酸偶联物),lb02(pmsa配体偶联物),lb03(pmsa配体偶联物),lb04(pmsa配体偶联物),lb05(生长抑素偶联物),lb06(生长抑素偶联物),lb07(奥曲肽,生长抑素类似物偶联物),lb08(兰瑞肽,生长抑素类似物偶联物),lb09(伐普肽(sanvar),生长抑素类似物偶联物),lb10(caix配体偶联物),lb11(caix配体偶联物),lb12(胃泌素释放肽受体(grpr),mba偶联物),lb13(促黄体激素释放激素(lh-rh)配体和gnrh偶联物),lb14(促黄体激素释放激素(lh-rh)和gnrh配体偶联物),lb15(gnrh拮抗剂,abarelix偶联物),lb16(钴胺素,维生素b12类似物偶联物),lb17(钴胺素,维生素b12类似物偶联物),lb18(αvβ3整联蛋白受体,环状rgd五肽偶联物),lb19(vegf受体的异二价肽配体偶联物),lb20(神经髓质素b偶联物),lb21(g蛋白偶联受体蛙皮素偶联物),lb22(类toll受体tlr2偶联物),lb23(雄激素受体偶联物),lb24(αv整合素受体西仑吉肽/环(-rgdfv-)偶联物),lb25(利福布汀类似物偶联物),lb26(利福布汀类似物偶联物),lb27(利福布汀类似物偶联物),lb28(氟氢可的松偶联物),lb29(地塞米松偶联物),lb30(丙酸氟替卡松偶联物),lb31(丙酸倍氯米松偶联物),lb32(曲安奈德偶联物),lb33(泼尼松偶联物),lb34(泼尼松龙偶联物),lb35(甲基强的松龙偶联物),lb36(倍他米松偶联物),lb37(伊立替康类似物偶联物),lb38(克唑替尼类似物偶联物),lb39(硼替佐米类似物偶联物),lb40(卡菲佐米类似物偶联物),lb41(卡菲佐米类似物偶联物),lb42(亮丙瑞林类似物偶联物),lb43(曲普瑞林类似物偶联物),lb44(克林霉素偶联物),lb45(利拉鲁肽类似物偶联物),lb46(索马鲁肽类似物偶联物),lb47(瑞他帕林类似物偶联物),lb48(indibulin类似物偶联物),lb49(长春碱类似物偶联物),lb50(利西那肽类似物偶联物),lb51(奥希替尼类似物偶联物),lb52(核苷类似物偶联物),lb53(厄洛替尼类似物偶联物)和lb54(拉帕替尼类似物偶联物),其结构如下所示:
lb01(叶酸偶联物),
lb03(pmsa配体偶联物),
lb04(pmsa配体偶联物),
lb05(生长抑素偶联物),
lb06(生长抑素偶联物),
lb07(奥曲肽,生长抑素类似物偶联物),
lb08(兰瑞肽,生长抑素类似物偶联物),
lb09(伐普肽(sanvar),生长抑素类似物偶联物),
lb10(caix配体偶联物),
lb12(胃泌素释放肽受体(grpr),mba偶联物),
lb14(促黄体激素释放激素(lh-rh)和gnrh配体偶联物),
lb15(gnrh拮抗剂,abarelix偶联物),
lb16(钴胺素,维生素b12类似物偶联物),
lb17(钴胺素,维生素b12类似物偶联物),
lb18(αvβ3整联蛋白受体,环状rgd五肽偶联物),
lb20(神经髓质素b偶联物),
lb21(g蛋白偶联受体蛙皮素偶联物),
lb22(类toll受体tlr2偶联物),
lb23(雄激素受体偶联物),
lb24(αv整合素受体的西仑吉肽/环(-rgdfv-)偶联物,
lb25(利福布汀类似物偶联物),
lb26(利福布汀类似物偶联物),
lb27(利福布汀类似物偶联物),
lb28(氟氢可的松偶联物),
lb29(地塞米松偶联物),
lb30(丙酸氟替卡松偶联物),
lb31(丙酸倍氯米松偶联物),
lb32(曲安奈德偶联物),
lb33(泼尼松偶联物),
lb34(泼尼松龙偶联物),
lb35(甲基强的松龙偶联物),
lb36(倍他米松偶联物),
lb37(伊立替康类似物偶联物),
lb38(克唑替尼类似物偶联物),
lb39(硼替佐米类似物偶联物),其中y5是n,ch,c(cl),c(ch3),或c(coor1);r1是h,c1-c6烷基,c3-c8芳基;
lb40(卡菲佐米类似物偶联物),
lb41(卡菲佐米类似物偶联物),
lb42(亮丙瑞林类似物偶联物),
lb43(曲普瑞林类似物偶联物),
lb44(克林霉素偶联物),
lb45(利拉鲁肽类似物偶联物),
lb46(索马鲁肽类似物偶联物),
lb47(瑞他帕林类似物偶联物),
lb48(indibulin类似物偶联物),
lb49(长春碱类似物偶联物),
lb50(利西那肽类似物偶联物),
lb51(奥希替尼类似物偶联物),
lb52(核苷类似物偶联物),
lb53(厄洛替尼类似物偶联物),
lb54(拉帕替尼类似物偶联物),
其中“-----”任选地是单键或双键,或者缺省;x1和y1独立地为o,nh,nhnh,nr5,s,c(o)o,c(o)nh,oc(o)nh,oc(o)o,nhc(o)nh,nhc(o)s,oc(o)n(r1),n(r1)c(o)n(r1),ch,c(o)nhnhc(o)和c(o)nr1;mab是抗体,优选单克隆抗体;n和m1独立地为1-20;l1,l2,r1,r1’,r2,z1,和z2与结构式(i)中定义的相同。x3是ch2,o,nh,nhc(o),nhc(o)nh,c(o),oc(o),oc(o)(nr3),r1,nhr1,nr1,c(o)r1或缺省;x4是h,ch2,oh,o,c(o),c(o)nh,c(o)n(r1),r1,nhr1,nr1,c(o)r1或c(o)o;x5是h,ch3,f或cl;m1和m2独立地为h,na,k,ca,mg,nh4,nr1r2r3;r6是5'-脱氧腺苷,me,oh或cn;
在另一个实施例中,通过本专利的双链连接体与细胞结合分子偶联的结构优选为一种,两种或更多种dna,rna,mrna,小干扰rna(sirna),微rna(mirna)和piwi相互作用rna(pirna)。短的rna(sirna,mirna,pirna)和长的非编码反义rna与细胞内的表观遗传变化相关(goodchild,j(2011),methodsinmolecularbiology(clifton,n.j.),7641–15)。本发明中的dna,rna,mrna,sirna,mirna或pirna可以是单链或双链,核苷酸单元为一百万至三百万,并且部分核苷酸可以是非天然(合成)形式,例如具有硫代磷酸酯键,如fomivirsen的寡核苷酸,或以硫代磷酸酯键而不是磷酸酯键连接天然rna和dna的核苷酸,分子中间的糖部分是脱氧核糖,在两端是2'-o-甲氧基乙基修饰的核糖,如mipomersen,的核苷酸,或含肽核酸(pna),吗啉代,硫代磷酸酯,硫代磷酰胺,或2'-o-甲氧基乙基(moe),2'-o-甲基,2'-氟,锁核酸(lna),或双环核酸(bna)核糖的寡核苷酸,或糖环中的2'-3'碳键被去除的核酸(whitehead,k.a.;等(2011),annualreviewofchemicalandbiomolecularengineering277–96;bennett,c.f.;swayze,e.e.(2010),annu.rev.pharmacol.toxicol.50259–29)。优选地,寡核苷酸的长度为约8至超过100个核苷酸。偶联物一个例子如下所示:
其中mab,m1,n,x1,l1,l2,z1,z2,“-----”与结构式(i)中定义的相同;
在另一个实施方案中,igg抗体与一种,或两种或更多种不同功能的分子或药物偶联,优选通过轻链和重链之间的一对巯基(通过还原二硫键),或轻重链之间一对巯基,或两个重链之间的上部一对巯基,以及两个重链之间的下部一对巯基特异性偶联,结构如st1,st2,st3,st4,st5或st6所示:
其中z1,z2,x,y,l1,l2,“-----”,m1和细胞毒性分子的定义与前文结构式(i)中相同。
此外,含有相同或不同双链连接体的细胞毒性分子,依次地与细胞结合分子偶联,或者,含有相同或不同双链连接体的不同细胞毒性分子,逐步加入含有细胞结合分子的偶联反应混合物中反应,在细胞结合分子的不同偶联位点处的细胞毒性分子和m1可以是不同的。
配方和应用
本专利申请的偶联物被配制成液体,或者适于冻干,而后可被复溶成液体的形态。可在病人上施用,无高水平抗体聚集的制剂配方包含0.1克/升-300克/升的偶联物活性成分、一种或多种多元醇(例如糖)、ph值为4.5至7.5的缓冲液、表面活性剂(如聚山梨酸20或80)、抗氧化剂(例如抗坏血酸和/或蛋氨酸)、强化剂(如甘露醇、山梨醇或氯化钠)、螯合剂(如edta)、金属络合物(如锌-蛋白络合物)、可生物降解聚合物(如聚酯)、防腐剂(如苯甲醇)和/或游离氨基酸。
用于制剂的合适缓冲液包括但不限于,有机酸盐,例如柠檬酸、抗坏血酸、葡糖酸、碳酸、酒石酸、琥珀酸、乙酸或邻苯二甲酸的钠、钾、铵或三羟乙基氨基盐,氨基丁三醇盐酸、硫酸或磷酸缓冲液。此外,氨基酸阳离子也可用作缓冲液。这些氨基酸包括但不限于,精氨酸、甘氨酸、甘氨酰甘氨酸和组氨酸。精氨酸缓冲液包括精氨酸乙酸盐、精氨酸氯化物、精氨酸磷酸盐、精氨酸硫酸盐,精氨酸琥珀酸盐等。在一个实施例中,精氨酸缓冲液是精氨酸乙酸盐。组氨酸缓冲液的实例包括组氨酸氯化物-精氨酸氯化物、组氨酸乙酸盐-精氨酸乙酸盐、组氨酸磷酸盐-精氨酸磷酸盐、组氨酸硫酸盐-精氨酸硫酸盐、组氨酸琥珀酸盐-精氨酸琥珀酸盐等。缓冲液的ph是4.5至ph7.5,优选约4.5至约6.5,更优选约5.0至约6.2。在一些实施例中,缓冲液中有机酸盐的浓度为约10mm至约500mm。
在制剂中可选地含有的“多元醇”是具有多个羟基的物质。多元醇可用作液体和冻干制剂中的稳定赋形剂和/或等渗剂。多元醇可以保护生物药物免受物理和化学降解。最好能被排除的共溶剂增加了蛋白质接口处溶剂的有效表面张力,能量最有利的结构构像是表面积最小的那些溶剂。多元醇包括糖(还原和非还原糖)、糖醇和糖酸。“还原糖”是指含有半缩醛基团的糖,它能够还原金属离子,或与蛋白质中的赖氨酸和其他氨基发生反应,“非还原糖”是指不具有还原糖性质的糖。还原糖的例子有果糖、甘露糖、麦芽糖、乳糖、阿拉伯糖、木糖、核糖、鼠李糖、半乳糖和葡萄糖。非还原糖包括蔗糖、海藻糖、山梨糖、松解糖和棉子糖。糖醇选自甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、乳糖醇、赤藓糖醇、苏糖醇、山梨醇和甘油。糖酸包括l-葡萄糖酸盐及其金属盐。液体配方或冻干制剂中的多元醇含量,按重量计,为0.0%-20%。在配方中优选浓度约为0.1%到15%的非还原糖,蔗糖或海藻糖,其中由于海藻糖的溶液稳定性,海藻糖更优。
在制剂中可选的表面活性剂可选自聚山梨醇酯(聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯65、聚山梨醇酯80、聚山梨醇酯81、聚山梨醇酯85等);泊洛沙姆(如泊洛沙姆188、聚(环氧乙烷)-聚(环氧丙烷)、泊洛沙姆407或聚丙二醇-丙二醇等);triton;十二烷基硫酸钠(sds);月桂基硫酸钠;辛基糖苷钠;十二烷基、肉荳蔻酰基、亚油基或硬脂基磺基甜菜碱;十二烷基、肉荳蔻酰基、亚油基或硬脂基肌氨酸;亚油酸、肉荳蔻基或十六烷基甜菜碱;月桂酰胺基丙基、椰油酰胺丙基、亚油酰胺基丙基、肉荳蔻酰基丙基、棕榈酰基丙基或异硬脂酰胺基丙基-甜菜碱(例如月桂酰胺丙基);肉荳蔻酰胺丙基、棕榈酰丙基或异硬脂酰胺基丙基-二甲胺;甲基椰油酰基钠或甲基油基牛磺酸二钠;十二烷基甜菜碱、十二烷基二甲基氧化胺、椰油酰胺丙基甜菜碱和可可两性甘氨酸酯;monaquattm系列(如异硬脂基乙基亚胺鎓乙基硫酸盐);聚乙二醇,聚丙二醇,乙二醇和丙二醇的共聚物(如pluronic、pf68等)。优选的表面活性剂是聚氧乙烯山梨糖醇脂肪酸酯,如聚山梨醇酯20、40、60或80(吐温tween20、40、60或80)。制剂中表面活性剂的浓度范围,按照重量计,为0.0%至约2.0%。在某些特定实施例中,表面活性剂浓度为约0.01%至约0.2%。在一个实施例中,表面活性剂浓度为约0.02%。
在制剂中可选的“防腐剂”是从根本上可以减小其中细菌的化合物。防腐剂的实例包括十八烷基二甲基芐基氯化铵、六甲基氯化铵、苯扎氯铵(烷基芐基二甲基氯化铵的混合物,其中烷基为长链烷基)和芐索氯铵。其他类型的防腐剂包括芳香醇如苯酚,丁基和芐基醇,对羟基苯甲酸烷基酯,如甲酯或丙酯,儿茶酚、间苯二酚、环己醇、3-戊醇和间甲酚。液体配方或冻干粉末中的防腐剂含量,按照重量计,为0.0%-5.0%。在一个实施例中,所用防腐剂是苯甲醇。
在制剂中合适的游离氨基酸,选自但不限于精氨酸、胱氨酸、甘氨酸、赖氨酸、组氨酸、鸟氨酸、异亮氨酸、亮氨酸、丙氨酸、甘氨酸谷氨酸或天冬氨酸中的一种或多种。优选碱性氨基酸为精氨酸、赖氨酸和/或组氨酸。如果组成中包含组氨酸,它可以充当缓冲剂和游离氨基酸,但是当使用组氨酸缓冲液时,通常还要包含一个非组氨酸的游离氨基酸,如赖氨酸。氨基酸可以以d-和/或l-型存在,但l-型比较常见。氨基酸可以任何合适的盐的形式存在,如精氨酸盐酸盐。液体配方或冻干粉末中的氨基酸含量,以重量计,为0.0001%-15.0%,优选为0.01%至5%。
可选地,制剂还包含甲硫氨酸或抗坏血酸作为抗氧化剂,浓度为约0.01至5毫克/毫升;可选地,制剂包含金属螯合剂,例如edta,egta等,浓度为约0.01至2mm。
最终的制剂可以用缓冲调节剂(如一种酸,包括hcl、h2so4、乙酸,h3po4、柠檬酸等,或是碱,如naoh、koh、nh4oh、乙醇胺、二乙醇胺或三乙醇胺、磷酸钠、磷酸钾、柠檬酸三钠、氨基丁三醇等)调节至优选的ph值。制剂还应当被调节至“等渗”,即目标制剂具有与人血基本相同的渗透压。等渗制剂渗透压通常为250至350mosm。可以使用蒸气压或冰冻型渗透压计测量等渗性。
用在本专利液体或冻干制剂中赋形剂包括:例如,岩藻糖、纤维二糖、麦芽三糖、蜜二糖、辛酮糖、核糖、木糖醇、精氨酸、组氨酸、甘氨酸、丙氨酸、蛋氨酸、谷氨酸、赖氨酸、咪唑、甘氨酰甘氨酸、甘露糖基甘油酸酯、tritonx-100、pluoronicf-127、纤维素、环糊精、(2-羟丙基)-β-环糊精、葡聚糖(10,40和/或70kd)、聚葡萄糖、麦芽糖糊精、聚蔗糖、明胶、羟丙基甲基纤维素、磷酸钠、磷酸钾、zncl2、锌、氧化锌、柠檬酸钠、柠檬酸三钠、氨基丁三醇、铜、纤连蛋白、肝素、人血清白蛋白、鱼精蛋白、甘油、edta、甲酚、苯甲醇、苯酚、多元醇、羰基被氢化还原成伯或仲羟基的糖。
其它可以在本专利申请的液体制剂中使用的赋形剂包括:调味剂、抗微生物剂、甜味剂、抗氧化剂、抗静电剂、脂质如磷脂或脂肪酸脂、类固醇如胆固醇、蛋白质赋形剂如血清白蛋白(人血清白蛋白)、重组人白蛋白、明胶、酪蛋白、成盐反离子如钠等。这些和另外的适用于本发明中的制剂的,已知的药物赋形剂和/或添加剂为本领域公知,如在由美国医药协会罗威(rowe)等人编着的第四版《药用辅料手册》(thehandbookofpharmaceuticalexcipients)中所列;以及由威尔金斯出版公司出版,热纳罗(gennaro)等人编着的第21版《雷明顿:药学科学与实践》(remington:thescienceandpracticeofpharmacy)中所列。
在更进一步的实施例中,本发明提供了制剂的制备方法,包括以下步骤:(a)冻干包含偶联物,赋形剂和缓冲体系的制剂;(b)在制剂可稳定存在的复溶介质中,复溶步骤(a)中的冻干混合物。步骤(a)的制剂可进一步包含稳定剂和一种或多种赋形剂,选自前述填充剂、盐、表面活性剂和防腐剂。复溶介质可选用水,如无菌水,抑菌性注射用水(bwfi)、乙酸、丙酸、琥珀酸、氯化钠、氯化镁、氯化钠的酸性溶液、氯化镁的酸性溶液或精氨酸的酸性溶液,其含量为约10至约250mm。
本发明的偶联物的液体制剂应具有各种预定的特征。需要考虑的主要问题之一是其稳定性,因为蛋白质/抗体在制造和储存期间,常会形成可溶及不溶的聚集体。此外,溶液中会发生各种化学反应(脱酰胺、氧化、剪切、异构化等),导致降解产物水平增加和/或生物活性丧失。液体或冻干制剂中的偶联物最好应在25℃时,具有超过18个月的货架期。更优的液体或冻干制剂中的偶联物应在25°时具有超过24个月的货架期。最为优选的液体制剂应该在2-8℃时具有约24至36个月的货架期,冻干粉末在2-8℃时,应该具有长达约60个月的货架期。液体制剂和冻干制剂应该具有在-20℃或-70℃下至少两年货架期。
在某些实施例中,制剂在冷冻(例如-20℃或-70℃)和解冻后,如在冷冻和解冻1、2或3个循环后,还是稳定的。稳定性可以通过各种不同的方式进行定性和/或定量评估,包括评估药物/抗体(蛋白质)比和多聚体的生成(如使用紫外吸收光谱、尺寸排除色谱法、测量混浊度和/或通过目视检查);评估电荷异质性(使用阳离子交换色谱法、图像毛细管等电聚焦(icief)或毛细管电泳);氨基末端或羧基末端序列分析;质谱分析或maldi/tofms或hplc-ms/ms分析;sds-page分析,以比较还原及完整的抗体;肽图(如胰蛋白酶或lys--c)分析;评估抗体的生物活性或抗原结合能力等。制剂不稳定性可能涉及下列一种或多种内容:聚集、去酰胺(例如asn脱酰胺)、氧化(例如met氧化)、异构化(例如asp异构化)、剪切或水解或裂解(例如铰链区裂解)、琥珀酰亚胺生成、半胱氨酸不成对、n端延伸、c端加工及糖基化差异等。
稳定的偶联物在药物制剂中应当可以“保持其生物活性”,在给定时间(例如12个月)内,所述偶联物的生物活性差异能够保持在制备时活性的约20%,优选约10%(测定的误差范围内)。生物活性可以通过如抗原结合和/或者体外细胞毒性分析测定。
容纳本专利申请中的偶联物制剂的药物容器或器具有:小瓶,瓶,预填充注射器,预填充或自动注射器。
临床使用时,通过本发明的双链连接体连接的偶联物将以溶液或冻干固体形式提供,固体可以再溶解于无菌注射用水中。偶联物给药合适方案的实例如下:每天,每周,每两周,每三周,每四周一次或每月一次,静脉注射给药8至54周。推注剂量混合在50至1000ml生理盐水,可任选地加入人血清白蛋白(如0.5至1ml的100mg/ml人血清白蛋白的浓缩溶液)。剂量为每周约50μg至20mg/kg体重,静脉注射(每次注射10μg至200mg/kg的范围)。治疗后4-54周,患者可接受第二疗程。关于给药途径,赋形剂,稀释剂,剂量,时间等的具体临床方案可由熟练的临床医生确定。
用体内外杀死特定细胞的方法,可以治疗的疾病的实例包括任何类型癌症的恶性肿瘤、自身免疫疾病、移植物排斥和感染(病毒、细菌或寄生虫)。
达到所需治疗效果需要的偶联物的量取决于许多因素,包括偶联物的化学特性、效力和生物利用度、疾病类型、患者所属物种、患者患病状态、给药途径,这些决定了所需药物剂量、给药方式和给药方案。
一般而言,可将本发明的偶联物配制成含有0.1至10%w/v偶联物的生理缓冲溶液中,供注射使用。典型的剂量范围是从1μg/kg至0.1g/kg(体重),每天、每周、每两周、每三周或每月一次。优选的剂量范围是每天0.01mg/kg至20mg/kg体重/每天,每周,每两周、每三周或每月,或幼儿等效剂量。待施用的药物的优选剂量可能取决于诸如疾病或病症的进展的类型和程度,特定患者的总体健康状况,所选化合物的相对生物功效,药物的配方,给药途径(静脉内,肌肉内或其他),药物指定运送途径的药代动力学性质,以及给药速度(推注或连续输注)和给药方案(给定时间内的重复次数)。
本发明的偶联物还能够以单位剂量形式给药,其中术语“单位剂量”是指能够给予患者的单次剂量,并且可以很容易地处置和包装,同时活性偶联物本身或如下文所述的药学上可接受的组合物,保持物理和化学上稳定的单位剂量。典型的每天/每周/每两周/每月总剂量范围是从0.01至100mg/kg体重。作为一般指导原则,人类的单位剂量范围为1mg到3000mg每天/每周/每两周/每三周/每月。单位剂量优选1至500mg,一月一次至四次,更优选为1mg至100mg,每周/每两周/每三周一次。本文提供的偶联物可以通过与一种或多种药学上可接受的赋形剂混合而配制成药物组合物。这样的单位剂量组合物可以通过口服给药,如片剂,简单胶囊或软凝胶胶囊的形式的药物;或鼻内给药,如粉剂,滴鼻剂或气雾剂的药物;或皮肤给药,如使用局部用软膏,乳膏,乳液,凝胶或喷雾剂或通过透皮贴剂给药。
在另一个实施方案中,包含治疗有效剂量的结构式为(i)的偶联物,或本发明中描述的其它任何偶联物的药物组合物,可以与其他治疗剂,如化学治疗剂,放射治疗剂,免疫治疗剂,自身免疫病症治疗剂,抗感染剂或其他偶联物协同给药,以有效治疗或预防癌症或自身免疫疾病或感染性疾病。协同剂优选自以下药物中的一种或几种阿巴西普(orencia),醋酸阿比特龙
通过本专利的双链连接体偶联的药物/细胞毒性分子可以是本专利中描述的药物/分子的任何类似物和/或衍生物。药物/细胞毒剂领域的技术人员将容易理解本文所述的每种药物/细胞毒性分子可以被修饰,所得化合物仍保留起始化合物的特异性和/或活性。可以使用这些化合物来代替本文所述的药物/细胞毒性分子。因此,本发明的药物/细胞毒性分子包括本文所述化合物的类似物和衍生物。
所有参考文献以及下面的实施例中的全部参考文献都完整明确地并入了本文。
实例
本发明用下面的实施例进一步地说明,这些实施例的内容并不旨在限制本发明的范围。在实施例中细胞系,除了特殊说明之外,均是依据美国标准培养物保藏中心(atcc)、德国菌种保藏中心(dsmz)或中国科学院上海细胞培养中心规范的条件保存。除了特殊说明外,细胞培养试剂来自于invitrogen公司。所有的无水试剂均由商业途径获得,并储存于sure-seal密封瓶中。其他的试剂和溶剂均按照最高规格购买,使用时未经进一步的处理。用varainprestarhplc进行制备hplc分离。nmr谱在varianmercury400mhz上获得,化学位移以ppm为单位,四甲基硅烷为参考(0ppm),耦合常数(j)的单位是hz。质谱数据在watersxevoqtof质谱仪(连接watersacquityuplc高效液相色谱仪和tuv检测器)上获得。
例1.1,2-双(2-(叔丁氧基)-2-氧代乙基)肼-1,2-二甲酸二叔丁酯的合成
向1,2-二甲酸肼二叔丁酯(8.01g,34.4mmol)的dmf(150ml)溶液中加入nah(60%,矿物油中,2.76g,68.8mmol)。在室温下搅拌30分钟后,加入2-溴乙酸叔丁酯(14.01g,72.1mmol)。将混合物搅拌过夜,加入甲醇(3ml)淬灭、浓缩后用乙酸乙酯(100ml)和水(100ml)稀释、分层,水层用乙酸乙酯(2×50ml)萃取。将有机层合并,用硫酸镁进行干燥、过滤、浓缩,并通过硅胶柱层析法(乙酸乙酯/正己烷1:5至1:3)纯化,得到无色油状的目标化合物(12.98g,82%产率)。msesim/z:c22h41n2o8[m+h]+:计算值461.28,实测值461.40。
例2.2,2'-(肼-1,2-二基)二乙酸的合成
向1,2-双(2-(叔丁氧基)-2-氧代乙基)肼-1,2-二甲酸二叔丁酯(6.51g,14.14mmol)的1,4-二恶烷(40ml)溶液中加入盐酸(12n,10ml)。将混合物搅拌30分钟,用二恶烷(20ml)和甲苯(40ml)稀释、浓缩,并依次与二恶烷(20ml)和甲苯(40ml)共同浓缩至干,得目标产品(2.15g,产率为103%,纯度约93%),不做进一步纯化,直接用在下一步。msesim/z:c4h9n2o4[m+h]+:计算值149.05,实测值149.40。
例3.2,2'-(1,2-双((苄氧基)羰基)肼-1,2-二基)二乙酸的合成
在2小时内,向2,2'-(肼-1,2-二基)二乙酸(1.10g,7.43mmol)的thf(200ml)和nah2po4(0.1m,250ml,ph8.0)的混合溶液中,分4次加入氯化苄基酯(5.01g,29.47mmol)。将混合物再搅拌6小时后,浓缩并在硅胶柱上纯化,用含有1%甲酸的h2o/ch3cn(1:9)洗脱,得到标题化合物(2.26g,73%产率,纯度约95%)。msesim/z:c20h21n2o8[m+h]+计算值417.12,实测值417.40.
例4.1,2-双(2-氯-2-氧代乙基)肼-1,2-二羧基二苄酯的合成
向2,2'-(1,2-双((苄氧基)羰基)肼-1,2-二基)二乙酸(350mg,0.841mmol)的二氯乙烷(30ml)溶液中加入草酰氯(905mg,7.13mmol),然后加入0.030mldmf。在室温下搅拌2小时后,将混合物用甲苯稀释,浓缩并与二氯乙烷(2×20ml)和甲苯(2×15ml)共浓缩至干,得到标题粗产物(其不稳定),无需进一步纯化即用于下一步(365mg,96%产率)。msesim/z:c20h19cl2n2o6[m+h]+计算值453.05,实测值453.50。
例51,2-双(2-(叔丁氧基)-2-氧代乙基)肼-1,2-二羧基二叔丁酯的合成
在氮气保护,室温条件下,10分钟内向nah(0.259g,6.48mmol,3.0eq.)的无水dmf(2ml)悬浮液中加入1,2-二甲酸肼二叔丁酯(0.50g,2.16mmol,1.0eq.)的无水dmf(8ml)溶液。将混合物在室温下搅拌10分钟,然后冷却至0℃。向其中滴加2-溴乙酸叔丁酯(1.4ml,8.61mmol,4.0eq.)。将所得混合物升温至室温并搅拌过夜。加入饱和氯化铵溶液(100ml),分离有机层,水层用乙酸乙酯(3×50ml)萃取。将合并的有机溶液用水和盐水洗涤,经无水na2so4干燥,浓缩并通过硅胶柱色谱(10:1正己烷/乙酸乙酯)纯化,得到标题化合物,为无色油状物(0.94g,99.6%产率)。esimsm/z:[m+na]+483.4。
例6.2,2'-(肼-1,2-二基)二乙酸的合成
在0℃下,向1,2-双(2-(叔丁氧基)-2-氧代乙基)肼-1,2-二甲酸二叔丁酯(0.94g,2.04mmol)的二氯甲烷(4ml)溶液中加入tfa(4ml)。将反应搅拌30分钟,然后升温至室温并搅拌过夜。浓缩混合物,用二氯甲烷稀释,浓缩。重复该操作三次,得到白色固体。用二氯甲烷打浆,过滤收集白色固体(0.232g,产率76.8%)。esimsm/z:[m+h]+149.2。
例7.2,2'-(1,2-双(2-氯乙酰基)肼-1,2-二基)二乙酸的合成
在0℃下,10分钟内向2,2'-(肼-1,2-二基)二乙酸(0.232g,1.57mmol,1.0eq.)的无水四氢呋喃(10ml)溶液中加入2-氯乙酰氯(0.38ml,4.70mmol,3.0eq.)。将反应升温至室温并搅拌过夜,然后浓缩。将残余物与四氢呋喃共浓缩三次,得到白色固体(0.472g,理论产率)。esimsm/z:[m+h]+301.1。
例8.2,8-二氧代-1,5-恶唑烷-5-酸叔丁酯的合成
在4℃下,向3,3'-亚氨基二丙酸(10.00g,62.08mmol)的1.0nnaoh(300ml)溶液中,加入二碳酸二叔丁酯(22.10g,101.3mmol)的四氢呋喃(200ml)溶液。添加1小时后,将混合物在4℃下搅拌2小时。用0.2mh3po4将混合物小心酸化至ph4,减压浓缩,用二氯甲烷萃取,硫酸钠干燥,过滤,浓缩后用硅胶柱纯化,用acoh/meoh/ch2cl2(0.01:1:5)洗脱,得到3,3'-((叔丁氧基羰基)亚氨基)二丙酸(13.62g,产率84%)。esimsm/z:c11h19no6[m+h]+:计算值262.27,实测值262.40。
在0℃,向3,3'-((叔丁氧基羰基)亚氨基)二丙酸(8.0g,30.6mmol)的二氯甲烷(500ml)溶液中加入五氧化二磷(8.70g,61.30mmol)。将混合物在0℃下搅拌2小时,然后在室温下搅拌1小时,通过短硅胶柱过滤,并用乙酸乙酯/二氯甲烷(1:6)洗脱。浓缩滤液,用乙酸乙酯/正己烷打浆,得到目标化合物(5.64g,74%产率)。esimsm/z:c11h17no5[m+h]+:计算值244.11,实测值244.30。
例9.3-((苄氧基)氨基)丙酸叔丁酯的合成
向苄基羟胺盐酸盐(10.0g,62.7mmol)的四氢呋喃(100ml)溶液中加入et3n(15ml)和丙烯酸叔丁酯(12.1g,94.5mmol)。将混合物回流过夜,浓缩后在硅胶柱上纯化,用乙酸乙酯/正己烷(1:4)洗脱,得到标题化合物(13.08g,83%产率)。
1hnmr(cdcl3)7.49-7.25(m,5h),4.75(s,2h),3.20(t,j=6.4hz,2h),2.54(t,j=6.4hz,2h),1.49(s,9h);esimsm/z:c14h21nnao3(m+na),计算值274.15,实测值274.20。
例10.3-(羟基氨基)丙酸叔丁酯的合成
在氢化反应容器中加入3-((苄氧基)氨基)丙酸叔丁酯(13.0g,51.76mmol)的甲醇(100ml)溶液和pd/c(0.85g,10%pd,含水50%)。抽空后,充入2atm的氢气,将反应混合物在室温下搅拌过夜。粗反应物通过硅藻土过滤,用乙醇洗,浓缩滤液并在硅胶柱上纯化,用甲醇/二氯甲烷(1:10-1:5)洗脱,得到标题化合物(7.25g,87%产率)。1hnmr(cdcl3)3.22(t,j=6.4hz,2h),2.55(t,j=6.4hz,2h),1.49(s,9h);esimsm/z:c7h15nnao3(m+na),计算值184.10,实测值184.30。
例11.3-((甲苯磺酰氧基)氨基)丙酸叔丁酯的合成
在二氯甲烷(50ml)和吡啶(20ml)的混合物中加入3-(羟基氨基)丙酸叔丁酯(5.10g,31.65mmol),在4℃下加入甲苯磺酰氯(12.05g,63.42mmol)。将混合物在室温下搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:10-1:6)洗脱,得到标题化合物(8.58g,86%产率)。1hnmr(cdcl3)7.81(s,2h),7.46(s,2h),3.22(t,j=6.4hz,2h),2.55(t,j=6.4hz,2h),2.41(s,3h),1.49(s,9h);esimsm/z:c14h21nnao5s(m+na),计算值338.11,实测值338.30。
例12.3,3'-(肼-1,2-二基)二丙酸二叔丁酯的合成
向3-氨基丙酸叔丁酯(3.05g,21.01mmol)的四氢呋喃(80ml)溶液中加入3-((甲苯磺酰氧基)氨基)丙酸叔丁酯(5.10g,16.18mmol)。将混合物在室温下搅拌1小时,然后在45℃下搅拌6小时,浓缩并在硅胶柱上纯化,用甲醇/二氯甲烷/et3n(1:12:0.01-1:8:0.01)洗脱,得到标题化合物(2.89g,62%产率)。esimsm/z:c14h28n2nao4(m+na),计算值311.20,实测值311.40。
例13.3,3'-(1,2-双(3-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丙酰基)肼-1,2-二基)二丙酸二叔丁基的合成
向3-马来酰亚胺-丙酸(1.00g,5.91mmol)的二氯甲烷(50ml)溶液中加入草酰氯(2.70g,21.25mmol)和dmf(50μl)。将混合物在室温下搅拌2小时,浓缩,并与二氯甲烷/甲苯共浓缩,得到3-马来酰亚胺-丙酰氯粗品。向3,3'-(肼-1,2-二基)二丙酸二叔丁酯(0.51g,1.76mmol)在二氯甲烷(35ml)的混合物中加入3-马来酰亚胺-丙酰氯粗品。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:15-1:8)洗脱,得到标题化合物(738mg,71%产率)。esimsm/z:c28h38n4nao10(m+na),计算值613.26,实测值613.40。
例14.3,3'-(1,2-双(3-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丙酰基)-肼-1,2-二基)二丙酸的合成
向3,3'-(1,2-双(3-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丙酰基)肼-1,2-二基)二丙酸二叔丁基(700mg,1.18mmol)的二恶烷(4ml)溶液中加入浓hcl1ml。将混合物搅拌30分钟,用无水乙醇(10ml)和甲苯(10ml)稀释,浓缩,并与乙醇(10ml)和甲苯(10ml)共浓缩,得到标题产物(粗品560mg),无需进一步纯化即用于下一步。esimsm/z:c20h21n4o10(m-h),计算值477.13,实测值477.20。
例15.双(2,5-二氧代吡咯烷-1-基)-3,3'-(1,2-双(3-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丙酰基)肼-1,2-二基)二丙酸酯的合成
向3,3'-(1,2-双(3-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丙酰基)-肼-1,2-二基)二丙酸粗品(约560mg,1.17mmol)的dma(8ml)溶液中加入nhs(400mg,3.47mmol)和edc(1.01g,5.26mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:12-1:7)洗脱,得到标题化合物(520mg,两步产率65%)。esimsm/z:c28h28n6nao14(m+na),计算值695.17,实测值695.40。
例16.3-(2-(2-(2-羟基乙氧基)乙氧基)乙氧基)丙酸叔丁酯的合成
在搅拌下向350ml无水四氢呋喃中加入80mg(0.0025mol)金属钠和三乙二醇(150.1g,1.00mol)。在钠完全溶解后,加入丙烯酸叔丁酯(24ml,0.33mol)。将溶液在室温下搅拌20小时,然后用8ml1.0mhcl中和。真空除去溶剂,将残余物悬浮在盐水(250ml)中,用乙酸乙酯(3×125ml)萃取。将合并的有机层用盐水(100ml)洗,水(100ml)洗,用硫酸钠干燥,除去溶剂。将得到的无色油状物真空干燥,得到69.78g(76%产率)标题产物。1hnmr1.41(s,9h),2.49(t,2h,j=6.4hz),3.59-3.72(m,14h).esimsm/z:-c13h25o6(m-h),计算值277.17,实测值277.20。
例17.3-(2-(2-(2-(甲苯磺酰氧基)乙氧基)乙氧基)乙氧基)丙酸叔丁酯的合成
向3-(2-(2-(2-羟基乙氧基)乙氧基)乙氧基)丙酸叔丁酯(10.0g,35.95mmol)的乙腈(50.0ml)溶液中加入吡啶(20.0ml)。通过加料漏斗在30分钟内滴加甲苯磺酰氯(7.12g,37.3mmol)的乙腈(50ml)溶液。5小时后,tlc分析显示反应完成。滤出形成的吡啶盐酸盐,浓缩滤液。将残余物在硅胶上纯化,用20%乙酸乙酯/正己烷溶液至纯乙酸乙酯洗脱,得到11.2g(76%产率)标题化合物。1hnmr1.40(s,9h),2.40(s,3h),2.45(t,2h,j=6.4hz),3.52-3.68(m,14h),4.11(t,2h,j=4.8hz),7.30(d,2h,j=8.0hz),7.75(d,2h,j=8.0hz);esimsm/z:c20h33o8s(m+h),计算值433.18,实测值433.30。
例18.3-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)丙酸叔丁酯的合成
向50mldmf中加入3-(2-(2-(2-(甲苯磺酰氧基)乙氧基)乙氧基)乙氧基)-丙酸叔丁酯(4.0g,9.25mmol)和叠氮化钠(0.737g,11.3mmol),搅拌。将反应加热至80℃。4小时后,tlc分析显示反应完成。将反应冷却至室温并用水(25ml)淬灭。分离水层并用乙酸乙酯(3×35ml)萃取。合并的有机层用无水硫酸镁干燥,过滤,真空除去溶剂,得到叠氮化物产物(2.24g,98%产率,hplc纯度约93%)粗品,无需进一步纯化即可用于下一步骤。1hnmr(cdcl3)1.40(s,9h),2.45(t,2h,j=6.4hz),3.33(t,2h,j=5.2hz),3.53-3.66(m,12h);esimsm/z:c13h26n3o8(m+h),计算值304.18,实测值304.20。
例19.3-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)丙酸的合成
向3-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)丙酸叔丁酯(2.20g,7.25mmol)的1,4-二恶烷(40ml)溶液中加入浓hcl(12m,10ml)。将混合物搅拌40分钟,用二恶烷(20ml)和甲苯(40ml)稀释,浓缩,并与二恶烷(20ml)和甲苯(40ml)共浓缩至干,得到标题产物粗品,用于下一步,无需进一步纯化(1.88g,105%产率,hplc纯度约92%)。msesim/z:c9h18n3o5[m+h]+计算值248.12,实测值248.40.
例20.13-氨基-4,7,10-三氧杂十二烷酸叔丁酯和13-氨基-双(4,7,10-三氧杂十二烷酸叔丁酯)的合成
在氢化反应容器内,将叠氮化物3-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)丙酸(5.0g,约14.84mmol)粗品溶解在乙醇(80ml)中,向其中加入300mg10%pd/c。将该系统抽真空,并在剧烈搅拌下充入2atm的氢气。然后将反应在室温下搅拌过夜,tlc显示原料消失。将反应粗品用短硅藻土垫过滤,用乙醇洗。浓缩滤液,在硅胶柱上使用含1%三乙胺的甲醇/二氯甲烷混合物(5%至15%)作为洗脱剂纯化,得到13-氨基-4,7,10-三氧杂十二烷酸叔丁酯(1.83g,44%产率,esimsm/z:c13h27no5(m+h),计算值278.19,实测值278.30)和13-氨基-双(4,7,10-三氧杂十二烷酸叔丁酯)(2.58g,32%产率,esimsm/z:c26h52no10(m+h),计算值538.35,实测值538.40)。
例21.3-(2-(2-(2-氨基乙氧基)乙氧基)乙氧基)丙酸盐酸盐的合成
在搅拌下向13-氨基-4,7,10-三氧杂十二烷酸叔丁酯(0.80g,2.89mmol)的30ml二恶烷溶液中加入10mlhcl(36%)。0.5小时后,tlc分析显示反应完成,浓缩反应混合物,并与乙醇和乙醇/甲苯共浓缩,得到标题产物盐酸盐(>90%纯度,0.640g,86%产率),无需进一步纯化。esimsm/z:c9h20no5(m+h),计算值222.12,实测值222.20。
例22.13-氨基-双(4,7,10-三氧杂十二烷酸)盐酸盐。
在搅拌下向13-氨基-双(4,7,10-三氧杂十二烷酸叔丁酯)(1.00g,1.85mmol)的30ml二恶烷溶液中加入10mlhcl(36%)。0.5小时后,tlc分析显示反应完成,浓缩反应混合物,并与乙醇和乙醇/甲苯共浓缩,得到标题产物盐酸盐(>90%纯度,0.71g,91%产率),无需进一步纯化。esimsm/z:c18h36no10(m+h),计算值426.22,实测值426.20。
例23.3-(2-(2-(2-羟基乙氧基)乙氧基)乙氧基)丙酸叔丁酯的合成
向2,2’-(乙烷-1,2-二基双(氧基))二乙醇(55.0ml,410.75mmol,3.0eq.)的无水四氢呋喃(200ml)溶液中加入钠块(0.1g)。搅拌混合物直至钠块消失,然后滴加丙烯酸叔丁酯(20.0ml,137.79mmol,1.0eq.)。将混合物搅拌过夜,然后在0℃下用盐酸溶液(20.0ml,1n)淬灭。通过旋转浓缩除去四氢呋喃,加入盐水(300ml)并将所得混合物用乙酸乙酯(3×100ml)萃取。将有机层用盐水(3×300ml)洗涤,经无水硫酸钠干燥,过滤并浓缩,得到无色油状物(30.20g,79.0%产率),其不经进一步纯化而直接使用。msesim/z:c13h27o6[m+h]+计算值278.1729,实测值278.1730。
例24.3-(2-(2-(2-(甲苯磺酰氧基)乙氧基)乙氧基)乙氧基)丙酸叔丁酯的合成
在0℃下,向3-(2-(2-(2-羟基乙氧基)乙氧基)乙氧基)丙酸叔丁酯(30.20g,108.5mmol,1.0eq.)和tscl(41.37g,217.0mmol,2.0eq.)的无水二氯甲烷(220ml)溶液中加入三乙胺(30.0ml,217.0mmol,2.0eq.)。将混合物在室温下搅拌过夜,然后用水(3×300ml)和盐水(300ml)洗涤,经无水硫酸钠干燥,过滤,浓缩并通过硅胶柱层析(3:1正己烷/乙酸乙酯)纯化得到无色油状物(39.4g,产率84.0%)。msesim/z:c20h33o8s[m+h]+计算值433.1818,实测值433.2838。
例25.3-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)丙酸叔丁酯的合成
将3-(2-(2-(2-(甲苯磺酰氧基)乙氧基)乙氧基)乙氧基)丙酸叔丁酯(39.4g,91.1mmol,1.0eq.)溶解于无水dmf(100ml),接着加入nan3(20.67g,316.6mmol,3.5eq.)。将混合物在室温下搅拌过夜。加入水(500ml)并用乙酸乙酯(3×300ml)萃取。将合并的有机层用水(3×900ml)和盐水(900ml)洗涤,用无水硫酸钠干燥,过滤,浓缩并通过硅胶柱层析(5:1正己烷/乙酸乙酯)纯化,得到浅黄色油状物(23.8g,85.53%产率)。msesim/z:c13h25o3n5na[m+na]+计算值326.2,实际值326.2。
例26.3-(2-(2-(2-氨基乙氧基)乙氧基)乙氧基)丙酸叔丁酯的合成
将raney-ni(7.5g,悬浮于水中)用水(三次)和异丙醇(三次)洗涤,并与异丙醇中的3-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)丙酸叔丁酯(5.0g,16.5mmol)混合。在室温下在氢气球下搅拌该混合物16小时,然后用硅藻土垫过滤,用异丙醇洗涤垫。浓缩滤液并通过柱层析(5-25%甲醇/二氯甲烷)纯化,得到浅黄色油状物(2.60g,57%产率)。msesim/z:c18h23no2na[m+na]+计算值309.1729,实测值309.1967。
例27.2-(2-(二苄基氨基)乙氧基)乙醇的合成
将2-(2-氨基乙氧基)乙醇(21.0g,200mmol)和碳酸钾(83.0g,600mmol)混合于乙腈(350ml)中,加入苄基溴(57.0ml,480mmol)。将混合物回流过夜后,加入水(1l),用乙酸乙酯(3×300ml)萃取。将合并的有机层用饱和食盐水(1000ml)洗涤,用无水硫酸钠干燥,过滤,浓缩并通过硅胶柱色谱(4:1石油醚/乙酸乙酯)纯化,得到无色油状物(50.97g,产率89.2%)。msesim/z:c18h23no2na[m+na]+:计算值309.17,实测值309.19。
例28.3-(2-(2-(二苄基氨基)乙氧基)乙氧基)丙酸叔丁酯的合成
向2-(2-(二苄基氨基)乙氧基)乙醇(47.17g,165.3mmol),丙烯酸叔丁酯(72.0ml,495.9mmol)和四丁基碘化铵(6.10g,16.53mmol)的二氯甲烷(560ml)溶液中加入50%氢氧化钠水溶液(300ml)。将混合物搅拌过夜。分离有机层,水层用乙酸乙酯(3×100ml)萃取。合并有机层并用水(3×300ml)和饱和食盐水(300ml)洗涤,用无水硫酸钠干燥,过滤,浓缩并通过硅胶柱色谱(7:1石油醚/乙酸乙酯)纯化,得到无色油状物(61.1g,89.4%产率)。msesim/z:c25h36no4[m+h]+:计算值414.2566,实测值414.2384。
例29.3-(2-(2-氨基乙氧基)乙氧基)丙酸叔丁酯的合成
在氢化反应瓶中向3-(2-(2-(2-(二苄基氨基)乙氧基)乙氧基)丙酸叔丁酯(20.00g,48.36mmol,1.0eq.)的四氢呋喃(30ml)和甲醇(60ml)溶液中加入pd/c(2.00g,10wt%)。将混合物在氢气环境中(1atm)振荡过夜,通过硅藻土(助滤剂)过滤,浓缩滤液,得到无色油状物(10.58g,93.8%产率)。msesim/z:c11h24no4[m+h]+:计算值234.1627,实测值234.1810。
例30.3-(2-(2-羟基乙氧基)乙氧基)丙酸叔丁酯的合成
向2,2’-氧代二乙醇(19.7ml,206.7mmol,3.0eq.)的无水四氢呋喃(100ml)溶液中加入钠(0.1g)。搅拌混合物直至钠块消失,然后滴加丙烯酸叔丁酯(10.0ml,68.9mmol,1.0eq.)。将混合物搅拌过夜,加入盐水(200ml)并用乙酸乙酯(3×100ml)萃取。将有机层用盐水(3×300ml)洗涤,经无水硫酸钠干燥,过滤,浓缩并通过硅胶柱层析(1:1正己烷/乙酸乙酯)纯化,得到无色油状物(8.10g,49.4%产率)。msesim/z:c11h23o5[m+h]+的计算值235.1467,实测值235.1667。
例31.3-(2-(2-(甲苯磺酰氧基)乙氧基)乙氧基)丙酸叔丁酯的合成
在0℃下,向3-(2-(2-羟基乙氧基)乙氧基)丙酸叔丁酯(6.24g,26.63mmol,1.0eq.)和tscl(10.15g,53.27mmol,2.0eq.)的无水二氯甲烷(50ml)溶液中加入吡啶(4.3ml,53.27mmol,2.0eq.)。将混合物在室温下搅拌过夜,然后用水(100ml)洗涤,水层用二氯甲烷(3×50ml)萃取。将合并的有机层用盐水(300ml)洗涤,经无水硫酸钠干燥,过滤,浓缩并通过硅胶柱层析(5:1正己烷/乙酸乙酯)纯化,得到无色油状物(6.33g,61.3%产率)。msesim/z:c18h27o7s[m+h]+计算值389.1556,实测值389.2809。
例32.3-(2-(2-叠氮基乙氧基)乙氧基)丙酸叔丁酯的合成
向3-(2-(2-(甲苯磺酰氧基)乙氧基)乙氧基)丙酸叔丁酯(5.80g,14.93mmol,1.0eq.)的无水dmf(20ml)溶液中加入nan3(5.02g,77.22mmol),5.0eq.)。将混合物在室温下搅拌过夜,加入水(120ml)并用乙酸乙酯(3×50ml)萃取。将合并的有机层用水(3×150ml)和盐水(150ml)洗涤,用无水硫酸钠干燥,过滤,浓缩并通过硅胶柱层析(5:1正己烷/乙酸乙酯)纯化,得到无色油状物(3.73g,产率69.6%)。msesim/z:c11h22o3n4na[m+h]+计算值260.1532,实测值260.2259。
例33.3-(2-(2-氨基乙氧基)乙氧基)丙酸叔丁酯的合成
将3-(2-(2-叠氮基乙氧基)乙氧基)丙酸叔丁酯(0.18g,0.69mmol)溶于甲醇(3.0ml,含60μl浓盐酸)中并与pd/c(10wt%,20mg)氢化反应30分钟。将催化剂通过硅藻土垫过滤,用甲醇洗涤硅藻土垫。浓缩滤液,得到无色油状物(0.15g,93%产率)。esim/z:c11h24no4[m+h]+的计算值234.16,实测值234.14。
例34.3-(2-(2-叠氮基乙氧基)乙氧基)丙酸的合成
将3-(2-(2-叠氮基乙氧基)乙氧基)丙酸叔丁酯(2.51g,9.68mmol)溶解于1,4-二恶烷(30ml)中并与10ml浓盐酸在室温下搅拌35分钟,用乙醇(30ml)和甲苯(30ml)稀释,并在真空下浓缩。将粗品在硅胶上使用甲醇/二氯甲烷(5%至10%)(含1%甲酸)纯化,得到标题化合物(1.63g,83%产率),esimsm/z:c7h12n3o4[m-h]-计算值202.06,实测值202.30。
例35.2,5-二氧代吡咯烷-1-基3-(2-(2-叠氮基乙氧基)乙氧基)丙酸酯的合成
向3-(2-(2-叠氮基乙氧基)乙氧基)丙酸(1.60g,7.87mmol)的30ml的二氯甲烷溶液中边搅拌边加入nhs(1.08g,9.39mmol)和edc(3.60g,18.75mmol)。8小时后,tlc分析显示反应完成,将反应混合物浓缩并在硅胶上使用乙酸乙酯(5%至10%)在二氯甲烷中的混合物作为洗脱液纯化,得到标题化合物(1.93g,产率82%)。esimsm/z:c11h17n4o6[m+h]+,计算值301.11,实际值301.20。
例36.2,5-二氧代吡咯烷-1-基3-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)丙酸酯的合成
向3-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)丙酸(4.50g,18.21mmol)的80ml二氯甲烷溶液中加入nhs(3.0g,26.08mmol)和edc(7.60g,39.58mmol),搅拌。8小时后,tlc分析显示反应完成,将反应混合物浓缩并在硅胶上使用乙酸乙酯(5%至10%)的二氯甲烷混合物作为洗脱液纯化,得到标题化合物(5.38g,86%产率)。esimsm/z:c13h20n4o7[m+h]+,计算值345.13,实测值345.30。
例37.(14s,17s)-1-叠氮基-17-(2-(叔丁氧基)-2-氧代乙基)-14-(4-((叔丁氧基羰基)-氨基)丁基)-12,15二氧代-3-,6,9-三氧杂-13,16-二氮杂十八烷-18-酸的合成
向(s)-2-((s)-2-氨基-6-((叔丁氧基羰基)氨基)己酰胺基)-4-(叔丁氧基)-4-氧代丁酸(2.81g,6.73mmol)在dma(70ml)和0.1mnah2po4(50ml,ph7.5)的混合溶液中加入2,5-二氧代吡咯烷-1-基3-(2-(2-(2-叠氮基乙氧基)乙氧基)-乙氧基)丙酸酯(3.50g,10.17mmol)。将混合物搅拌4小时,减压浓缩,在硅胶柱上使用含有0.5%乙酸的甲醇/二氯甲烷(5%至15%)溶液洗脱纯化,得到标题化合物(3.35g,77%产率)。esimsm/z:c28h51n6o11[m+h]+,计算值647.35,实测值647.80。
例38.(14s,17s)叔丁基-1-叠氮基-14-(4-((叔丁氧基羰基)氨基)丁基)-17-((4-(羟甲基)苯基)氨基甲酰基)-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十九烷-19-酸酯的合成
向(14s,17s)-1-叠氮基-17-(2-(叔丁氧基)-2-氧代乙基)-14-(4-((叔丁氧基羰基)-氨基)丁基)-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷-18-酸(3.30g,5.10mmol)和(4-氨基苯基)甲醇(0.75g,6.09mmol)的dma(25ml)溶液中,加入edc(2.30g,11.97mmol)。将混合物搅拌过夜,减压浓缩,在硅胶柱上纯化,用5%-8%的甲醇/二氯甲烷混合液洗脱,得到标题化合物(3.18g,83%产率)。esimsm/z:c35h58n7o11[m+h]+,计算值752.41,实测值752.85。
例39.(14s,17s)-叔丁基-1-氨基-14-(4-((叔丁氧基羰基)氨基)丁基)-17-((4-(羟甲基)苯基)氨基甲酰基)-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十九烷-19-酸酯的合成
向加氢瓶中加入(14s,17s)叔丁基-1-叠氮基-14-(4-((叔丁氧基羰基)氨基)丁基)-17-((4-(羟甲基)苯基)氨基甲酰基)-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十九烷-19-酸酯(1.50g,1.99mmol)的四氢呋喃(35ml)溶液和pd/c(200mg,10%pd,含水50%)。将混合物在1atm的h2下振荡过夜,通过硅藻土(助滤剂)过滤,浓缩滤液,得到标题化合物(1.43g,99%产率),其不经进一步纯化直接用于下一步骤。esimsm/z:c35h60n5o11[m+h]+,计算值726.42,实测值726.70。
例40.(s)-15-叠氮基-5-异丙基-4,7-二氧代-10,13-二氧杂-3,6-二氮杂十五烷-1-酸的合成
向(s)-2-(2-氨基-3-甲基丁酰胺基)乙酸(val-gly)(1.01g,5.80mmol)的dma(50ml)和0.1mnah2po4(50ml,ph7.5)的混合溶液中加入2,5-二氧代吡咯烷-1-基3-(2-(2-(叠氮基乙氧基)乙氧基)丙酸酯(1.90g,6.33mmol)。将混合物搅拌4小时,减压浓缩,在硅胶柱上使用含有0.5%乙酸的甲醇/二氯甲烷(5%至15%)混合溶剂洗脱纯化,得到标题化合物(1.52g,73%产率)。esimsm/z:c14h26n5o6[m+h]+,计算值360.18,实测值360.40。
例41.(s)-2,5-二氧代吡咯烷-1-基15-叠氮基-5-异丙基-4,7-二氧代-10,13-二氧杂-3,6-二氮杂十五烷-1-酸酯的合成
将(s)-15-叠氮基-5-异丙基-4,7-二氧代-10,13-二氧杂-3,6-二氮杂十五烷-1-酸(1.50g,4.17mmol)溶于40ml二氯甲烷中,然后加入nhs(0.88g,7.65mmol)和edc(2.60g,13.54mmol)。搅拌8小时后,tlc分析显示反应完成,将反应混合物浓缩并在硅胶柱上纯化,使用乙酸乙酯/二氯甲烷(5%至20%)作为洗脱液,得到标题化合物(1.48g,78%产率)。esimsm/z:c18h29n6o8[m+h]+,计算值457.20,实测值457.50。
例42.4-(((苄氧基)羰基)氨基)丁酸的合成
将4-氨基丁酸(7.5g,75mmol)和naoh(6g,150mmol)溶解于水(40ml),在0℃加入氯甲酸苄酯(16.1g,95mmol)的四氢呋喃(32ml)溶液。将反应在0℃搅拌1小时,室温3小时。减压蒸馏除去四氢呋喃,用浓盐酸调节水溶液ph值至3。用乙酸乙酯萃取,饱和食盐水洗,无水硫酸钠干燥,浓缩得到白色固体(16.4g,92%)。esim/z:c12h16no4[m+h]+:计算值238.10,实测值238.22。
例43.4-(((苄氧基)羰基)氨基)丁酸叔丁酯的合成
将dmap(0.8g,6.56mmol)和dcc(17.1g,83mmol)加入到4-((((苄氧基)羰基)氨基)丁酸(16.4g,69.2mmol)和叔丁醇(15.4g,208mmol)的二氯甲烷(100ml)溶液中。室温搅拌过夜,将反应物过滤并浓缩滤液。将残留物溶于乙酸乙酯中,用1nhcl,饱和食盐水洗涤,用硫酸钠干燥,过滤,浓缩后通过柱色谱(10至50%乙酸乙酯/石油醚)纯化,得到目标化合物(7.5g,37%产率)。msesim/z:c16h23no4na[m+na]+:计算值316.16,实测值316.13。
例44.叔丁基4-氨基丁酸酯的合成
将4-(((苄氧基)羰基)氨基)丁酸叔丁酯(560mg,1.91mmol)溶于甲醇(50ml)中,与pd/c催化剂(10wt%,100mg)混合,然后氢化(1atm)反应3小时。滤出催化剂,减压蒸馏除去所有挥发物,得到标题化合物(272mg,90%产率)。msesim/z:c8h18no2[m+h]+:计算值160.13,实测值160.13。
例45.3,3'-(苄基氮杂二基)二丙酸二叔丁酯的合成
将苯基甲胺(2.0ml,18.29mmol,1.0eq.)和丙烯酸叔丁酯(13.3ml,91.46mmol,5.0eq.)的混合物在80℃下回流过夜,然后浓缩。通过硅胶柱(20:1正己烷/乙酸乙酯)纯化粗产物,得到标题化合物,为无色油状物(5.10g,77%产率)。
esimsm/z:c21h34no4[m+h]+计算值364.2,实测值364.2;1hnmr(400mhz,cdcl3)δ7.38–7.21(m,5h),3.58(s,2h),2.76(t,j=7.0hz,4h),2.38(t,j=7.0hz,4h),1.43(s,17h)。
例46.3,3'-氮杂二丙基二丙酸二叔丁酯的合成
在氢化反应瓶中,向3,3'-(苄基氮杂二基)二丙酸二叔丁酯(1.37g,3.77mmol,1.0eq.)的甲醇(10ml)溶液中加入pd/c(0.20g,10%pd/c,含水50%)。将混合物在h2气中振荡过夜,然后通过硅藻土垫过滤。浓缩滤液得到标题化合物为无色油状物(1.22g,89%产率)。esimsm/z:c14h28no4[m+h]+计算值274.19,实测值274.20。
例47.4-(2-(((苄氧基)羰基)氨基)丙烷酰胺基丁酸叔丁酯的合成
在0℃下,向4-氨基丁酸叔丁酯(1.00g,6.28mmol,1.0eq.)和z-l-丙氨酸(2.10g,9.42mmol,1.5eq.)在无水二氯甲烷(50ml)中的溶液中加入hatu(3.10g,8.164mmol,1.3eq.)和三乙胺(2.6ml,18.8mmol,3.0eq.)。将反应物在0℃下搅拌10分钟,然后加热至室温并搅拌过夜。将混合物用二氯甲烷稀释,用水和盐水洗涤,经无水硫酸钠干燥,浓缩,并通过硅胶柱色谱(10:3石油醚/乙酸乙酯)纯化,得到标题化合物,为无色油状物(1.39g,61%产率)。esimsm/z:c19h29n2o5na[m+h]+计算值387.2,实测值387.2。
例48.4-(2-氨基丙酰胺基)丁酸叔丁酯的合成
在氢化反应瓶中,向4-(2-(((苄氧基)羰基)氨基)丙酰胺基)丁酸叔丁酯(1.39g,3.808mmol,1.0eq.)的甲醇(12ml)溶液中加入pd/c(0.20g,10wt%)。将混合物在氢气中振荡2小时,然后通过硅藻土(助滤剂)过滤,浓缩,得到标题化合物,为浅黄色油状物(0.838g,95%产率)。esimsm/z:c11h23n2o3[m+h]+计算值231.16,实测值231.15。
例49.3-(2-(2-(二苄基氨基)乙氧基)乙氧基)丙酸的合成
在室温下,向3-(2-(2-(二苄基氨基)乙氧基)乙氧基)丙酸叔丁酯(2.3g,5.59mmol,1.0eq.)的二氯甲烷(10ml)溶液中加入tfa(5ml)。搅拌90分钟后,将反应混合物用无水甲苯稀释并浓缩,重复该操作三次,得到标题化合物,为浅黄色油状物(2.0g,理论产率),将其直接用于下一步骤。esimsm/z:c21h28no4[m+h]+计算值358.19,实测值358.19。
例50.五氟苯基3-(2-(2-(二苄基氨基)乙氧基)乙氧基)-丙酸酯的合成
在0℃下,向3-(2-(2-(二苄基氨基)乙氧基)乙氧基)丙酸(2.00g,5.59mmol,1.0eq.)在无水二氯甲烷(30ml)的溶液中加入dipea直至ph为中性,然后加入五氟苯酚(1.54g,8.38mmol,1.5eq.)和dic(1.04ml,6.70mmol,1.2eq.)。10分钟后,将反应升温至室温并搅拌过夜。将混合物过滤,浓缩并通过硅胶柱柱色谱(15:1石油醚/乙酸乙酯)纯化,得到标题化合物,为无色油状物(2.10g,72%产率)。esimsm/z:c27h27f5no4[m+h]+计算值524.2,实测值524.2。
例51.2-苄基-13-甲基-1,1,14-二氧代-1-苯基-5,8-二氧杂-2,12,15-三氮杂十九烷-19-酸叔丁酯的合成
0℃时,向4-(2-氨基丙酰胺基)丁酸叔丁酯(0.736g,3.2mmol,1.0eq.)和五氟苯基3-(2-(2-(二苄基氨基)乙氧基)乙氧基)丙酸酯(2.01g,3.84mmol,1.2eq.)的无水dma(20ml)溶液中加入dipea(1.7ml,9.6mmol,3.0eq.)。在0℃下搅拌10分钟,将反应升温至室温并搅拌过夜。加入水(100ml)并将混合物用乙酸乙酯(3×100ml)萃取。将合并的有机层用水(3×200ml)和盐水(200ml)洗涤,用na2so4干燥,过滤,浓缩并通过硅胶柱层析(25:2二氯甲烷/甲醇)纯化,得到标题化合物,为浅黄色油状物(1.46g,80%产率)。esimsm/z:c32h48n3o6[m+h]+计算值570.34,实测值570.33。
例52.2-苄基-13-甲基-11,14-二氧代-1-苯基-5,8-二氧杂-2,12,15-三氮杂十九烷-19-酸的合成
在室温下,向2-苄基-13-甲基-11,14-二氧代-1-苯基-5,8-二氧杂-2,12,15-三氮杂十九烷-19-酸叔丁酯(0.057g,0.101mmol,1.0eq.)的二氯甲烷(3ml)溶液中加入tfa(1ml)并搅拌40分钟。用无水甲苯稀释反应物,然后浓缩。重复该操作三次,得到标题化合物,为无色油状物(0.052g,理论产率),将其直接用于下一步骤。esimsm/z:c28h40n3o6[m+h]+计算值514.28,实测值514.28。
例53.4-(((苄氧基)羰基)氨基)丁酸的合成
将4-氨基丁酸(7.5g,75mmol)和氢氧化钠(6g,150mmol)的水(40ml)溶液冷却至0℃并滴加cbzcl(16.1g,95mmol)的四氢呋喃(32ml)溶液。搅拌1小时后,使反应升温至室温,搅拌3小时。真空除去四氢呋喃,通过加入6n盐酸将水溶液的ph调节至1.5。用乙酸乙酯萃取,有机层用盐水洗涤,干燥并浓缩,得到标题化合物(16.4g,92%产率)。msesim/z:c12h16no5[m+h]+计算值238.10,实测值238.08。
例54.4-(((苄氧基)羰基)氨基)丁酸叔丁酯的合成
向4-(((苄氧基)羰基)氨基)丁酸(16.4g,69.2mmol)和t-buoh(15.4g,208mmol)的二氯甲烷(100ml)溶液中加入dmap(0.8g,6.56mmol)和dcc(17.1g,83mmol)。在室温下搅拌过夜,过滤反应物并浓缩滤液。将残余物溶于乙酸乙酯中,用1n盐酸,盐水洗涤,用无水硫酸钠干燥。浓缩并通过柱层析法纯化(10至50%乙酸乙酯/正己烷),得到标题化合物(7.5g,37%产率)。msesim/z:c16h23no4na[m+na]+计算值316.16,实测值316.13。
例55.叔丁基4-氨基丁酸酯的合成
将4-(((苄氧基)羰基)氨基)丁酸叔丁酯(560mg,1.91mmol)溶解在甲醇(50ml)中,并与pd/c催化剂(10wt%,100mg)混合,然后在室温下氢化(1atm)3小时。滤除催化剂,真空除去所有挥发物,得到标题化合物(272mg,90%产率)。msesim/z:c8h18no2[m+h]+计算值160.13,实测值160.13。
例56.2-(2-(((苄氧基)羰基)氨基)丙酰胺基)乙酸叔丁酯的合成
将2-(((苄氧基)羰基)氨基)丙酸(0.84g,5mmol),2-氨基乙酸叔丁酯(0.66g,5mmol),hobt(0.68g,5mmol),edc(1.44g,7.5mmol)溶于二氯甲烷(20ml),然后加入dipea(1.7ml,10mmol)。将反应混合物在室温下搅拌过夜,用水(100ml)洗涤,并将水层用乙酸乙酯萃取。合并有机层,用硫酸镁干燥,过滤,减压浓缩,残余物在硅胶柱上纯化,得到标题产物(0.87g,52%)。esim/z:c17h25n2o5[m+h]+计算值337.17,实测值337.17。
例57.2-(2-(((苄氧基)羰基)氨基)丙酰胺基)乙酸的合成
将2-(2-(((苄氧基)羰基)氨基)丙酰胺基)乙酸叔丁酯(0.25g,0.74mmol)溶于二氯甲烷(30ml)中,然后加入tfa(10ml)。将混合物在室温搅拌过夜,浓缩,得到标题化合物,其不经进一步纯化直接用于下一步。esim/z:c13h17n2o5[m+h]+计算值281.11,实测值281.60。
例58.2,2-二丙炔酰胺基乙酸的合成
向2,2-二氨基乙酸(2.0g,22.2mmol)的乙醇(15ml)和50mmnah2po4缓冲液(25ml,ph7.5)的混合物中加入2,5-二氧代吡咯烷-1-基丙炔酸酯(9.0g,53.8mmol)。将混合物搅拌8小时,浓缩,用0.1m盐酸酸化至ph3.0,用乙酸乙酯(3×30ml)萃取。合并有机层,用无水硫酸钠干燥,过滤,浓缩并在硅胶柱上纯化,用甲醇/二氯甲烷(1:10to1:6)洗脱,得到标题化合物(3.27g,76%产率)。1h-nmr(cdcl3)11.8(br,1h),8.12(d,2h),6.66(m,1h),2.66(s,2h)。esimsm/z:c8h6n2o4[m+h]+计算值195.03,实测值195.20。
例59.2,2-二丙炔酰胺基乙酸五氟苯基酯的合成
在室温下,将2,2-二丙炔酰胺基乙酸(2.01g,10.31mmol),五氟苯酚(2.08g,11.30mmol),dipea(1.00ml,5.73mmol)和edc(4.01g,20.88mmol)的二氯甲烷(100ml)溶液搅拌过夜,浓缩并在硅胶柱柱上纯化,用乙酸乙酯/二氯甲烷(1:15to1:8)洗脱,得到标题化合物(3.08g,83%产率)。1h-nmr(cdcl3)8.10(d,2h),6.61(m,1h),2.67(s,2h)。esimsm/z:c14h6f5n2o4[m+h]+计算值361.02,实测值361.20。
例60.(s)-2-((s)-2-(2,2-二丙炔酰胺基乙酰胺基)丙酰胺基)-丙酸的合成
向(s)-2-((s)-2-氨基丙炔酰胺基)丙酸(422)(1.10g,6.87mmol)的dma(18ml)和50mmnah2po4缓冲液(ph7.5,30ml)混合物中加入2,2-二丙炔酰胺基乙酸五氟苯基酯(3.00g,8.33mmol)。将混合物搅拌14小时,浓缩,用0.1m盐酸酸化至ph3.0,用乙酸乙酯(3×40ml)萃取。合并有机层,用无水硫酸钠干燥,过滤,浓缩并在硅胶柱柱上纯化,用甲醇/二氯甲烷(1:10to1:5)洗脱,得到标题化合物(1.80g,78%产率)。esimsm/z:c14h17n4o6[m+h]+计算值337.11,实测值337.30。
例61.(s)-2,5-二氧代吡咯烷-1-基2-((s)-2-(2,2-二丙酰胺基-乙酰胺基)丙酰胺基)丙酸酯的合成
(将(s)-2-((s)-2-(2,2-二丙炔酰胺基乙酰胺基)丙酰胺基)-丙酸(1.01g,3.00mmol),nhs(0.41g,3.56mmol),dipea(0.40ml,2.29mmol)和edc(1.51g,7.86mmol)的二氯甲烷(50ml)溶液在室温下搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:15to1:7)洗脱,得到标题化合物(1.05g,81%产率)。esimsm/z:c18h20n5o8[m+h]+计算值434.12,实测值434.40。
例62.二叔丁基14,17-二氧代-4,7,10,21,24,27-六氧杂-13,18-二氮杂三十烷-15-炔-1,30-二酸酯的合成
将乙炔二羧酸(0.35g,3.09mmol,1.0eq.)溶于nmp(10ml)中,并冷却至0℃,向其中加入3-(2-(2-(2-氨基乙氧基)乙氧基)-乙氧基)丙酸叔丁酯(2.06g,7.43mmol,2.4eq.),然后加入dmtmm2.39g,8.65mmol,2.8eq.)。在0℃下搅拌反应物6小时,然后用乙酸乙酯稀释并用水和盐水洗涤。将有机溶液浓缩并用乙酸乙酯和石油醚的混合溶剂打浆。滤出固体,浓缩滤液并通过柱层析(80-90%乙酸乙酯/石油醚)纯化,得到浅黄色油状物(2.26g,>100%产率),其不经进一步纯化而使用。msesim/z:[m+h]+633.30。
例63.14,17-二氧代-4,7,10,21,24,27-六氧杂-13,18-二氮杂三十烷-15-炔-1,30-二酸的合成
将二叔丁基14,17-二氧代-4,7,10,21,24,27-六氧杂-13,18-二氮杂三十烷-15-炔-1,30-二酸酯(2.26g)溶解在二氯甲烷中(15ml)并冷却至0℃,然后加入tfa(15ml)。将反应温度升至室温并搅拌45分钟,然后旋蒸除去溶剂和残留的tfa。通过柱层析法(0-15%甲醇/二氯甲烷)纯化粗产物,得到浅黄色油(1.39g,两步产率86%)。msesim/z:[m+h]+521.24。
例64.二叔丁基2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-21-炔-1,42-二酸酯的合成
向14,17-二氧代-4,7,10,21,24,27-六氧杂-13,18-二氮杂三十烷-15-炔-1,30-二酸(1.38g,2.65mmol),2-叔丁基(2-氨基丙酰胺基)丙酸酯(0.75g,3.47mmol)在dma(40ml)的混合物中加入edc(2.05g,10.67mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:5至1:1)洗脱,得到标题化合物(2.01g,82%产率,hplc纯度约95%)。msesim/z:c42h73n6o16[m+h]+计算值917.50,实测值917.90。
例65.2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-21-炔-1,42-二酸的合成
将二叔丁基2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-21-炔-1,42-二酸酯(1.50g,1.63mmol)溶于二氯甲烷(10ml)和tfa(10ml)的混合物中。将混合物搅拌过夜,用甲苯(20ml)稀释,浓缩,得到标题化合物(1.33g,101%产率,hplc纯度约92%),其不经进一步纯化即用于下一步。msesim/z:c34h56n6o16[m+h]+计算值805.37,实测值805.85。
例66.双(2,5-二氧代吡咯烷-1-基)2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-21-炔-1,42-二酸酯的合成
向2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-21-炔-1,42-二酸(1.30g,1.61mmol)的dma(10ml)溶液中加入nhs(0.60g,5.21mmol)和edc(1.95g,10.15mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:4至2:1)洗脱,得到标题化合物(1.33g,83%产率,hplc纯度约95%)。msesim/z:c42h63n8o20[m+h]+计算值999.40,实测值999.95。
例67.2,3-双(2-溴乙酰胺基)琥珀酰二酰氯的合成
在2,3-二氨基琥珀酸(5.00g,33.77mmol)的四氢呋喃/水/dipea(125ml/125ml/8ml)的混合物中加入2-溴乙酰溴(25.0g,125.09mmol)。将混合物搅拌过夜,浓缩并通过硅胶柱色谱(h2o/ch3cn5:95)纯化,得到2,3-双(2-溴乙酰胺基)琥珀酸(9.95g,76%产率),为浅黄色油状物。msesim/z:c8h11br2n2o6[m+h]+计算值388.89,实测值388.68。
向2,3-双(2-溴乙酰胺基)琥珀酸(3.50g,9.02mmol)的二氯甲烷(80ml)溶液中加入草酰氯(5.80g,46.05mmol)和dmf(0.01ml)。将混合物搅拌2.5小时,用甲苯稀释,浓缩,与二氯乙烷(2×20ml)和甲苯(2×15ml)共浓缩至干,得到2,3-双(2-溴乙酰胺基)琥珀二酰氯粗产物(不稳定),不经进一步纯化即用于下一步(3.90g,102%产率)。msesim/z:c8h9br2cl2n2o4[m+h]+计算值424.82,实测值424.90。
例68.2,3-双(((苄氧基)羰基)氨基)琥珀酸的合成
向2,3-二氨基琥珀酸(4.05g,27.35mmol)在四氢呋喃(250ml)和nah2po4(0.1m,250ml,ph8.0)的混合溶液中加入cbzcl(15.0g,88.23mmol),2小时内分4次加完。将混合物再搅拌6小时,浓缩并在硅胶柱上纯化,用含有1%甲酸的h2o/ch3cn(1:9)洗脱,得到标题化合物(8.65g,76%产率,约95%纯度)。msesim/z:c20h21n2o8[m+h]+计算值417.12,实测值417.60。
例69.双(2,5-二氧代吡咯烷-1-基)2,3-双(((苄氧基)羰基)-氨基)琥珀酸酯的合成
向2,3-双(((苄氧基)羰基)氨基)琥珀酸(4.25g,10.21mmol)的dma(70ml)溶液中加入nhs(3.60g,31.30mmol)和edc(7.05g,36.72mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:6)洗脱,得到标题化合物(5.42g,87%产率,纯度95%)。msesim/z:c28h27n4o12[m+h]+计算值611.15,实测值611.60。
例70.2,3-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)琥珀酸的合成
在2,3-二氨基琥珀酸(5.00g,33.77mmol)的四氢呋喃/水/dipea(125ml/125ml/2ml)混合溶液中加入马来酸酐(6.68g,68.21mmol)。将混合物搅拌过夜,浓缩,得到2,3-双((z)-3-羧基丙烯酰胺基)琥珀酸(11.05g,99%产率),为白色固体。msesim/z:c12h13n2o10[m+h]+计算值345.05,实测值345.35。
将乙酸酐(30ml)加入到2,3-双((z)-3-羧基丙烯酰胺基)琥珀酸(11.05g,33.43mmol)的hoac(70ml),dmf(10ml)和甲苯(50ml)的混合溶液中。将混合物搅拌2小时,连接dean-stark分水器,在100℃回流6小时,浓缩,与乙醇(2×40ml)和甲苯(2×40ml)共浓缩,并在硅胶柱上纯化,用h2o/ch3cn(1:10)洗脱,得到标题化合物(7.90g,76%产率,约95%纯度)。msesim/z:c12h9n2o8[m+h]+计算值309.03,实测值309.30。
例71.双(2,5-二氧代吡咯烷-1-基)2,3-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)琥珀酸酯的合成
向2,3-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)琥珀酸(4.00g,12.98mmol)的dmf(70ml)溶液中加入nhs(3.60g,31.30mmol)和edc(7.05g,36.72mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:6)洗脱,得到标题化合物(5.73g,88%产率,hplc纯度约96%)。msesim/z:c20h15n4o12[m+h]+计算值503.06,实测值503.45。
例72.(3s,6s,39s,42s)-二叔丁基-6,39-双(4-((叔丁氧基羰基)氨基)丁基)-22,23-双(2,5-二氧代-2,5-)二氢-1h-吡咯-1-基)-3,42-二((4-(羟甲基)苯基)氨基甲酰基)-5,8,21,24,37,40-六氧代-11,14,17,28,31,34-六氧杂-4,7,20,25,38,41-六氮杂四十四烷-1,44-二酸酯的合成
将edc(1.30g,6.77mmol)加入到(14s,17s)-叔丁基-1-氨基-14-(4-((叔丁氧基羰基)氨基)丁基)-17-((4-(羟甲基)苯基)氨基甲酰基)-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十九烷-19-酸酯(1.43g,1.97mmol)和2,3-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)琥珀酸(0.30g,0.97mmol)的dma(25ml)溶液中,将混合物搅拌过夜,减压浓缩,在硅胶柱上纯化,用甲醇/二氯甲烷(5%-8%)洗脱,得到标题化合物(1.33g,80%产率)。esimsm/z:c82h123n12o28[m+h]+,计算值1722.85,实测值1722.98。
例73.叔丁基1-叠氮基-14,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷-18-酸酯的合成
向3-(2-(2-(2-叠氮基乙氧基)乙氧基)乙氧基)丙酸(1.55g,6.27mmol),2-(2-氨基丙酰胺基)丙酸叔丁酯(1.35g,6.27mmol)的dma(60ml)溶液中,加入edc(3.05g,15.88mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:3)洗脱,得到标题化合物(2.42g,86%产率,hplc纯度约95%)。msesim/z:c19h36n5o7[m+h]+计算值446.25,实测值446.60。
例74.1-叠氮基-14,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷-18-酸的合成
向叔丁基1-叠氮基-14,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷-18-酸酯(2.20g,4.94mmol)的1,4-二恶烷(40ml)溶液中加入浓hcl(12m,10ml)。将混合物搅拌40分钟,用二恶烷(20ml)和甲苯(40ml)稀释,浓缩,并与二恶烷(20ml)和甲苯(40ml)共浓缩至干,得到标题粗产物,用于下一步,无需进一步纯化(1.92g,100%产率,hplc纯度约94%)。msesim/z:c15h28n5o7[m+h]+计算值390.19,实测值390.45。
例75.21,22-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-1,42-二酸的合成
在氢化反应器中向1-叠氮基-14,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷-18-酸(1.90g,4.88mmol)的dma(40ml)溶液中加入pd/c(0.20克,含水50%)。将系统在真空下抽空,并在剧烈搅拌下通入2atm的氢气,在室温下搅拌6小时,tlc显示原料消失。将反应粗品通过短硅藻土垫过滤,用乙醇洗。滤液减压浓缩,得到粗产物1-氨基-1,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷-18-酸的dma溶液,直接用于下一步。esimsm/z:c15h30n3o7(m+h),计算值364.20,实测值364.30。
向上述氨基化合物的dma(-30ml)溶液中加入0.1mnah2po4(ph7.5,20ml),然后加入双(2,5-二氧代吡咯烷-1-基)2,3-双(2,5-)二氧代-2,5-二氢-1h-吡咯-1-基)琥珀酸酯(1.30g,2.59mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用含8%水的ch3cn溶液洗脱,得到标题化合物(1.97g,81%产率)。esimsm/z:c42h63n8o20(m+h),计算值999.41,实测值999.95。
例76.双(2,5-二氧代吡咯烷-1-基)21,22-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-1,42-二酸酯的合成
向21,22-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-1,42-二酸(1.50g,1.50mmol)的dma(10ml)的溶液中加入nhs(0.60g,5.21mmol)和edc(1.95g,10.15mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:4至2:1)洗脱,得到标题化合物(1.50g,83%产率,hplc纯度约95%)。msesim/z:c50h69n10o24[m+h]+计算值1193.44,实测值1193.95。
例77.(s)-2-(羟基甲基)吡咯烷-1-羧酸叔丁酯的合成
将溶解在50ml四氢呋喃中的boc-l-脯氨酸(10.0g,46.4mmol)冷却至0℃,小心地加入bh3的四氢呋喃溶液(1.0m,46.4ml)。将混合物在0℃下搅拌1.5小时,然后倒入冰水中并用乙酸乙酯萃取。将有机层用盐水(50ml)洗涤,经无水硫酸钠干燥,并在减压下浓缩,得到标题化合物(8.50g,91%产率),为白色固体。1h-nmr(500mhz,cdcl3)δ3.94(dd,j=4.9,2.7hz,2h),3.60(ddd,j=18.7,11.9,9.3hz,2h),3.49–3.37(m,1h),3.34–3.23(m,1h),2.06–1.91(m,1h),1.89–1.69(m,2h),1.65–1.51(m,1h),1.49–.40(m,9h)。
例78.(s)-2-甲酰基吡咯烷-1-羧酸叔丁酯的合成
向(s)-2-(羟甲基)吡咯烷-1-羧酸叔丁酯(13.0g,64.6mmol)的二甲基亚砜(90ml)的溶液中加入三乙胺(40ml),搅拌15分钟。将混合物在冰浴上冷却,并在40分钟内分批加入三氧化硫-吡啶络合物(35.98g,226mmol)。将反应升温至室温并搅拌2.5小时。加入冰(250g)后,将混合物用二氯甲烷(150ml×3)萃取。将有机相用50%柠檬酸溶液(150ml),水(150ml),饱和碳酸氢钠溶液(150ml)和盐水(150ml)洗涤,经无水硫酸钠干燥。在真空中除去溶剂,得到标题醛(10.4g,81%产率),为稠油状物,且不经进一步纯化而使用。1h-nmr(500mhz,cdcl3)δ9.45(s,1h),4.04(s,1h),3.53(dd,j=14.4,8.0hz,2h),2.00–1.82(m,4h),1.44(d,j=22.6hz,9h)。
例79.(4r,5s)-4-甲基-5-苯基-3-丙酰基恶唑烷-2-酮的合成
在-78℃,n2条件下,向正丁基锂的正己烷(21.6ml,2.2m,47.43mmol)溶液中滴加4-甲基-5-苯基恶唑烷-2-酮(8.0g,45.17mmol)的四氢呋喃(100ml)溶液。将溶液在-78℃保持1小时,然后缓慢加入丙酰氯(4.4ml,50.59mmol)。将反应混合物升温至-50℃,搅拌2小时,然后加入饱和氯化铵溶液(100ml)淬灭。真空除去有机溶剂,用乙酸乙酯(3×100ml)萃取所得溶液。用饱和碳酸氢钠溶液(100ml)和盐水(100ml)洗涤有机层,用无水硫酸钠干燥,过滤并减压浓缩。通过柱层析(20%乙酸乙酯/正己烷)纯化残余物,得到标题化合物,为稠油状物(10.5g,98%产率)。1h-nmr(500mhz,cdcl3)δ7.45–7.34(m,3h),7.30(d,j=7.0hz,2h),5.67(d,j=7.3hz,1h),4.82–4.70(m,1h),2.97(dd,j=19.0,7.4hz,2h),1.19(t,j=7.4hz,3h),0.90(d,j=6.6hz,3h)。
例80.(s)-叔丁基2-((1r,2r)-1-羟基-2-甲基-3-((4r,5s)-4-甲基-2-氧代-5-苯基恶唑烷-3-基))-3-氧代丙基)吡咯烷-1-羧酸叔丁酯的合成
在0℃下,向(4r,5s)-4-甲基-5-苯基-3-丙酰基恶唑烷-2-酮(9.40g,40.4mmol)的二氯甲烷(60ml)溶液中加入三乙胺(6.45ml,46.64mmol),然后加入1m二丁基硼三氟甲磺酸酯的二氯甲烷(42ml,42mmol)溶液。将混合物在0℃下搅拌45分钟,冷却至-70℃,然后在30分钟内缓慢加入(s)-2-甲酰基吡咯烷-1-羧酸叔丁酯(4.58g,22.97mmol)的二氯甲烷(40ml)溶液。将反应混合物在-70℃下搅拌2小时,0℃下搅拌1小时,室温下搅拌15分钟,然后用磷酸盐缓冲溶液(ph7,38ml)淬灭。在低于10℃下加入甲醇-30%h2o2溶液(2:1,100ml),搅拌20分钟后,加入水(100ml)并将混合物减压浓缩。向残余物中加入更多的水(200ml),用乙酸乙酯(3×100ml)萃取混合物。用1nkhso4(100ml),碳酸氢钠溶液(100ml)和盐水(100ml)洗涤有机层,用无水硫酸钠干燥并减压浓缩。通过快速柱层析(10%-50%乙酸乙酯/正己烷)纯化残余物,得到标题化合物,为白色固体(7.10g,71%产率).1h-nmr(500mhz,cdcl3)δ7.39(dt,j=23.4,7.1hz,3h),7.30(d,j=7.5hz,2h),5.67(d,j=7.1hz,1h),4.84–4.67(m,1h),4.08–3.93(m,3h),3.92–3.84(m,1h),3.50(d,j=9.0hz,1h),3.24(d,j=6.7hz,1h),2.15(s,1h),1.89(dd,j=22.4,14.8hz,3h),1.48(d,j=21.5hz,9h),1.33(d,j=6.9hz,3h),0.88(d,j=6.4hz,3h)。
例81.(s)-2-((1r,2r)-1-甲氧基-2-甲基-3-((4r,5s)-4-甲基-2-氧代-5-苯基恶唑烷-3-基))-3-氧代丙基)吡咯烷-1-羧酸叔丁酯的合成
在n2下,向(s)-叔丁基2-((1r,2r)-1-羟基-2-甲基-3-((4r,5s)-4-甲基-2-氧代-5-苯基恶唑烷-3-基)-3-氧代丙基)吡咯烷-1-甲酸(5.1g,11.9mmol)和分子筛(
例82.(2r,3r)-3-((s)-1-(叔丁氧基羰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸的合成
在0℃下,在5分钟内向(s)-2-((1r,2r)-1-甲氧基-2-甲基-3-((4r,5s)-4-甲基-2-氧代-5-苯基恶唑烷-3-基)-3-氧代丙基)吡咯烷-1-甲酸-(3)-氧代丙基)吡咯烷-1-羧酸叔丁酯(1.80g,4.03mmol)的四氢呋喃(30ml)和水(7.5ml)溶液中加入30%h2o2(1.44ml,14.4mmol)。然后加入lioh(0.27g,6.45mmol)的水溶液(5ml)。在0℃下搅拌3小时后,加入1n亚硫酸钠(15.7ml)并将混合物升温至室温且搅拌过夜。真空除去四氢呋喃,水相用二氯甲烷(3×50ml)洗涤,除去恶唑烷酮助剂。用1n盐酸将水相酸化至ph3并用乙酸乙酯(3×50ml)萃取。用盐水(50ml)洗涤有机层,用无水硫酸钠干燥,过滤并减压浓缩,得到标题化合物,为无色油状物(1.15g,98%产率)。1h-nmr(500mhz,cdcl3)δ3.99–3.74(m,2h),3.44(d,j=2.6hz,3h),3.23(s,1h),2.60–2.45(m,1h),1.92(tt,j=56.0,31.5hz,3h),1.79–1.69(m,1h),1.58–1.39(m,9h),1.30–1.24(m,3h)。
例83.(2r,3r)-3-甲氧基-2-甲基-3-((s)-吡咯烷-2-基)丙酸甲酯的合成
在0℃下,向(2r,3r)-3-((s)-1-(叔丁氧基羰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸(0.86g,2.99mmol)的甲醇(10ml)溶液中缓慢加入氯化亚砜(1.08ml,14.95mmol)。将反应升温至室温并搅拌过夜。将混合物减压浓缩,与甲苯共浓缩,得到标题化合物(0.71g,100%产率),为白色固体,无需进一步纯化即可用于下一步。hrms(esi)m/z:c10h20no3[m+h]+计算值202.14,实测值202.14。
例84.(4s,5s)-4-((叔丁氧基羰基)氨基)-5-甲基-3-氧代庚酸乙酯的合成
向用冰冷却的n-boc-l-异亮氨酸(4.55g,19.67mmol)的四氢呋喃(20ml)溶液中加入1,1’-羰基二咪唑(3.51g,21.63mmol)。待气体停止产生后,将所得混合物升温至室温,搅拌3.5小时。
5℃下,向新制备的异丙基溴化镁的四氢呋喃(123mmol,30ml)溶液中滴加预冷至(0℃)的丙二酸单乙酯(6.50g,49.2mmol)溶液。然后将混合物在室温下搅拌1.5小时。将该烯醇镁溶液在冰水浴上冷却,并在1小时内通过双头针向其中加入咪唑化物溶液。将所得混合物在0℃下搅拌30分钟,然后在室温下搅拌64小时。通过加入10%柠檬酸水溶液(5ml)淬灭反应混合物,并用另外的10%柠檬酸水溶液(110ml)酸化至ph3。用乙酸乙酯(3×150ml)萃取混合物。将有机萃取液用水(50ml),饱和碳酸氢钠水溶液(50ml)和饱和氯化钠水溶液(50ml)洗涤,用无水硫酸钠干燥,并减压浓缩。残留物通过硅胶柱层析纯化,用乙酸乙酯/正己烷(1:4)作为洗脱液,得到标题化合物(5.50g,93%产率)。1h-nmr(500mhz,cdcl3)δ5.04(d,j=7.8hz,1h),4.20(p,j=7.0hz,3h),3.52(t,j=10.7hz,2h),1.96(d,j=3.7hz,1h),1.69(s,2h),1.44(s,9h),1.28(dd,j=7.1,2.9hz,3h),0.98(t,j=6.9hz,3h),0.92–0.86(m,3h)。
例85.(3r,4s,5s)-4-((叔丁氧基羰基)氨基)-3-羟基-5-甲基庚酸乙酯的合成
在-60℃下向(4s,5s)-4-((叔丁氧基羰基)氨基)-5-甲基-3-氧代庚酸乙酯(5.90g,19.83mmol)的乙醇(6ml)溶液中一次性加入硼氢化钠(3.77g,99.2mmol)。将反应混合物在-55℃下搅拌5.5小时,然后用10%柠檬酸水溶液(100ml)淬灭。用另外的10%柠檬酸水溶液将所得溶液酸化至ph2,然后用乙酸乙酯(3×100ml)萃取。用饱和氯化钠水溶液(100ml)洗涤有机物,用无水硫酸钠干燥,并减压浓缩。通过柱层析(10-50%乙酸乙酯/正己烷)纯化残余物,得到标题化合物,为非对映异构体(2.20g,37%产率)和两种非对映异构体的混合物(2.0g,34%产率,约9:1比率)。1h-nmr(500mhz,cdcl3)δ4.41(d,j=9.3hz,1h),4.17(tt,j=7.1,3.6hz,2h),4.00(t,j=6.9hz,1h),3.55(dd,j=11.7,9.3hz,1h),2.56–2.51(m,2h),2.44(dd,j=16.4,9.0hz,1h),1.79(d,j=3.8hz,1h),1.60–1.53(m,1h),1.43(s,9h),1.27(dd,j=9.3,5.0hz,3h),1.03–0.91(m,7h)。
例86.(3r,4s,5s)-4-((叔丁氧基羰基)氨基)-3-羟基-5-甲基庚酸的合成
向(3r,4s,5s)-4-((叔丁氧基羰基)氨基)-3-羟基-5-甲基庚酸乙酯(2.20g,7.20mmol)的乙醇(22ml)溶液中加入1n氢氧化钠(7.57ml,7.57mmol)。将混合物在0℃下搅拌30分钟,然后在室温下搅拌2小时,通过加入1n盐酸水溶液将所得溶液酸化至ph4,然后用乙酸乙酯(3×50ml)萃取。将有机萃取液用1n硫酸氢钾水溶液(50ml)和饱和氯化钠水溶液(50ml)洗涤,用无水硫酸钠干燥,并减压浓缩,得到化合物(1.90g,95%产率)。1h-nmr(500mhz,cdcl3)δ4.50(d,j=8.7hz,1h),4.07(d,j=5.5hz,1h),3.59(d,j=8.3hz,1h),2.56–2.45(m,2h),1.76–1.65(m,1h),1.56(d,j=7.1hz,1h),1.45(s,9h),1.26(t,j=7.1hz,3h),0.93(dd,j=14.4,7.1hz,6h)。
例87.(3r,4s,5s)-4-((叔丁氧基羰基)(甲基)氨基)-3-甲氧基-5-甲基庚酸的合成
向(3r,4s,5s)-4-((叔丁氧基羰基)氨基)-3-羟基-5-甲基庚酸(1.90g,6.9mmol)的四氢呋喃(40ml)溶液中加入氢化钠(在0℃下,60%矿物油中,1.93g,48.3mmol)。搅拌1小时后,加入碘甲烷(6.6ml,103.5mmol)。在0℃下继续搅拌40小时,然后加入饱和碳酸氢钠水溶液(50ml),接着加入水(100ml)。将混合物用乙醚(2×50ml)洗涤,并将水层用1n硫酸氢钾水溶液酸化至ph3,然后用乙酸乙酯(3×50ml)萃取。将合并的有机萃取液用5%硫代硫酸钠水溶液(50ml)和饱和氯化钠水溶液(50ml)洗涤,用无水硫酸钠干燥,减压浓缩,得到标题化合物(1.00g,48%产率)。1h-nmr(500mhz,cdcl3)δ3.95(d,j=75.4hz,2h),3.42(d,j=4.4hz,3h),2.71(s,3h),2.62(s,1h),2.56–2.47(m,2h),1.79(s,1h),1.47(s,1h),1.45(d,j=3.3hz,9h),1.13–1.05(m,1h),0.96(d,j=6.7hz,3h),0.89(td,j=7.2,2.5hz,3h)。
例88.boc-n-me-l-val-oh的合成
在0℃下,向boc-l-缬氨酸-oh(2.00克,9.2mmol)和碘甲烷(5.74ml,92mmol)的无水四氢呋喃(40ml)溶液中加入氢化钠(3.68克,92mmol)。将反应混合物在0℃下搅拌1.5小时,然后升温至室温并搅拌24小时。用冰水(50ml)淬灭反应,加入水(100ml)后,将反应混合物用乙酸乙酯(3×50ml)洗涤,将水溶液酸化至ph3,然后用乙酸乙酯(3×50ml)萃取。将合并的有机相用无水硫酸钠干燥并浓缩,得到白色固体boc-n-me-val-oh(2.00g,94%产量)。1h-nmr(500mhz,cdcl3)δ4.10(d,j=10.0hz,1h),2.87(s,3h),2.37–2.13(m,1h),1.44(d,j=26.7hz,9h),1.02(d,j=6.5hz,3h),0.90(t,j=8.6hz,3h)。
例89.(2r,3r)-3-((s)-1-((3r,4s,5s)-4-((叔丁氧基羰基)-(甲基)氨基)-3-甲氧基-5-甲基庚酰基)吡咯烷酮-吡啶-2-基)-3-甲氧基-2-甲基丙酸甲酯的合成
向(2r,3r)-3-甲氧基-2-甲基-3-((s)-吡咯烷-2-基)丙酸甲酯(0.71g,2.99mmol)和(3r,4s,5s)-4-((叔在0℃下,将丁氧基羰基)(甲基)氨基)-3-甲氧基-5-甲基庚酸(1g,3.29mmol)的dmf(10ml)溶液中加入氰基膦酸二乙酯(545μl,3.59mmol),然后加入三乙胺(1.25ml,8.99mmol)。将反应混合物在0℃下搅拌2小时,然后加热至室温并搅拌过夜。反应混合物用乙酸乙酯(50ml)稀释,用1n硫酸氢钾水溶液(20ml),水(20ml),饱和碳酸氢钠水溶液(20ml)和饱和氯化钠水溶液(20ml)洗涤,用硫酸钠干燥,并减压浓缩。将残余物在硅胶柱色谱上纯化,用乙酸乙酯/正己烷(1:5至2:1)洗脱,得到标题化合物(0.9g,62%产率),为白色固体。hrms(esi)m/z:c25h46n2o7[m+h]+计算值487.33,实测值487.32。
例90.(s)-2-((1r,2r)-1-甲氧基-3-(((s)-1-甲氧基-1-氧代-3-苯基丙-2-基)氨基)-2-甲基-3-氧代丙基)吡咯烷-1-羧酸叔丁酯的合成
在0℃下,向(2r,3r)-3-((s)-1-(叔丁氧基羰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸(100mg,0.347mmol)和l-苯丙氨酸甲酯盐酸盐(107.8mg,0.500mmol)的dmf(5ml)溶液中加入氰基膦酸二乙酯(75.6μl,0.451mmol),然后加入三乙胺(131μl,0.94mmol)。将反应混合物在0℃下搅拌2小时,然后升温至室温并搅拌过夜。然后将反应混合物用乙酸乙酯(80ml)稀释,用1n硫酸氢钾水溶液(40ml),水(40ml),饱和碳酸氢钠水溶液(40ml)和饱和氯化钠水溶液(40)洗涤。用无水硫酸钠干燥,减压浓缩。通过柱层析(15-75%乙酸乙酯/正己烷)纯化残余物,得到标题化合物(130mg,83%产率),为白色固体。1h-nmr(500mhz,cdcl3)δ7.28(dd,j=7.9,6.5hz,2h),7.23(t,j=7.3hz,1h),7.16(s,2h),4.81(s,1h),3.98–3.56(m,5h),3.50(s,1h),3.37(d,j=2.9hz,3h),3.17(dd,j=13.9,5.4hz,2h),3.04(dd,j=14.0,7.7hz,1h),2.34(s,1h),1.81–1.69(m,2h),1.65(s,3h),1.51–1.40(m,9h),1.16(d,j=7.0hz,3h)。
例91.用三氟乙酸去除boc保护基的一般步骤
向n-boc氨基酸(1.0mmol)的二氯甲烷(2.5ml)溶液中加入三氟乙酸(1.0ml)。在室温下搅拌1-3小时后,将反应混合物减压浓缩。与甲苯共浓缩得到脱保护的产物,其不经任何进一步纯化即可使用。
例92.(2r,3r)-3-甲基-((s)-1-((3r,4s,5s)-4-((s)-2-((叔丁氧基羰基)氨基)-n,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸甲酯的合成
在0℃下,向(2r,3r)-3-甲氧基-3-((s)-1-((3r,4s,5s)-3-甲氧基-5-甲基-4-(甲氨基)庚酰基)吡咯烷-2-基)甲酯-2-甲基丙酸酯(715mg,1.85mmol)去boc保护产物和boc-val-oh(1.2g,5.56mmol)的二氯甲烷(20ml)溶液中加入brop(1.08g,2.78mmol)),然后加入二异丙基乙胺(1.13ml,6.48mmol)。将混合物在0℃下暗处搅拌30分钟,然后在室温下搅拌48小时。反应混合物用乙酸乙酯(50ml)稀释,用1n硫酸氢钾水溶液(20ml),水(20ml),饱和碳酸氢钠水溶液(20ml)和饱和氯化钠水溶液(20ml))洗涤,用na2so4干燥,并减压浓缩。将残余物在硅胶柱上纯化,用乙酸乙酯/正己烷(1:5至4:1)洗脱,得到标题化合物(0.92g,85%产率),为白色固体。hrms(esi)m/z:c30h55n3o8[m+h]+计算值586.40,实测值586.37。
例93.(2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基丁酰胺)-3-甲氧基-5-甲基庚基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸甲酯
在0℃时,向(2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-((叔丁氧基羰基)氨基)-n,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸甲酯(50mg,0.085mmol)的去boc保护产物和五氟苯基2-(二甲基氨基)-2-甲基丙酸酯(74.5mg,0.25mmol)的dmf(2ml)溶液中加入dipea(44μl,0.255mmol)。将反应混合物升温至室温并搅拌2小时,然后用乙酸乙酯(30ml)稀释,用水(10ml)和饱和氯化钠水溶液(10ml)洗涤,经硫酸钠干燥,并减压浓缩。将残余物在硅胶柱上纯化,用乙酸乙酯/正己烷(1:5至5:1)洗脱,得到标题化合物(50mg,100%产率)。hrms(esi)m/z:c31h58n4o7[m+h]+计算值599,实测值599。
例94.(2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基丁酰胺))-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸的合成
在0-4℃,5分钟内向(2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸甲酯的1,4-二恶烷(3ml)溶液中逐滴加入氢氧化锂(14mg,0.334mmol)的水(3ml)溶液。将反应混合物升温至室温并搅拌2小时。用1nhcl将混合物中和至ph7并在真空下浓缩,不经进一步纯化即用于下一步。hrms(esi)m/z:c30h57n4o7[m+h]+:计算值585.41,实测值585.80。
例95.(2r,3r)-五氟苯基3-((s)-1-((3r,4s,5s)-4-((s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基丁酰胺)-3-甲氧基-5-甲基庚基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸酯的合成
在0℃时,向(2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基丁酰胺)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸(0.0836mmol)和五氟苯酚(18.5mg,0.1mmol)的二氯甲烷(2ml)溶液中加入dic(12.7mg,0.1mmol)。将混合物升温至室温并搅拌过夜。将反应混合物减压浓缩,不经进一步纯化即用于下一步。hrms(esi)m/z:c36h56f5n4o7[m+h]+计算值751.40,实测值751.70。
例96.(s)-2-((叔丁氧基羰基)氨基)-3-(4-羟基-3-硝基苯基)丙酸甲酯的合成
向boc-l-酪氨酸甲酯(5g,16.9mmol)的四氢呋喃(50ml)溶液中加入亚硝酸叔丁酯(10ml,84.6mmol),然后将反应混合物在室温下搅拌5小时。浓缩反应混合物,并通过硅胶柱纯化,用乙酸乙酯/正己烷(1:10至1:5)洗脱,得到化合物(4.5g,78%产率),为黄色固体。hrms(esi)m/z:c15h21n2o7[m+h]+计算值341.13,实测值341.30。
例97.(s)-3-(3-氨基-4-羟基苯基)-2-((叔丁氧基羰基)氨基)丙酸甲酯的合成
向(s)-3-(3-氨基-4-羟基苯基)-2-(叔丁氧基羰基氨基)丙酸甲酯(2g,6.44mmol)的乙酸乙酯(20ml)溶液中加入pd/c(0.2g),在氢气环境下搅拌2小时。过滤混合物,减压浓缩滤液,得到标题化合物(1.7g,95%产率),为白色固体。hrms(esi)m/z:c15h23n2o5[m+h]+计算值311.15,实测值311.30。
例98.化合物a-1的合成
在0℃时,向14,17-二氧代-4,7,10,21,24,27-六氧杂-13,18-二氮杂三十烷-15-炔-1,30-二酸(95mg,0.182mmol)和(s)-3-(3-氨基-4-羟基苯基)-2-(叔丁氧基羰基氨基)丙酸甲酯(56.6mg,0.182mmol)的dmf(5ml)溶液中加入edc(128.5mg,0.338mmol),然后加入dipea(64μl,0.365mmol)。将反应混合物升温至室温并搅拌过夜。用乙酸乙酯(30ml)稀释反应混合物,用水(10ml),饱和氯化钠水溶液(10ml)洗涤,硫酸钠干燥,并减压浓缩。将残余物在硅胶柱上纯化,用二氯甲烷/甲醇(20:1至10:1)洗脱,得到化合物a-1(68mg,47%产率)。hrms(esi)m/z:c37h55n4o15[m+h]+计算值795.36,实测值795.30。
例99.化合物a-2的合成
在0℃下,向化合物a-1(32mg,0.04mmol)的二氯甲烷(3ml)溶液中加入tfa(1ml)。将反应混合物升温至室温并搅拌30分钟,用甲苯稀释,浓缩,与甲苯共浓缩,不经进一步纯化即用于下一步。hrms(esi)m/z:c33h47n4o15[m+h]+:计算值795.36,实测值795.30。
例100.化合物a-3的合成
在0℃时,向(2r,3r)-五氟苯基3-((s)-1-((3r,4s,5s)-4-((s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸酯和化合物a-2(31.7mg,0.04mmol)的dma(2ml)溶液中加入dipea(9μl,0.053mmol)。将反应混合物升温至室温并搅拌30分钟。将混合物减压浓缩,并通过制备型hplc(c-18,250mm×10mm),用h2o/ch3cn(9ml/min,从90%水至40%水,40分钟)洗脱纯化,得到化合物a-3(14mg,42%产率)。hrms(esi)m/z:c62h101n8o19[m+h]+计算值1261.71实测值1261.30。
例101.(s)-1-((3r,4s,5s)-4-((叔丁氧基羰基)(甲基)氨基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯的合成
在0℃下,向(s)(叔丁基-2-((1r,2r)-1-甲氧基-3-(((s)-1-甲氧基-1-氧代-3-苯基丙烷-2-基)氨基)-2-甲基-3-氧代丙基)吡咯烷-1-羧酸乙酯(0.29mmol)的去boc保护产物和(3r,4s,5s)-4-((叔丁氧基羰基)(甲基)氨基)-3-甲氧基-5-甲基庚酸(96.6mg,0.318mmol)的dmf(5ml)溶液中加入氰基膦酸二乙酯(58μl,0.347mmol),然后加入三乙胺(109μl,0.78mmol)。将反应混合物在0℃下搅拌2小时,然后升温至室温并搅拌过夜。将反应混合物用乙酸乙酯(80ml)稀释,用1n硫酸氢钾水溶液(40ml),水(40ml),饱和碳酸氢钠水溶液(40ml)和饱和氯化钠水溶液(40ml)洗涤。用无水硫酸钠干燥并减压浓缩。通过柱层析(15-75%乙酸乙酯/正己烷)纯化残余物,得到标题化合物(150mg,81%产率),为白色固体。lc-ms(esi)m/z:c34h55n3o8[m+h]+计算值634.40,实测值634.40。
例102.(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-((叔丁氧基羰基)氨基))-n,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯的合成
在0℃下,向(s)-甲基2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((叔丁氧基羰基))(甲基)氨基)-3-甲氧基-5-甲基庚酰基)-吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸酯的去boc保护的产物(0.118mmol)和boc-val-oh(51.8mg,0.236mmol))的二氯甲烷(5ml)溶液中加入brop(70.1mg,0.184mmol),然后加入二异丙基乙胺(70μl,0.425mmol)。将混合物置于避光处并在0℃下搅拌30分钟,然后在室温下搅拌2天,将反应混合物用乙酸乙酯(80ml)稀释,用1n硫酸氢钾水溶液(40ml),水(40ml),饱和碳酸氢钠水溶液(40ml)和饱和氯化钠水溶液(40ml)洗涤。用无水硫酸钠干燥并减压浓缩,通过柱层析(20-100%乙酸乙酯/正己烷)纯化残余物,得到标题化合物为白色固体(67mg,77%产率)。lc-ms(esi)m/z:c39h64n4o9[m+h]+计算值733.47,实测值733.46。
例103.(s)-2-((2r,3r)-3-((s)-1-((6s,9s,12s,13r)-12-((s)-仲丁基)-6,9二异丙基-13-甲氧基-2,2,5,11-四甲基-4,7,10-三氧代-3-氧杂-5,8,11-三氮杂十五烷-15-酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯的合成
在0℃下,向(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2)-((叔丁氧基羰基)氨基)-n,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯的去boc产物(0.091mmol)和boc-n-me-val-oh(127mg,0.548mmol)的dmf(5ml)溶液中加入氰基膦酸二乙酯(18.2μl,0.114mmol),然后加入n-甲基吗啉(59μl,0.548mmol)。将反应混合物在0℃下搅拌2小时,然后升温至室温并搅拌过夜。将反应混合物用乙酸乙酯(80ml)稀释,用1n硫酸氢钾水溶液(40ml),水(40ml),饱和碳酸氢钠水溶液(40ml)和饱和氯化钠水溶液(40ml)洗涤。用硫酸钠干燥,减压浓缩。通过柱层析(20-100%乙酸乙酯/正己烷)纯化残余物,得到标题化合物为白色固体(30mg,39%产率)。lc-ms(esi)m/z:c45h75n5o10[m+h]+计算值846.55,实际值846.56。
例104.(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-n,3-二甲基-2-((s)-3-甲基-2-(甲基氨基)丁酰胺基)丁酰胺基)-3-甲氧基-5-甲基-庚基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺)-3-苯基丙甲酯的合成
在室温下,向(s)-(2r,3r)-3-((s)-1-((6s,9s,12s,13r)-12-((s)-仲丁基)-6,9-二异丙基-13-甲氧基-2,2,5,11-四甲基-4,7,10-三氧代-3-氧杂-5,8,11-三氮杂十五烷-15-酰基)吡咯烷-2-基)3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯(75.0mg,0.0886mmol)的二氯甲烷溶液(5ml)中加入三氟乙酸(2ml)。在室温下搅拌1小时,将反应混合物减压浓缩并与甲苯共浓缩得到去保护的标题产物,其无需进一步纯化即可使用。
例105.(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-n,3-二甲基-2-(s)-3-甲基-2-(甲基氨基)丁酰胺基)丁酰胺基)-3-甲氧基-5-甲基庚酰基)-吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸的合成
将(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-n,3-二甲基-2-((s)-3-甲基-2-(甲氨基)丁酰胺基)丁酰胺基)-3-甲氧基-5-甲基-庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯(25mg,0.030)与浓hcl(0.3ml)和1,4-二恶烷(0.9ml)的混合物在室温下搅拌35分钟。用乙醇(1.0ml)和甲苯(1.0ml)稀释混合物,浓缩并与乙醇/甲苯(2:1)共浓缩,得到标题化合物,为白色固体(22mg,约100%产率),其不经进一步纯化即用于下一步。lc-ms(esi)m/z:c39h66n5o8[m+h]+计算值732.48,实测值732.60。
例106.(2s)-2-((2r,3r)-3-((2s)-1-((11s,14s,17s)-1-叠氮基-17-((r)-仲丁基)-11,14二异丙基-18-甲氧基-10,16-二甲基-9,12,15-三氧代-3,6-二氧杂-10,13,16-三氮杂二十烷—20-酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸的合成
在两小时内,分四份向(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-n,3-二甲基-2-((s)-3-甲基-2-(甲氨基)丁酰胺基)丁酰胺基)-3-甲氧基-5-甲基庚酰基)-吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸粗品(22毫克,0.030mmol)的dma(0.8ml)和nah2po4缓冲溶液(ph7.5,1.0m,0.7ml)的混合物中加入2,5-二氧代吡咯烷-1-基3-(2-(2-叠氮基乙氧基)乙氧基)丙酸盐(18.0mg,0.060mmol)。将混合物搅拌过夜,浓缩并在硅胶柱(甲醇/二氯甲烷/hoac1:8:0.01)上纯化,得到标题化合物(22.5mg,82%产率)。lc-ms(esi)m/z:c46h77n8o11[m+h]+计算值917.56,实测值917.60。
例107.(2s)-2-((2r,3r)-3-((2s)-1-((11s,14s,17s)-1-氨基-17-((r)-仲丁基)-11,14二异丙基-18-甲氧基-10,16-二甲基-9,12,15-三氧代-3,6-二氧杂-10,13,16-三氮杂二十烷-20-酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸合成。
在氢化反应瓶里,向(2s)-2-((2r,3r)-3-((2s)-1-((11s,14s,17s)-1-叠氮基-17-((r)-仲丁基)-11,14二异丙基-18-甲氧基-10,16-二甲基-9,12,15-三氧代-3,6-二氧杂-10,13,16-三氮杂环氧乙烷-20-酰基)吡咯烷-2-基)-3-的甲氧基-2-甲基丙酰胺基)-3-苯基丙酸(22.0mg,0.024mmol)的甲醇(5ml)溶液中加入pd/c(5mg,10wt%,50%水)。将反应瓶抽空,并充入25psih2,将混合物振荡4小时,通过硅藻土过滤。浓缩滤液,得到标题产物(约20mg,92%产率),其不经进一步纯化直接用于下一步。esimsm/z:c46h79n6o11[m+h]+计算值891.57,实测值891.60。
例108.(s)-2-((2r,3r)-3-((s)-1-((6s,9s,12s,13r)-12-((s)-仲丁基)-6,9-二异丙基-13-甲氧基-2,2,5,11-四甲基-4,7,10-三氧代-3-氧杂-5,8,11-三氮杂十五烷-15-酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸的合成
向(s)-(2r,3r)-3-((s)-1-((6s,9s,12s,13r)-12-((s)-仲丁基)-(s)-6,9-二异丙基-13-甲氧基2,2,5,1-1四甲基-4,7,10-三氧代-3-氧杂-5,8,11-三氮杂十五烷-15酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯(30mg,0.035mmol)的四氢呋喃(1.0ml)溶液中加入lioh水溶液(1.0m,0.8ml)。将混合物在室温下搅拌35分钟,用0.5mh3po4调节ph至6,浓缩并在硅胶柱上纯化(甲醇/二氯甲烷/hoac1:10:0.01),得到标题化合物(25.0mg,85%产率)。lc-ms(esi)m/z:c44h74n5o10[m+h]+计算值832.54,实测值832.60。
例109.(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-n,3-二甲基-2-(s)-3-甲基-2-(甲基氨基)丁酰胺基)丁酰胺基)-3-甲氧基-5-甲基庚酰基)-吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸的合成
向(s)-2-((2r,3r)-3-((s)-1-((6s,9s,12s,13r)-12-((s)-仲丁基)-6,9-二异丙基-13-甲氧基-2,2,5,11-四甲基-4,7,10-三氧代-3-氧杂-5,8,11-三氮杂十五烷-15-酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸(25mg,0.030mmol)的二恶烷(2.0ml)溶液中加入浓盐酸(12n,0.6ml)。将混合物在室温下搅拌30分钟,用二恶烷(4ml)和甲苯(4ml)稀释,浓缩并用c18hplc纯化,用甲醇和水洗脱(200mm×φ20mm,9ml/min,40分钟从5%甲醇至40%甲醇),得到标题化合物(20.0mg,90%产率)。lc-ms(esi)m/z:c39h66n5o8[m+h]+计算值732.48,实测值732.90。
例110.(s)-2-((2r,3r)-3-((s)-1-((5s,8s,11s,14s,15r)-14-((s)-仲丁基)-8,11-二异丙基-15-甲氧基-5,7,13三甲基-3,6,9,12-四氧代-1-苯基-2-氧杂-4,7,10,13-四氮杂十七烷-17-酰基)吡咯烷吡啶-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯的合成
在0℃下,依次向mmaf-ome(0.132g,0.178mmol,1.0eq.)和z-l-丙氨酸(0.119g,0.533mmol,3.0eq.)在无水二氯甲烷(10ml)中的溶液中加入hatu(0.135g,0.356mmol,2.0eq.)和nmm(0.12ml,1.07mmol,6.0eq.)。将反应物在0℃下搅拌10分钟,然后加热至室温并搅拌过夜。将混合物用二氯甲烷稀释,用水和盐水洗涤,经无水硫酸钠干燥,浓缩,并通过硅胶柱色谱(20:1二氯甲烷/甲醇)纯化,得到标题化合物,为白色泡沫状固体(0.148g,88%产率)。esimsm/z:c51h79n6o11[m+h]+计算值951.6,实测值951.6。
例111.(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-((s)-2-((s)-2-氨基-n-甲基丙酰胺基)-3-甲基丁酰胺基)-n,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯的合成
在氢化反应瓶中将pd/c(0.100g,10%pd/c,含水50%)加入到(s)-2-((2r,3r)-3-((s)-1-((5s,8s,11s,14s,15r)-14-((s)-仲丁基)-8,11-二异丙基-15-甲氧基-5,7,13三甲基-3,6,9,12-四氧代-1-苯基-2-氧杂-4,7,10,13-四氮杂十七烷-17-酰基)吡咯烷吡啶-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯(0.148g,0.156mmol,1.0eq.)的甲醇(5ml)溶液中。将混合物在氢气中振荡5小时,然后通过硅藻土垫过滤。浓缩滤液,得到标题化合物,为白色泡沫状固体(0.122g,96%产率)。esimsm/z:c43h73n6o9[m+h]+计算值817.5,实测值817.5。
例112.(s)-2-((2r,3r)-3-((s)-1-((8s,11s,14s,17s,20s,21r)-20-((s)-仲丁基)-14,17二异丙基-21-甲氧基-8,11,13,19-四甲基-3,6,9,12,15,18-六氧代-5-丙烯酰胺基-4,7,10,13,16,19-六氮杂二十三烷-1-炔-23-羰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸(a-4)的合成
向化合物(s)-2-((2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-((s)-2-((s)-2-氨基-n-甲基丙酰胺基)-3-甲基丁酰胺基)-n,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯(20mg,0.027mmol)在dma(2ml)和0.1mna2hpo4(ph8.0,1ml)的混合物中,在3小时内分三份加入(s)-2,5-二氧代吡咯烷-1-基2-((s)-2-(2,2-二丙二酰胺基)-乙酰胺基)丙酰胺基)丙酸酯(20.1mg,0.046mmol),然后将混合物再搅拌12小时。浓缩反应混合物,并通过反相hplc(200mm×10mm,c18柱,10-100%乙腈/水,40分钟,流速8ml/min)纯化,得到标题化合物(22.1mg,78%产率)。esimsm/z::c53h80n9o13[m+h]+计算值1050.58,实测值1050.96。
例113.(z)-4-肼基-4-氧代丁-2-烯酸盐酸盐的合成
将盐酸肼(7.00g,102.1mmol)和马来酸酐(10.01克)在dma(100ml)中混合。将混合物搅拌过夜,浓缩并在乙醇中重结晶,得到标题化合物(12.22g,92%产率)。esimsm/z:c4h7n2o3[m+h]+计算值131.04,实测值131.20。
例114.(2s)-2-((2r,3r)-3-((2s)-1-((11s,14s,17s,18r)-17-((s)-仲丁基)-11,14-二异丙-18-甲氧基-10,16-二甲基-9,12,15-三氧代-1-((双(2-(z)-3-羧基丙烯酰肼基)磷酰基)氨基)-3,6-二氧杂-10,13,16-三氮杂二十烷-20-基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸(a-5)的合成
在0℃下,(z)-4-肼基-4-氧代丁-2-烯酸hcl盐(22.0mg,0.132mmol)和dipea(10μl,0.057mmol)在四氢呋喃(5ml)的混合物中加入pocl3(10.1mg,0.0665mmol)。搅拌20分钟后,将混合物升温至室温并再搅拌4小时。然后向混合物中加入(s)-2-((2r,3r)-3-((s)-1-((11s,14s,17s,18r)-1-氨基-17-((s)-仲丁基)-11,14二异丙基-18-甲氧基-10,16-二甲基-9,12,15-三氧代-3,6-二氧杂-10,13,16-三氮杂二十烷-20-酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸(60mg,0.067mmol)和dipea(20μl,0.114mmol)。将混合物在50℃搅拌过夜,浓缩,并通过反相hplc(200mm×10mm,c18柱,10-100%乙腈/水,40分钟,流速ml/min)纯化,得到标题化合物(25.6mg,31%产率)。esimsm/z:c54h84n88o18p[m+h]+计算值1195.59,实测值1196.10。
例115.(s,e)-2-甲基-n-(3-甲基丁-2-亚基)丙烷-2-磺酰胺的合成
在n2保护下室温下向(s)-叔丁基亚磺酸胺(100g,0.825mol)的四氢呋喃(1l)溶液中加入ti(oet)4(345ml,1.82mol)和3-甲基-2-丁酮(81ml,0.825mol)。加热反应液,回流16小时后冷却至室温,然后倒入冰水(1l)。过滤并且用乙酸乙酯洗滤饼。分离滤液中的有机相,无水硫酸钠干燥后减压浓缩,其残留物减压蒸馏(15-20torr,95℃)得目标产物10(141g,90%产率),为黄色油状物。1hnmr(500mhz,cdcl3)δ2.54–2.44(m,1h),2.25(s,3h),1.17(s,9h),1.06(dd,j=6.9,5.1hz,6h)。msesim/z:c9h19nanos[m+na]+:计算值212.12,实测值212.11。
例116.(2s,3s)-2-叠氮基-3-甲基戊酸的合成
将nan3(20.0g,0.308mol)溶于水(50ml)后加入二氯甲烷(80ml)并冷却至0℃,向该溶液中加入tf2o(10ml,59.2mmol)。加完后在0℃下继续搅拌2小时。分离出有机相,水相用二氯甲烷萃取(2×40ml)。合并有机相,用饱和nahco3(3×80ml)洗。室温下将此二氯甲烷溶液加入到(l)-异亮氨酸(4.04g,30.8mmol),碳酸钾(6.39g,46.2mmol),五水硫酸铜(77.4mg,0.31mmol)的混合甲醇/水(1:2v/v,300ml)溶液中。加料过程中反应体系内温度会稍微升高。混合液在室温下搅拌16小时,减压蒸去溶剂,水相用水(250ml)稀释,用浓盐酸(大约280ml)酸化至ph6,然后用磷酸盐缓冲液稀释(0.25m,ph6.2,250ml),用乙酸乙酯(5×100ml)洗去磺酸胺副产物。水相用浓盐酸酸化至ph2后用乙酸乙酯(3×150ml)萃取。合并有机相,无水硫酸钠干燥,过滤浓缩得标题化合物(4.90g,99%产率),为亮黄色油状物。1hnmr(500mhz,cdcl3)δ12.01(s,1h),3.82(d,j=5.9hz,1h),2.00(ddd,j=10.6,8.6,5.5hz,1h),1.54(dqd,j=14.8,7.5,4.4hz,1h),1.36–1.24(m,1h),1.08–0.99(m,3h),0.97–0.87(m,3h)。
例117.d-n-甲基哌啶酸的合成
向d-呱啶酸(10.0g,77.4mmol)的甲醇(100ml)溶液中加入甲醛(37%水溶液,30.8ml,154.8mmol)和pd/c(10wt%,1.0g)。将该反应液在h2(1atm)环境中搅拌过夜,而后用硅藻土过滤,甲醇洗。滤液浓缩得标题化合物(10.0g,90%产率),为白色固体。
例118.(r)-五氟苯基1-甲基哌啶-2-羧酸酯的合成
向d-n-甲基呱啶酸(2.65g,18.5mmol)的乙酸乙酯(50ml)溶液中加入五氟苯酚(3.75g,20.4mmol)和dcc(4.21g,20.4mmol)。反应在室温下搅拌16小时,硅藻土过滤,用10ml乙酸乙酯洗。滤液不用进一步纯化,直接使用。msesim/z:c13h13f5no2[m+h]+计算值309.08;实测值309.60。
例119.五氟苯基2-(二甲基氨基)-2-甲基丙酸酯的合成
在0℃下向2-(二甲基氨基)-2-甲基丙酸(5.00g,38.10mmol)的乙酸乙酯(200ml)溶液中加入2,3,4,5,6-五氟苯酚(10.4g,57.0mmol)),然后加入dic(8.8ml,57.0mmol)。将反应混合物升温至室温,搅拌过夜并过滤。浓缩滤液,得到标题化合物(12.0g,>100%产率),不经进一步纯化即用于下一步。msesim/z:c12h13f5no2[m+h]+计算值298.08;实测值298.60.
例120.2,2-二乙氧基乙硫基酰胺的合成
将二乙氧基乙腈(100g,0.774mol)溶解于甲醇(1.5l),在室温下加入(nh4)2s(48%水溶液,143ml,1.05mol)。搅拌16h后,浓缩反应液。向残留物中加入二氯甲烷,用饱和nahco3溶液洗,饱和食盐水洗,之后用无水硫酸钠干燥,过滤后减压浓缩。粗品用石油醚和二氯甲烷打浆,真空抽滤,收集固体并用石油醚洗涤。总共得到100g(79%产率)目标产物,为白色固体。1hnmr(500mhz,cdcl3)δ7.81(d,j=71.1hz,2h),5.03(s,1h),3.73(dq,j=9.4,7.1hz,2h),3.64(dq,j=9.4,7.0hz,2h),1.25(t,j=7.1hz,6h)。
例121.2-(二乙氧基甲基)噻唑-4-羧酸乙酯的合成
将分子筛(
例122.2-甲酰基噻唑-4-羧酸乙酯的合成
向2-(二乙氧基甲基)噻唑-4-羧酸乙酯(130g,0.50mol)的丙酮(1.3l)溶液中加入2nhcl溶液(85ml,0.165mmol),加热至回流(反应液温度约60℃)。tlc显示起始原料反应完全后(约1-2h),减压除去丙酮,残留物用二氯甲烷稀释(1.3l),并依次用饱和nahco3水溶液、水和食盐水洗,然后用无水硫酸钠干燥。滤出干燥剂后浓缩有机相,所得粗产品用石油醚/乙醚溶液打浆,析出的固体经真空过滤收集,得白色固体(40g,43%产率)。1hnmr(500mhz,cdcl3)δ10.08–10.06(m,1h),8.53–8.50(m,1h),4.49(q,j=7.1hz,2h),1.44(t,j=7.1hz,3h)。msesim/z:c7h8no3s[m+h]+:计算值186.01,实测值186.01。
例123.乙基2-((r,e)-3-(((s)-叔丁基亚磺酰基)亚氨基)-1-羟基-4-甲基戊基)噻唑-4-甲酸乙酯的合成
在n2保护下,于-78℃下向二异丙胺(121ml,0.86mol)的四氢呋喃溶液中加入正丁基锂溶液(2.5m,302ml,0.76mol)。反应在30分钟内升温至0℃然后重新冷却至-78℃,向其中加入(s,e)-2-甲基-n-(3-甲基丁-2-亚基)丙烷-2-磺酰胺(57g,0.30mol)的四氢呋喃(200ml)溶液。搅拌1小时后滴加clti(oipr)3(168.5g,0.645mol)的四氢呋喃(350ml)溶液。搅拌1小时后再缓慢滴入2-甲酰基噻唑-4-羧酸乙酯(40g,0.215mol)的四氢呋喃(175ml)溶液,所得溶液在-78℃继续搅拌2小时。tlc监测反应进行完全后,用乙酸和四氢呋喃(体积比1:4,200ml)的混合液淬灭反应,而后将反应液倒入冰水,用乙酸乙酯萃取(4×500ml)。有机相用水和食盐水洗,无水硫酸钠干燥,过滤并浓缩。残留物经柱层析(二氯甲烷/乙酸乙酯/石油醚2:1:2)纯化,得标题化合物(60g,74%产率),为无色油状物。1h-nmr(500mhz,cdcl3)δ8.13(s,1h),6.63(d,j=8.2hz,1h),5.20–5.11(m,1h),4.43(q,j=7.0hz,2h),3.42–3.28(m,2h),2.89(dt,j=13.1,6.5hz,1h),1.42(t,j=7.1hz,3h),1.33(s,9h),1.25–1.22(m,6h)。msesim/z:c16h26nan2o4s2[m+na]+计算值397.13,实测值397.11。
例124.2-((1r,3r)-3-((s)-1,1-二甲基乙基亚磺酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯的合成
将2-((r,e)-3-(((s)-叔丁基亚磺酰基)亚氨基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(23.5g,62.7mol)溶于四氢呋喃(200ml),冷却至-45℃,向其中缓慢加入ti(oet)4(42.9ml,188mol),加完后搅拌1小时。然后分批加入nabh4(4.75g,126mmol),反应在-45℃搅拌3小时。tlc监测发现起始原料仍有剩余。将反应用hoac/thf(v/v1:4,25ml)淬灭,缓慢加入乙醇(25ml),将反应液倒入冰水(100g),升至室温。经过硅藻土过滤,分离有机相,水洗、饱和食盐水洗、无水硫酸钠干燥,过滤并浓缩。残留物经柱层析(乙酸乙酯/石油醚1:1)纯化得标题化合物(16.7g,71%产率),为白色固体。1hnmr(500mhz,cdcl3)δ8.10(s,1h),5.51(d,j=5.8hz,1h),5.23–5.15(m,1h),4.41(q,j=7.0hz,2h),3.48–3.40(m,1h),3.37(d,j=8.3hz,1h),2.29(t,j=13.0hz,1h),1.95–1.87(m,1h),1.73–1.67(m,1h),1.40(t,j=7.1hz,3h),1.29(s,9h),0.93(d,j=7.3hz,3h),0.90(d,j=7.2hz,3h).msesim/z:计算值c16h28nan2o4s2[m+na]+:399.15,实测值399.14。
例125.2-((1r,3r)-3-氨基-1-羟基-4-甲基戊基)噻唑-4-甲酸乙酯盐酸盐的合成
在0℃下向2-((1r,3r)-3-((s)-1,1-二甲基乙基亚磺酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(6.00g,16.0mmol)的乙醇(40ml)溶液中加入4nhcl的1,4-二氧六环(40ml)溶液。反应逐渐升至室温后搅拌2.5小时。浓缩后用乙醚打浆,得白色固体,共4.54g(92%产率)。
例126.2-((1r,3r)-3-((2s,3s)-2-叠氮基-3-甲基戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯的合成
将azido-ile-oh(5.03g,28.8mol)溶于四氢呋喃(120ml)并冷却至0℃,依次加入nmm(6.2ml,56.0mmol)和氯甲酸异丁酯(3.7ml,28.8mol)。在0℃搅拌30分钟,室温1h,在0℃下,分批加入2-((1r,3r)-3-氨基-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯盐酸盐(4.54g,14.7mmol)。在0℃搅拌30分钟后,逐渐升至室温并继续搅拌2小时。反应在0℃下加冰水淬灭并用乙酸乙酯萃取三遍。合并有机相用1nhcl洗,饱和nahco3洗和食盐水洗,无水硫酸钠干燥。过滤浓缩,残留物经柱层析(0-30%乙酸乙酯/石油醚)纯化得到白色固体(4.55g,74%产率)。
例127.乙基2-((1r,3r)-3-((2s,3s)-2-叠氮基-3-甲基戊酰胺基)-4-甲基-1-((三乙基甲硅烷基)氧基)戊基)噻唑-4-羧酸乙酯
在0℃下依次向2-((1r,3r)-3-((2s,3s)-2-叠氮基-3-甲基戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(5.30g,12.8mmol)的二氯甲烷(50ml)溶液中加入咪唑(1.75g,25.6mmol)和三乙基氯硅烷(4.3ml,25.6mol)。反应液历时1小时升至室温后,继续搅拌1小时。加入饱和食盐水淬灭,分出有机相,水相用乙酸乙酯萃取。合并后的有机相经干燥、过滤、浓缩后用柱层析(15-35%乙酸乙酯/石油醚)纯化得标题化合物(6.70g,99%产率),为白色固体。1hnmr(500mhz,cdcl3)δ8.12(s,1h),6.75(d,j=8.0hz,1h),5.20–5.12(m,1h),4.44(q,j=7.0hz,2h),4.06–3.97(m,1h),3.87(d,j=3.8hz,1h),2.14(d,j=3.8hz,1h),2.01–1.91(m,3h),1.42(t,j=7.1hz,3h),1.34–1.25(m,2h),1.06(d,j=6.8hz,3h),1.00–0.93(m,18h),0.88(dd,j=19.1,6.8hz,6h)。msesim/z:c24h44n5o4ssi[m+h]+:计算值526.28,实测值526.28。
例128.2-((1r,3r)-3-((2s,3s)-2-叠氮基-n,3-二甲基戊酰胺基)-4-甲基-1-((三乙基甲硅烷基)氧基)戊基)噻唑-4羧酸乙酯的合成
将2-((1r,3r)-3-((2s,3s)-2-叠氮基-3-甲基戊酰胺基)-4-甲基-1-((三乙基甲硅烷基)氧基)戊基)噻唑-4-羧酸乙酯(5.20g,9.9mmol,1.0eq.)的四氢呋喃(50ml)溶液冷却至-45℃,加入khmds(1m甲苯溶液,23.8ml,23.8mmol,2.4eq.)。将所得混合物在-45℃下搅拌20分钟,然后加入碘甲烷(1.85ml,29.7mmol,3.0eq.)。将反应混合物升温至室温,搅拌超过4.5小时,然后用乙醇(10ml)淬灭反应。粗产物用乙酸乙酯(250ml)稀释并用盐水(100ml)洗涤。水层用乙酸乙酯(3×50ml)反萃取。将有机层干燥,过滤,浓缩并通过柱层析法用15-35%乙酸乙酯/石油醚梯度洗脱,得到标题产物(3.33g,63%产率),为浅黄色油状物。1hnmr(500mhz,cdcl3)δ8.09(s,1h),4.95(d,j=6.6hz,1h),4.41(q,j=7.1hz,2h),3.56(d,j=9.5hz,1h),2.98(s,3h),2.27–2.06(m,4h),1.83–1.70(m,2h),1.41(t,j=7.2hz,3h),1.29(ddd,j=8.9,6.8,1.6hz,3h),1.01(d,j=6.6hz,3h),0.96(dt,j=8.0,2.9hz,15h),0.92(d,j=6.6hz,3h),0.90(d,j=6.7hz,3h);msesim/z:c25h46n5o4ssi[m+h]+计算值540.30,实测值540.30。
例129.2-((3s,6r,8r)-3-((s)-仲丁基)-10,10-二乙基-6-异丙基-5-甲基-1-((r)-1-甲基哌啶-2-基)-1,4-二氧代-9-氧杂-2,5-二氮杂-10-硅杂十二烷-8-基)噻唑-4-甲酸乙酯的合成
向五氟苯基酯的乙酸乙酯溶液中加入干的pd/c(10wt%,300mg)和2-((1r,3r)-3-((2s,3s)-2-叠氮基-n,3-二甲基戊酰胺基)-4-甲基-1-乙基((三乙基甲硅烷基)氧基)戊基)噻唑-4-羧酸酯(3.33g,6.61mmol)。反应液在氢气(1atm)环境中搅拌27小时,而后用硅藻土过滤,乙酸乙酯洗。滤液旋干经柱层析(0-5%甲醇/乙酸乙酯)纯化得标题化合物(3.90g,86%产率)。msesim/z:c32h59n4o5ssi[m+h]+计算值639.39,实测值639.39。
例130.2-((1r,3r)-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯的合成
将2-((3s,6r,8r)-3-((s)-仲丁基)-10,10-二乙基-6-异丙基-5-甲基-1-((r)-1-甲基哌啶-2)-)-1,4-二氧代-9-氧杂-2,5-二氮杂-10-基十二烷-8-基)噻唑-4-羧酸乙酯(3.90g,6.1mmol)溶于acoh/水/四氢呋喃(v/v/v3:1:1,100ml)中,并在室温下搅拌48小时。然后浓缩,残留物经柱层析(2:98至15:85甲醇/乙酸乙酯)纯化得到标题化合物(2.50g,两步产率72%)。msesim/z:c26h45n4o5s[m+h]+计算值525.30,实测值525.33。
例131.2-((1r,3r)-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-酸的合成
在0℃下,将lioh水溶液(0.4n,47.7ml,19.1mmol,4.0eq.)加入到2-((1r,3r)-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-甲酰胺基)-戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯(2.50g,4.76mmol,1.0eq.)的1,4-二氧六环(47.7ml)溶液中。室温搅拌2小时后浓缩。残留物经柱层析(100%二氯甲烷至二氯甲烷/甲醇/氨水80:20:1)纯化,得到标题化合物(2.36g,99%产率),为无定形固体。msesim/z:c24h41n4o5s[m+h]+计算值497.27,实测值497.28。
例132.2-((1r,3r)1-乙酰氧基-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-酸的合成
在0℃,向2-((1r,3r)-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-甲酰胺基)戊基)-1-羟基-4-甲基戊基)噻唑-4-羧酸(2.36g,4.75mmol)的吡啶(50ml)溶液中,缓慢加入乙酸酐(2.25ml,24mmol)。反应经2小时逐渐升至室温,并继续搅拌24小时。将反应浓缩并将残余物通过反相hplc(c18柱,50×250mm,50ml/min,10-90%乙腈/水,45分钟)纯化,得到标题化合物(2.25g,88%产率),呈无定形白色固体。msesim/z:c26h43n4o6s[m+h]+计算值539.28,实测值539.28。
例133.(1r,3r)-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基-1-(4-(五氟苯甲酰基)噻唑-2-基)戊基酯
在0℃下,向2-((1r,3r)-1-乙酰氧基-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基-哌啶-2-甲酰胺基)戊酰胺的溶液)-4-甲基戊基)噻唑-4-羧酸(860mg,1.60mmol,1.0eq.)在二氯甲烷(20ml)的溶液中,加入五氟苯酚(440mg,2.40mmol,1.5eq.)和n,n'-二异丙基碳二亚胺(220mg,1.75mmol,1.1eq.)。将反应混合物升温至室温并搅拌过夜。减压除去溶剂后,将反应混合物用乙酸乙酯(20ml)稀释,然后经硅藻土过滤。浓缩滤液,在硅胶柱(上纯化1:10至1:3乙酸乙酯/二氯甲烷),得到标题化合物(935.3mg,82%产率),将其直接用于下一步骤。msesim/z:c32h42f5n4o6s[m+h]+计算值704.28,实测值704.60。
例134.2-((6s,9r,11r)-6-((s)-仲丁基)-13,13-二乙基-9-异丙基-2,3,3,8-四甲基-4,7-二氧代-12氧杂-2,5,8-三氮杂-13-硅杂十五烷-11-基)噻唑-4-羧酸乙酯的合成
将干燥pd/c(10wt%,300mg)和2-((1r,3r)-3-((2s,3s)-2-叠氮基-n,3-二甲基戊酰胺基)-4-甲基-1-乙基((三乙基甲硅烷基)氧基)戊基)噻唑-4-羧酸酯(3.33g,6.16mmol)加到五氟苯基2-(二甲基氨基)-2-甲基丙酸酯(约2.75g,1.5eq.)的乙酸乙酯溶液中。将反应混合物在氢气下搅拌27小时,然后通过硅藻土塞过滤,并用乙酸乙酯洗涤滤垫。将合并的有机相浓缩并通过柱层析法,用0-5%甲醇/乙酸乙酯溶液梯度洗脱,得到标题产物(3.24g,84%产率)。msesim/z:c31h59n4o5ssi[m+h]+计算值626.39,实测值626.95。
例135.2-((1r,3r)-3-((2s,3s)-2-(2-(二甲氨基)-2-甲基丙酰胺基)-n,3-二甲基戊酰胺)-1-羟基-4-甲基戊基)噻唑-4-羧酸乙酯的合成
将2-((6s,9r,11r)-6-((s)-仲丁基)-13,13-二乙基-9-异丙基-2,3,3,8-四甲基-4,7-二氧代-12-氧杂-2,5,8-三氮杂-13-硅杂十五烷-11-基)噻唑-4-羧酸乙酯(3.20g,5.11mmol)溶于脱氧的acoh/水/四氢呋喃(v/v/v3:1:1,100ml)中,并在室温下搅拌48小时。然后浓缩反应物并通过硅胶柱纯化(2:98至15:85甲醇/乙酸乙酯),得到标题化合物(2.33g,89%产率)。msesim/z:c25h45n4o5s[m+h]+计算值512.30,实测值512.45.
例136.2-((1r,3r)-3-((2s,3s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基戊酰胺)-1-羟基-4-甲基戊基)噻唑-4-羧酸的合成
在0℃,将lioh水溶液(0.4n,47.7ml,19.1mmol,4.0eq.)加入到2-((1r,3r)-3-((2s,3s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸酯(2.30克,4.50毫摩尔,1.0eq.)的二恶烷(50毫升)溶液中,将反应混合物在室温下搅拌2小时,然后浓缩。用硅胶柱纯化(先用100%ch2cl2,然后用二氯甲烷/甲醇/nh4oh80:20:1洗脱),得到标题化合物(2.13g,98%产率),为无定形固体。msesim/z:c23h41n4o5s[m+h]+计算值485.27,实测值485.55。
例137.2-((6s,9r,11r)-6-((s)-仲丁基)-9-异丙基2,3,3,8-四甲基-4,7,13-三氧代-12-氧杂-2,5,8-三氮杂十四烷-11-基)噻唑-4-羧酸的合成
在0℃下,向2-((1r,3r)-3-((2s,3s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基丙酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸(2.10g,4.33mmol)的吡啶(50ml)溶液中缓慢加入乙酸酐(2.25ml,24mmol)。2小时使反应混合物升温至室温,并在室温下搅拌24小时。将反应浓缩并将残余物通过反相hplc(c18柱,50mm×250,50ml/min,10-90%乙腈/水,45分钟)纯化,得到呈无定形白色固体的标题化合物(1.95g,86%产率)。msesim/z:c25h43n4o6s[m+h]+计算值526.28,实测值526.80。
例138.五氟苯基2-((6s,9r,11r)-6-((s)-仲丁基)-9-异丙基-2,3,3,8-四甲基-4,7,13-三氧代-12-氧杂2,5,8-三氮杂十四烷-11-基)噻唑-4-羧酸酯的合成
在0℃下,向2-((6s,9r,11r)-6-((s)-仲丁基)-9-异丙基2,3,3,8-四甲基-4,7,13-三氧代-12-氧杂-2,5,8-三氮杂十四烷-11-基)噻唑-4-羧酸(1.90g,3.61mmol,1.0eq.)的二氯甲烷(70ml)溶液中,加入五氟苯酚(1.00g,5.43mmol,1.5eq.)和n,n'-二异丙基碳二亚胺(512mg,3.96mmol,1.1eq.)。将反应混合物升温至室温并搅拌过夜。在减压下除去溶剂后,将反应混合物用乙酸乙酯(80ml)稀释,然后用硅藻土过滤。浓缩滤液,在硅胶柱上纯化(1:10至1:3乙酸乙酯/二氯甲烷),得到标题化合物(2.09mg,84%产率),将其直接用于下一步骤。msesim/z:c31h42f5n4o6s[m+h]+计算值693.27,实测值693.60。
例139.2-(三苯基亚正膦基)丙酸叔丁酯的合成
将2-溴代丙酸叔丁酯(15.5g,74.1mmol,1.0eq.)和三苯基膦(19.4g,74.1mmol,1.0eq.)在无水乙腈(45ml)中的混合物在室温下搅拌18小时。减压除去乙腈,加入甲苯使白色沉淀析出。倾倒出甲苯,将白色固体溶于二氯甲烷(100ml)中并转移至分液漏斗中。向漏斗中加入10%naoh(100ml),振荡后有机层立即变黄。将有机层分离,并将水层用二氯甲烷(30ml)萃取一次。将二氯甲烷层合并,用盐水(50ml)洗涤一次,然后用na2so4干燥,过滤并浓缩,得到叶立德,为黄色固体(16.8g,58%)。
例140.(s)-3-(4-(苄氧基)苯基)-2-((叔丁氧基羰基)氨基)丙酸甲酯的合成
向boc-l-tyr-ome(20.0g,67.7mmol,1.0eq.),k2co3(14.0g,101.6mmol,1.5eq.)和ki(1.12g,6.77mmol,0.1eq.)在丙酮(100ml)的混合物中缓慢加入bnbr(10.5ml,81.3mmol,1.2eq.)。然后,混合物回流过夜。加入水(250ml)并用乙酸乙酯(3×100ml)萃取。将合并的有机层用盐水(300ml)洗涤,经无水na2so4干燥,过滤,浓缩并通过硅胶柱层析法纯化(4:1正己烷/乙酸乙酯),得到白色固体(26.12g,99%产率)。1hnmr(500mhz,cdcl3)δ7.44–7.41(m,2h),7.41–7.36(m,2h),7.35–7.30(m,1h),7.04(d,j=8.5hz,2h),6.93–6.89(m,2h),5.04(s,2h),4.97(d,j=7.7hz,1h),4.55(d,j=6.9hz,1h),3.71(s,3h),3.03(dd,j=14.4,5.7hz,2h),1.44(d,j=18.6hz,10h);msesim/z:c22h27no5na[m+na]+计算值408.18,实测值408.11。
例141.(s)-(1-(4-(苄氧基)苯基)-3-氧代丙-2-基)氨基甲酸叔丁酯的合成
在-78℃时,1小时内向(s)-3-(4-(苄氧基)苯基)-2-((叔丁氧基羰基)氨基)-丙酸甲酯(26.1g,67.8mmol,1.0eq.)的无水二氯甲烷(450ml)溶液中加入dibal(1.0m正己烷溶液,163ml,2.2eq.)。将混合物在-78℃下搅拌3小时,然后用50ml乙醇淬灭。滴加1nhcl直至达到ph4。使得到的混合物升温至0℃,再进行分层,水层进一步用乙酸乙酯(3×100ml)萃取。将合并的有机溶液用盐水洗涤,经无水na2so4干燥并浓缩。用石油醚/乙酸乙酯打浆并过滤,得到标题化合物,为白色固体(18.3g,76%产率)。msesim/z:c22h27no5na[m+na]+计算值378.11,实测值378.11。
例142.(s,z)-叔丁基5-(4-(苄氧基)苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊-2-烯酸叔丁酯
将(s)-(1-(4-(苄氧基)苯基)-3-氧代丙-2-基)氨基甲酸叔丁酯(0.84g,2mmol,1.0eq.)溶解于无水二氯甲烷(50ml)中,向其中加入2-(三苯基-亚磷酰基)丙酸叔丁酯(1.6g,4mmol,2.0eq.),将溶液在室温下搅拌1.5小时,用tlc确定反应完成。通过柱层析法(10-50%乙酸乙酯/正己烷)纯化反应液,得到标题化合物(1.16g,98%产率)。
例143.(4r)-4-((叔丁氧基羰基)氨基)-5-(4-羟基苯基)-2-甲基戊酸叔丁酯的合成
将(s,z)-5-(4-(苄氧基)苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊-2-烯酸叔丁酯(467mg,1mmol)溶于甲醇(30ml)中,与pd/c催化剂(10wt%,250mg)混合,在室温下氢化(1atm)过夜。滤出催化剂,减压浓缩滤液,得到标题化合物(379mg,99%产率)。
例144.(4r)-4-((叔丁氧基羰基)氨基)-5-(4-羟基-3-硝基苯基)-2-甲基戊酸叔丁酯的合成
将(4r)-4-((叔丁氧基羰基)氨基)-5-(4-羟基苯基)-2-甲基戊酸叔丁酯(379mg,1mmol,1.0eq.)溶于四氢呋喃(20ml)中,向其中加入亚硝酸叔丁酯(315mg,3mmol,3.0eq.)的四氢呋喃(2ml)溶液。将反应物在室温下搅拌3小时,然后倒入水中,用乙酸乙酯(2×50ml)萃取,将合并的有机相用盐水(50ml)洗涤,用无水na2so4干燥,过滤并浓缩。通过柱层析法(10-50%乙酸乙酯/正己烷)纯化,得到标题化合物(300mg,71%产率)。
例145.(4r)-5-(3-氨基-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
将(4r)-4-((叔丁氧基羰基)氨基)-5-(4-羟基-3-硝基苯基)-2-甲基戊酸叔丁酯(200mg,0.47mmol)溶于乙酸乙酯(30ml)中,与钯催化剂(10%pd/c,100mg)混合并在室温下氢化(1atm)2小时。滤出催化剂,真空除去所有挥发物,得到标题化合物(185mg,99%)。msesim/z:c21h35n2o5[m+h]+计算值395.25,实测值395.26。
例146.(4r)-4-((叔丁氧基羰基)氨基)-5-(4-((叔丁基二甲基甲硅烷基)氧基)-3-硝基苯基)-2-甲基戊酸叔丁酯的合成
向(4r)-4-((叔丁氧基羰基)氨基)-5-(4-羟基-3-硝基苯基)-2-甲基戊酸叔丁酯(424mg,1mmol)的二氯甲烷(20ml)溶液中加入咪唑(408mg,6mmol)和叔丁基二甲基氯硅烷(602mg,4mmol)。在室温下持续搅拌所得溶液3小时。之后,反应混合物用盐水(50ml)洗涤,用无水na2so4干燥,浓缩并通过柱色谱法(10%至30%乙酸乙酯/正己烷)纯化,得到标题化合物(344mg,64%产率)。
例147.(4r)-5-(3-氨基-4-((叔丁基二甲基甲硅烷基)氧基)苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
将(4r)-4-((叔丁氧基羰基)氨基)-5-(4-((叔丁基二甲基甲硅烷基)氧基)-3-硝基苯基)-2-甲基戊酸叔丁酯(200mg,0.37mmol)溶于乙酸乙酯(30ml)中,与钯碳催化剂(10wt%,100mg)混合,并在室温氢化反应(1atm)2小时。滤出催化剂,真空除去所有挥发物,得到标题化合物(187mg,99%产率)。
例148.2-(1-叠氮基-14,17二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷酰胺基)-4-((2r)-5-(叔丁氧基)-2--((叔丁氧基羰基)氨基)-4-甲基-5-氧代戊基)苯基1-叠氮基-14,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷-18-酸酯的合成
向1-叠氮基-14,17-二甲基-12,15-二氧代-3,6,9-三氧杂-1,1,16-二氮杂十八烷-18-酸(1.50g,3.85mmol)和(4r)-叔丁基-5-(3-氨基-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸酯(0.75g,1.90mmol)的dma(40ml)溶液中加入edc(2.05g,10.67mmol)和dipea(0.70ml,4.0mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:5至1:1)洗脱,得到标题化合物(2.01g,82%产率,hplc纯度约95%)。msesim/z:c51h85n12o17[m+h]+计算值1137.61,实测值1137.90。
例149.(4r)-5-(22,23-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-3,6,39,42-四甲基-2,5,8,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,14,17,20,31,34,37,4,7,10,23,28,41,44]七氧杂-七氮杂环四十六烷-46-基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
将2-(1-叠氮基-14,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷酰胺基)-4-((2r)-5-(叔丁氧基)-2--((叔丁氧基羰基)氨基)-4-甲基-5-氧代戊基)苯基1-叠氮基-14,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷-18-酸酯(900mg,0.79mmol)溶于乙酸乙酯(30ml)中,与钯碳催化剂(10wt%,100mg)混合,并在室温下氢化反应(1atm)4小时。滤除催化剂并在真空下除去所有挥发物,得到2-(1-氨基-1,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷酰胺基)-4-((2r)-5-(叔丁氧基)-2-((叔丁氧基羰基)氨基)-4-甲基-5-氧代戊基)苯基1-氨基-1,17-二甲基-12,15-二氧代-3,6,9-三氧杂-13,16-二氮杂十八烷-18-酸酯(815mg,96%产量),无需进一步纯化即可使用。msesim/z:c51h88n8o17[m+h]+计算值1085.62,实测值1085.95。
将edc(1.25g,6.51mmol)和dipea(0.35ml,2.0mmol)加入到上述二氨基化合物(810mg,0.75mmol)和2,3-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)琥珀酸(231mg,0.75mmol)的dma(10毫升)溶液中。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:5至1:1)洗脱,得到标题化合物(844mg,83%产率,hplc纯度约95%)。msesim/z:c63h92n10o23[m+h]+计算值1357.63,实测值1357.95。
例150.(2r)-1-(22,23-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-3,6,39,42-四甲基-2,5,8,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,14,17,20,31,34,37,4,7,10,23,28,41,44]七氧杂-七氮杂环四十六烷-46-基)-4-羧基戊-2-铵的合成
将(4r)-5-(22,23-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-3,6,39,42-四甲基-2,5,8,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,14,17,20,31,34,37,4,7,10,23,28,41,44]七氧杂-七氮杂环四十六烷-46-基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(840mg,0.62mmol)溶解在二氯甲烷(6ml)和tfa(4ml)的混合物中。将混合物搅拌过夜,用甲苯(10ml)稀释,浓缩,得到标题化合物(7.43g,100%产率,hplc纯度约91%),其不经进一步纯化即用于下一步骤。msesim/z:c54h76n10o21[m+h]+计算值1200.51,实测值1200.95。
例151.(4r)-4-(2-((1r,3r)-1-乙酰氧基-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-基)甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(3-(3-(2-(2-叠氮基乙氧基)乙氧基)丙酰胺基)-4-羟基苯基)-2-甲基戊酸的合成
向(4r)-4-(2-((1r,3r)-1-乙酰氧基-3-((2s,3s)-n,3-(二甲基-2-((r)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(3-氨基-4-羟基苯基)-2-甲基戊酸(100mg,0.131mmol)(huangy.等,medchem.#44,249thacsnationalmeeting,denver,co,mar.22-26,2015;wo2014009774)的dma(10ml)和nah2po4缓冲溶液(ph7.5,1.0m,0.7ml)的混合溶液中,两小时内分四次加入2,5二氧代吡咯烷-1-基3(2(2叠氮基乙氧基)乙氧基)丙酸酯(80.0mg,0.266mmol)。将混合物搅拌过夜,浓缩并在制备型hplc(3.0×25cm,25ml/min)上纯化,在45分钟内用80%水/甲醇至10%水/甲醇洗脱,得到标题化合物(101.5mg,82%产率)。lc-ms(esi)m/z:c45h70n9o11s[m+h]+计算值944.48,实测值944.70。
例152.(4r)-4-(2-((1r,3r)-1-乙酰氧基-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基-戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(3-(3-(2-(2-氨基乙氧基)乙氧基)丙酰胺基)-4-羟基苯基)-2-甲基戊酸的合成
在氢化反应瓶中,向(4r)-4-(2-((1r,3r)-1-乙酰氧基-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-基)甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(3-(3-(2-(2-叠氮基乙氧基)乙氧基)丙酰胺基)-4-羟基苯基)-2-甲基戊酸(100.0mg,0.106mmol)的含有0.1%hcl的甲醇(25ml)溶液中,加入pd/c(25mg,10%pd,含水50%)。将容器中的空气抽真空后,加入35psi的氢气,将混合物振荡4小时,通过硅藻土过滤。将滤液浓缩并且在制备性hplc(3.0×25cm,25ml/min)上纯化,在45分钟内用85%水/甲醇至15%水/甲醇洗脱,得到标题化合物(77.5mg,79%产率)。lc-ms(esi)m/z:c45h72n7o11s[m+h]+计算值918.49,实测值918.60。
例153.(4r)-5-(4-乙酰氧基-3-硝基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
在0℃下,向(4r)-4-((叔丁氧基羰基)氨基)-5-(4-羟基-3-硝基苯基)-2-甲基戊酸叔丁酯(107.1mg,0.252mmol)的二氯甲烷(4.0ml)溶液中依次加入乙酸酐(0.11ml,1.17mmol)和三乙胺(0.16ml)。然后将反应物升温至室温并搅拌1小时,用二氯甲烷稀释并用水和盐水洗涤,用无水na2so4干燥,过滤并浓缩。通过柱层析(0-15%乙酸乙酯/石油醚)纯化残余物,得到无色油状物(120.3mg,理论产率)。msesim/z:c23h35n2o8[m+h]+计算值467.23,实测值467.23。
例154.(4r)-5-(4-乙酰氧基-3-氨基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
将(4r)-5-(4-乙酰氧基-3-硝基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(120.3mg,0.258mmol)溶于乙酸乙酯(5ml)和乙酸(0.5ml)中。向其中加入pd/c(10wt%,10mg),在室温下,在氢气球下搅拌该混合物30分钟,然后通过硅藻土垫过滤,并用乙酸乙酯洗涤硅藻土垫。将滤液浓缩并通过柱层析(0-25%乙酸乙酯/石油醚)纯化,得到黄色油状物(120.9mg,理论产量)。msesim/z:c23h37n2o6[m+h]+计算值437.26,实测值437.28。
例155.(4r)-5-(3-(4-(((苄氧基)羰基)氨基)丁酰胺基)-4-((叔丁基二甲基甲硅烷基)氧基)苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸乙酯
将2,5-二氧代吡咯烷-1-基4-(((苄氧基)羰基)氨基)丁酸叔丁酯(0.396g,1.2mmol)和(4r)-5-(3-氨基-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸乙酯(0.44g,1.2mmol)溶于乙醇(10ml)中,然后加入磷酸盐缓冲溶液(ph=7.5,0.1m,2ml)。反应混合物在室温下搅拌过夜,然后减压除去溶剂,并将残余物通过硅胶柱层析纯化,得到标题产物(0.485g,70%)。esim/z::c31h44n3o8[m+h]+计算值:586.31,实测值:586.31。
例156.(4r)-5-(3-(4-氨基丁酰胺基)-4-((叔丁基二甲基甲硅烷基)氧基)苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸乙酯的合成
将(4r)-5-(3-(4-(((苄氧基)羰基)氨基)丁酰胺基)-4-((叔丁基二甲基-甲硅烷基)氧基)苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸乙酯(0.35克,0.5mmol)溶于甲醇(5ml)中,然后加入pd/c(10wt%,35mg)。将反应混合物在室温下,在氢气球下搅拌过夜,然后通过硅藻土过滤,并将滤液减压浓缩,得到标题产物(0.22g,79%产率)。esimsm/z:c29h52n3o6si[m+h]+计算值:566.35,实测值:566.35。
例157.2-((6s,9s,12r,14r)-9-((s)-仲丁基)-14-羟基-6,12-二异丙基-2,2,5,11-四甲基-4,7,10-三氧代-3-氧杂-5,8,11-三氮杂十四烷-14-基)噻唑-4-甲酸
向boc-n-me-l-val-oh(33mg,0.14mmol)的乙酸乙酯溶液中加入五氟苯酚(39mg,0.21mmol)和dcc(32mg,0.154mmol)。将反应混合物在室温下搅拌16小时,然后用硅藻土过滤,用乙酸乙酯洗涤。将滤液浓缩并再溶解于dma(2ml)中,然后加入2-((1r,3r)-3-((2s,3s)-2-氨基-n,3-二甲基戊酰胺基)-1-羟基-4-甲基戊基)噻唑-4-羧酸(52mg,0.14mmol)和dipea(48.5μl,0.28mmol)。将反应混合物在室温下搅拌24小时,然后浓缩并通过反相hplc(c18柱,10-100%乙腈/水)纯化,得到标题化合物(40.2mg,49%产率)。esimsm/z::c28h49n4o7s[m+h]+计算值585.32,实测值585.32。
例158.2-((6s,9s,12r,14r)-9-((s)-仲丁基)-6,12-二异丙基-2,2,5,11-四甲基-4,7,10,16-四氧-3,15-二氧杂-5,8,11-三氮杂十七烷-11-基)噻唑-4-羧酸的合成
将2-((6s,9s,12r,14r)-9-((s)-仲丁基)-14-羟基-6,12-二异丙基-2,2,5,11-四甲基-4,7,10-三氧代-3-氧杂-5,8,11-三氮杂十四烷-14-基)噻唑-4-羧酸(40mg,0.069mmol)溶解在吡啶(8ml)中,在0℃时加入乙酸酐(20.4mg,0.2mmol),将反应混合物升温至室温,并搅拌过夜。浓缩混合物,通过硅胶柱纯化,用二氯甲烷/甲醇梯度洗脱,得到产物(48.1mg,约100%产率)。esimsm/z:c30h51n4o8s[m+h]+计算值627.33,实测值627.33。
例159.合成(4r)-4-(2-((6s,9s,12r,14r)-9-((s)-仲丁基)-6,12-二异丙基-2,2,5,11-四甲基-44,7,10,16-四氧代-3,15-二氧杂-5,8,11-三氮杂十七烷-14-基)噻唑-4-甲酰胺基)-2-甲基-5-苯基戊酸
向2-((6s,9s,12r,14r)-9-((s)-仲丁基)-6,12-二异丙基-2,2,5,11-四甲基-4,7,10,16-四氧-3,15-二氧杂-5,8,11-三氮杂十七烷-11-基)噻唑-4-羧酸(48.1mg,0.077mmol)的乙酸乙酯溶液中加入五氟苯酚(21.2mg,0.115mmol)和dcc(17.4mg,0.085mmol)。将反应混合物在室温下搅拌16小时,然后用硅藻土过滤,用乙酸乙酯洗涤。将滤液浓缩并再溶于dma(4ml)中,然后加入(4r)-4-氨基-2-甲基-5-苯基戊酸(20.7mg,0.1mmol)和dipea(26.8μl,0.154mmol)。反应混合物在室温下搅拌24小时,然后浓缩并通过反相hplc(c18柱,10-100%乙腈/水)纯化,得到标题化合物(63mg,约100%产率)。
例160.(4r)-4-(2-((3s,6s,9r,11r)-6-((s)-仲丁基)-3,9-二异丙基-8-甲基-4,7,13-三氧代-12-氧杂-2,5,8-三氮杂十四烷-11-基)噻唑-4-甲酰胺基)-2-甲基-5-苯基戊酸盐酸盐的合成
将(4r)-4-(2-((6s,9s,12r,14r)-9-((s)-仲丁基)-6,12-二异丙基-2,2,5,11-四甲基-44,7,10,16-四氧代-3,15-二氧杂-5,8,11-三氮杂十七烷-14-基)噻唑-4-甲酰胺基)-2-甲基-5-苯基戊酸(60mg,0.073mmol)溶解在乙酸乙酯(3ml)和氯化氢(0.8ml,12m)的混合溶液。将混合物搅拌30分钟并用甲苯(5ml)和二恶烷(5ml)稀释。浓缩混合物,然后与二恶烷(5ml)和甲苯(5ml)共浓缩至干,得到的标题产物粗品(57.1mg,103%产率),不经进一步纯化用于下一步。esimsm/z:c37h58n5o7s[m+h]+计算值716.40,实测值716.60。
例161.(4r)-5-(3-(2-(2-(((苄氧基)羰基)氨基)-丙酰胺基)乙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊叔丁酯的合成
将2-(2-(((苄氧基)羰基)氨基)丙酰胺基)乙酸(0.2g,0.7mmol),(4r)-5-(3-氨基-4-羟基苯基)-4-((将叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.19g,0.48mmol)和hatu(0.18g,0.48mmol)溶于二氯甲烷(20ml)中,然后加入tea(134μl,0.96mmol)。将反应混合物在室温下搅拌过夜,减压浓缩,残余物在硅胶柱上纯化,得到标题产物(0.3g,95%)。esim/z:c34h49n4o9[m+h]+计算值657.34,实测值657.34。
例162.(4r)-5-(3-(2-(2-氨基丙酰胺基)乙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
在氢化反应瓶中,将pd/c(0.1g,33wt%,含水50%)加入到(4r)-5-(3-(2-(2-(((苄氧基)羰基)氨基)-丙酰胺基)乙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.3g,0.46mmol)的甲醇(10ml)溶液中。将混合物在1atmh2下振荡过夜,然后通过硅藻土(助滤剂)过滤,浓缩滤液,得到标题化合物(0.21g,87%),不经进一步纯化用于下一步。esim/z:c26h43n4o7[m+h]+计算值523.31,实测值523.31。
例163.b-1(具有双链连接体的tubulysin片段)的合成
将(4r)-5-(3-(2-(2-氨基丙酰胺基)乙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.11g,0.2mmol),4,17-二氧代-4,7,10,21,24,27-六氧杂-13,18-二氮杂三十烷-15-炔-1,30-二酸(0.104g,0.2mmol),hatu(0.07g,0.2mmol)溶于二氯甲烷(10ml)中,然后加入tea(55ul,0.4mmol)。将反应混合物在室温下搅拌过夜,减压浓缩并在硅胶柱上纯化,得到产物b-1(0.046g,23%)。esim/z:c48h75n6o17[m+h]+计算值1007.51,实测值1007.52。
例164.b-2(具有双链连接体的tubulysin片段)的合成
向溶于二氯甲烷(1ml)的化合物b-1(0.046g,0.045mmol)中加入tfa(1ml),将反应混合物在室温下搅拌2小时,浓缩并与二氯甲烷/甲苯共浓缩,得到化合物b-2粗品(38.6mg,100%产率),不经进一步纯化用于下一步。esim/z:c39h59n6o15[m+h]+计算值851.40,实测值851.95。
例165.b-3(具有双链连接体的tubulysin类似物)的合成
向化合物b-2(38.6mg,0.045mmol)的dma(4ml)溶液中加入五氟苯基2-((6s,9r,11r)-6-((s)-仲丁基)-9-异丙基-2,3,3,8-四甲基-4,7,13-三氧-12-氧杂-2,5,8-三氮杂十四烷-11-基)噻唑-4-羧酸酯(31.14mg,0.045mmol),然后加入dipea(28μl,0.159mmol),将反应物搅拌过夜。浓缩溶液并通过反相hplc(c18柱,10mm×250mm,9ml/min)纯化,用mecn/h2o梯度(10%mecn至70%mecn,45分钟)洗脱,得到标题产物(7.9mg,13%产率)。esim/z:c64h99n10o20s[m+h]+计算值1359.67,实测值1359.62。
例166.(4r)-5-(3-(2-(((苄氧基)羰基)氨基)-3-甲基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
将(4r)-5-(3-氨基-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.2g,0.51mmol),2-(((苄氧基)羰基)氨基)-3-甲基丁酸(0.13g,0.51mmol),hatu(0.2g,0.51mmol)溶解在二氯甲烷(20ml)中,然后加入tea(110μl,0.8mmol)。将反应混合物在室温下搅拌过夜。然后减压除去溶剂,用硅胶柱纯化,得到标题产物(0.29g,90%产率)。esim/z:c34h50n3o8[m+h]+计算值628.35,实测值628.35。
例167.(4r)-5-(3-(2-氨基-3-甲基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
在氢化反应瓶中,将pd/c(0.1g,33wt%,含水50%)加入到(4r)-5-(3-(2-(((苄氧基)羰基)氨基)中-3-甲基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.29g,0.46mmol)的甲醇(10ml)溶液。将混合物在1atmh2下振荡过夜,然后通过硅藻土(助滤剂)过滤。浓缩滤液,得到标题化合物(0.23g,100%),不经进一步纯化用于下一步。esim/z::c26h44n3o6[m+h]+计算值494.64,实测值494.64。
例168.(4r)-5-(3-(2-(2-(((苄氧基)羰基)氨基)丙酰胺基)-3-甲基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基基)-2-甲基戊酸-叔丁酯的合成
将(4r)-叔丁基-5-(3-(2-氨基-3-甲基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸酯(0.23g,0.46mmol),2-(((苄氧基)羰基)氨基-丙酸(0.10g,0.46mmol)和hatu(0.18g,0.46mmol)溶解在二氯甲烷(20ml)中,然后加入tea(110μl,0.8mmol)。将反应混合物在室温下搅拌过夜,减压浓缩,然后在硅胶柱上纯化,得到标题产物(0.3g,95%)。esim/z:c37h55n4o9[m+h]+计算值699.39,实测值699.35。
例169.(4r)-5-(3-(2-(2-氨基丙酰胺基)-3-甲基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
在氢化反应瓶中,将pd/c(0.1g,33wt%,含水50%)加入到(4r)-5-(3-(2-(2-(((苄氧基)羰基)氨基)丙酰胺基)-3-甲基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基基)-2-甲基戊酸叔丁酯(0.3g,0.43mmol)的甲醇(10ml)溶液中。将混合物在1atm氢气下振荡过夜,然后通过硅藻土(助滤剂)过滤,浓缩滤液,得到标题化合物(0.22g,93%产率),不经进一步纯化用于下一步。esim/z:c29h49n4o7[m+h]+计算值565.35,实测值565.31。
例170.b-4(具有双链连接体的tubulysin片段)的合成
将(4r)-5-(3-(2-(2-氨基丙酰胺基)-3-甲基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.05g,0.09mmol),11,14-二氧代-4,7,18,21-四氧杂-10,15-二氮杂十二烷-12-炔-1,24-二酸(0.038g,0.09mmol),hatu(0.067g,0.18mmol)溶于二氯甲烷(10ml)中,然后加入tea(55μl,0.4mmol)。将反应混合物在室温下搅拌过夜,减压浓缩并在硅胶柱上纯化,得到产物b-4(0.01g,12%)。esim/z:c47h73n6o15[m+h]+计算值961.51,实测值961.52。
例171.b-5(具有双链连接体的tubulysin片段)的合成
将化合物b-4(0.01g,0.01mmol)溶于二氯甲烷(1ml)中,然后加入tfa(0.8ml)。将反应混合物在室温下搅拌2小时,浓缩,得到化合物b-5(10mg),不经进一步纯化直接用于下一步。esim/z:c38h56n6o13[m+h]+计算值804.39,实测值804.65。
例172.b-6(具有双链连接体的tubulysin类似物)的合成
向化合物b-5(约10mg)的dma(4ml)溶液中加入五氟苯基活化的化合物(6.92mg,0.01mmol)和dipea(3.4μl,0.02mmol)。将反应混合物搅拌过夜,浓缩并在hplc上纯化(c18柱,10mm×250mm),用mecn/h2o梯度(10%mecn至70%mecn,45分钟,9ml/min)洗脱,得到产物b-6(8.1mg,62%)。esim/z:c63h97n10o18s[m+h]+计算值1313.66,实测值1313.66。
例173.b-7(具有双链连接体的tubulysin片段)的合成
将(4r)-5-(3-(2-(2-氨基丙酰胺基)乙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.21g,0.4mmol),11,14-二氧代-4,7,18,21-四氧杂-10,15-二氮二十四烷-12-炔-1,24-二酸(0.17g,0.4mmol),hatu(0.15g,0.4mmol)溶于二氯甲烷(10ml)中,然后加入tea(110μl,0.8mmol)。将反应混合物在室温下搅拌过夜,减压浓缩并在硅胶柱上纯化,得到产物b-7(0.126g,34%)。esim/z:c44h67n6o15[m+h]+计算值919.46,实测值919.46。
例174.b-8(具有双链连接体的tubulysin片段)的合成
将化合物b-7(0.041g,0.045mmol)溶于二氯甲烷(1ml)中,然后加入tfa(1ml)。将反应混合物在室温下搅拌2小时,浓缩,得到化合物b-8,不经进一步纯化直接用于下一步。esim/z:c35h51n6o13[m+h]+计算值763.35,实测值763.80。
例175.b-9(具有双链连接体的tubulysin类似物)的合成
向化合物b-8(9.1mg,0.012mmol)的dma(1ml)溶液中加入五氟苯基活性化合物(8.3mg,0.012mmol)和dipea(1.4ul,0.008mmol)。将反应混合物搅拌过夜,浓缩并在hplc上(c18柱,10mmx250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至70%mecn,45分钟,9ml/min),得到标题产物b-9(4.7mg,31%)。esim/z:c60h91n10o18s[m+h]+计算值1271.62,实测值1271.62。
例176.(4r)-5-(3-(2-(((苄氧基)羰基)氨基)-丙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
将(4r)-5-(3-氨基-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.3g,0.76mmol),2-(((苄氧基)羰基)氨基丙酸(0.17g,0.76mmol),hatu(0.29g,0.76mmol)溶于二氯甲烷(20ml)中,然后加入tea(110μl,0.8mmol)。将反应混合物在室温下搅拌过夜,减压浓缩,然后在硅胶柱上纯化,得到标题产物(0.43g,95%)。esim/z:c32h46n3o8[m+h]+计算值600.32,实测值600.32。
例177.(4r)-5-(3-(2-氨基丙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
在氢化反应瓶中,将pd/c(0.1g,33wt%,含水50%)加入到(4r)-5-(3-(2-(((苄氧基)羰基)氨基)丙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.3g,0.5mmol)的甲醇(10ml)溶液中。将混合物在1atmh2下振动过夜,然后通过硅藻土(助滤剂)过滤。浓缩滤液,得到标题化合物(0.24g,100%),不经进一步纯化即用于下一步。esim/z:c24h40n3o6[m+h]+:计算值466.28,实测值466.28。
例178.(4r)-5-(3-(2-(2-(((苄氧基)羰基)氨基)-丙酰胺基)丙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
将(4r)-5-(3-(2-氨基丙酰胺基)-4-羟基苯基)-4-((叔丁氧基-羰基)氨基)-2-甲基戊酸叔丁酯(0.24g,0.5mmol),2-(((苄氧基)羰基)氨基)-丙酸(0.11g,0.5mmol)和hatu(0.2g,0.5mmol)溶解在二氯甲烷(20ml)中,然后加入tea(110μl,0.8mmol)。将反应混合物在室温下搅拌过夜,减压浓缩,然后在硅胶柱上纯化,得到标题产物(0.28g,85%)。esim/z:c35h51n4o9[m+h]+计算值671.36,实测值671.35。
例179.(4r)-5-(3-(2-(2-丙酰胺基)丙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
在氢化反应瓶中,将pd/c(0.028g,10wt%,含水50%)加入到(4r)-5-(3-(2-(2-(((苄氧基)羰基)氨基)丙酰胺基)丙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.28g,0.42mmol)的甲醇(10ml)溶液中。将混合物在1atmh2下振荡过夜,然后通过硅藻土(助滤剂)过滤。浓缩滤液,得到标题化合物(0.18g,100%),不经进一步纯化即用于下一步。esim/z:c27h45n4o7[m+h]+:计算值437.32,实测值437.31。
例180.b-10(具有双链连接体的tubulysin片段)的合成
将(4r)-5-(3-(2-(2-氨基丙酰胺基)丙酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.064g,0.12mmol),11,14-二氧代-4,7,18,21-四氧杂-10,15-二氮杂四环-12-炔-1,24-二酸(0.042g,0.097mmol)和hatu(0.073g,0.194mmol)溶于二氯甲烷(10ml)中,然后加入tea(27.5ul,0.2mmol)。将反应混合物在室温下搅拌过夜,减压浓缩,然后在硅胶柱上纯化,得到标题产物b-10(0.074g,82%)。esim/z:c45h69n6o15[m+h]+计算值933.47,实测值933.46。
例181.b-11(具有双链连接体的tubulysin片段)的合成
将化合物b-10(0.074g,0.08mmol)溶于二氯甲烷(1ml)中,然后加入tfa(1ml)。将反应物在室温下搅拌2小时,浓缩,得到化合物b-11,不经进一步纯化直接用于下一步。
例182.b-12(具有双链连接体的tubulysin类似物)的合成
向化合物b-11(62.08mg,0.08mmol)的dma(1ml)溶液中加入五氟苯基活性化合物(55.36mg,0.08mmol),然后加入dipea(27μl,0.16mmol),搅拌反应物过夜。然后浓缩溶液并通过hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至70%mecn,45分钟,9ml/min),得到标题产物b-12(20mg,20%)。esim/z:c60h91n10o18s[m+h]+计算值1285.63,实测值1285.63。
例183.b-13(具有双链连接体的tubulysin片段)的合成
将(4r)-5-(3-氨基-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.19g,0.48mmol),11,14-二氧代-4,将7,18,21-四氧杂-10,15-二氮杂四环-12-炔-1,24-二酸(0.173g,0.4mmol)和hatu(0.3g,0.8mmol)溶于二氯甲烷(50ml)中,然后加入tea(110μl,0.8mmol)。将反应混合物在室温下搅拌过夜,减压浓缩,然后在硅胶柱上纯化,得到标题产物b-13(0.25g,80%)。esim/z:c39h59n4o13[m+h]+计算值791.40,实测值791.40。
例184.b-14(具有双链连接体的tubulysin片段)的合成
将化合物b-13(0.1g,0.14mmol)溶于二氯甲烷(1ml)中,然后加入tfa(0.8ml)。将反应混合物在室温下搅拌2小时,然后浓缩,得到化合物b-14,不经进一步纯化直接用于下一步。
例185.b-15(具有双链连接体的tubulysin类似物)的合成
向化合物b-14(88.76mg,0.14mmol)的dma(1ml)溶液中加入五氟苯基活性化合物(96.88mg,0.14mmol),然后加入dipea(47.5ul,0.28mmol),将反应物搅拌过夜。然后浓缩溶液,并通过hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至70%mecn,45分钟,9ml/min),得到标题产物b-15(40mg,25%)。esim/z:c55h83n8o16s[m+h]+计算值1143.56,实测值1143.56。
例186.(4r)-5-(3-(4-(((苄氧基)羰基)氨基)-丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
将(4r)-5-(3-氨基-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.2g,0.5mmol),4-(((苄氧基)羰基)氨基)丁酸(0.12g,0.5mmol)和hatu(0.2g,0.5mmol)溶解在二氯甲烷(50ml)中,然后加入tea(110μl,0.8mmol)。将反应混合物在室温下搅拌过夜,减压浓缩,然后在硅胶柱上纯化,得到标题产物(0.26g,85%)。esim/z:c33h48n3o8[m+h]+:计算值614.34,实测值614.34。
例187.(4r)-5-(3-(4-氨基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯的合成
在氢化反应瓶中,将pd/c(0.028g,10wt%,含水50%)加入到(4r)-5-(3-(4-(((苄氧基)羰基)氨基)丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(0.09g,0.15mmol)的甲醇(10ml)溶液中。将混合物在1atmh2下振荡过夜,然后通过硅藻土(助滤剂)过滤。浓缩滤液,得到标题化合物(0.07g,100%),不经进一步纯化即用于下一步。esim/z:c25h42n3o6[m+h]+:计算值480.30,实测值480.31。
例188.b-16(具有双链连接体的tubulysin片段)的合成
将(4r)-5-(3-(4-氨基丁酰胺基)-4-羟基苯基)-4-((叔丁氧基羰基)-氨基)-2-甲基戊酸叔丁酯(39mg,0.08mmol),11,14-二氧代-4,7,18,21-四氧杂-10,15-二氮杂四环-12-炔-1,24-二酸(43mg,0.1mmol)和hatu(30.4mg,0.08mmol)溶于二氯甲烷(50ml)中,然后加入tea(110ul,0.8mmol)。将反应混合物在室温下搅拌过夜,减压浓缩,然后在硅胶柱上纯化,得到标题产物b-16(42mg,60%)。esim/z:c43h66n5o14[m+h]+计算值876.45,实测值876.40。
例189.b-17(具有双链连接体的tubulysin片段)的合成
将化合物b-16(17mg,0.019mmol)溶于二氯甲烷(0.8ml)中,然后加入tfa(0.5ml)。将反应混合物在室温下搅拌2小时,然后浓缩,得到化合物b-17(17mg,>100%),不经进一步纯化即用于下一步。esim/z:c34h50n5o12[m+h]+计算值720.34,实测值720.70。
例190.b-18(具有双链连接体的tubulysin类似物)的合成
向化合物b-17(13.6mg,0.019mmol)的dma(1ml)溶液中加入五氟苯基活性化合物(13mg,0.019mmol)和dipea(6.4μl,0.038mmol)。将反应混合物搅拌过夜,浓缩并通过hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至70%mecn,45分钟,9ml/min),得到标题产物b-18(9.9mg,42%)。esim/z:c59h90n9o17s[m+h]+计算值1228.61,实测值1228.60。
例191.(4r)-4-((叔丁氧基羰基)氨基)-5-(3-(4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酰胺基)-4-((4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酰基)氧基)苯基)-2-甲基戊酸叔丁酯的合成
将(4r)-5-(3-氨基-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(68mg,0.17mmol),4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酸(94.5mg,0.52mmol)和hatu(161.5mg,0.425mmol)溶解在二氯甲烷(50ml)中,然后加入tea(73ul,0.52mmol)。将反应混合物在室温搅拌过夜,减压浓缩,通过硅胶柱纯化,用乙酸乙酯/二氯甲烷(1:10)洗脱,得到标题产物(98mg,80%)。esim/z:c37h49n4o11[m+h]+计算值725.33,实测值725.34。
例192.(2r)-4-羧基-1-(3-(4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酰胺基)-4-((4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酰基)氧基)苯基)戊-2-铵三氟乙酸盐的合成
将(4r)-4-((叔丁氧基羰基)氨基)-5-(3-(4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酰胺基)-4-((4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酰基)氧基)苯基)-2-甲基戊酸叔丁酯(98mg,0.135mmol)溶于二氯甲烷(5ml),然后加入tfa(3ml)。将反应混合物在室温下搅拌2小时,然后浓缩,得到标题化合物(95mg,>100%产率),不经进一步纯化直接用于下一步。esim/z:c28h33n4o9[m+h]+计算值569.22,实测值569.60。
例193.(4r)-4-(2-((6s,9r,11r)-6-((s)-仲丁基)-9-异丙基-2,3,3,8-四甲基-4,7,13-三氧代-12-氧杂-2,5,8-三氮杂十四烷-11-基)噻唑-4-甲酰胺基)-5-(3-(4-(2,5-二氧代-2,5-二氢-1h-吡咯1-(异)酰胺基)-4-((4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酰基)氧基)苯基)-2-甲基戊酸(b-19)的合成
向(2r)-4-羧基-1-(3-(4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酰胺基)-4-((4-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丁酰基)氧基)苯基)戊-2-铵三氟乙酸盐(76.9mg,0.135mmol)的dma(1ml)溶液中,加入五氟苯基活性化合物(44mg,0.06mmol)和dipea(45.8μl,0.27mmol)。将反应混合物搅拌过夜,浓缩并通过hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至70%mecn,45分钟,9ml/min),得到标题产物b-19(37mg,55%)。esim/z:c53h73n8o14s[m+h]+计算值1077.49,实测值1077.50。
例194.(4r)-4-(叔丁氧基羰基)氨基)-5-(3-(3-(2-(2-(2-(2,5-二氧代-2,5-二氢-1h-)-叔丁基-4-叔丁酯吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酰胺基)-4-((3-(2-(2-(2-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基乙氧基)乙氧基)乙氧基)乙氧基)丙酰基)氧基)苯基)-2-甲基戊酸叔丁酯的合成
将(4r)-5-(3-氨基-4-羟基苯基)-4-((叔丁氧基羰基)氨基)-2-甲基戊酸叔丁酯(100mg,0.25mmol),3-(2-(2-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酸(75mg,0.25mmol)和hatu(190mg,0.5mmol)溶于二氯甲烷(50ml)中,然后加入tea(73ul,0.5mmol)。将反应混合物在室温下搅拌过夜,在减压下浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:3)洗脱,得到标题产物(180.1mg,75%)。esim/z:c47h69n4o17[m+h]+计算值961.45,实测值961.81。
例195.(2r)-4-羧基-1-(3-(3-(2-(2-(2-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酰胺基)-4-((3-(2-(2-(2-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酰基)氧基)苯基)戊-2-铵三氟乙酸盐的合成
将(4r)-4-((叔丁氧基羰基)氨基)-5-(3-(3-(2-(2-(2-(2,5-二氧代-2,5-二氢-1h-)-叔丁基吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酰胺基)-4-((3-(2-(2-(2-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酰基)氧基)苯基)-2-甲基戊酸叔丁酯(180.0mg,0.187mmol)溶于二氯甲烷(12ml)中,然后加入tfa(6ml)。将反应混合物在室温下搅拌2小时,然后浓缩,并与二氯甲烷/甲苯共浓缩至干,得到标题化合物(155mg,>100%产率),其不经进一步纯化即用于下一步骤。esim/z:c38h54n4o15[m+h]+计算值805.35,实测值805.60。
例196.(4r)-4-(2-((6s,9r,11r)-6-((s)-仲丁基)-9-异丙基2,3,3,8-四甲基-4,7,13-三氧代-12-氧杂-2,5,8-三氮杂十四烷-11-基)噻唑-4-甲酰胺基)-5-(3-(3-(2-(2-(2-(2,5-二氧代-2--1,5-二氢-1h-吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酰胺基)-4-((3-(2-(2-(2-(2,5-二氧代-2,5-二氢1h-吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酰基)氧基)苯基)-2-甲基戊酸(b-20)的合成
向(2r)-4-羧基-1-(3-(3-(2-(2-(2-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酰胺基)-4-((3-(2-(2-(2-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酰基)氧基)苯基)戊-2-铵三氟乙酸盐(43mg,0.06mmol)的dma(1ml)溶液中加入五氟乙酸活性酸化合物(48.5mg,0.06mmol)和dipea(34μl,0.2mmol)。将反应混合物搅拌过夜,浓缩并通过hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至70%mecn,45分钟,9ml/min),得到标题产物b-20(35mg,45%)。esim/z:c59h85n8o18s[m+h]+计算值1313.61,实测值1313.85。
例197.(4r)-5-(22,23-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-3,6,39,42-四甲基-2,5,8,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,14,17,20,31,34,37,4,7,10,23,28,41,44]七氮杂环四十六烷-46-基)-4-(2-((6s,9r,11r)-6-((s)-仲丁基)-9-异丙基-2,3,3,8-四甲基-4,7-13-三氧代-12-氧杂-2,5,8-三氮杂十一烷-11-基)噻唑-4-甲酰胺基)-2-甲基戊酸(b-21)的合成
向(2r)-1-(22,23-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-3,6,39,42四甲基-2,5,8-,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,1,118,20,20,31,34,37,4,7,10,23,28,41,44]七氧杂七氮杂环四十六烷-46-基)-4-羧戊烷-2-铵三氟乙酸盐(60mg,0.050mmol)的dma(1.5ml)溶液中加入五氟苯酚活性化合物(44mg,0.06mmol)和0.1mnah2po4(ph7.5,0.8ml)。将反应混合物搅拌过夜,浓缩并通过hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至70%mecn,45分钟,9ml/min),得到标题产物b-21(44mg,52%产率)。esim/z:c79h117n14o26s[m+h]+计算值1709.79,实测值1709.55。
例198.(4r)-4-(2-((4r,6r,9s,12s,15s,18s)-9-((s)-仲丁基)-6,12二异丙基-7,13,15,18-四甲基-2,8,11,14,17,20,23-七氧代-21-丙烯酰胺基-3-氧杂-7,10,13,16,19,22-六氮杂二十五烷-24炔-4-基)噻唑4-甲酰胺基)-2-甲基-5-苯基戊酸(b-22)的合成
在(4r)-4-(2-((3s,6s,9r,11r)-6-((s)-仲丁基)-3,9-二异丙基-8-甲基-4,7,13-三氧代-12-氧杂-2,5,8-三氮杂十四烷-11-基)噻唑-4-甲酰胺基)-2-甲基-5-苯基戊酸盐酸盐(25mg,0.034mmol)在dma(2ml)和0.1mna2hpo4ph8.0(1ml)的混合物中,3小时内分三批加入(s)-2,5-二氧代吡咯烷-1-基2-((s)-2-(2,2-二丙酰胺基-乙酰胺基)丙酰胺基)丙酸酯(23.1mg,0.053mmol),然后将混合物再搅拌12小时。浓缩混合物,并通过hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,45分钟,9ml/min),得到标题化合物(30.0mg,85%产率)。esimsm/z:c51h71n9o12s[m+h]+计算值1034.49,实测值1034.90。
例199.(4r)-4-(2-((1r,3r)-1-乙酰氧基-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-甲酰胺基)戊基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(4-羟基-3-(3-(2-(2-((双((z)-3-羧基丙烯酰肼基)磷酰基)氨基)乙氧基)乙氧基)-丙酰胺基)苯基)-2-甲基戊酸(b-23)的合成
在0℃下,向(z)-3-羧基丙烯酰肼盐酸盐(22.0mg,0.132mmol)在四氢呋喃(5ml)和dipea(10μl,0.057mmol)的混合物中加入pocl3(10.1mg,0.0665mmol)。在0℃下搅拌20分钟后,将混合物升温至室温并再搅拌4小时。然后向混合物中加入化合物(4r)-4-(2-((1r,3r)-1-乙酰氧基-3-((2s,3s)-n,3-二甲基-2-((r)-1-甲基哌啶-2-甲酰胺基)戊酰胺基)-4-甲基戊基)噻唑-4-甲酰胺基)-5-(3-(3-(2-(2-氨基乙氧基)乙氧基)丙酰胺基)-4-羟基苯基)-2-甲基戊酸(60mg,0.065mmol))和dipea(20μl,0.114mmol)。将混合物在50℃搅拌过夜,浓缩,并通过hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,40分钟,8ml/min),得到标题化合物(23.1mg,32%产率)。esimsm/z:c53h81n11o18ps[m+h]+计算值1222.51,实测值1222.80。
例200.(1r,3r)-1-(4-(((2r)-5-((2-氨基乙基)氨基)-1-(22,23-双(2,5-二氧代-2,5-二氢-1h-)-吡咯-1-基)-3,6,39,42-四甲基-2,5,8,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,14,17,20,31,34,37,4,7,10,23,28,41,44]七氧杂七氮杂环四十六烷-46基)-4-甲基-5-氧代戊-2-基)氨基甲酰基)噻唑-2-基)-3-((2s,3s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基戊酰胺基)-4-甲基戊基乙酸酯(b-24)的合成
将edc(15.0mg,0.078mmol),乙基-1,2-二胺盐酸盐(8.0mg,0.060mmol)和dipea(0.010ml,0.060mmol)加入到化合物b-21(22.0mg,0.0129mmol)的dma(1ml)溶液中。将混合物搅拌过夜,浓缩,并通过反相hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,40分钟,8ml/min),得到标题化合物(14.0mg,62%产率)。esimsm/z:c81h123n16o25s[m+h]+计算值1751.85,实测值1751.20。
例201.(1r,3r)-1-(4-(((28r)-1-氨基29-(22,23-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-3,6,39,42-四甲基-2,5,8,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,14,17,20,31,34,37,4,7,10,23,28,41,44]七氧杂七氮杂环四十六烷-46基)-26-甲基-25-氧代3,6,9,12,15,18,21-七氧杂-24-氮杂二十九烷-28-基)氨基甲酰基)噻唑-2-基)-3-((2s,3s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基戊酰胺基)-4-甲基戊基乙酸酯(b-25)的合成
向化合物b-21(22.0mg,0.0129mmol)的dma(1ml)溶液中加入edc(15.0mg,0.078mmol),3,6,9,12,15,18,21-七氧杂三十三烷-1,23-二胺盐酸盐(26.0mg,0.059mmol)和dipea(0.010ml,0.060mmol)。将混合物搅拌过夜,浓缩,并通过反相hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,40分钟,8ml/min),得到标题化合物(14.5mg,55%产率)。esimsm/z:c95h151n16o32s[m+h]+计算值2060.03,实测值2060.80。
例202.(1r,3r)-1-(4-(((28r)-27-(22,23-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-3,6-,39,42-四甲基-2,5,8,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,14,17,20,31,34,37,4,7,10,23,28,41,44]七氧杂七氮杂环四十六烷-46基)-1-羟基-26-甲基-25-氧代-3,6,9,12,15,18,21-七氧杂-24-氮杂二十九烷-28基)氨基甲酰基)噻唑-2-基)-3-((2s,3s)-2-(2-(二甲基氨基)-2-甲基丙酰胺基)-n,3-二甲基戊酰胺基)-4-甲基戊基乙酸酯(b-26)的合成
将edc(15.0mg,0.078mmol)和23-氨基-3,6,9,12,15,18,21-七氧杂二十三烷-1-醇(22.0mg,0.059mmol)加入到化合物b-21(22.0mg,0.0129mmol)的dma(1ml)溶液中。将混合物搅拌过夜,浓缩,并通过反相hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,40分钟,8ml/min),得到标题化合物(14.1mg,53%产率)。esimsm/z:c95h150n15o33s[m+h]+计算值2061.02,实测值2061.74。
例203.(2s)-2-((4r)-5-(22,23-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-3,6,39,42-四甲基-2,5,8,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,14,17,20,31,34,37,4,7,10,23,28,41,44]七氧杂七氮杂环四十六烷-46基)-4-(2-((6s,9r,11r)-6-((s)-仲丁基)-9-异丙基-2,3,3,8-四甲基-4,7,13-三氧代-12-氧杂-2,5,8-三氮杂十四烷-11-基)噻唑-4-甲酰胺基)-2-甲基戊酰胺基)-6-((叔丁氧基羰基)氨基)己酸叔丁酯(b-27)的合成
向化合物b-21(25.0mg,0.0146mmol)的dma(1ml)溶液中加入edc(15.0mg,0.078mmol)和(s)-2-氨基-6-((叔丁氧基羰基)氨基)己酸叔丁酯(9.0mg,0.030mmol)。将混合物搅拌过夜,浓缩,并通过反相hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,40分钟,8ml/min),得到标题化合物(20.5mg,71%产率)。esimsm/z:c94h144n16o29s[m+h]+计算值1994.00,实测值1994.85。
例204.(2s)-6-氨基-2-((4r)-5-(22,23-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-3,6,39,42-四甲基-2,5,8,21,24,37,40,43-八氧代-3,4,5,6,7,8,9,10,12,13,15,16,18,19,20,21,22,23,24,25,26,27,29,30,32,33,35,36,37,38,39,40,41,42,43,44-三十六氢-2h-苯并[b][1,14,17,20,31,34,37,4,7,10,23,28,41,44]七氧杂七氮杂环四十六烷-46基)-4-(2-((6s,9r,11r)-6-((s)-仲丁基)-9-异丙基2,3,3,8-四甲基4,7,13-三氧代-12-氧杂-2,5,8-三氮杂十四烷-11-基)噻唑-4-甲酰胺基)-2-甲基戊酰胺基)己酸(b-28)的合成
将化合物b-27(20.0mg,0.010mmol)溶于二氯甲烷(1ml)中,然后加入tfa(1ml)。将反应混合物在室温下搅拌2小时,然后浓缩,并通过反相hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,40分钟,8ml/min),得到标题化合物(13.5mg,73%产率)。esim/z:c85h129n16o27s[m+h]+计算值1837.89,实测值1838.20。
例205.(2s,4r)-4-羟基吡咯烷-2-羧酸甲酯盐酸盐的合成
在0至4℃下,向反式-4-羟基-l-脯氨酸(15.0g,114.3mmol)的无水甲醇(250ml)溶液中滴加氯化亚砜(17ml,231mmol)。将所得混合物在室温下过夜搅拌。浓缩,用乙醇/正己烷重结晶,得到标题化合物(18.0g,87%产率)。esimsm/z:168.2([m+na]+)。
例206.(2s,4r)-1-叔丁基2-甲基-4-羟基吡咯烷-1,2-二羧酸酯的合成
向(2s,4r)-4-羟基吡咯烷-2-羧酸甲酯盐酸盐(18.0g,107.0mmol)的甲醇(150ml)和碳酸氢钠溶液(2.0m,350ml)的混合物中加入boc2o(30.0g,137.6mmol)在4小时内分为三份。再搅拌4小时后,将反应混合物浓缩至约350ml并用乙酸乙酯(4×80ml)萃取。将合并的有机层用盐水(100ml)洗涤,干燥的(硫酸镁),过滤,浓缩并通过硅胶柱层析(1:1正己烷/乙酸乙酯)纯化,得到标题化合物(22.54g,86%产率)。esimsm/z:268.2([m+na]+)。
例207.(s)-1-叔丁基-2-甲基-4-氧代吡咯烷-1,2-二羧酸酯的合成
通过dess-martin氧化制备标题化合物可参考francomanfre等j.org.chem.1992,57,2060-2065。此外,也可使用swern的氧化,操作步骤如下:将草酰氯(13.0ml,74.38mmol)的二氯甲烷(350ml)溶液冷却至-78℃,加入无水dmso(26.0ml)。将溶液在-78℃下搅拌15分钟,然后将(2s,4r)-1-叔丁基-2-甲基-4-羟基吡咯烷-1,2-二羧酸酯(8.0g,32.63mmol)的二氯甲烷(100ml)溶液加入。在-78℃下搅拌2小时后,滴加三乙胺(50ml,180.3mmol),将反应溶液升温至室温。将混合物用nah2po4溶液稀释(1.0m,400ml),分层,用二氯甲烷(2×60ml)萃取水层,合并有机层,用硫酸镁干燥,过滤,浓缩并通过硅胶柱层析(7:3正己烷/乙酸乙酯)纯化,得到标题化合物(6.73g,85%产率)。esimsm/z:266.2([m+na]+)。
例208.(s)-1-叔丁基-2-甲基4-亚甲基吡咯烷-1,2-二羧酸酯的合成
在0℃下,向溴化甲基三苯基鏻(19.62g,55.11mmol)的四氢呋喃(150ml)悬浮液中加入叔丁醇钾(6.20g,55.30mmol)的无水四氢呋喃(80ml)溶液。在0℃下搅拌2小时后,将得到的黄色叶立德加入到(s)-1-叔丁基-2-甲基4-氧代吡咯烷-1,2-二羧酸酯(6.70g,27.55mmol)的四氢呋喃(40ml)溶液中。在室温下搅拌1小时,浓缩反应混合物,用乙酸乙酯(200ml)稀释,用水(150ml),盐水(150ml)洗涤,经硫酸镁干燥,浓缩并在硅胶柱层析上纯化(9:1正己烷/乙酸乙酯),得到标题化合物(5.77g,87%产率)。eimsm/z:264([m+na]+)。
例209.(s)-4-甲基吡咯烷-2-羧酸甲酯盐酸盐的合成
在4℃下,向(s)-1-叔丁基-2-甲基-4-亚甲基吡咯烷-1,2-二羧酸酯(5.70g,23.63mmol)的乙酸乙酯(40ml)溶液中加入盐酸(12m,10ml)。将混合物搅拌1小时,用甲苯(50ml)稀释,浓缩,之后用乙醇/正己烷重结晶,得到标题化合物,为盐酸盐(3.85g,92%产率)。eimsm/z:142.2([m+h]+)。
例210.(s)-2-(羟甲基)-4-亚甲基吡咯烷-1-羧酸叔丁酯的合成
在0℃下,向(s)-1-甲基-4-亚甲基吡咯烷-1,2-二甲酸叔丁酯(5.20g,21.56mmol)的无水四氢呋喃(100ml)溶液中加入lialh4(15ml,在四氢呋喃中2m)。在0℃下搅拌4小时后,通过加入甲醇(5ml)和水(20ml)淬灭反应。将反应混合物用1mhcl中和至ph7,用乙酸乙酯(80ml)稀释,通过硅藻土过滤,分离,水层用乙酸乙酯萃取。合并有机层,用硫酸钠干燥,浓缩并在硅胶柱色谱(1:5乙酸乙酯/二氯甲烷)上纯化,得到标题化合物(3.77g,82%产率)。eimsm/z:236.40([m+na]+)。
例211.(s)-(4-亚甲基吡咯烷-2-基)甲醇盐酸盐的合成
在4℃下,向(s)-2-(羟甲基)-4-亚甲基吡咯烷-1-羧酸叔丁酯(3.70g,17.36mmol)的乙酸乙酯(30ml)溶液中加入hcl(12m,10ml))。将混合物搅拌1小时,用甲苯(50ml)稀释,浓缩,并用乙醇/正己烷结晶,得到标题盐酸盐(2.43g,94%产率)。eimsm/z:115.1([m+h]+)。
例212.4-(苄氧基)-3-甲氧基苯甲酸的合成
向4-羟基-3-甲氧基苯甲酸(50.0g,297.5mmol)的乙醇(350ml)和氢氧化钠溶液(2.0m,350ml)的混合物中加入苄溴(140.0g,823.5mmol)。将混合物在65℃下搅拌8小时,浓缩,与水(2×400ml)共浓缩至约400ml,用6n盐酸酸化至ph3.0。过滤收集固体,用乙醇重结晶,在45℃下真空干燥,得到标题化合物(63.6g,83%产率)。esimsm/z:281.2([m+na]+)。
例213.4-(苄氧基)-5-甲氧基-2-硝基苯甲酸的合成
向4-(苄氧基)-3-甲氧基苯甲酸(63.5g,246.0mmol)二氯甲烷(400ml)和乙酸(100ml)溶液中加入发烟硝酸(25.0ml,528.5mmol)。将混合物搅拌6小时,浓缩,用乙醇结晶,在40℃下真空干燥,得到标题化合物(63.3g,85%产率)。esimsm/z:326.1([m+na]+)。
例214.(s)-(4-(苄氧基)-5-甲氧基-2-硝基苯基)(2-(羟甲基)-4-亚甲基吡咯烷-1-基)甲酮的合成
将催化量的dmf(30μl)加入到4-(苄氧基)-5-甲氧基-2-硝基苯甲酸(2.70g,8.91mmol)和草酰氯(2.0ml,22.50mmol)的无水二氯甲烷溶液中,将所得混合物在室温下搅拌2小时。用旋转浓缩仪除去过量的二氯甲烷和草酰氯。在n2条件下,0℃将乙酰氯重新悬浮在新鲜的二氯甲烷(70ml)中,并缓慢加入到预混合的((s)-(4-亚甲基吡咯烷-2-基)甲醇盐酸盐(1.32g,8.91mmol)和et3n(6ml)的二氯甲烷溶液中。将反应混合物升温至室温,继续搅拌8小时。除去二氯甲烷和et3n后,将残余物在水和乙酸乙酯(70/70ml)之间分配。用乙酸乙酯(2×60ml)进一步萃取水层。将合并的有机层用盐水(40ml)洗涤,干燥(硫酸镁)并浓缩。用快速硅胶柱层析(2:8正己烷/乙酸乙酯)纯化残余物,得到标题化合物(2.88g,76%产率)。eimsm/z:449.1([m+na]+)。
例215.(s)-(4-(苄氧基)-5-甲氧基-2-硝基苯基)(2-(((叔丁基二甲基硅烷基)氧基)甲基)-4-亚甲基吡咯烷-1-基)甲酮的合成
向(s)-(4-(苄氧基)-5-甲氧基-2-硝基苯基)(2-(羟甲基)-4-亚甲基吡咯烷-1-基)甲酮(2.78g,8.52mmol)在二氯甲烷(10ml)和吡啶(10ml)的混合物中,加入叔丁基氯二甲基硅烷(2.50g,16.66mmol)。将混合物搅拌过夜,浓缩并在硅胶柱上纯化,用乙酸乙酯/二氯甲烷(1:6)洗脱,得到标题化合物(3.62g,83%产率,纯度95%)。msesim/z:c27h37n2o6si[m+h]+计算值513.23,实测值513.65。
例216.(s)-(4-羟基-5-甲氧基-2-硝基苯基)(2-(羟甲基)-4-亚甲基吡咯烷-1-基)甲酮的合成
向(s)-(4-(苄氧基)-5-甲氧基-2-硝基苯基)(2-(羟甲基)-4-亚甲基吡咯烷-1-基)甲酮(2.80g,7.03mmol)在二氯甲烷(30ml)和甲磺酸(8ml)的混合物中,加入phsch3(2.00g,14.06mmol)。将混合物搅拌0.5小时,用二氯甲烷(40ml)稀释,小心地用0.1mna2co3溶液中和。分离混合物,用二氯甲烷(2×10ml)萃取水溶液。合并有机层,用na2so4干燥,浓缩并在硅胶柱上纯化,用甲醇/二氯甲烷(1:15至1:6)洗脱,得到标题化合物(1.84g,85%产率,约95%纯度)。msesim/z:c14h17n2o6[m+h]+计算值309.10,实测值309.30。
例217.(s)-((戊烷-1,5-二基二(氧基))双(5-甲氧基-2-硝基-4,1-亚苯基))二(((s)-2-(羟甲基)-4-亚甲基吡咯-1-基)甲酮)的合成
向(s)-(4-羟基-5-甲氧基-2-硝基苯基)(2-(羟甲基)-4-亚甲基吡咯烷-1-基)甲酮(0.801g,2.60mmol)的丁酮(10ml)溶液中,加入碳酸铯(2.50g,7.67mmol),然后加入1,5-二碘戊烷(415mmol,1.28mmol)。将混合物搅拌26小时,浓缩并在硅胶柱上纯化,用甲醇/二氯甲烷(1:15至1:5)洗脱,得到标题化合物(0.675g,77%产率,约95%纯度)。msesim/z:c33h41n4o12[m+h]+计算值685.26,实测值685.60。
例218.(s)-((戊烷-1,5-二基二(氧基))双(2-氨基-5-甲氧基-4,1-亚苯基))二(((s)-2-(羟甲基)-4-亚甲基吡咯-1-基)甲酮)的合成
在(s)-((戊烷-1,5-二基二(氧基))双(5-甲氧基-2-硝基-4,1-亚苯基))二(((s)-2-(羟甲基)-4-亚甲基吡咯-1-基)甲酮)(0.670g,0.98mmol)的甲醇(10ml)溶液中,加入na2s2o4(1.01g,5.80mmol)的h2o(8ml)溶液。将混合物在室温下搅拌超过30小时。浓缩反应混合物,并在高真空下与dma(2×10ml)和乙醇(2×10ml)共浓缩至干,得到含有无机盐的标题化合物(总重1.63g),其无需进一步纯化,直接用于下一步反应。eimsm/z:647.32([m+na]+)。
例219.c-1(具有双链连接体的pbd二聚体类似物)的合成
在0℃下,向含有吡啶(0.100ml,1.24mmol)的(3s,6s,39s,42s)-6,39-双(4-((叔丁氧基羰基)氨基)丁基)-22,23-双(2,5-二氧代-2,5-)二氢-1h-吡咯-1-基)-3,42-二((4-(羟甲基)苯基)氨基甲酰基)-5,8,21,24,37,40-六氧代-11,14,17,28,31,34-六氧杂-4,7,20,25,38,41-六氮杂四十四烷-1,44-二酸二叔丁酯的四氢呋喃(8ml)溶液中,滴加三光气(0.290mg,0.977mmol)的四氢呋喃(3.0ml)溶液。将反应混合物在0℃下搅拌15分钟,然后直接用于下一步骤。
在0℃下,向含有无机盐的(s)-((戊烷-1,5-二基二(氧基))双(2-氨基-5-甲氧基-4,1-亚苯基))二(((s)-2-(羟甲基)-4-亚甲基吡咯-1-基)甲酮(0.842mg,约0.49mmol)的乙醇(10ml)悬浮液中,加入前述四氢呋喃溶液。将混合物在0℃下搅拌4小时,然后升温至室温1小时,浓缩,并通过反相hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,40分钟,8ml/min),得到标题化合物(561.1mg,三步产率48%)。
例220.c-2(具有双链连接体的pbd二聚体类似物)的合成
在0℃下,将戴斯-马丁试剂(138.0mg,0.329mmol)加入到化合物c-1(132.0mg,0.055mmol)的二氯甲烷(5.0ml)溶液中。将反应混合物升温至室温并搅拌2小时。然后加入饱和nahco3/na2so3溶液(5.0ml/5.0ml),用二氯甲烷(3×25ml)萃取混合物。将合并的有机层用nahco3/na2so3(5.0ml/5.0ml),盐水(10ml)洗涤,用na2so4干燥,过滤,浓缩并用反相hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,40分钟,8ml/min),得到标题化合物(103.1mg,78%产率),为泡沫状物。esimsm/z:c117h158n16o38[m+h]+计算值2396.09,实测值2396.65。
例221.c-3(具有双链连接体的pbd二聚体类似物)的合成
将c-2化合物(55.0mg,0.023mmol)溶于二氯甲烷(3ml)中,然后加入tfa(3ml)。将反应混合物在室温下搅拌2小时,然后浓缩,并与二氯甲烷/甲苯共浓缩至干,得到粗产物c-3(48.0mg,100%产率,hplc纯度92%),通过反相hplc(c18柱,10mm×250mm)纯化,用mecn/h2o梯度洗脱(10%mecn至100%mecn,40分钟,8ml/min),得到c-3(42.1mg,88%产率,96%纯度),为泡沫状固体。esimsm/z:c99h126n16o34[m+h]+计算值2083.86,实测值2084.35。
例222.(s)-1-(4-(苄氧基)-5-甲氧基-2-硝基苯甲酰基)-4-亚甲基吡咯烷-2-羧酸甲酯的合成
将催化量的dmf(30μl)加入到4-(苄氧基)-5-甲氧基-2-硝基苯甲酸(2.70g,8.91mmol)和草酰氯(2.0ml,22.50mmol)的无水二氯甲烷溶液中,将所得混合物在室温下搅拌2小时。用旋转浓缩仪除去过量的二氯甲烷和草酰氯。在n2条件下,0℃将乙酰氯重新悬浮在新鲜的二氯甲烷(70ml)中,并缓慢加入到预混合的(s)-4-亚甲基吡咯烷-2-羧酸甲酯盐酸盐(1.58g,8.91mmol)和et3n(6ml)的二氯甲烷溶液中。将反应混合物升温至室温,继续搅拌8小时。除去二氯甲烷和et3n后,将残余物在水和乙酸乙酯(70/70ml)之间分配。用乙酸乙酯(2×60ml)进一步萃取水层。将合并的有机层用盐水(40ml)洗涤,干燥(硫酸镁)并浓缩。用快速硅胶柱层析(2:8正己烷/乙酸乙酯)纯化残余物,得到标题化合物(2.88g,76%产率)。eimsm/z:449.1([m+na]+)。
例223.(s)-1-(4-(苄氧基)-5-甲氧基-2-硝基苯甲酰基)-4-亚甲基吡咯烷-2-甲醛的合成
在-78℃和n2条件下,剧烈搅拌(s)-1-(4-(苄氧基)-5-甲氧基-2-硝基苯甲酰基)-4-亚甲基吡咯烷-2-羧酸甲酯(2.80g,6.57mmol)的无水二氯甲烷(60ml)溶液并滴加dibal-h(1n二氯甲烷溶液,10ml)。将混合物再搅拌90分钟后,加入2ml甲醇和5%盐酸(10ml)淬灭反应。将所得混合物升温至0℃,分离各层,水层进一步用二氯甲烷(3×50ml)萃取。将合并的有机层用盐水洗涤,干燥(硫酸镁)并浓缩。用快速硅胶柱层析(95:5氯仿/甲醇)纯化残余物,得到标题化合物(2.19g,84%产率)。eimsm/z:419.1([m+na]+)。
例224.(s)-8-(苄氧基)-7-甲氧基-2-亚甲基-2,3-二氢-1h-苯并[e]-吡咯并[1,2-a]吖庚因-5(11ah)-酮的合成
将(s)-1-(4-(苄氧基)-5-甲氧基-2-硝基苯甲酰基)-4-亚甲基吡咯烷-2-甲醛(2.18g,5.50mmol)和na2s2o4(8.0g,45.97mmol)的四氢呋喃(60ml)和水(40ml)的混合物在室温下搅拌20小时。在高真空下除去溶剂。将残余物重新悬浮在甲醇(60ml)中,逐滴加入盐酸(6m)直至达到ph2。将所得混合物在室温下搅拌1小时,去除甲醇后用乙酸乙酯(100ml)稀释。用饱和nahco3水溶液和盐水洗涤乙酸乙酯溶液,干燥(硫酸镁)并浓缩。用快速硅胶柱层析(97:3氯仿/甲醇)纯化残余物,得到标题化合物(1.52g,80%)。eimsm/z:372.1([m+na]+)。
例225.(s)-8-羟基-7-甲氧基-2-亚甲基-2,3-二氢-1h-苯并[e]-吡咯并[1,2-a]氮杂-5(11ah)-酮的合成
在0℃下,向(s)-8-(苄氧基)-7-甲氧基-2-亚甲基-2,3-二氢-1h-苯并[e]-吡咯并[1,2-a]氮杂卓-5(11ah)-酮(1.50g,4.32mmol)的二氯甲烷(70ml)溶液中加入25ml的甲磺酸。将混合物在0℃下搅拌10分钟,然后在室温下搅拌2小时。用二氯甲烷稀释,用冷的1.0n碳酸氢钠调节ph至4并过滤。用二氯甲烷(3×60ml)萃取水层。合并有机层,用无水硫酸钠干燥,过滤,浓缩并在硅胶柱层析(甲醇/二氯甲烷1:15)上纯化,得到811mg(73%产率)标题产物。ei-msm/z:281.1([m+na]+)。
例226.(11as,11a's)-8,8'-(戊烷-1,5-二基双(氧))二(7-甲氧基-2-亚甲基-2,3-二氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂卓-5(11ah)-酮)的合成
向搅拌的碳酸铯(0.761g,2.33mmol)的丁酮(8ml)悬浮液中加入(s)-8-羟基-7-甲氧基-2-亚甲基-2,3-二氢-1h-苯并[e]吡咯[1,2-a]氮杂-5(11ah)-酮(401mg,1.55mmol)和1,5-二碘戊烷(240mg,0.740mmol)。将混合物在室温下搅拌过夜,浓缩,并在硅胶柱上纯化(乙酸乙酯/二氯甲烷1:10),得到337mg(78%产率)标题产物。eimsm/z:607.2([m+na]+)。
例227.(s)-7-甲氧基-8-((5-((s)-7-甲氧基-2-亚甲基-5-氧代-2,3,5,10,11,11a-六氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-8-基)氧基)戊基)氧基)-2-亚甲基-2,3-二氢-1h-苯并[e]吡咯并[1,22-a][1,4]二氮杂卓-5(11ah)-酮的合成
在0℃下,向(11as,11a’s)-8,8’-(戊烷-1,5-二基双(氧))双(7-甲氧基-2-亚甲基-2,3-二氢-1h-苯并[e]吡咯烷[1,2-a][1,4]二氮杂-5(11ah)-酮)(150mg,0.256mmol)的无水二氯甲烷(1ml)和无水乙醇(1.5ml)的溶液中加入硼氢化钠的甲氧基乙醚(85μl,0.5m,0.042mmol)混合物。5分钟后除去冰浴,将混合物在室温下搅拌3小时,然后冷却至0℃,用饱和氯化铵淬灭,用二氯甲烷稀释,并分层。将有机层用盐水洗涤,用无水硫酸钠干燥,通过硅藻土过滤并浓缩。通过反相hplc(c18,乙腈/水)纯化残余物。用二氯甲烷萃取合适的组分并浓缩,得到标题化合物(64.7mg,43%),msm/z:609.2([m+na]+),625.3([m+k]+)和627.2([m+na+h2o]+);完全还原的化合物(16.5mg,11%),msm/z:611.2([m+na]+),627.2([m+k]+),629.2([m+na+h2o]+);回收未反应的原料(10.2mg,7%),msm/z:607.2([m+na]+),625.2([m+na+h2o]+)。
例228.(s)-8-((5-(((s)-10-(3-(2-(2-叠氮基乙氧基)乙氧基)丙酰基)-7-甲氧基-2-亚甲基-5-氧代-23,5,10,11,11a六氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-8-基)氧基)戊基)氧)-7-甲氧基-2-亚甲基-2,3-二氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-5(11ah)-酮的合成
向(s)-7-甲氧基-8-((5-(((s)-7-甲氧基-2-亚甲基-5-氧代-2,3,5,10,11,11a-六氢)-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-8-基)氧基)戊基)氧基)-2-亚甲基-2,3-二氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-5(11ah)-酮(60.0mg,0.102mmol)和2,5-二氧代吡咯烷-1-基3-(2-(2-叠氮基乙氧基)乙氧基)丙酸酯(40.5mg,0.134mmol)的二氯甲烷(5ml)的混合物中加入edc(100.5mg,0.520mmol)。将混合物在室温下搅拌过夜,浓缩并在硅胶柱上纯化(乙酸乙酯/二氯甲烷,1:6),得到63.1mg(81%产率)标题产物。esimsm/z:c40h50n7o9[m+h]+计算值772.36,实测值772.30。
例229.(s)-8-((5-((s)-10-(3-(2-(2-氨基乙氧基)乙氧基)丙酰基)-7-甲氧基-2-亚甲基-5-氧代-23,5,10,11,11a六氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-8-基)氧基)戊基)氧)-7-甲氧基-2-亚甲基-2,3-二氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-5(11ah)-酮的合成
向(s)-8-((5-(((s)-10-(3-(2-(2-叠氮基乙氧基)乙氧基)丙酰基)-7-甲氧基-2-亚甲基-5-氧代-2,3,5,10,11,11a六氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-8-基)氧基)戊基)氧基)-7-甲氧基-2-亚甲基-2,3-二氢-1h-苯并[e]吡咯并[1,2-a][1,4]二氮杂-5(11ah)-酮(60mg,0.078mmol)的四氢呋喃(5ml)和na2hso4缓冲溶液(ph7.5,1.0m,0.7ml)的混合物中加入pph3(70mg,0.267mmol)。将混合物在室温下搅拌过夜,浓缩后在制备hplc上纯化,用水/乙腈(35分钟,从90%水至35%水)洗脱,在高真空下干燥后得到45.1mg(79%产率)标题产物。esimsm/z:c40h52n5o9[m+h]+计算值746.37,实测值746.50。
例230.(s)-n-(2-((s)-8-((5-(((11s,11as)-10-((s)-15-叠氮基-5-异丙基-4,7-二氧代-10,13-二氧杂-3,6-二氮杂十七烷-1-酰基)-11-羟基-7-甲氧基-2-亚甲基-5-氧代-2,3,5,10,11,11a-六氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-8-基)氧基)戊基)-氧基)-7-甲氧基-2-亚甲基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-10(5h)-基)-2-氧代乙基)-2-(3-(2-(2-叠氮基乙氧基)乙氧基)丙酰胺基)-3-甲基丁酰胺的合成
向(s)-7-甲氧基-8-((5-(((s)-7-甲氧基-2-亚甲基-5-氧代2,3,5,10,11,11a六氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-8-基)氧基)戊基)氧基)-2-亚甲基-2,3-二氢-1h-苯并[e]吡咯并[1,2a][1,4]二氮杂-5(11ah)-酮(60.0mg,0.102mmol)和(s)-15-叠氮基-5-异丙基-4,7-二氧代-10,13-二氧杂-3,6-二氮杂十七-1-酸(90.2mg,0.25mmol)在dma(8毫升)的混合物中,加入brop(240.2mg,0.618mmol)。在室温下搅拌该混合物过夜,浓缩并在硅胶柱色谱(甲醇/二氯甲烷,1:10至1:5)上纯化,得到97.1mg(74%产率)标题产物。esimsm/z:c61h87n14o17[m+h]+,计算值1287.63,实测值1287.95。
例231.(s)-n-(2-((s)-8-((5-(((11s,11as)-10-((s)-15-氨基-5-异丙基-4,7-二氧代10,13-二氧杂-3,6-二氮杂十七烷-1-酰基)-11-羟基-7-甲氧基-2-亚甲基-5-氧代2,3,5,10,11,11a六氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-8-基)氧基)戊基)氧基)-7-甲氧基-2-亚甲基-5-氧代2,3,11,11a四氢1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-10(5h)-基)-2-氧代乙基)-2-(3-(2-(2-氨基乙氧基)乙氧基)-丙酰胺基)-3-甲基丁酰胺(c-4)的合成
向(s)-n-(2-((s)-8-((5-(((11s,11as)-10-((s)-15-叠氮基-5-异丙基-4,7)的溶液二氧代-10,13-二氧杂-3,6-二氮杂十七烷-1-酰基)-11-羟基-7-甲氧基-2-亚甲基-5-氧代2,3,5,10,11,11a六氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-8-基)氧基)戊基)-氧基)-7-甲氧基-2-亚甲基-5-氧代-2,3,11,11a四氢-1h-苯并[e]吡咯并[1,2,2-a][1,4]二氮杂-10(5h)-基)-2-氧代乙基)-2-(3-(2-(2-叠氮基乙氧基)乙氧基)丙酰胺基)-3-甲基丁酰胺(85mg,0.066mmol)在四氢呋喃(5ml)和nah2po4缓冲溶液(ph7.5,1.0m,0.7ml)的混合物中加入pph3(100mg,0.381mmol)。将混合物在室温下搅拌过夜,经lc-ms确认形成(s)-n-(2-((s)-8-((5-(((11s,11as)-10-((s)-15-氨基-5-异丙基)-4,7-二氧代-10,13-二氧杂-3,6-二氮杂十七烷-1-酰基)-11-羟基-7-甲氧基-2-亚甲基-5-氧代-2,3,5,10,11,11a-六氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-8-基)氧基)戊基)氧)-7-甲氧基-2-亚甲基-5-氧代-2,3,11,11a-四氢-1h-苯并[e]吡咯并[1,2-α][1,4]二氮杂-10(5h)-基)-2-氧代乙基)-2-(3-(2-(2-氨基乙氧基)乙氧基)丙酰胺基)-3-甲基丁酰胺(esimsm/z:c61h90n10o17[m+na]+,计算值1257.66,实测值1257.90)后,加入双(2,5-二氧代吡咯烷-1-基)2,3-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)琥珀酸酯(33mg,0.066mmol)。将混合物继续搅拌4小时,浓缩后在制备型hplc上纯化,用水/ch3cn(从90%水至30%水,35分钟)洗脱,在高真空下干燥后,得到40.1mg(40%产率)标题产物c-4。esimsm/z:c73h95n12o23[m+h]+,计算值1507.66,实测值1507.90。
例232.硝基-α-鹅膏毒素的合成
在0℃下,向α-鹅膏毒素(15.0mg,0.0163mmol)的乙酸(0.5ml)和二氯甲烷(1ml)溶液中加入70%hno3(0.3ml)。将反应在0℃下搅拌1小时,然后在室温下搅拌2小时。加入水(5ml)和dma(4ml),将混合物浓缩并通过制备型hplc(h2o/mecn)纯化,得到浅黄色固体(9.8mg,62%产率)。esimsm/z:c39h54n11o16s[m+h]+计算值963.34,实测值964.95。
例233.硝基-β-鹅膏毒素的合成
在0℃下,向β-鹅膏毒素(15.0mg,0.0163mmol)的乙酸(0.5ml)和二氯甲烷(1ml)溶液中加入70%hno3(0.3ml)。将反应在0℃下搅拌1小时,然后在室温下搅拌2小时。加入水(5ml)和dma(4ml),将混合物浓缩并通过制备型hplc(h2o/mecn)纯化,得到浅黄色固体(9.8mg,62%产率)。esimsm/z:c39h53n10o17s[m+h]+计算值965.32,实测值965.86。
例234.具有双链连接体的可缀合的α-鹅膏毒素类似物(d-1)的合成
向硝基-α-鹅膏毒素(9.0mg,0.0093mmol)的dma(1ml)溶液中加入pd/c(3mg,10wt%,含水50%),然后在室温下氢化(1atm)6小时。滤除催化剂,然后加入0.1mnah2po4(0.5ml,ph7.5)和双(2,5-二氧代吡咯烷-1-基)21,22-双(2,5-二氧代-2,5-二氢--1h-吡咯-1-基)-2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-1,42-二酸酯(11.0mg,0.0092mmol)。将混合物在室温下搅拌过夜,浓缩后在制备性hplc上纯化,用水/ch3cn(35分钟,从90%水至30%水)洗脱,在高真空下干燥后得到6.1mg(35%产率)标题产物d-1。esimsm/z:c81h116n19o31s[m+h]+,计算值1882.77,实测值1882.20。
例235.具有双链连接体的可偶联的α-鹅膏毒素类似物(d-1)的合成
向硝基-β-鹅膏毒素(9.0mg,0.0093mmol)的dma(1ml)溶液中加入pd/c(3mg,10wt%,含水50%),然后在室温下氢化(1atm)6小时。滤除催化剂,然后加入0.1mnah2po4(0.5ml,ph7.5)和双(2,5-二氧代吡咯烷-1-基)21,22-双(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-2,5,38,41-四甲基-4,7,20,23,36,39-六氧代-10,13,16,27,30,33-六氧杂-3,6,19,24,37,40-六氮杂四十二烷-1,42-二酸酯(11.0mg,0.0092mmol)。将混合物在室温下搅拌过夜,浓缩并在制备性hplc上纯化,用水/ch3cn(35分钟,从90%水至30%水)洗脱,在高真空下干燥后得到(7.0mg,40%产率)标题产物d-2。esimsm/z:c81h115n18o32s[m+h]+,计算值1883.76,实测值1884.10。
例236.偶联物的一般制备方法。
向2.0ml10mg/mlph6.0-8.0的her2抗体混合物中分别加入0.70-2.0ml100mmnah2po4缓冲液,ph6.5-8.5缓冲液,tcep(16-20μl,20mm水溶液)和化合物a-3,a-4,a-5,b-3,b-6,b-9,b-12,b-15,b-18,b-19,b-20,b-21,b-22,b-23,b-24,b-25,b-26,b-28,c-3,c-4,d-1或d-2(28-32μl,20mmdma溶液)。将混合物在室温下温育
其中n=2.0-4.5。
例237.与t-dm1对比,偶联物a-3a,a-4a,a-5a,b-3a,b-6a,b-9a,b-12a,b-15a,b-18a,b-19a,b-20a,b-21a,b-22a,b-23a,b-24,b-25,b-26,b-28,c-3a,c-4a,d-1a和d-2a的体外细胞毒性评价:
用于细胞毒性测定的细胞系是人胃癌细胞系nci-n87,细胞在含有10%fbs的rpmi-1640中生长。测定时,将细胞(180μl,6000个细胞)加入到96孔板中的每个孔中,并在37℃,5%co2下温育24小时。接下来,在适当的细胞培养基里,用不同浓度的测试化合物(20μl)处理细胞(总体积,0.2ml)。对照孔含有细胞和培养基但无测试化合物。将孔板在37℃和5%co2下温育120小时,然后向孔中加入mtt(5mg/ml)(20μl),并将孔板在37℃下孵育1.5小时。小心去除培养基,然后加入dmso(180μl),振荡15分钟,在490nm和570nm处测量吸光度,620nm为参考。依照以下公式计算抑制率:抑制率%=[1-(分析值-空白对照值)/(控制值-空白对照值)]×100
细胞毒性结果(ic50):
例238.体内抗肿瘤活性(携带nci-n87异种移植肿瘤的balb/c裸鼠)。
在人胃癌n-87细胞系肿瘤异种移植模型中评估了偶联物a-3a,b-6a,b-12a,b-15a,b-18a,b-20a,b-21a,b-24a,b-28a,c-3a和d-2a以及t-dm1的体内疗效。在五周龄的雌性balb/c裸鼠(104只动物)右肩下用0.1ml无血清培养基中的n-87癌细胞(5×106个细胞/小鼠)进行皮下接种。肿瘤生长8天至平均大小110mm3。然后将动物随机分成13组(每组8只动物)。第一组小鼠用作对照组,注射磷酸缓冲盐水(pbs)载体。10组分别用偶联物a-3a,b-6a,b-12a,b-15a,b-18a,b-20a,b-21a,b-24a,b-28a和t-dm1静脉注射,剂量3mg/kg。剩余2组用偶联物c-3a和d-1a静脉注射,剂量1mg/kg。每4天测量一次肿瘤的三维尺寸,并使用公式:肿瘤体积=1/2(长×宽×高)计算肿瘤体积。同时还测量了动物的体重。当满足下列任何一项标准时,处死小鼠:(1)体重减少超过处理前体重的20%,(2)肿瘤体积大于2000mm3,(3)病情严重无法进食或(4)皮肤坏死。如果肿瘤无法被感知,则认为小鼠是无肿瘤的。
试验结果绘制在图47中。所有13种偶联物都不会导致动物体重减轻。在第50天,由于肿瘤体积大于1800mm3且小鼠十分虚弱,处死对照组的动物。所有的测试12种偶联物均显示出抗肿瘤活性。偶联化合物b-24a,c-3a,b-20a,b-21a和d-20a组表现出比t-dm1更好的抗肿瘤活性。然而,偶联物b-18a,b-15a,a-3a,b-6a,b-28a和b-12a组的抗肿瘤活性比t-dm1更差。剂量为3mg/kg的t-dm1抑制肿瘤生长28天,但其在测试期间无法完全去除肿瘤,而从第15天至第43天,偶联物b-20a,b-21a和d-20a可以完全去除一些动物的肿瘤。这些剂量下抑制肿瘤生长的情况如下:
在实验结束时(第50天),处死pbs,a-3a,b-21a,t-dm1和b-15a组的动物并剥离肿瘤,显示如图48。
例239.与单链连接的常规偶联物和双链连接的偶联物在小鼠血清中稳定性对比研究
将45只6-7周龄的雌性icr小鼠分成3组。每组包括15只小鼠,用于一个adc药物的pk研究。将这15只小鼠进一步随机分成三组(n=5)。每只小鼠分别给药偶联物t-dm1,b-21a和t-1a(huangy.等,medchem。#44,249thacsnationalmeeting,denver,co,mar.22-26,2015;wo2014009774),剂量为10mg/kg/每只大鼠,静脉注射。根据nci的啮齿动物采血指南采集血液。原则上,每组中的小鼠轮流采血,以避免在24小时内出血超过两次。在给药后0时(给药前),0.083,0.25,0.5,1,4,8,24,48,96,168,312和504小时,用70μl毛细管从眼眶后窦血中取血。通过特异性elisa技术分析血浆样品中的总抗体和药物偶联的抗体。偶联的抗体或小鼠血清中的总抗体浓度测量方法如下:将96孔的elisa板分别在4℃下用抗dm1抗体,抗tubulysin抗体或抗her-2的fab片段抗体包被过夜(1μg/ml,在10mmpbs中,ph7.2)。然后将板用洗涤缓冲液pbs-t(pbs/0.02%tween20)洗涤三次,然后用1%(w/v)bsa/pbs-t稀释缓冲液在37℃封闭1小时。除去封闭缓冲液后,与用1%bsa/pbs-t缓冲液稀释的标准品或小鼠血清样品(三份重复),在37℃下孵育1小时,然后洗涤平板,在37℃下加入ap偶联的驴抗人抗体,孵育30分钟。再次洗涤平板,然后加入用于显色的pnpp底物,用1mol/l氢氧化钠淬灭显色反应后,在酶标仪上405nm波长读数。从四参数拟合标准曲线获得偶联抗体或总抗体的浓度。
结果如图49所示,动物给予三种adc后,总抗体和药物偶联抗体的pk呈现为典型的两相清除曲线。给药后8小时,在血浆和外周组织等值,在给药后24小时出现消除期并持续至最后的取样时间点。总之,对于t-dm1,t-1a和b-21a这三种adc的偶联物暴露值(auclast)分别为14981,14713和16981hr·μg/kg。所有这三种偶联物的分布体积是总血液体积的两倍。偶联物的清除率(cl)为0.59,0.57和0.47ml/hr/kg,几乎是总抗体的一半。b-21a的清除率,偶联的抗体和总抗体的,小于其他两种adc,这表明双链连接的偶联物较常规单链连接的偶联物在小鼠血清中更稳定。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种高效刺激活化t细胞的方法
- 一种基于细胞表型的高内涵多指标肾毒性的检测方法及其应用
- 管花肉苁蓉苯乙醇苷在制备抗黑色素瘤药物中的应用
- 一种提升安全性、用于表达密码子优化的Anti-MART-1 TCR基因的慢病毒载体的制备及其应用
- 表达α1,3半乳糖转移酶的癌细胞/树突状细胞融合肿瘤疫苗及其制备方法
- 异源融合基因修饰的癌细胞/树突状细胞融合肿瘤疫苗及其制备方法
- 用于癌症治疗的免疫刺激性hiv tat衍生多肽的制作方法
- 用于癌症治疗的免疫刺激性hiv tat衍生多肽的制作方法
- 用于治疗hbv感染和相关病症的结合免疫效应细胞表面抗原和hbv抗原的双或多特异性多肽的制作方法
- 一种经腺病毒基因修饰的肿瘤特异性细胞毒性t淋巴细胞的培养方法