一种立体选择性提高的菜豆环氧水解酶突变体及其应用的制作方法
本发明涉及一种立体选择性提高的菜豆环氧水解酶突变体及其应用,属于酶工程技术领域。
背景技术:
对映纯对氯环氧苯乙烷(pcso)与其水解产物对氯苯乙二醇(pcped)是多种手性药物与功能材料的重要中间体,如r型对氯环氧苯乙烷((r)-pcso)可以用于合成cb1拮抗剂;r型对氯苯乙二醇((r)-pcped)是nmda受体抑制剂——依利罗地的重要手性砌块。目前,一系列合成对映纯pcso与pcped的生物化学方法已经被报道。其中,suresh等人利用一类手性大环席夫碱类化合物催化对氯苯乙烯加氧合成(r)-pcso,其eep最高可达47%;karboune等人利用来自重组黑曲霉(aspergillusniger)的环氧化物水解酶(aneh)水解外消旋对氯环氧苯乙烷制备(r)-pcso,当转化率达到51%时,eep为87%并保留s型底物;manoj等人使用两种对映选择性互补的eh(steh与aneh)协同水解外消旋pcso合成(r)-pcso,eep达到93%。利用ehs催化制备(r)-pcso与(r)-pcped与席夫碱催化合成相比,具有eep高,来源清洁,更易分离等优势。
环氧化物水解酶(epoxidehydrolases,ehs,ec3.3.2.-)能够催化外消旋环氧化物的水解动力学拆分或对映归一性水解,保留单一构型环氧化物或转化为手性邻二醇。该反应的立体化学结果与酶对底物的立体选择性(包括对映选择性与对映归一性)紧密相关:具有对映选择性的ehs快速催化某一构型环氧化物的水解反应,得到相应的产物邻二醇以及保留另一构型环氧化物,即进行酶促动力学拆分。其中,ehs对外消旋环氧化物的对映选择率e决定环氧化物的对映体纯度。若继续反应,另一构型环氧化物也会被水解,即进行酶促对映归一性水解。底物完全转化时,区域选择性系数决定最终产物邻二醇的对映体纯度。环氧化物和邻二醇的对映体纯度通常用对映体过量值ee评价,分别表示为ees和eep。
ehs广泛存在于各生物体中,如真菌、细菌、古生菌、病毒、植物和哺乳动物等。迄今为止,ncbi数据库中收录的ehs基因序列已达数千个。pdb数据库中与ehs晶体结构相关的数据已达两百多条,根据其晶体结构与催化机理的不同,ehs分为三类:(1)α/β水解折叠ehs,例如有微生物来源的areh,植物来源的steh和动物来源的mmseh;(2)非α/β水解折叠ehs,例如来源于人的lta4h;(3)其他类型,例如来源于红串红球菌的leh。为了更好地将pveh1应用于对映纯的环氧化物与邻二醇的工业生产,对现有的ehs中进行结构和特性方面的优化显得十分必要。
技术实现要素:
为了更好地将pveh1应用于对映纯的环氧化物与邻二醇的工业生产,本发明利用定点突变获得了立体选择性提高的pveh1突变体。本发明采用全质粒pcr的方法对102位色氨酸进行单向定点突变,获得了立体选择性和催化活性同时提高的突变酶w102l,解决了立体选择性不能满足生产高对映纯环氧化物与邻二醇的需求,为拓宽pveh1的工业应用奠定了基础。
本发明的第一个目的是提供一种催化外消旋环氧化物的方法,所述方法是向含有外消旋环氧化物的体系中加入seqidno.1所示的环氧化物水解酶或表达seqidno.1所示的环氧化物水解酶的细胞。
在本发明的一种实施方式中,所述细胞包括真菌细胞或细菌细胞。
在本发明的一种实施方式中,所述细胞包括大肠杆菌、酵母或枯草芽孢杆菌。
在本发明的一种实施方式中,所述含有外消旋环氧化物的体系为溶液体系。
在本发明的一种实施方式中,所述外消旋环氧化物包括但不限于外消旋对氯环氧苯乙烷。
在本发明的一种实施方式中,所述方法是在ph为6~8的有机相中进行催化反应。
在本发明的一种实施方式中,所述有机相包括但不限于甲醇。
在本发明的一种实施方式中,所述方法是将seqidno.1所示的环氧化物水解酶表达至大肠杆菌中,培养菌体细胞,以200~280u/g底物的添加量加入所述细胞,催化外消旋对氯环氧苯乙烷生成r型对氯环氧苯乙烷及r型对氯苯乙二醇。
在本发明的一种实施方式中,所述方法是将seqidno.1所示的环氧化物水解酶表达至大肠杆菌中,培养菌体细胞,以235u/g底物的添加量加入所述细胞,催化外消旋对氯环氧苯乙烷生成r型对氯环氧苯乙烷及r型对氯苯乙二醇。
本发明还提供所述环氧化物水解酶在食品、医药领域水解外消旋环氧化物方面的应用。
在本发明的一种实施方式中,所述应用包括制备手性药物或功能材料。
本发明的有益效果:
本发明通过菜豆来源的环氧水解酶1(pveh1)的trp102进行单向定点突变,获得对映选择性与对映归一性(即立体选择性)提高的突变酶w102l。与野生型相比,w102l对外消旋对氯环氧苯乙烷rac-pcso的e值从2.6提高至25.5,这表明w102l对rac-pcso的对映选择性提高了9.8倍。同时,该突变体的稳定性没有发生变化,有利于酶在工业生产上的应用
附图说明
图1为pveh1w102l拆分pcso液相色谱分析以及ees与初始底物浓度关系;(a)为全细胞催化反应的液相色谱分析;(b)为ees与初始底物浓度关系;
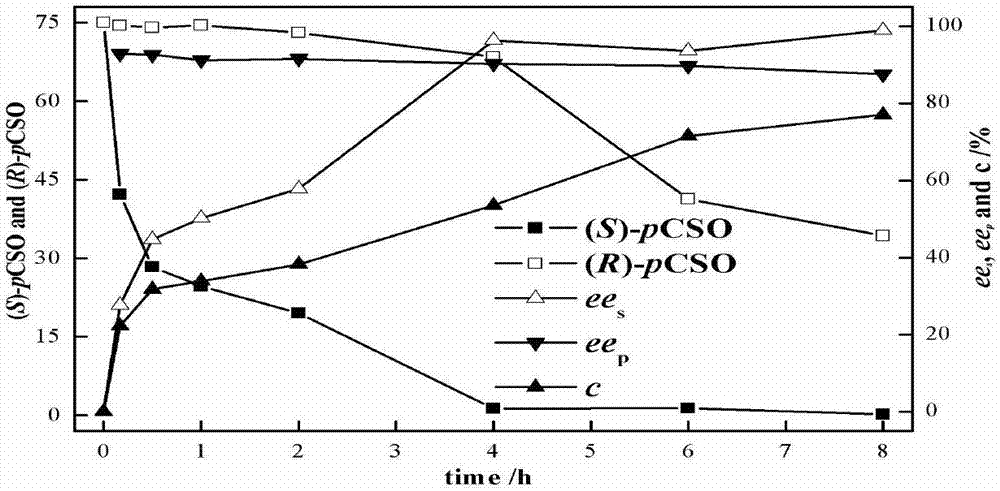
图2为pveh1w102l全细胞动力学拆分rac-pcso进程曲线。
具体实施方式
突变体命名方式:
采用“原始氨基酸位置替换的氨基酸”来表示突变体。如w102l,表示位置102的氨基酸由亲本pveh1的trp替换成leu,位置的编号对应于亲本pveh1的氨基酸序列。
全细胞比活力和对映选择性测定:称取100mg重组菌湿菌体悬浮于1ml磷酸钠缓冲液(100mmol·l-1,ph=7.0)中,吸取200μl菌悬液(100mg·ml-1)加入到含750μl磷酸钠缓冲液的2mlep管中,25℃孵育5min后加入50μlrac-pcso(200mmol·l-1,溶剂为甲醇)至终浓度为10mmol·l-1,25℃、800r·min-1恒温震荡反应器中反应10min,取50μl样品用1ml乙酸乙酯萃取,有机相经无水硫酸镁干燥。样品分析采用高效液相色谱仪waterse2695、手性液相色谱柱和紫外检测器。rac-pcso高效液相色谱条件为:流动相为正己烷:异丙醇=80:20,柱温为30℃,流速为0.8ml·min-1,检测波长为220nm,手性液相色谱柱as-h(250mm×4.6mm×5μm)。(r)-对氯环氧苯基乙烷((r)-pcso):6.290min,(s)-p对氯环氧苯基乙烷((s)-pcso):7.062min,(r)-对氯苯基乙二醇((r)-pcped):7.977min,(s)-对氯苯基乙二醇((s)-pcped):9.059min。在上述测定条件下,酶活单位定义为每分钟消耗1μmol的pcso或rac-mcso所需的酶量定义为1个单位酶活(u)。全细胞比活力(u·g-1)计算如公式(1)所示,其中c全细胞催化rac-pcso或rac-mcso的转化率,c0为初始浓度,t为反应时间,v为反应体积,m为全细胞质量。
底物ees和产物eep的计算公式(2)和(3)所示,其中rs和ss分别代表(r)-pcso和(s)-pcso的峰面积,rp和sp表示(r)-pcped和(s)-pcped的峰面积[17]。酶的对映选择性通常用对映体比率(enantiomericratio,e)来评价,e值越高,则对映选择性越高,其计算公式如(4),其中c是转化率。
实施例1:突变质粒构建
利用高纯度质粒小提试剂盒pureplasmidminikit(购于康为试剂有限公司)从实验室保藏的e.colibl21(de3)/pet-28a-pveh1(叶慧华,胡蝶,李闯,等.新型菜豆环氧化物水解酶的异源表达及对映归一性催化特性[j].中国生物工程杂志,2016,36(10):21-27.169:41-54.)中提取质粒作为单向定点突变的模板,
所用的引物为w102l-f(5’-3’gttgcccatgatctcggagccctagta);w102l-r(tactagggctccgagatcatgggcaac)。
利用
实施例2:突变体酶的获取
将获得的突变酶表达载体接种(接种量为1%)于2ml含1%卡那霉素的lb培养基中,于37℃、220r·min-1培养过夜;取2ml培养液转接于100ml含1%卡那霉素的lb培养基中,培养至od600为0.6~0.8时,加入100μl的iptg(500mmol·l-1)至终浓度为0.5mmol·l-1,20℃下诱导10h后离心收集重组菌菌体。经测定,菌体的环氧化物水解酶对rac-pcso的酶活为27u/g菌体。
实施例3:全细胞催化初始底物浓度分析
在2mlep管中加入湿菌体菌悬液浓度为200mg·ml-1的pveh1w102l全细胞,底物初始浓度从0到300mmol·l-1的rac-pcso,缓冲液为磷酸钠缓冲液(ph=7.0,100mmol·l-1),反应体系为1ml,25℃、220r·min-1恒温摇床中反应12h后,取50μl样品用1ml乙酸乙酯萃取,有机相经无水硫酸镁干燥后hplc测定ees。
如图1(a)所示,利用pveh1w102l全细胞催化rac-pcso水解过程中未见明显的副产物生成,其中(s)-pcso被pveh1w102l优先催化水解为(r)-pcped。
采用终浓为200mg·ml-1的pveh1w102l分别拆分初始浓度从50到300mmol·l-1不等的rac-pcso,反应12h,结果如图1(b)。当底物初始浓度≤150mmol·l-1时,最终ees均可到达99%,这意味着经过24h反应后(s)-pcso基本被水解完全。而当底物初始浓度大于150mmol·l-1时,体系中的(s)-pcso不能被完全水解。
实施例4:全细胞催化反应进程
在2mlep管中加入湿菌体菌悬液浓度为200mg·ml-1的pveh1w102l全细胞,底物初始浓度为150mmol·l-1的rac-pcso,缓冲液为磷酸钠缓冲液(ph=7.0,100mmol·l-1),反应体系为1ml,25℃、220r·min-1恒温摇床中,反应不同时间取50μl样品用1ml乙酸乙酯萃取,有机相经无水硫酸镁干燥后使用hplc测定残余(r)-pcso和(s)-pcso的浓度、ees、eep和c绘制反应进程曲线。
通过对于pveh1w102l全细胞动力学拆分初始浓度为150mmol·l-1的rac-pcso定期取样监测(结果如图2),发现在pveh1w102l催化的rac-pcso水解开环反应中,产物(r)-pcped的eep可达到90%以上,符合利用生物催化法生产高对映纯(r)-pcped的工业要求;此外,反应过程中(s)-pcso的浓度从初始的75mmol·l-1经过4h的反应快速下降到了1.29mmol·l-1,仅为初始浓度的0.8%。此时(r)-pcso的产率为45.62%,(s)-pcso的保留率仅为0.8%,ees为96.30%,并且(r)-pcped产率达到了50.91%,eep为90.26%。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种立体选择性提高的菜豆环氧水解酶突变体及其应用
<160>4
<170>patentinversion3.3
<210>1
<211>320
<212>prt
<213>人工序列
<400>1
metgluglyvalgluhisargthrvalgluvalasnglyilelysmet
151015
hisvalalaglulysglygluglyprovalvalleupheleuhisgly
202530
pheprogluleutrptyrsertrparghisglnileleualaleuser
354045
alaleuglytyrargalavalalaproaspleuargglytyrglyasp
505560
thraspalaproalaservalsersertyrthrileleuhisleuval
65707580
alaaspvalvalalaleuileaspserleuglyvalaspglnvalphe
859095
leuvalalahisaspleuglyalaleuvalglytrptyrthrcysleu
100105110
pheargproaspargilelysalatyrvalcysleuservalprophe
115120125
metproargasnprolysvallysprovalaspalametargalaleu
130135140
tyrglyaspasptyrtyrilecysargpheglngluproglylysmet
145150155160
gluthrleutyraspasnasnilegluglualailelysasnmetleu
165170175
thrserargargproglyproproileleuprolysgluglyalagly
180185190
serasnproleualaserglyserleuproserargproleuproser
195200205
trpleuserglngluaspleuthrtyrtyralaserlyspheglylys
210215220
thrglyleuthrglyglyleuasntyrtyrargasnleuasnleuasn
225230235240
trpgluleuthralaalatrpthrglyvalglnvallysvalproval
245250255
lyspheilethrglyaspleuaspilevalhisthrserleuglythr
260265270
lysasptyrilegluserglyalaphelysargaspvalpropheleu
275280285
glugluvalvalvalglngluglyvalalahispheasnasnglnglu
290295300
alaalagluaspvalserasnhisiletyrasppheileasnlysphe
305310315320
<210>2
<211>1125
<212>dna
<213>人工序列
<400>2
cccctctagaaataattttgtttaactttaagaaggagatataccatgggcagcagccat60
catcatcatcatcacagcagcggcctggtgccgcgcggcagccatatggaaggcgtagaa120
cacaggacagtggaagtgaatggcatcaaaatgcatgtagcagagaaaggagagggtcct180
gtcgtcttgttcctccatggcttccccgagctctggtactcctggcgccaccagattctg240
gctctcagcgccctcgggtaccgcgccgtggctcctgatctgcgtggctacggagacacc300
gatgccccggcttcggtgagcagctacaccatcttgcacctcgtggctgacgtcgtggca360
ctcattgactcacttggtgtggatcaagtcttcctcgttgcccatgatctcggagcccta420
gtaggatggtacacatgtttatttcgacctgatagaatcaaggcctatgtttgcctcagc480
gtccctttcatgcccagaaacccaaaagtgaagcccgttgatgccatgcgtgccctttat540
ggggatgactactacatctgcagattccaggaaccaggcaagatggaaactctgtatgac600
aataatatcgaagaagcaatcaagaacatgcttacaagtaggagaccaggaccaccaatc660
ctccccaaagaaggagcgggttccaatccccttgcttcagggtcccttccatcaaggcct720
cttccatcttggctctcacaggaagatctgacttactatgcttctaaatttggcaagaca780
ggcttaactggtggcctcaactactatagaaatctcaacctcaattgggagctcacagca840
gcatggactggagttcaagtcaaagttcctgtgaagttcattacaggtgatttggatata900
gttcacacctcactggggaccaaagactacatagagagtggtgctttcaagagagatgtg960
ccatttttggaggaagtggttgtgcaggaaggggttgctcacttcaacaaccaagaagct1020
gcagaggatgtcagcaatcacatttatgattttatcaacaagttctgactcgagcaccac1080
caccaccaccactgagatccggctgctaacaaagcccgaaaggaa1125
<210>3
<211>27
<212>dna
<213>人工序列
<400>3
gttgcccatgatctcggagccctagta27
<210>4
<211>27
<212>dna
<213>人工序列
<400>4
tactagggctccgagatcatgggcaac27
- 还没有人留言评论。精彩留言会获得点赞!