一种lncRNA分子用于检测和治疗卵巢癌的方法与流程
本发明涉及分子检测技术领域,尤其涉及lncrna检测和治疗卵巢癌的方法。
背景技术:
长链非编码rna(lncrnas)是一类长度超过200个核苷酸的非编码rna,广泛控制生理和病理过程,如基因转录和翻译、染色质修饰、细胞周期调控、细胞分化和癌症或肿瘤抑制信号。越来越多的证据表明,lncrnas在多种癌症的起始和发展过程中起着复杂而广泛的作用,包括卵巢癌(oc)。据报道,lncrnaccat2在oc中的上调与不良预后相关;lncrnah19的异位表达导致形成oc的恶性细胞。lncrnahotair通过调节pik3r3来促进增殖、迁移和侵袭卵巢癌skov3细胞。然而,在oc中,lncrnas的功能和机制尚未完全阐明。
作为一种小型内源性单链非编码rna,mirnas也被认为是oc中的重要参与者。mir-34家族,包括mir-34a、mir-34b、mir-34c,已被证明是强大的跨广谱肿瘤抑制的亚型。在oc中,mir-34家族在上皮性卵巢癌的发病机制中起着重要作用,mir-34a、mir-34b和mir-34c的失活可能对oc进展非常重要。从机理上来说,mir-34家族由肿瘤抑制因子p53直接激活并且在其启动子区域内由cpg甲基化激活。然而,mir-34在转录后水平的调控仍然很少有相关报道。
越来越多的证据表明,lncrnas可以作为竞争性的内源性rna(cernas)结合几种mirnas。在此,lncrna或microrna经常相互作用,在多种生理和病理过程中发挥生物学功能,包括致癌。例如,zhangz.etal演示了hotair作为cerna与mir-373在oc中调节rab22a的表达。yangy报道,uca1可以作为内源性海绵直接与mir-485-5p结合抑制上皮性卵巢癌转移。然而,关于mir-34家族与lncrnas的关联知之甚少。
在本发明中,我们发现了一个新的lncrnaloc100288181(命名为lnc-oc1),通过geo数据库分析,与对照正常组织相比,在卵巢癌组织中表达上调。同时,lnc-oc1的高表达可预测预后不良。从功能上分析,lnc-oc1的表达丧失抑制了卵巢癌细胞增殖、迁移和异种移植物生长。重要的是,lnc-oc1作为cerna抑制mir-34a和mir-34c。最后,在小鼠模型体内实验中,我们证实lnc-oc1通过抑制mir-34a和mir-34c在肿瘤发生和转移中发挥了促进作用。综上所述,我们的发明可以提供一个新的诊断生物标志物和一个强有力的治疗靶点oc。
技术实现要素:
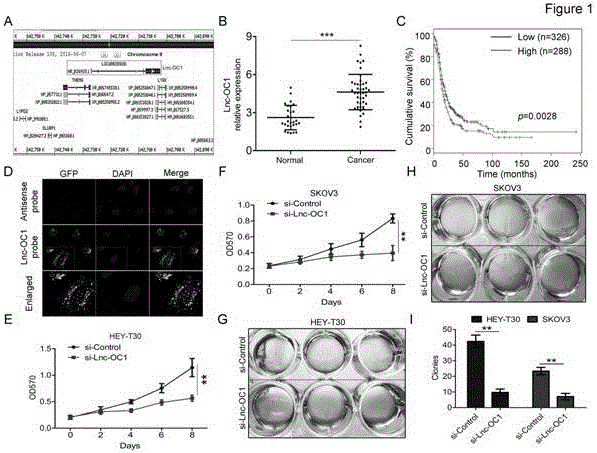
之前的研究表明,在oc中,1ncrna的表达谱有明显的改变。为了确定oc中不同表达的1ncrna,本发明筛选了上文所选的geo数据库中的1ncrna表达谱,并确定了loc100288181在卵巢癌中表达上调。我们命名了这个1ncrna为lnc-oc1。lnc-oc1位于染色体8(图1a)。基于geo数据库原始数据的统计分析表明,与正常卵巢组织相比,lnc-oc1的表达显著增加(n=44)(p=0.0004;图1b)。同时,多变量生存分析显示卵巢癌患者的lnc-oc1表达水平与整体生存率较低(p=0.0028)(图1c)。这些发现表明,lnc-oc1可以作为oc中的致癌基因。
本发明检测到lnc-oc1的亚细胞位置。rna-fish结果显示了lnc-oc1在细胞核和hey-t30细胞的细胞质中的分布(图1d)。为了研究lnc-oc1在oc中的精确生物学作用,我们通过转染sirna,使lnc-oc1在hey-t30和skov3细胞中保持沉默。mtt分析显示,在hey-t30和skov3细胞中,lnc-oc1表达缺失抑制细胞生长(图1e和1f)。与mtt法的结果一致,在平板克隆形成试验中转染sirna后,细胞活力被抑制(图1g-i)。使用流式细胞术体外检测lnc-oc1是否控制hey-t30和skov3细胞的细胞周期分布:go/g1,s,g2/m期。结果显示,lnc-oc1的沉默明显导致go/g1的比例降低,降低了hey-t30和skov3细胞中s+g2/m期的百分比(图2a-c)。此外,凋亡试验表明,lnc-oc1sirna转染的hey-t30和skov3细胞与对照组相比,在早期和晚期的凋亡细胞比例均高于对照组(图2d-f)。这些结果表明,lnc-oc1可以通过促进细胞周期进程和抑制细胞凋亡来诱导oc细胞增殖。
本发明为进一步描述生物信号角色lnc-oc1,采用transwell法评估与对照组相比被lnc-oc1sirna转染的hey-t30和skov3细胞的入侵和迁移能力。数据显示,lnc-oc1的沉默抑制了hey-t30和skov3细胞的入侵和迁移(图3a-f)。此外,我们还检测了在被lnc-oc1sirna转染的hey-t30和skov3细胞中的上皮标志物e-cadherin和间质化标志物vimentin、snail和n-cadherin的表达水平。lnc-oc1的降低显著提高了e-cadherin蛋白水平,降低了vimentin、snail和n-cadherin的蛋白水平(图3g)。免疫荧光分析也表明,lnc-oc1在细胞膜上的表达降低减少了vimentin表达(图1h-i)。在f-actin染色中也有类似的结果,被对照组sirna转染的hey-t30和skov3细胞与lnc-oc1sirna转染的hey-t30和skov3细胞相比表现的出像纺锤状的形态(图3j)。综上所述,我们的数据表明,lnc-oc1在oc中可能是一个关键的emt诱导物。
本发明进一步探究了lnc-oc1调节卵巢癌细胞生长的机制。通过ncbiblast算法搜索与lnc-oc1碱基互补配对的microrna。我们发现,mir-34a和mir-34c都与lnc-oc1(图4a)形成两个互补的碱基配对。为了确定他们是否真的受到lnc-oc1的控制,我们克隆了包含mir-34a/34c结合位点在内的lnc-oc1的cdna片段至psicheck2双荧光素酶质粒并同时转染带有对照组microrna模拟物,mir-34a模拟物或mir-34c模拟物的结构构入hey-t30细胞中。结果表明,mir-34a或mir-34c的过表达显著降低了lnc-oc1野生型结构的荧光素酶活性。之后,我们突变了图4a中描述的野生型结构,并将它们与对照组microrna模拟物,mir-34a模拟物或mir-34c模拟物的结构重新构入hey-t30细胞。结果表明,结合位点的突变消除了mir-34a/34c对lnc-oc1荧光素酶活性的影响(图4b)。此外,mir-34a或mir-34c的异位表达显著降低lnc-oc1的表达水平(图4c和4d),反之亦然(图4e)。
本发明通过建立异种移植小鼠模型提供了lnc-oc1-mir-34a/34c轴在oc中作用的活体证据。25只小鼠皮下注射hey-t30细胞,分为五组,sirna对照组,sirnalnc-oc1,体内lnc-oc1sirna+对照拮抗剂,lnc-oc1sirna+mir-34a拮抗剂和lnc-oc1sirna+mir-34c拮抗剂。用lnc-oc1sirna转染的小鼠与对照组sirna转染的小鼠相比oc异体移植生长发育明显。与预期结果一致,mir-34c和mir-34a的抑制可以恢复lnc-oc1沉默对移植瘤生长的抑制作用。
作为一种关键的非蛋白质编码rna,1ncrnas对癌症的发展和进展至关重要。然而,与在mirnas上的研究相比,只有极少数的1ncrnas参与了oc的研究。在本发明中,我们证明了一种新的1ncrnalnc-oc1在卵巢癌组织中被过度表达,lnc-oc1的高表达预测预后不良。此外,lnc-oc1的下调可以抑制oc细胞增殖、入侵、迁移和异种移植生长。lnc-oc1与mir-34a/34c形成了反抑制反馈环。我们的发明描述了lnc-oc1在oc中的作用,并在机理上发现它可能表现出与mir-34a/34c的调控轴。如上所述,肿瘤抑制因子mir-34已达到治疗癌症的临床试验阶段。在此,lnc-oc1的沉默能够释放mir-34a和mir-34c这可能在未来的卵巢癌患者中能作为一种新的治疗方法。
附图说明
图1lncrnalnc-oc1在oc中被上调,并促进hey-t30和skov3细胞增殖。(a)基因的位置示意图表示lncrnalnc-oc1。(b)由geo数据库获得的lnc-oc1在卵巢癌和正常卵巢组织中的相对表达量(p=0.0004,t检测)。(c)基于toga数据库采用多变量生存分析来确定与卵巢癌的总生存与lnc-oc1表达的相关性。“高”和“低”表达组被组中值分隔。(d)rna-fish检测hey-t30细胞中lnc-oc1的亚细胞位置。细胞核被dapi染成蓝色,测量尺:10μm。(e和f)mtt法测定了被lnc-oc1sirna和对照组sirna转染的hey-t30(e)和skov3(f)细胞的增殖率(n=6)。(g和h)对被lnc-oc1sirna和对照组sirna转染的hey-t30和skov3细胞的平板克隆形成实验测定结果。(i)在指示细胞中量化种群数量。都进行mtt和平板克隆形成实验。数据显示为平均值±标准误差。由单因素方差分析进行的统计学分析,**为p<0.01。
图2在hey-t30和skov3细胞中,lnc-oc1的下调引起细胞周期阻滞和凋亡(a-c)通过流式细胞术测定被lnc-oc1sirna和对照组sirna转染的hey-t30和skov3细胞的周期分布,并sirna。(d-f)annexinv-fttc/pi法对比被lnc-oc1sirna和对照组sirna转染的hey-t30和skov3细胞的细胞凋亡率。所有数据均来自于三次独立的实验,并通过单因素方差分析进行统计分析。*,p<0.05。**,p<0.01。***,p<0.001。
图3lnc-oc1的沉默抑制了hey-t30和skov3细胞的细胞侵袭和迁移。(a-f)lnc-oc1在hey-t30和skov3细胞中的下调抑制细胞侵袭和迁移,通过transwell法入侵(a-c)和转染(d-f)。每个数据都是三次独立重复试验,显示为平均值±标准误差。由单因素方差分析所决定的统计学意义,**,p<0.01。(g)由westernblot测定e-cadherin,vimentin,snail和n-cadherin表达在指定组中的表达。(h-j)免疫荧光染色检测e-cadherin、snail、f-actin被lnc-oc1sirna和对照组sirna转染的hey-t30和skov3细胞的表达及分布。
图4lnc-oc1和mir-34a/34c之间的相互抑制参与了oc的发展。(a)在lnc-oc1的mrna序列中,目前公认的mir-34a和mir-34c结合位点(野生型和突变型)。(b)荧光素酶报告,以评估mir-34a和mir-34c对lnc-oc1表达的影响。数据显示为平均值±标准误差(n=6)。统计学意义,由t检验决定,*,p<0.05,**,p<0.01。半定量rt-pcr测定发现(c和d)mir-34a(c)或mir-34c(d)的过度表达抑制了hey-t30细胞中lnc-oc1的表达。(e)lnc-oc1沉默抑制了mir-34a和mir-34c在hey-t30细胞中的表达。(f和g)hey-t30异种移植到指示组的代表性图片(f)和生长曲线(g)。数据显示为平均值±标准误差(n=5)。由t检验决定的统计学意义,**,p<0.01。
具体实施方式
在本发明的具体实施方案中,大致方法如下:
1.细胞培养:
卵巢癌(oc)细胞hey-t30和skov3由americantypeculturecollection获得,并遵照说明书进行培养。
2.sirna和mirna的转染
sirna和mirna使用lipofectaminernaimax根据说明书进行转染。细胞在转染之前在6孔板中培养达到50-70%。5μl的sirna(20μm)或mirna(20μm)用opti-mem培养基稀释到100μl,6μllipofectaminernaimax添加到100μl的opti-mem培养基中。5min后,稀释了的sirna或microrna与稀释的lipofectaminernaimax混合15min。然后添加到混合800μl的新鲜培养基的细胞中,孵化6h更换新鲜的完全培养基。转染细胞孵育48h后进行进一步的分析。
3.平板克隆形成试验
采用100nmlnc-oc1sirna转染卵巢hey-t30和skov3细胞,对照组sirna用lipofecataminernaimax培养48h。之后,接种1×103个细胞到含完全培养基的6孔板中于5%的co2培养箱中37℃培养14d。然后用4%多聚甲醛(pfa)对平板克隆进行固定,用0.1%的结晶紫溶液进行30min染色,在倒置显微镜下拍照并计算多于50多个细胞的菌落。
4.细胞增殖检测
被100nmlnc-oc1sirna或对照组sirna转染的hey-t30和skov3细胞(5×103)接种于96孔板。使用mtt法根据说明书,在第0、2、4、6和8d测定增殖率。
5.rna荧光原位杂交
用rna-fish检测hey-t30细胞中lnc-oc1的亚细胞分布。在室温条件下,将细胞在4%的多聚甲醛中固定30min,乙醇梯度脱水(70%,70%,80%,95%,95%,100%)。然后样本37℃过夜孵育地高辛标记的rna-fish探针,二抗anti-digoxigenin-fitc孵育2h。反义rna探针作为阴性对照。结果用共聚焦显微镜来测量的。rna-fish探针的序列如下:ctgtggtcacaaaggcctga(lnc-oc1)。
6.细胞周期检测
收集转染的细胞并固定在70%乙醇中4℃过夜。之后固定样本用新鲜预冷的pbs洗两次并且孵育核糖核酸酶(50μg/ml,beyotime)和碘化丙啶(pi)(100μg/ml,beyotime),37℃30min。使用facscalibur(bdbiosciences,sanjose,ca,usa)收集2万个细胞,并通过f1owjo软件7.6.1(treestarinc,ashland,or,usa)对细胞周期分布进行分析。
7.细胞凋亡检测
根据说明书,使用annexinv-fttc细胞凋亡检测试剂盒i(bdpharmingen,sandiego,ca,usa)进行细胞凋亡测试。用facscalibur对凋亡细胞进行检测,并通过f1owjo软件7.6.1进行分析。
8.transwell入侵和迁移分析
对于入侵检测,悬浮1×105个细胞于250μl含1%fbs的培养基中并接种于含25μl生长因子的无血清培养基中于24孔transwell上室内(8μm;bdbioscience)。对于迁移试验,悬浮2×105细胞于未经过预处理的24孔板上室中。这两种方法的下室中都加入含10%fbs的新鲜培养基。24h后,被入侵或迁移的细胞用0.1%的结晶紫染色,并对每个样本随机拍取10张照片。
9.质粒构造和荧光素酶报告分析
对hey-t30的cdna使用常规的rt-pcr对lnc-oc1含有mir-34a或mir-34c结合位点的cdna片段进行扩增,并插入到psicheck-2质粒sgfi和pmei的限制位点。根据说明书采用定向诱变系统(beyotime)构建lnc-oc1含突变型mir-34a或mir-34c结合位点的基因质粒。用于克隆和定向诱变的引物如下:
5'-gaccgcgatcgcctcaagtaattgggagtgctc-3'(lnc-oc1-wt1-forward);5'-cttagtttaaactcaccatgtttccagccaag-3'(lnc-oc1-wt1-reverse);5'-gaccgcgatcgccgtctcgaccttgatggagctc-3'(lnc-oc1-wt2-forward);5'-cttagtttaaacgaccgttgtcacctgttgc-3'(lnc-oc1-wt2-reverse);5'-ctggtcctgagttgctggggctttctctgcctgtcattcctagaatggactttg-3'(lnc-oc1-mutl-forward);5'-caaagtccattctaggaatgacaggcagagaaagccccagcaactcaggaccag-3'
(lnc-oc1-mutl-reverse);5'-ggaatgggggcagccttgatgtgcgccctgtcattccccatgctgaggag-3'(lnc-oc1-mutt-forward);5'-ctcctcagcatggggaatgacagggcgcacatcaaggctgcccccattcc-3'(lnc-
oc1-mutt-reverse);5'-ctggtcctgagttgctgagggctcttcttgcctgtcattcctagaatggactttg-3'(lnc-oc1-mut3-forward);5'-caaagtccattctaggaatgacaggcaagaagagccctcagcaactcaggaccag-3'(lnc-oc1-mut3-reverse);5'-ggaatgggggcagcctctaacatgtgtcctgtcattccccatgctgaggag-3'(lnc-oc1-mut4-forward);5'-ctcctcagcatggggaatgacaggacacatgttagaggctgcccccattcc-3'(lnc-oc1-mut4-reverse)。
10.异种移植小鼠模型
对4-6周龄的balb/c裸鼠皮下注射体内转染了对照组sirna,lnc-oc1sirna,lnc-oc1sirna+对照组mirna拮抗剂,lnc-oc1sirna+mir-34a拮抗剂和lnc-oc1sirna+mir-34c拮抗剂的hey-t30细胞32d。有明显肿瘤的第二天测量长度肿瘤体积(0.5×长×宽2)。该研究方案得到了动物护理和使用委员会的批准。
11.geo基因表达数据分析
geo基因表达数据由ncbigeo数据库获得,目前的研究使用的五个数据库为:gse36668,gse18520,gse9891,gse26193,gse63885。
12.lnc-oc1的生存分析
lnc-oc1在oc中的临床意义通过tcga数据库的rna序列进行评估。将tcga生存数据序列与lncrna表达水平联系起来,lnc-oc1的表达量高和低由中值定义,数据由kaplan-meier生存曲线和对数曲线进行统计分析。
- 还没有人留言评论。精彩留言会获得点赞!