一种活性生物碱Misszrtlide及其类似物的合成方法与流程
本发明属于生物碱领域,特别涉及一种活性吲哚类生物碱Misszrtlide及其类似物的合成方法。
背景技术:
海洋是一个巨大的天然药物宝库,特别是当中的生物碱,它们是一类碱性含有酰胺基和其他复杂碳骨架环系结构的、由不同的氨基酸或其直接衍生物合成而来的次级代谢物。它在生物体内表现出良好的抗肿瘤、抗病毒、抗菌以及酶抑制等活性。日本的Umezawa从一株海洋细菌中分离得到一种对肿瘤细胞具有强抑制作用胞外多糖——Marinactin,目前在日本已作为治疗肿瘤的佐剂上市。我国的学者也从细菌Pseudomonas sp.的代谢产物中分离得到灵菌红素——Prodigiosin,先作为天然色及抗菌素进行开发。(韦成礼,李玲.国内外从海洋微生物开发新型药物的研究概况[J].有机化学,2013,33(6):1195-1234)。因为在自然界分离获得的生物碱的量非常少且采集难度高,远远不能满足实际临床研究和产业化应用需求,所以寻找一条经济高效、人工、对环境无害化的路径来解决海洋生物碱药物的药源问题已成为当今紧迫的课题之一。
Misszrtlide是从我国湛江市徐闻县采集的海绵的共附生曲霉属真菌Aspergillus sp.SCSIOXWS03F03次级代谢产物中分离得到的一种新生物碱,它对人的前列腺癌细胞株系LNCaP(IC50=4.9μM)和急髓白血病M3细胞株HL-60(IC50=3.1μM)都表现出非常好的活性,,正因为其对于广泛的癌细胞都有抑制作用,该化合物可能成为新型的海洋药物。但由于从自然界分离提取的量非常少,所以用合成的方法代替提取分离它的前景非常可观和可行。
技术实现要素:
为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供一种活性吲哚类生物碱Misszrtlide及其类似物的合成方法。
本发明的目的通过下述方案实现:
Misszrtlide是一个新天然分离出来的吲哚类生物碱,Nα-((R)-2-羟基-苯丙酰)-1-(3,3-二甲基丙烯基)-L-色氨酸甲酯【methyl Nα-((R)-2-hydroxy-3-phenylpropanoyl)-1-(3-methylbut-2-en-1-yl)-L-tryptophanate】,分子式为C26H30N2O4,白色固体。
活性生物碱Misszrtlide及其类似物的结构式如下所示:
一种活性生物碱Misszrtlide及其类似物的合成方法,主要包括以下步骤:
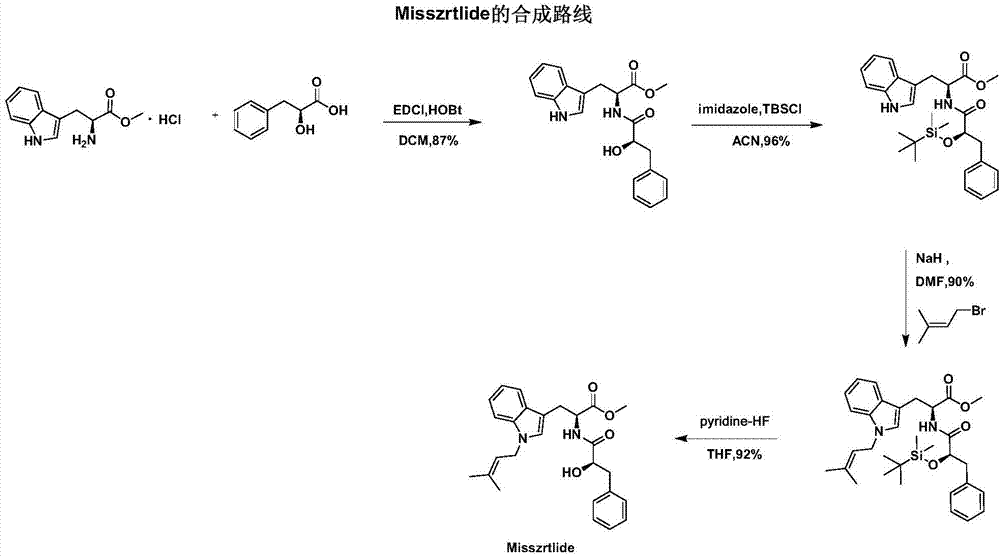
(1)酰胺的偶联:以手性原料L-色氨酸甲酯盐酸盐(H-Trp-OMe·HCl)和L-苯基乳酸(L-(-)-3-Phenyllactic acid)作为底物,在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)/1-羟基苯并三唑(HOBt)的条件进行不消旋的酰胺连接,得到Nα-((R)-2-羟基-苯丙酰)-L-色氨酸甲酯(Misszrtlide的类似物之一);
(2)羟基的保护:将步骤(1)中所得产物Nα-((R)-2-羟基-苯丙酰)-L-色氨酸甲酯在咪唑(imidazole)条件下与叔丁基二甲基氯硅烷(TBSCl)反应,得到Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-L-色氨酸甲酯;
(3)R1基的连接:将步骤(2)中的产物Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-L-色氨酸甲酯在碱性条件下与R1Br反应,得到Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-1-(R1基)-L-色氨酸甲酯;
(4)叔丁基二甲基硅基的脱除:用氟化氢吡啶溶液(pyridine-HF)对步骤(3)中的产物Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-1-(R1基)-L-色氨酸甲酯进行脱除叔丁基二甲基硅基(TBS)的保护处理,得到最终产物Nα-((R)-2-羟基-苯丙酰)-1-(R1基)-L-色氨酸甲酯。
步骤(3)中所述的R1Br中的R1为3,3-二甲基丙烯基、对甲苯璜酰基、甲璜酰基中的一种,当R1为3,3-二甲基丙烯基时,得到的产物即为活性生物碱Misszrtlide。
步骤(1)具体包括以下步骤:将L-苯基乳酸(L-(-)-3-Phenyllactic acid)溶于有机溶剂中,然后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)反应3-5min(优选为5min)后,接着加入1-羟基苯并三唑(HOBt)搅拌反应30-60min(优选为60min)后,再向其中加入L-色氨酸甲酯盐酸盐(H-Trp-OMe·HCl),通入氮气,在室温(25-29℃)反应24-36h(优选为30h),反应结束后将所得反应液纯化即得Nα-((R)-2-羟基-苯丙酰)-L-色氨酸甲酯;
步骤(1)中L-苯基乳酸、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1-羟基苯并三唑和L-色氨酸甲酯盐酸盐的摩尔比为5.5-7:5-6.5:5-7:5-7,优选为6:5:5:5。
步骤(1)中所述的有机溶剂为二氯甲烷(DCM)、二甲基甲酰胺(DMF)、四氢呋喃(THF)中的至少一种,优选为二氯甲烷(DCM)。
步骤(1)中所述的纯化是指将所得反应液经过减压旋干,用二氯甲烷(DCM)和水萃取三次,冷冻干燥有机相,再经过柱层析分离纯化即得目标产物。
步骤(2)具体包括以下步骤:将步骤(1)中的产物Nα-((R)-2-羟基-苯丙酰)-L-色氨酸甲酯溶解于有机溶剂中,加入咪唑(imidazole)搅拌反应20-30min(优选为30min)后,再加入叔丁基二甲基氯硅烷(TBSCl),然后通入氮气,在室温(25-29℃)反应3-6h(优选4h),反应结束后将所得反应液纯化即得到Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-L-色氨酸甲酯。
步骤(2)中所述的Nα-((R)-2-羟基-苯丙酰)-L-色氨酸甲酯、咪唑和叔丁基二甲基氯硅烷的摩尔比为5-7:10-12:5.5-7;优选为5:10:6。
步骤(2)中所述的有机溶剂为乙腈(MeCN)、四氢呋喃(THF)中的至少一种,优选为乙腈(MeCN)。
步骤(2)中所述的纯化是指将所得反应液经过减压旋干,用二氯甲烷(DCM)和水萃取三次,冷冻干燥有机相,再经过柱层析分离纯化即得目标产物。
步骤(3)具体包括以下步骤:将步骤(2)中的产物Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-L-色氨酸甲酯溶解于有机溶剂中,加入碱搅拌反应30-60min(优选为60min)后,再加入R1Br,然后通入氮气,在室温(25-29℃)反应3-6h(优选为3h),反应结束后将所得反应液纯化即得到Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-1-(R1基)-L-色氨酸甲酯;
步骤(3)中所述的Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-L-色氨酸甲酯、碱和R1Br的摩尔比为1-2:10-15:1-3;优选为1:10:1.5。
步骤(3)中所述的碱为氢化钠(NaH);
步骤(3)中所述的溶剂为N,N-二甲基甲酰胺(DMF)、四氢呋喃(THF)中的至少一种,优选为N,N-二甲基甲酰胺(DMF)。
步骤(3)中所述的纯化是指将所得反应液经过减压旋干,用二氯甲烷(DCM)和水萃取三次,冷冻干燥有机相,再经过柱层析分离纯化即得目标产物。
步骤(4)具体包括以下步骤:将步骤(3)的产物Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-1-(R1基)-L-色氨酸甲酯溶解于有机溶剂中,然后加入氟化氢吡啶溶液(pyridine-HF),通入氮气,在室温(25-29℃)反应2-4h(优选2h),薄层色谱(TLC)跟踪反应,反应完全后将所得反应液纯化即得活性生物碱Misszrtlide或其类似物。
步骤(4)中所述的Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-1-(R1基)-L-色氨酸甲酯、氟化氢吡啶溶液(pyridine-HF)的摩尔比为1-2:10-12,优选为1:10;
步骤(4)中所述的有机溶剂为四氢呋喃(THF)、二氯甲烷(DCM)中的至少一种,优选为四氢呋喃。
步骤(4)中所述的纯化是指将所得反应液经过减压旋干,用二氯甲烷(DCM)和水萃取三次,冷冻干燥有机相,再经过柱层析和高效液相色谱分离纯化即得目标产物。
步骤(1)-(4)中所述的连接的条件均是在氮气环境下室温(25-29℃)反应,薄层色谱(TLC)跟踪反应。
步骤(1)-(4)中若未指明温度的,均指在室温(25-29℃)。
生物碱Misszrtlide及其类似物的合成具体流程图如图1所示,当R1为3,3-二甲基丙烯基时,得到的产物即为活性生物碱Misszrtlide,活性生物碱Misszrtlide的合成具体流程图如图2所示。
本发明的机理为:
本发明的生物碱Misszrtlide及其类似物的合成方法采用以手性原料L-色氨酸甲酯盐酸盐(H-Trp-OMe·HCl)和L-苯基乳酸(L-(-)-3-Phenyllactic acid)作为底物,在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)/1-羟基苯并三唑(HOBt)的条件进行不消旋的酰胺连接。随后采用在咪唑(imidazole)条件下与叔丁基二甲基氯硅烷(TBSCl)反应使得羟基得以保护,避免下一步在碱性条件下与R1Br反应过程中与色氨酸吲哚上的N-H发生竞争。最后用氟化氢吡啶溶液(pyridine-HF)温和高效地脱除叔丁基二甲基硅基(TBS)的保护最终通过4步反应以高产率、易处理得到Misszrtlide或其类似物。
本发明相对于现有技术,具有如下的优点及有益效果:
(1)本发明采用的4步合成大大缩减了合成时间和纯化工序,合成工艺简单,原料成本低,反应条件温和,纯度高,易于产业化,具有广阔的市场前景。
(2)采用的缩合试剂为EDCI和HOBt能够有效避免手性原料在酰胺化的时候发生消旋反应,有效提高了产率和控制副产物的生成。
(3)与以往用强酸脱除TBS保护基相比,本发明采用一个温和的氟化氢吡啶溶液(pyridine-HF),能够大大减少对使用者身体的危害和事故的发生。
(4)并得出最优时间和反应条件(温度和试剂用量),让每一步反应或者最大的产率和最短的时间。
附图说明
图1为Misszrtlide及其类似物的合成具体流程图。
图2为Misszrtlide的合成具体流程图。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例中所用试剂如无特殊说明均可从市场常规购得。
实施例1:活性生物碱Misszrtlide的合成
(1)酰胺的偶联
在250mL的圆底烧瓶中,将4.0g的L-苯基乳酸(L-(-)-3-Phenyllactic acid,24mmol)溶于100mL干燥二氯甲烷(DCM)中,然后加入3.8g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI,20mmol)反应5min后,接着加入2.7g的1-羟基苯并三唑(HOBt,20mmol)搅拌反应60min后,再向其中加入5.1g的L-色氨酸甲酯盐酸盐(H-Trp-OMe·HCl,20mmol),通入氮气,在室温(25-29℃)反应30h,薄层色谱(TLC)跟踪反应,反应完全后减压旋干,用二氯甲烷(DCM)和水萃取三次,冷冻干燥有机相,再经过柱层析分离,得到Nα-((R)-2-羟基-苯丙酰)-L-色氨酸甲酯(Misszrtlide类似物之一),其核磁共振氢谱和核磁共振碳谱数据如下所示,说明本步骤成功合成了Nα-((R)-2-羟基-苯丙酰)-L-色氨酸甲酯。
1H NMR(300MHz,DMSO-d6)δ10.91(m,1H),7.79(d,J=8.1Hz,1H),7.44(d,J=7.8Hz,1H),7.36(m,1H),7.28(m,5H),7.09(ddd,J=8.1,7.0,1.2Hz,1H),7.01(m,1H),6.97(dd,J=4.1,1.7Hz,1H),5.77(d,J=5.8Hz,1H),4.67(m,1H),3.60(s,3H),3.15(qd,J=14.6,6.2Hz,2H),2.95(dd,J=13.8,3.7Hz,1H),2.69(dd,J=13.7,8.1Hz,1H).
13C NMR(75MHz,DMSO-d6)δ173.50,172.46,170.79,138.76,136.58,130.00,128.35,127.59,126.49,124.17,121.46,118.91,118.56,111.87,109.29,72.32,60.23,52.58,52.36,40.75,40.70,40.48,40.20,39.92,39.64,39.36,39.09,27.59,21.17,14.51.
(2)羟基的保护
在50mL的圆底烧瓶中,将1.83g实施例1中的产物Nα-((R)-2-羟基-苯丙酰)-L-色氨酸甲酯(5mmol)溶解于50mL乙腈(MeCN)中,加入0.68g的咪唑(imidazole,10mmol)搅拌反应30min后,再向其加入0.91g的叔丁基二甲基氯硅烷(TBSCl,6mmol),通入氮气,在室温(25-29℃)反应4h,薄层色谱(TLC)跟踪反应,反应完全后减压旋干,用二氯甲烷(DCM)和水萃取三次,冷冻干燥有机相,再经过柱层析分离,得到Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-L-色氨酸甲酯。
(3)二甲基丙烯基的链接
在50mL的圆底烧瓶中,将0.96g实施例2中的产物Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-L-色氨酸甲酯(1mmol)溶解于20mL的N,N-二甲基甲酰胺(DMF)中,加入0.24g的氢化钠(NaH,10mmol)搅拌反应60min后,再向其加入0.3mL的1-溴-3-甲基-2-丁烯(1.5mmol),通入氮气,在室温(25-29℃)反应3h,薄层色谱(TLC)跟踪反应,反应完全后减压旋干,用二氯甲烷(DCM)和水萃取三次,冷冻干燥有机相,再经过柱层析分离,得到Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-1-(3,3-二甲基丙烯基)-L-色氨酸甲酯;
(4)叔丁基二甲基硅基的脱除
在50mL的圆底烧瓶中,将0.55g实施例3中的产物Nα-((R)-2-叔丁基二甲基硅醚-苯丙酰)-1-(3,3-二甲基丙烯基)-L-色氨酸甲酯(1mmol)溶解于20mL的无水四氢呋喃(THF)中,加入2.3mL的氟化氢吡啶溶液(pyridine-HF,10mmol),通入氮气,在室温(25-29℃)反应2h,薄层色谱(TLC)跟踪反应,反应完全后减压旋干,用二氯甲烷(DCM)和水萃取三次,冷冻干燥有机相,再经过柱层析和高效液相色谱分离纯化。得到最终目标产物生物碱Misszrtlide,总产率70%,纯度99%以上。最终目标产物生物碱Misszrtlide的核磁共振氢谱数据和核磁共振碳谱数据如下所示,说明本实施例成功合成了生物碱Misszrtlide。
1H NMR(300MHz,Chloroform-d)δ7.42(d,J=7.9Hz,1H),7.27(dddd,J=15.6,12.3,7.9,6.2Hz,7H),7.11(d,J=7.5Hz,1H),7.06(d,J=6.8Hz,1H),5.34(m,1H),4.93(dt,J=8.4,5.5Hz,1H),4.64(s,1H),4.62(s,1H),4.30(dd,J=7.7,4.1Hz,1H),3.30(dd,J=14.7,5.6Hz,1H),3.16(m,2H),2.88(d,J=7.7Hz,1H),2.83(d,J=7.7Hz,1H),1.84(s,3H),1.78(s,3H).
13C NMR(75MHz,Chloroform-d)δ172.50,172.23,136.83,136.24,136.17,129.75,128.59,128.20,126.95,126.19,121.61,119.95,119.13,118.74,109.66,108.17,72.63,52.49,52.32,44.05,40.53,27.84,25.69,18.07.
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!