一种重组的C肽免疫原及其应用的制作方法
本发明涉及免疫检测
技术领域:
,具体涉及一种重组的C肽免疫原及其应用。
背景技术:
:C肽(C-Peptide)又称连接肽,是胰岛β细胞的分泌产物,它与胰岛素有一个共同的前体--胰岛素原,胰岛素原是一条很长的蛋白质链,胰岛素原在酶的作用下被分解为三段,前后两段又重新联接,成为有A链和B链组成的胰岛素,中间一段独立出来,形成一个有31个氨基酸的多肽,成为C肽。C肽有以下特点:(1)在胰岛的β细胞的分泌中,Ins与C肽总克分子量相等。(2)胰岛素半衰期为4.8min,而C肽为11分钟胰岛素原为17.5min。(3)胰岛素在肝肾内分解而C肽不被分解是完整链从肾脏排出。(4)C肽无生物学活性,但具有很强的种属特异性,与抗胰岛素无交叉免疫反应。由于胰岛素原的浓度还不到C肽的十分之一,故一般测得C肽(总C肽)可代表血中的游离C肽。C肽检测稳定性强,不受外源性胰岛素的干扰,在胰岛β细胞功能评估方面优于胰岛素,C肽水平测定,可了解糖尿病患者胰岛β细胞的功能,应用于糖尿病诊断及分型,低血糖综合症的鉴别诊断,胰岛移植后功能恢复评估,肝肾疾病的辅助诊断。但是,直接免疫C肽抗原小鼠不产生抗C肽特异性抗体,加入一般的载体蛋白如牛血清白蛋白(BSA)、血蓝蛋白(KLH)以及GST融合蛋白同样很难得到高亲和力的特异性抗体体。对于这一特殊的半抗原,选择合适的免疫原成为了制备其优良抗体的关键。技术实现要素:有鉴于此,本发明的目的在于提供一种重组的C肽免疫原,使其免疫动物后能够产生较高效价的多克隆抗体或单克隆抗体;本发明的另外一个目的在于提供一种利用上述C肽免疫原获得的杂交瘤细胞,使其能够产生较高效价的单克隆抗体;本发明的另外一个目的在于提供一种利用上述C肽免疫原获得的单克隆抗体,使其具备较高的效价。为实现上述发明目的,本发明提供如下技术方案:一种重组的C肽免疫原,是由C肽和丙型病毒性肝炎核心蛋白形成的融合蛋白。针对现有技术中采用一般的载体蛋白无法获得高亲和力(即高效价)的C肽抗体,本发明以HCVcore(丙型病毒性肝炎核心蛋白)作为载体蛋白,与C肽形成新的融合蛋白,相比其他一般的载体蛋白可获得高效价的C肽抗体。本发明所述重组的C肽免疫原进一步是由连接肽将所述C肽和丙型病毒性肝炎核心蛋白由连接组成融合蛋白,其中的连接肽是本领域中常用的不影响载体蛋白和抗原蛋白免疫原性的短肽,在本发明具体实施方式中其序列为Asp-Gly-Arg。作为优选,本发明所述丙型病毒性肝炎核心蛋白选择其第1至第118个氨基酸形成的蛋白,其氨基酸序列如SEQIDNO:1所示。本发明所述重组的C肽免疫原氨基酸序列即为SEQIDNO:1所示序列+连接肽+C肽序列。出于制备的需要,在进行所述重组的C肽免疫原的制备时,扩增引物一般包含筛选标签,如组氨酸标签,以便后面阳性克隆的筛选,但筛选标签并不是本发明所述重组的C肽免疫原所必须具备的。在本发明具体实施方式中,所述重组的C肽免疫原氨基酸序列如SEQIDNO:2所示。其中,第1-6位氨基酸序列为6个组氨酸筛选标签,第7-124位氨基酸序列为所述丙型病毒性肝炎核心蛋白1-118位氨基酸序列,第125-127位氨基酸序列为连接肽序列,第128-158位氨基酸序列为C肽序列。采用本发明所述重组的C肽免疫原免疫小鼠进行血清效价检测,结果显示,单纯的C肽抗原因分子量太小几乎不免疫动物产生抗体,而作为对照的C肽-GST融合蛋白抗原虽能产生抗体,但效价明显不如本发明所述C肽免疫原。在杂交瘤细胞株和单克隆抗体的试验中,经过本发明所述C肽免疫原免疫后的小鼠,经过杂交瘤细胞的制备以及单克隆抗体的筛选,所获得单抗效价可达到1000K,表明抗C肽的单克隆抗体具备较高的效价。同时,本发明连续免疫了50只不同的小鼠进行杂交瘤细胞株的制备并筛选出37株单克隆抗体,这些单克隆抗体均具备高达1000K效价的优异效果,表明了所述C肽免疫原在制备杂交瘤细胞以及单克隆抗体中高效价的可重现性,能够在产业上进行应用。基于以上优异的技术效果,本发明提供了所述C肽免疫原在制备抗C肽单克隆抗体杂交瘤细胞株和/或C肽抗体中的应用。其中,所述C肽抗体为C肽多克隆抗体或C肽单克隆抗体。根据上述应用,本发明还提供了一种抗C肽单克隆抗体杂交瘤细胞株,由本发明所述C肽免疫原免疫动物后制备获得。同时还提供了一种抗C肽的单克隆抗体,由所述抗C肽单克隆抗体杂交瘤细胞株分泌获得。基于前述获得的单克隆抗体的高效价性能,本发明提出了由本发明所述C肽免疫原制备获得单克隆抗体,特别是效价高达1000k的单抗在制备检测C肽、糖尿病诊断及分型、低血糖综合症的鉴别诊断、胰岛移植后功能恢复评估或肝肾疾病的辅助诊断的产品中的应用。所述产品的形式可以是检测诊断领域中的任何形式,如基于Elisa原理的试剂盒、免疫层析试纸、胶体金试纸等等。具体地,本发明提供了一种C肽胶体金检测试纸,其关键核心在于采用所述单克隆抗体作为检测试纸的检测线。在本发明具体实施方式中,所述C肽胶体金检测试纸由样品垫、底板、硝酸纤维膜、金标垫和吸水垫组成,在硝酸纤维膜上划有T线(即检测线,由本发明所述单克隆抗体经包被缓冲液稀释后划线)和C线(即质控线,由羊抗鼠IgG抗体经包被缓冲液稀释后划线),具体的结构示意图可参见图1。本发明所述C肽胶体金检测试纸,随着C肽浓度的升高,在T线以及C线上的显色逐渐变深,可以用于定量或半定量检测。由以上技术方案可知,本发明通过选择丙型病毒性肝炎核心蛋白作为C肽的载体蛋白,两者形成的融合蛋白能够产生高效价的C肽特异性抗体,相比常用的GST载体蛋白具备明显的高亲和力优势,能够更好地应用于糖尿病诊断及分型、低血糖综合症的鉴别诊断、胰岛移植后功能恢复评估以及肝肾疾病的辅助诊断。附图说明图1所示为本发明所述C肽胶体金检测试纸结构示意图;图2所示为本发明所述C肽免疫原的SDS-PAGE图;图3所示为不同C肽免疫原的抗血清效价曲线图;其中1表示本发明所述C肽免疫原的曲线,2表示C肽-GST蛋白抗原的曲线,3表示C肽的曲线;图4所示为梯度C肽浓度的胶体金检测试条显色效果对比图。具体实施方式本发明公开了一种重组的C肽免疫原及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明所述C肽免疫原及其应用已经通过实施例进行了描述,相关人员明显能在不脱离本
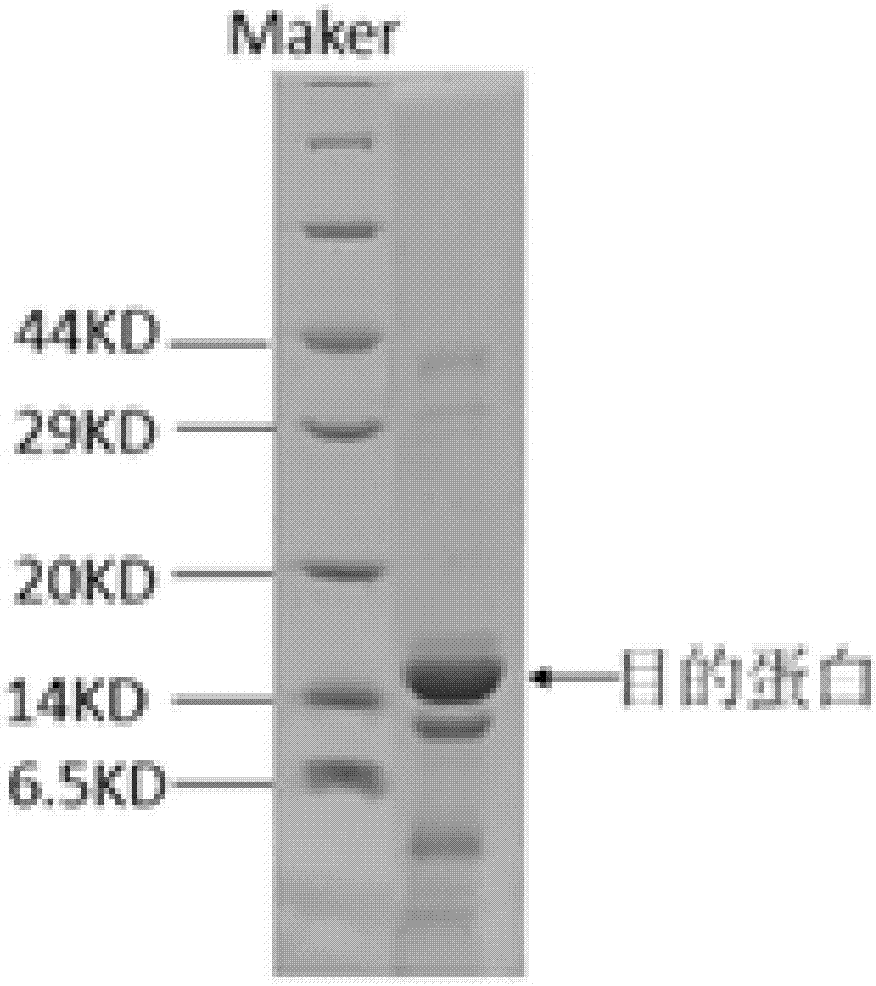
发明内容、精神和范围内对本文所述C肽免疫原及其应用进行改动或适当变更与组合,来实现和应用本发明技术。以下就本发明所提供的一种重组的C肽免疫原及其应用做进一步说明。实施例1:本发明所述C肽免疫原的制备C肽基因序列如SEQIDNO:3所示,HCVCore(1-118aa)基因序列如SEQIDNO:4所示,设计HCVCore(1-118aa)引物H1和H2,H1基因序列为SEQIDNO:5,H2基因序列为SEQIDNO:6所示,H1中的GAATTC为EcoRⅠ的酶切位点,CATCACCATCACCATCAC为6个组氨酸标签;H2中AGCTTC为搭桥拼接的C肽5′端的基因序列,ACGGCCGTC为连接肽基因序列;设计C肽引物C1和C2分别为C1SEQIDNO:7和C2SEQIDNO:8所示,C1中GACGGCCGT为连接肽基因序列,C2中GGATCC为BamHⅠ的酶切位点,以上序列均交由商业公司合成。分别扩增HCVCore(1-118aa)基因(用pJFH1质粒为模板)及C肽基因,结束后用H1和C2扩增所述C肽免疫原融合基因,将纯化回收得到的C肽免疫原融合基因及载体PLM1用EcoRⅠ和BamHⅠ酶切,构建PLM1-Core(1-118)-C肽表达载体,将质粒转入大肠杆菌BL21(DE3)感受态细胞,通过用菌落PCR的方法挑选阳性克隆子。将得到的阳性克隆子在LB培养基中培养,用IPTG诱导表达。得到的菌液用镍柱进行亲和纯化,然后采用SDS-PAGE进行鉴定,结果见图2,本发明所述C肽免疫原约17KD。实施例2:本发明所述C肽免疫原的免疫将适量重组C肽免疫原蛋白与等量弗氏完全佐剂混合所得乳化液以0.5ml的剂量皮下注射给BALB/c小鼠(湖南斯莱克景达实验动物有限公司,6周龄雌性,5只)腹部位点,第一次免疫14天后腹腔增强免疫(适量抗原与等量弗氏不完全佐剂混合,每次0.5ml),增强免疫到三针后,采尾血进行效价检测。与此同时用相同的方法将重组C肽-GST蛋白抗原(湖南远泰生物生物技术有限公司生产)及C肽抗原(长沙优宝生物科技有限公司)同时免疫了5只同龄的BALB/c雌性小鼠。效价达到融合要求的BALB/c小鼠,融合前3天,用双倍剂量抗原腹腔注射进行终免。实施例3:BALB/c小鼠血清效价检测用pH9.51×CB缓冲溶液稀释C肽抗原,使其终浓度为2μg/ml,每孔0.1ml加入96酶免反应板,4℃过夜。次日,用含1%BSA的0.02MpH7.2PBS每孔0.2ml,37℃1小时,用于检测。取小鼠尾血,血清稀释倍数依次为:AB行-2000,CD行-20000,EF行-200000,GH行-2000000,第1-5列为C肽抗原免疫的5只小鼠血清,6-10列为本发明C肽免疫原免疫的5只小鼠血清,11-15列为重组C肽-GST蛋白抗原免疫的5只小鼠血清,第16列为空白对照,稀释的血清0.1ml/孔于检测板中,37℃1小时,水洗六次后加入10000倍稀释的辣根过氧化酶标记的羊抗鼠IgG(三诺生物传感股份有限公司),37℃1小时同上洗后,每孔加入100μl含0.02%(M/V)3.3’.5.5’--四甲基联苯胺,0.003%(V/V)双氧水,pH5.0柠檬酸磷酸缓冲液,37℃10分钟,加入1M硫酸溶液,每孔50μl,测450nm吸收值。结果如表1和表2,以稀释度为横轴,OD450所测得的平均值为纵轴绘图3。表112345678A0.1780.1590.2740.2770.1612.6873.1992.55B0.1970.1440.2330.2340.1582.733.0422.517C0.120.1330.1250.1330.1590.7551.8280.659D0.130.1160.1470.1310.1570.6341.7560.723E0.1460.1330.0950.1120.1590.1430.340.17F0.1330.1350.0920.110.1560.1330.3150.135G0.1350.1280.0970.1070.160.0960.1040.088H0.1180.1250.1150.1090.160.0950.1040.09表2910111213141516A3.1792.7551.8791.7741.6291.7391.6720.159B3.0922.8591.5071.4421.321.3911.4620.156C2.7740.820.3410.3860.2990.3690.3080.157D2.7430.8710.3350.3390.2440.2950.3270.156E0.6820.1230.1240.1140.1090.1120.1140.159F0.6460.1340.1150.1250.110.1080.1060.155G0.1530.090.0890.0850.0890.0840.0880.16H0.1380.0930.0840.0790.0820.0870.0810.158图3是根据ELISA方法检测的抗血清效价曲线图,该图反映血清效价的整体趋势,更加直观。从表1-2和图3均可以判断,单纯的C肽抗原因分子量太小几乎不免疫动物产生抗体,C肽-GST重组抗原能产生抗体,但效价不如本发明C肽免疫原高,本发明C肽免疫原血清效价能达到融合要求,符合后续杂交瘤细胞株以及单抗的试验免疫原要求。实施例4:杂交瘤细胞株的建立与抗C肽蛋白单克隆抗体的制备(1)饲养细胞的制备以昆明鼠腹腔巨噬细胞作饲养细胞。在融合前1天,昆明鼠拉颈处死,75%酒精浸泡5-10min,在超净台内,无菌操作下剪开腹部皮肤及腹膜,用无菌吸管注入HAT细胞培养液5-10ml,反复冲洗,回收冲洗液,调整细胞浓度为1×105个/ml,加入96孔细胞培养板,100μl/孔,37℃,5%CO2培养过夜。(2)免疫脾细胞的制备小鼠末次免疫后3-5天,在无菌条件下取出脾脏,制成细胞悬液。(3)骨髓瘤细胞的制备小鼠骨髓瘤细胞Sp2/0,取两大瓶,制成细胞悬液,离心,弃上清,打散。(4)细胞融合及HAT选择杂交瘤在50mL无菌塑胶离心管内,将上述骨髓瘤细胞中加入免疫小鼠脾细胞,1500rpm离心弃上清,充分打散,缓慢加入1ml融合剂(三诺生物传感股份有限公司),融合后1分钟,静置1min,缓慢加入50ml的基础培养液终止细胞融合,1200rpm,离心8分钟。弃上清,100ml的HAT培养基液轻轻混悬,平分于10块有饲养细胞的96孔培养板中,100μl/孔,37℃,5%CO2培养。培养至第7天,换HT培养液。(5)抗体的检测用pH9.51×CB缓冲溶液稀释C肽抗原,使其终浓度为2μg/ml,每孔0.1ml加入96酶免反应板,4℃过夜。次日,用含1%BSA的0.02MpH7.2的PBS每孔0.2ml封闭反应板,37℃1小时,拍干,检测备用。重组融合后第10-14天,取细胞上清0.1ml/孔于检测板中,37℃1小时,水洗六次后加入10000倍稀释的辣根过氧化酶标记的羊抗鼠IgG(三诺生物传感股份有限公司),37℃1小时同上洗后,每孔加入100μl含0.02%(M/V)3.3’.5.5’--四甲基联苯胺,0.003%(V/V)双氧水,pH5.0柠檬酸磷酸缓冲液,37℃10分钟,加入1M硫酸溶液,每孔50μl,测450nm吸收值。以测定值减去空白值≥2.0为阳性细胞孔。(6)有限稀释及阳性克隆筛选用有限稀释法筛选单克隆,单克隆C肽蛋白及Core(1-118aa)蛋白两种蛋白进行抗体表位筛选,仅选取C肽蛋白阳性值≥2.0,而Core(1-118aa)蛋白无阳性的单克隆孔。(7)单克隆抗体的制备6-8周BALB/c雄性小鼠,每只小鼠腹腔注射0.5ml不完全佐剂,7-10天后腹腔注射50万个杂交瘤细胞。接种细胞9-15天后可产生腹水,密切观察动物的健康状况与腹水征象,在小鼠频于死亡之前,腹水尽可能多时,拉颈处死小鼠,用滴管将腹水取出,收集腹水,离心取上清,放于-20℃冰箱保存备用。腹水用3倍体积PBS稀释后加入等体积饱和硫酸铵,用PBS复溶后,4℃透析过夜,再过蛋白A亲和层析柱(购自纽龙生物技术有限公司)。当在OD280nm下的吸附值达到基线时,再用0.1M的洗脱液(pH3.0)洗脱并回收该抗体。所回收的溶液用0.1MTRIS(pH9)中和,中和后4℃透析过夜。(8)单克隆抗体抗体效价测定以间接ELISA法检测,测定抗体的效价,抗体稀释100倍,1000倍,10000倍,100000倍,1000000倍,如表3。表3由表2可知,单克隆抗体效价可达到1000K,说明抗C肽单克隆抗体均有较高的效价。(9)C肽-Core(1-118aa)作为免疫原的可重现性实验按以上描述的方法,用本发明所述C肽免疫原免疫50只BALB/c小鼠,经过克隆筛选,共制备出39株单克隆抗体,其中37株效价高达1000K,效价如下表4-7所示。表4表5表6表7表4-7可以看出,抗体的效价几乎均可达到1000k,利用本发明重组免疫原作为制备C肽单克隆抗体的免疫原,能很好的制备出一批具有高效价的C肽单抗,表明了所述C肽免疫原在制备杂交瘤细胞以及单克隆抗体中高效价的可重现性,能够在产业上进行应用。实施例5:胶体金快速检测试纸的制备1.硝酸纤维素膜的制备包被缓冲液的配制:含3%甲醇、2%蔗糖的0.02MPH7.5Tris缓冲液为包被缓冲液置4℃备用,有效期一周。硝酸纤维素膜的制备:用包被缓冲液将本发明效价在1000K的抗C肽的单克隆抗体抗体稀释到0.5~2mg/ml,划线为T线,即为检测线,T线靠近金标垫端,距金标垫端约7mm;用包被缓冲液将羊抗鼠IgG抗体(Arist)稀释到0.2-0.5mg/ml,划线为C线,即为质控线,C线靠近吸水垫。两线距离3-5mm,均匀。37℃烘干,封装备用。2.胶体金、金标记单克隆抗体的制备(1)溶液的配制①氯金酸的配制:用超纯水溶解氯金酸,配成1%溶液,置4℃备用,有效期3个月。②柠檬酸三钠的配制:用超纯水溶解柠檬酸钠,配成1%溶液,置4℃备用,有效期3天。③0.2M碳酸钾的配制:用超纯水配制,置4℃备用,有效期半年。1000ml0.2M碳酸钾溶液配方:27.6g碳酸钾,超纯水定容至1000ml。④10%BSA的配置:用超纯水配制,置4℃备用,有效期一个月。100ml10%BSA配方:10gBSA粉末,超纯水定容至100ml。⑤标记金重悬液的配制:0.5%酪蛋白(Casein),0.1%叠氮钠(NaN3),0.2%吐温-20,3%蔗糖,0.01MpH7.2PBS溶液,0.22μ膜滤过,置4℃备用,有效期6个月。(2)胶体金颗粒的制备:用超纯水将1%氯金酸稀释成0.04%,置电热套内煮沸,按每100ml加入5ml1%柠檬酸三钠,继续煮沸,直到液体呈亮红色即停止加热。制备好的胶体金外观应纯净、透亮、无沉淀和漂浮物,有效期两周。(3)胶体金标记单克隆抗体的制备:用0.2M碳酸钾调节胶体金的PH值至7-8,按5~10μg抗体/ml胶体金加入本发明抗C肽的单克隆抗体,混匀,搅拌下加入10%BSA至终浓度为0.1%。10000rpm、4℃离心10min,弃上清,将沉淀用适量的标记金重悬液重悬,置4℃备用,有效期半个月。3.金标垫的制备每0.6cmx10cm的金垫,均匀地涂上300ul的5%~20%的金标记抗体,于37℃烘干,封装,干燥防潮箱中保存备用。4.试纸条样品垫的制备(1)样品垫处理液的配制:0.2%吐温-20,1%BSA,、0.05%NaN3,0.01MpH7.2PBS溶液,置4℃备用,有效期两个月。(2)样品垫的制备:将样品垫切割成2.8cmx30cm浸泡于样品垫处理液中5min,37℃烘干,封装,干燥防潮箱中保存备用。5.试纸条的组装将硝酸纤维素膜、金标垫、吸收垫、样品垫按图1依次层叠起来,切成3.0mm宽的试条,20条一小包,加入干燥剂1包,真空封装。室温保存,有效期1年。实施例6:胶体金快速检测试纸检测C肽抗原用实施例5制备的是试条,检测C肽抗原浓度分别为:0,0.5ng/ml,1ng/ml,3ng/ml,5ng/ml,10ng/ml,16ng/ml,20ng/ml检测值判读数据如表8,对应的试条显色情况如图4。表8质控品浓度(ng/ml)00.51.03.05.010.016.020.0对应色卡值BC9C8C7C6C4C2C1根据表8数据以及图4显色效果可以得出,本发明抗C肽的单克隆抗检测指控品由低值到高值,显色也越来越明显,将可以用于定量或半定量检测。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。序列表<110>三诺生物传感股份有限公司<120>一种重组的C肽免疫原及其应用<130>MP1725641<160>8<170>SIPOSequenceListing1.0<210>1<211>118<212>PRT<213>人工序列(ArtificialSequence)<400>1MetSerThrAspProLysProGlnArgLysThrLysArgAspThrAsn151015CysArgProGluAspValLysPheProGlyGlyGlyGlnIleValGly202530GlyValTyrLeuLeuProArgArgGlyProArgLeuGlyValArgThr354045ThrArgLysThrSerGluArgSerGlnProArgGlyArgArgGlnArg505560PheProLysAspArgArgSerThrGlyLysAlaTrpGlyLysProGly65707580ArgProTrpProLeuTyrGlyAsnGluGlyLeuGlyTrpAlaGlyTrp859095LeuLeuSerProArgGlySerArgProSerTrpGlyProThrAspPro100105110ArgHisArgSerArgAsn115<210>2<211>158<212>PRT<213>人工序列(ArtificialSequence)<400>2HisHisHisHisHisHisMetSerThrAspProLysProGlnArgLys151015ThrLysArgAspThrAsnCysArgProGluAspValLysPheProGly202530GlyGlyGlnIleValGlyGlyValTyrLeuLeuProArgArgGlyPro354045ArgLeuGlyValArgThrThrArgLysThrSerGluArgSerGlnPro505560ArgGlyArgArgGlnArgPheProLysAspArgArgSerThrGlyLys65707580AlaTrpGlyLysProGlyArgProTrpProLeuTyrGlyAsnGluGly859095LeuGlyTrpAlaGlyTrpLeuLeuSerProArgGlySerArgProSer100105110TrpGlyProThrAspProArgHisArgSerArgAsnAspGlyArgGlu115120125AlaGluAspLeuGlnValGlyGlnValGluLeuGlyGlyGlyProGly130135140AlaGlySerLeuGlnProLeuAlaLeuGluGlySerLeuGln145150155<210>3<211>93<212>DNA<213>人工序列(ArtificialSequence)<400>3gaagctgaagacttgcaagttggtcaagttgaattgggtggtggtccaggcgcgggtagc60ttgcaaccattggcgttggaaggttctttgcaa93<210>4<211>278<212>DNA<213>人工序列(ArtificialSequence)<400>4atgagcacaaatcctaaacctcaaagaaaaaccaaaagaaacaccaaccgtcgcccagaa60gacgttaagttcccgggcggcggccagatcgttggcggagtatacttgttgccgcgcagg120ggccccaggttgggtgtgcgcacgacaaggaaaacttcggagcggtcccagccacgtggg180agacgccagcccatccccaaagatcggcgctccactggcaaggcctggggaaaaccaggt240cgcccctggcccctatatgggaatgagggactcggctg278<210>5<211>81<212>DNA<213>人工序列(ArtificialSequence)<400>5cgcgcgaattcaggaggaatttaaaatgagaggatcgcatcaccatcaccatcacatgag60cacaaatcctaaacctcaaag81<210>6<211>32<212>DNA<213>人工序列(ArtificialSequence)<400>6agcttcacggccgtccacgttgcgcgacctat32<210>7<211>25<212>DNA<213>人工序列(ArtificialSequence)<400>7gacggccgtgaagctgaagacttgc25<210>8<211>21<212>DNA<213>人工序列(ArtificialSequence)<400>8ggatccttgcaaagaaccttc21当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1