基于花菁的有机化合物、中间体及应用的制作方法
本发明涉及荧光探针,具体的说是一种基于花菁的有机化合物、中间体及应用。
背景技术:
生物体内存在多种内源性活性物种,包括活性氧物种、活性硫物种、活性氮物种等。超氧阴离子(O2·-)是存在于细胞中的众多活性氧中最重要的一种,其在不同的生理和病理过程中起着重要的作用。活性硫物种(Reactive Sulfur Species,RSS)是生物体内一类含硫分子的总称,是生物体内最重要的内源性活性物种之一。活性硫物种在调节生物体内氧化还原稳态以及其他过程如健康和疾病中都起着至关重要的角色。硫烷硫是活性硫物种的一种,是指以6价电子的形式(S0)可逆地附着在其它硫原子上的离子化硫。硫烷硫有多种存在形式:单质硫(S8)、过硫化物
(R-S-SH)、聚硫化物(R-S-Sn-S-R)和多硫化氢(H2Sn,n≥1)等。其中多硫化氢,作为硫化氢的直接氧化形式,被认为是替代硫化氢的新的信号分子。主要是因为越来越多研究表明,由硫化氢参与的生理性活动其实际上是由多硫化氢介导的,而硫化氢只是多硫化氢生理性活动所释放的标志物。除此之外,研究表明,多硫化氢的产生依赖活性氧对细胞的刺激并产生于线粒体中。因此,详细的了解多硫化氢在正常和疾病状态下的产生、分布和生理功能,以及多硫化氢与超氧阴离子之间的相互关系,对阐明细胞信号转导机制有着重要的意义。
目前,用于检测O2·-的方法有:电子顺磁共振法,SOD酶活性测定法,高效液相色谱法(HPLC)以及电化学方法。对多硫化氢的检测方法主要为比色法,电化学分析,色谱分析法。然而这些方法大都需要样品的预处理及大型检测设备,因此不适合在生物体内进行原位、实时的检测。荧光探针方法以其高时空分辨、操作简便和原位非损伤检测等优点,能够在细胞水平上可实现原位、实时、动态的可视化检测,因此该技术在生物活性物种检测领域,已成为一种功能强大的研究辅助工具。
技术实现要素:
本发明的目的在于提供一种基于花菁的有机化合物、中间体及应用。
为实现上述目的,本发明采用的技术方案为:
一种基于花菁的有机化合物,基于花菁的有机化合物结构式Ⅰ所示,
所述获得式Ⅰ所示基于花菁的有机化合物的中间体式II所示化合物,
一种基于花菁的有机化合物的应用,所述基于花菁的有机化合物在定性/定量地检测O2·-和H2Sn中的应用。
所述基于花菁的有机化合物在定性/定量地检测模拟生理环境下、细胞或生物体内外的O2·-和H2Sn中的应用。
一种荧光探针,探针为结构式如式Ⅰ所示的有机化合物。
一种荧光探针的应用,所述探针在定性/定量地检测O2·-和H2Sn中的应用。
所述探针在定性/定量地检测模拟生理环境下、细胞或生物体内外的O2·-和H2Sn中的应用。
本发明的有益效果:
本发明化合物作为荧光探针,在一定量活性氧刺激下,进而用于检测O2·-和H2Sn的探针,其在检测O2·-和H2Sn前后荧光探针吸收和荧光发射波长会有改变。可用于水体系、模拟生理环境和细胞内O2·-和H2Sn水平的检测,并可大大降低外部检测条件的干扰,提高检测精度。本发明化合物用作荧光探针,可用于细胞内O2·-和H2Sn检测,这对深入研究O2·-和H2Sn在生物体内的信号转导过程和机理,进一步了解O2·-和H2Sn的生理和病理作用具有重要的生物医学意义。本发明具有灵敏度高,选择性好,响应时间短,可对检测目标物进行原位、实时监测,且应用范围广泛等优点。
附图说明
图1为本发明实施例提供的采用的荧光探针对不同浓度O2·-和H2Sn检测前后荧光光谱变化图。
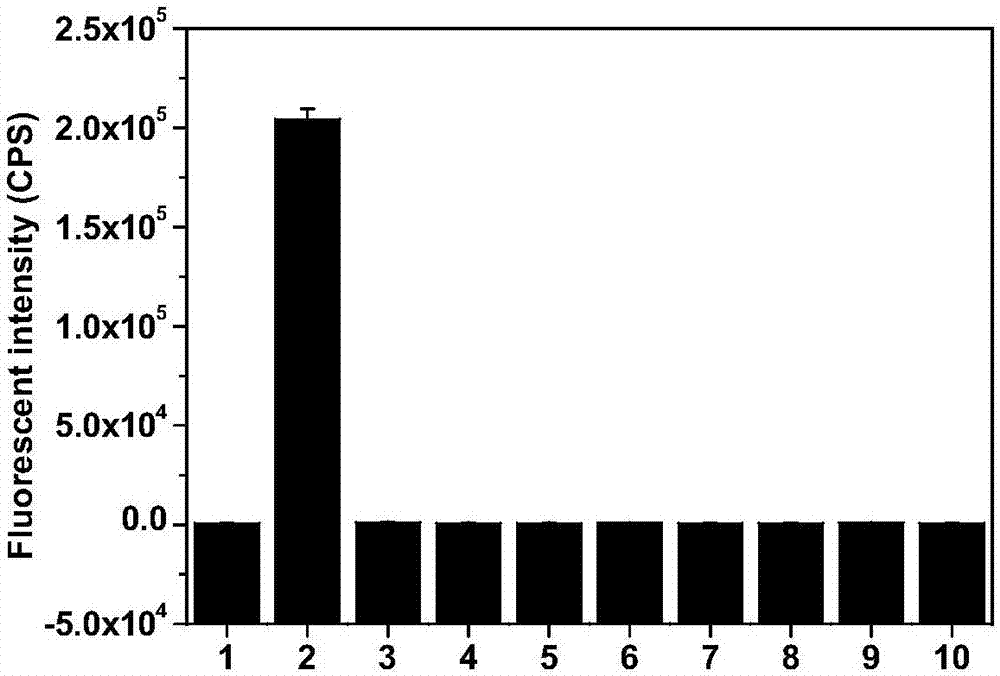
图2为本发明实施例提供的所采用的荧光探针对O2·-的选择性示意图;其中,横坐标从左至右依次为:1、空白;2、O2·-(10μM);3、羟基自由基(10μM);4、双氧水(100μM);5、过氧化亚油酸(100μM);6、枯烯氢过氧化物(100μM);7、过氧化叔丁醇(150μM);8、一氧化氮(100μM);9、过氧化亚硝酰阴离子(20μM);10、次氯酸(100μM)。
图3为本发明实施例提供的所采用的荧光探针对H2Sn的选择性示意图;其中,横坐标从左至右依次为:1、空白;2、二硫化钠(10μM);3、四硫化钠(10μM);4、多硫化半胱氨酸(20μM);5、S8(20μM);6、硫氢化钠(100μM);7、谷胱甘肽(100μM);8、氧化型谷胱甘肽(100μM);9、半胱氨酸(100μM);10、胱氨酸(100μM);11、同型半胱氨酸(100μM)。
图4为本发明实施例4提供的所采用的荧光探针(1μM)孵育细胞15分钟后,用于检测细胞内本底O2·-的共聚焦显微镜照片。
图5为本发明实施例4提供的所采用的荧光探针(1μM)孵育细胞15分钟后,再加入O2·-(1μM)培养15分钟,用于检测细胞内外加O2·-共聚焦显微镜照片。
图6为本发明实施例4提供的所采用的荧光探针(1μM)孵育细胞15分钟后,用于检测细胞内本底H2Sn的共聚焦显微镜照片
图7为本发明实施例4提供的所采用的荧光探针(1μM)孵育细胞15分钟后,再加入Na2S4(1μM)培养15分钟,用于检测细胞内外加H2Sn共聚焦显微镜照片。
具体实施方式
下面结合附图对本发明作进一步的限定,但本发明不限于实施例。本发明化合物如结构式I所示,以所述化合物作为检测O2·-和H2Sn的荧光探针。本发明所述荧光探针,在O2·-和H2Sn存在下,对应的荧光发射波长和强度发生变化,可用于O2·-和H2Sn的检测,并可大大降低外部检测条件的干扰,提高检测精度。本发明化合物作为荧光探针可用于细胞内外O2·-和H2Sn水平的检测,对深入研究O2·-和H2Sn的细胞信号转导,尤其是对研究H2Sn在活细胞内的生理和病理作用,具有重要的生物医学意义。
基于花菁的有机化合物结构式为:
将式Ⅰ化合物加入待测定水体、模拟生理环境或生物体内外中,与O2·-反应,导致式Ⅰ化合物的荧光强度和波长的改变,得结构式II结构的化合物。因此利用式Ⅰ化合物可对O2·-进行定性、定量的检测。
式II化合物进一步的与待测定水体、模拟生理环境或生物体内外中的H2Sn反应,导致式II化合物的荧光强度和波长的改变,得结构式III结构的化合物。因此利用式II化合物可对H2Sn进行定性、定量的检测。
实施例1
基于花菁的有机化合物的制备:
本发明基于花菁的有机化合物,式Ⅰ化合物中所示花菁类荧光团为市售商品,然后在荧光团指定的位置修饰上不同的检测基团,得到的相应的花菁类化合物。具体实施例如下:
(1)化合物II的制备
将对甲胺硝基苯(0.06g,0.4mmol)溶解在20ml无水DMF的圆底烧瓶里,室温条件下,加入0.0167g氢化钠,在氩气保护下搅拌15分钟。然后将花菁荧光团(0.255g,0.4mmol)加入到上述溶液里,室温反应1小时。用过量的饱和碘化钾溶液洗涤,洗涤后再用二氯甲烷萃取,旋蒸得粗产物。粗产品用柱层析色谱进行纯化,洗脱机选择二氯甲烷:甲醇=1:4,得到化合物II,0.17g,产率68%。LC-MS(API-ES):m/z C41H47N4O2+Calcd 627.37,found[M+H]+627.37.
(2)式Ⅰ化合物的制备
将化合物II(0.12g,0.22mmol)溶于10mL乙醇中,将NaBH4(0.0155g,0.41mmol)溶解在2ml乙醇中,冰浴条件下,将2mL的NaBH4溶液逐滴滴加到圆底烧瓶中,在氩气保护下反应10分钟。反应后用稀盐酸中和,用除氧的饱和碘化钾溶液洗涤和二氯甲烷萃取,旋蒸得粗产物。粗产品用柱层析色谱进行纯化,洗脱剂选择二氯甲烷和甲醇(5:1/v/v),得到0.059g(0.09mmol)黄色固体式Ⅰ化合物,产率42.7%。LC-MS(API-ES):m/z C41H48N4O2Calcd 628.38,found[M+H]+628.38.
实施例2
将制备所得式Ⅰ化合物作为荧光探针应用于水体系、模拟生理环境和活细胞内对O2·-和H2Sn进行检测,模拟生理条件,以下各项实验均在pH=7.4条件下进行(HEPES缓冲溶液,浓度为10mM),探针浓度采用10μM。细胞实验中探针所采用1μM。
上述制备所得式Ⅰ化合物作为探针对O2·-的响应:
于每个10ml比色管中加入不同浓度的O2·-(0-10μM),用10mMHEPES(pH 7.4)定容到10ml,最后加入式Ⅰ化合物(最终浓度10μM)。摇匀溶液,25℃下平衡15分钟后,吸取1ml溶液到荧光皿中测定荧光光谱。在700-840nm处测定荧光光谱(参见图1)。上述工作液检测后于各个10ml比色管中继续加入Na2S4(0-10μM),摇匀溶液,25℃下平衡15分钟后,吸取1ml溶液到荧光皿中测定荧光光谱。在700-840nm处测定荧光光谱(参见图1)。
上述式Ⅰ化合物可用于实现生物体内的O2·-检测,式Ⅰ化合物与O2·-反应后产物结构为化合物II,结构如下:
再进一步的由式Ⅰ化合物与O2·-反应所生成的化合物II,能够对H2Sn进行进一步检测,化合物II与Na2S4反应后生成化合物III,产物结构如下:
实施例3
式Ⅰ化合物对O2·-的选择性
pH采用HEPES缓冲溶液控制在7.4。取多个10mL比色管,并在每个10mL比色管中加入待测物,用10mM HEPES(pH 7.4)定容到10ml,最后加入式Ⅰ化合物(最终浓度10μM)。摇匀溶液,25℃下平衡15min后,将各个比色管中工作液分别倒入到荧光皿中测定荧光强度。式Ⅰ化合物对O2·-的选择性如图2所示,待测物依次为:1、空白;2、O2·-(10μM);3、羟基自由基(10μM);4、双氧水(100μM);5、过氧化亚油酸(100μM);6、枯烯氢过氧化物(100μM);7、过氧化叔丁醇(150μM);8、一氧化氮(100μM);9、过氧化亚硝酰阴离子(20μM);10、次氯酸(100μM)。经上述操作后,向各个比色管中继续加入Na2S4(0-10μM),如图3所示,待测物依次为:1、空白;2、二硫化钠(10μM);3、四硫化钠(10μM);4、多硫化半胱氨酸(20μM);5、S8(20μM);6、硫氢化钠(100μM);7、谷胱甘肽(100μM);8、氧化型谷胱甘肽(100μM);9、半胱氨酸(100μM);10、胱氨酸(100μM);11、同型半胱氨酸(100μM)。摇匀溶液,25℃下平衡15min后,将各个比色管中工作液分别倒入到荧光皿中测定荧光强度。化合物II对H2Sn的选择性如图3所示。
并由图2可知式Ⅰ化合物对O2·-具有很好的选择性。由图3可知探针对H2Sn具有很好的选择性,在测定条件下对其他活性硫物种不能使化合物II荧光变化。
实施例4
式Ⅰ化合物在A549细胞内的成像
小鼠肺癌细胞A549作为生物模型,按照American type Tissue Culture Collection规定进行培养至细胞密度为50%左右。首先,在37℃下,A549细胞用化合物I(1μM)孵育15分钟后用PBS冲洗细胞三次作为对照组,细胞显示无荧光(图4)。然后,而后向上述体系细胞的处理和对照组一样,加入O2·-(1μM)孵育15分钟,用PBS冲洗细胞三次,有明显的荧光生成(参见图5)。因此,化合物I可用于检测活细胞外源添加的O2·-。
在37℃下,细胞用化合物II(1μM)孵育15分钟后用PBS冲洗细胞三次作为对照组,细胞在755-845nm处显示有微弱荧光(图6)。而后向上述体系细胞的处理和对照组一样,然后Na2S4(1μM)加入到细胞中,15分钟后共聚焦成像,有强烈的荧光生成(参见图7)。因此,探针可以用来直接检测活细胞外源添加的H2Sn。
由上述可见本发明所述荧光探针,在O2·-和H2Sn存在下,对应的荧光发射波长和强度发生变化,可用于O2·-和H2Sn的检测,并可大大降低外部检测条件的干扰,提高检测精度。这类化合物作为荧光探针可用于细胞内外O2·-和H2Sn水平的检测,对深入研究O2·-和H2Sn的细胞信号转导,尤其是对研究H2Sn在活细胞内的生理和病理作用,具有重要的生物医学意义。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。作为荧光染料是本发明新化合物的一种用途,不能认定本发明的化合物仅用于荧光染料,对于本发明所属技术领域的普通技术人员来说,在基于本发明化合物用作荧光染料的相同作用机理的考虑下,还可以做出若干简单推理,得出本发明的化合物的其他应用用途,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种锌配合物晶体的制造方法与工艺
- 有机化合物及有机光电装置及显示装置的制造方法
- 有机化合物、电荷传输材料、组合物、有机场致发光元件、显示装置及照明装置的制造方法
- 有机化合物、组合物、有机光电装置以及显示装置的制造方法
- 一种有机锡分子印迹聚合物微球,固相萃取柱及其应用的制造方法与工艺
- 一种有机化合物,包含该化合物的有机电致发光器件材料及包含该材料的有机电致发光器件的制造方法与工艺
- 一种有机化合物,包含该化合物的有机电致发光器件材料及包含该材料的有机电致发光器件的制造方法与工艺
- 带偶氮功能基团共价有机化合物作为气体吸附材料的应用的制造方法与工艺
- 有机化合物、有机光电装置及显示装置的制造方法
- 一种手性锌配合物的制造方法与工艺
- 一种有机化合物及其在有机电致发光器件中的应用的制造方法与工艺
- 一种有机化合物,包含该化合物的有机电致发光器件材料及包含该材料的有机电致发光器件的制造方法与工艺
- 一种有机化合物,包含该化合物的有机电致发光器件材料及包含该材料的有机电致发光器件的制造方法与工艺
- 带偶氮功能基团共价有机化合物作为气体吸附材料的应用的制造方法与工艺
- 有机化合物、有机光电装置及显示装置的制造方法
- 液态电极易挥发有机化合物净化装置的制造方法
- 新颖的有机化合物及包含该有机化合物的有机发光元件的制作方法
- 液态电极易挥发有机化合物净化装置的制造方法
- 有机化合物和组合物以及有机光电装置和显示装置的制造方法
- 采用色烯或色满染料、特定的有机化合物、氧化剂、碱剂及金属盐的头发着色方法