洗脱溶液的制作方法
发明的技术领域
本发明涉及放射性药物领域,且尤其涉及适用于正电子发射断层摄影(PET)的化合物的制备。本发明还提供可用于合成用18F标记的化合物的方法。本发明还提供放射性氟化反应,其包括本发明的方法和方便地进行本发明的方法和放射性氟化反应的盒。
相关技术描述
用[18F]氟离子(18Fˉ)亲核取代目前是获得用于PET成像的[18F]-标记的示踪剂的最重要的途径(Schubiger等编,“PET Chemistry: The Driving Force of Molecular Imaging(PET化学:分子成像的驱动力)”(在Ernst Schering Res Found Workshop; 2007: 62中);2007 Springer GmbH)。
18F-通常作为水溶液通过质子照射[18O]水自核反应18O(p,n)18F生成(Ruth和Wolf,Radiochim. Acta 1979; 26: 21)。众所周知,以水性形式的18Fˉ的反应性不是非常高且需要许多操作来提供反应性亲核试剂。一个重要的步骤是加入阳离子反荷离子(例如,Kryptofix和钾的阳离子络合物或TBA+)。通常,18Fˉ的水溶液首先吸附到阴离子交换树脂上(Schlyer等,Appl Rad Isotop 1990; 41: 531),接着用含有碳酸盐如K2CO3或KHCO3且伴随有穴状配体如Kryptofix™ (K222)或四丁基铵的水性乙腈溶液洗脱 (Hamacher等,J Nucl Med 1986; 27: 235;Brodack等,App Rad Isotop 1988; 39: 699)。或者,如由McConathy等(Appl Rad Isotop 2003; 58: 657-666)所述,该18Fˉ可用碳酸盐从阴离子交换柱洗脱且将其加到穴状配体在乙腈中的溶液中。乙腈是洗脱溶液的主要溶剂选择,因为在其中K[18F]/Kryptofix或四丁铵18Fˉ具有优异的溶解性。并且,假定使18F-具有反应性的下一步骤通常包括使用乙腈来提供较低沸点的共沸物以便除去水,这使得在加入阳离子反荷离子的步骤中使用乙腈作为溶剂是明智之举。
在本领域中描述了使用制备18Fˉ的这些标准方法来合成各种PET示踪剂。具体地讲,在加入阳离子反荷离子的步骤中使用乙腈是一致的特点,如由例如以下文献所述:Yu (Biomed Imaging Interven J 2006; 2 (4): 1-11)在2-脱氧-2-[18F]氟代葡萄糖([18F]-FDG)的合成中;Oh等(Nuc Med Biol 2005; 32(8): 899-905)在1-H-1-(3-[18F]氟-2-羟基丙基)-2-硝基咪唑([18F]FMISO)的合成中;Oh等(Nuc Med Biol 2004; 31: 803-809)在3-脱氧-3-[18F]氟代胸腺嘧啶(18F-FLT)的合成中;McConathy等(Appl Rad Isotop 2003; 58: 657-666)在1-氨基-3-[18F]氟环丁烷-1-甲酸([18F]FACBC)的合成中;Kryza等(Nuc Med Biol 2008; 35: 255-260)在[18F]氟代胆碱的合成中;Ackerman等(2011 J Label Comp Radiopharm; 54: 788-794)在2-[(4-[18F]氟苯甲酰氧基)甲基]-1,4-萘醌的合成;和Sun等(Nuc Med Biol 2006; 33: 153-158)在[18F]氟代乙酸钠的合成中。
传统上,洗脱溶液是在合成当天新鲜制备的,但现代正电子发射断层摄影(PET)示踪剂生产商可能为了方便而制备散装溶液或用于储存的预填充小瓶。预填充小瓶的使用允许更明确限定、可靠且可重现的合成方法(Hjelstuen等,Eur J Pharm Biopharm 2011; 78: 307)。另外,预填充小瓶可在低生物负载和所记录的储存期限下制造,与手动混合溶液相比,其充当对于生产质量管理规范(GMP)品质的较好起始点。
已知乙腈在碱性pH下将水解,如在图1中所示出,以两步机制形成乙酰胺和乙酸铵(Chin, Acc Chem Res 1991; 24: 145):
。
上述反应的速率常数比较低。乙酸盐通常被视为弱亲核试剂且将不会对18F标记过程造成任何问题。并且,乙酰胺是已知的[18F]氟离子标记溶剂且认为不会不利地影响18F标记反应(Knust等,J Radioanal Chem 1982; 74: 283;Knust等,Appl Radiat Isot 1986; 37: 853)。
然而,本发明人现在观察到,在[18F]FACBC和[18F]FDG的合成中使用的包含乙腈的洗脱溶液在室温或更高温度下储存期间产生mg/ml水平的乙酰胺和乙酸铵,这在合成反应中导致先前没有意识到的问题。发现[18F]FACBC合成受洗脱液变劣的影响,当洗脱溶液在30℃下储存12个月时,RCY从62.5%降低到44.7%。当洗脱液在50℃下储存时,[18F]FDG的合成受到影响,在储存3个月之后,RCY从86.8%降低到66.7%。
根据这些最新意识到的问题,需要研究合成18F-标记的PET示踪剂的新策略。
发明概述
本发明提供制备用于放射性氟化反应的18F-氟离子(18Fˉ)的新方法,其具有优于已知方法的优点。本发明的方法在制备散装溶液并将其储存在预填充小瓶中而不是在合成当天新鲜制备的情况下特别有利。本发明还提供了放射性氟化反应,其包括本发明的方法;以及用于在自动放射合成设备上进行本发明的方法和/或本发明的放射性氟化方法的盒。
附图简述
图1为表示在5℃、25℃和40℃下储存期间在[18F]FACBC和[18F]FDG洗脱液小瓶中产生的乙酰胺的曲线图(n = 2-3)。
图2为表示在5℃、25℃和40℃下储存期间在[18F]FACBC和[18F]FDG洗脱液小瓶中产生的乙酸盐的曲线图(n = 2-3)。
图3表示洗脱液在30℃(●)、40℃(♦)下储存之后[18F]FACBC的RCY及洗脱液在25℃(■)、40℃(▲)下储存之后[18F]FDG的RCY。
图4表示具有甲醇(MeOH)的洗脱液在30℃(▲)、50℃(●)下储存之后[18F]FACBC的RCY及具有乙腈(MeCN)的洗脱液在30℃(♦)、40℃(■)下储存之后[18F]FDG的RCY。
发明详述
一方面,本发明提供制备用于放射性氟化反应的18Fˉ的方法,其中所述方法包括:
(i) 将18Fˉ的水溶液捕集到离子交换柱上;和
(ii) 使洗脱溶液通过所述18Fˉ吸附到其上的所述离子交换柱以获得18Fˉ洗脱液,其中所述洗脱溶液包含在合适溶剂中的阳离子反荷离子,其前提条件为所述洗脱溶液不包含乙腈。
在本发明的上下文中术语“放射性氟化”是指用于制备18F-标记化合物的放射化学反应,其中使18Fˉ与前体化合物反应,所述前体化合物包含适合用18Fˉ亲核取代的取代基。
术语将18Fˉ的水溶液“捕集”到离子交换柱上是指使18F-保留在离子交换柱上的过程。在本发明的上下文中,合适的“离子交换柱”为保留18F-且在来自核反应18O(p,n)18F的水溶液通过时允许H218O通过的固相萃取(SPE)柱。优选所述离子交换柱为阴离子交换柱,最优选为甲基季铵盐(QMA)柱。
术语“18Fˉ洗脱液”是指包含18Fˉ的溶液,且所述洗脱溶液在使洗脱溶液通过离子交换柱时获得。
所述“洗脱溶液”不含乙腈,且优选由在所述合适溶剂中的所述阳离子反荷离子组成。
在本发明的上下文中的“阳离子反荷离子”为在与18Fˉ组合时用以改善18Fˉ的反应性的带正电荷的反荷离子。适用于本发明方法的合适阳离子反荷离子的实例包括大但软的金属离子,诸如与穴状配体络合的铷、铯、钾或者四烷基铵盐。优选的阳离子反荷离子为穴状配体的金属络合物,最优选其中所述金属为钾且其中所述穴状配体为Kryptofix 222。
所述洗脱溶液的“合适溶剂”不包括任何乙腈。优选所述合适溶剂为烷醇,且优选为乙醇或甲醇,最优选为甲醇。所述合适溶剂为100%烷醇或者为“烷醇的水溶液”。例如,所述合适溶剂可包括在60:40-100:0范围内、优选在80:20-100:0范围内且最优选在90:10-100:0范围内的烷醇:水比率。一定量的水可有助于18Fˉ的一致洗脱,但优选具有尽可能少的水,因为水的百分数与随后的干燥时间成正比。
本发明的方法在洗脱溶液方便地制备成散装溶液和/或在用于储存用的预填充小瓶中的情况下最有利。如在现有技术的描述中所提到,预填充小瓶的使用容许更明确限定、可靠且可重现的合成方法 (Hjelstuen等,Eur J Pharm Biopharm 2011; 78: 307),且预填充小瓶可在低生物负载和所记录的储存期限下制造,与手动混合溶液相比,其充当对于生产质量管理规范(GMP)品质的较好起始点。
本发明的方法任选可包括另外的步骤:
(iii) 干燥在步骤(ii)中自所述柱洗脱的所述18Fˉ。
术语“干燥”是指使所述合适溶剂(如上所述)蒸发以产生无水18Fˉ。该干燥步骤合适地通过加热和/或使用诸如乙腈的溶剂以提供较低沸点的共沸物来进行。
18F-标记的PET示踪剂借助于自动放射合成设备方便地制备。存在这样设备的多个市售实例。诸如FASTlabTM(GE Healthcare)的设备包括在其中进行放射化学的一次性盒,所述一次性盒安装到所述设备上以进行放射合成。
在一个优选的实施方案中,本发明的方法自动进行。最优选本发明的方法在适合供自动放射合成设备使用的盒上进行。
术语“自动”是指其中工艺主要使用机器或设备进行,即,包括最少的手动步骤。
术语“盒”是指在其中进行放射化学的一次性装置。所述盒安装到自动合成设备以便进行放射合成且通常包括流体路径、反应容器和用于接收试剂小瓶的口以及在后放射合成清除步骤中使用的任何固相萃取柱。存在“自动合成设备”的多个市售实例,包括TRACERlabTM和FASTlabTM (GE Healthcare Ltd)。
另一方面,本发明提供获得18F-标记的正电子发射断层摄影(PET)示踪剂的放射性氟化反应,其中所述放射性氟化反应包括前体化合物与18Fˉ的反应,其中所述前体化合物可包含一个或多个保护基团,且其中所述18Fˉ通过如本文定义的方法获得。
与本发明的放射性氟化反应共有的本发明方法的任何特点的合适且优选的实施方案也适于本发明的放射性氟化反应。
“18F-标记的PET示踪剂”为18F-标记化合物,当施用到受试者时,其优选结合到所述受试者体内的特定目标以使得所述目标可通过所述受试者外部使用PET成像检测来自18F的发射而成像。术语“PET成像”是指在体内生成功能性过程的三维图像或图片的核医学成像技术。所述技术检测由作为PET示踪剂的一部分引入体内的诸如氟-18的正电子发射放射性核素间接发射的γ射线对。随后体内示踪剂浓度的三维图像通过计算机分析构建。
“前体化合物”包含18F-标记的PET示踪剂的非放射性衍生物,其设计成使得与18Fˉ的化学反应就地发生,具体地讲,可在最少数量的步骤中(理想地,在单个步骤中)进行且不需要显著的纯化(理想地,不再进行纯化),从而给出18F-标记的PET示踪剂。所述前体化合物为合成的且可以良好的化学纯度方便地获得。
合适的“保护基团”在本领域中熟知且由Theodora W. Greene和Peter G. M. Wuts在“Protective Groups in Organic Synthesis(有机合成中的保护基团)”(第四版,John Wiley & Sons, 2007)中更加详细地论述。
技术人员应了解,本文所述的本发明方法可用于制备可使用用18Fˉ的亲核放射性氟化制备的任何18F-标记的PET示踪剂。所述18F-标记的PET示踪剂的非限制性实例包括在下表1中列出的18F-标记的PET示踪剂:
在上表1中列出的反应是本领域中的常见常识且例如描述在“Fluorine in Medicinal Chemistry and Chemical Biology(在医药化学和化学生物中的氟)(Wiley 2009, Ojima编)”的第14章;“Handbook of Radiopharmaceuticals: Radiochemistry and Applications(放射性药物手册:放射化学和应用)(Wiley 2003, Welch和Redvanley编)的第6章;“Basic Sciences of Nuclear Medicine(核医学的基础科学)”(Springer 2011, Khalil编)的第6章;和“Molecular Imaging: Radiopharmaceuticals for PET and SPECT(分子成像:用于PET和SPECT的放射性药物)”(Springer 2009, Vallabhajosula编)的第10章中。
在一个优选的实施方案中,所述18F-标记的PET示踪剂为[18F]FDG、[18F]FMISO、[18F]FLT和[18F]FMISO中的一种,最优选为[18F]FDG或[18F]FACBC,且最特别优选为[18F]FACBC。
在本文关于基于乙腈的洗脱溶液的储存报道的实验中,发现,与[18F]FDG相比较,在[18F]FACBC的标记期间乙酸盐的浓度高3倍:
与[18F]FDG相比较,在[18F]FACBC的合成中,更多的洗脱液(1105μl相比825μl)且因此更多的乙酸盐引入反应容器中。该差别在标记期间增大,因为对于[18F]FACBC来讲,用于标记的体积较小(1.0ml相比1.6ml)。这些重合因子(coincidental factor)如较小体积的洗脱液和较大体积的标记溶剂使得与[18F]FACBC反应相比较如本文所述的[18F]FDG的合成更耐洗脱液储存。可能在别处的[18F]FDG合成设置会更倾向于洗脱液储存(It may well be that [18F]FDG synthesis setups elsewhere could be more prone to eluent storage)。在其他18F-标记的PET示踪剂如上文列出的18F-标记的PET示踪剂的情况下,可同样如此,且本发明因此为易于实施且对最后产品的品质没有损害的溶液。
最优选的是,本发明的放射性氟化反应自动进行,最优选在如上述合适且优选的自动放射合成设备上自动进行。
又一方面,本发明提供用于在自动合成设备上进行放射性氟化反应的盒,其中所述盒包括:
(i) 适合捕集18Fˉ的水溶液的阴离子交换柱,其中所述阴离子交换柱如本文中所定义;
(ii) 含有如本文定义的洗脱溶液的第一容器;
(iii) 含有在与18Fˉ反应时产生如本文定义的18F-标记的PET示踪剂的前体化合物的第二容器,其中所述18Fˉ通过如本文定义的方法得到。
与本发明的盒共有的本发明方法和/或本发明的反射性氟化反应的任何特点的合适且优选的实施方案也适于本发明的盒。
实施例简述
实施例1描述储存的现有技术洗脱溶液的分析。
实施例2描述使用储存的洗脱液相比新鲜制备的洗脱液的[18F]FACBC和[18F]FDG的合成。
实施例3描述使用储存的本发明洗脱液相比新鲜制备的本发明洗脱液的[18F]FACBC的合成。
在实施例中使用的简写表
ATR 衰减全反射
DTGS 氘化硫酸三甘肽
[18F]FACBC 1-氨基-3-[18F]氟环丁烷-1-甲酸
[18F]FDG 2-脱氧-2-[18F]氟-D-葡萄糖
FT-IR 傅里叶变换红外
K222 Kryptofix 222
MeCN 乙腈
MeOH 甲醇
QMA 甲基季铵盐
RCY 放射化学产率
SPE 固相萃取
TLC 薄层色谱
UV 紫外光。
实施例
所有试剂和溶剂都自Merck购买且不经进一步纯化而使用。[18F]FDG前体:1,3,4,6-四-O-乙酰-2-O-三氟甲磺酰基-β-D-吡喃甘露糖自ABX购买,而[18F]FACBC前体:顺-1-(N-(叔丁氧基羰基)氨基)-3-[[(三氟甲基)磺酰基]氧基]-环丁烷-1-甲酸乙酯自GE Healthcare获得。Oasis HLB plus柱和Sep-Pak柱:QMA light Plus (K2CO3形式)、tC18 light、Alumina N light自Waters (Milford, MA, USA)购买。对于所有放射性测量使用Capintec NaI离子室(CRC15R型)。放射薄层色谱(radio-TLC)在Packard瞬时成像器上使用硅胶预涂板(Merck 60F254)进行。
实施例1:现有技术洗脱溶液的储存
将用涂覆有Fluorotec® (West)的氯化丁基橡胶塞(chlorobutyl stopper)盖住且在填充洗脱溶液之后用铝盖密封的3.0ml的由1型硼硅酸盐玻璃组成的FASTlab洗脱液小瓶(FIOLAX, mglas AG, Münnerstadt, Germany)用于储存对于[18F]FACBC或[18F]FDG合成优化的两种洗脱溶液。
洗脱溶液如下:
所述小瓶使用5℃、25℃、30℃、40℃和50℃的储存温度在暗处在竖直位置储存。两种洗脱液储存9个月的时间,在此期间测量乙酰胺和乙酸盐的水平。乙酰胺使用具有DTGS检测器和单一反射金刚石ATR(来自SensIR Technologies的DuraSamplIR II)的Perkin Elmer Spectrum 2000 Explorer FT-IR光谱仪通过红外光谱量化。乙酸盐通过具有UV检测的液相色谱(Agilent 1100系列)量化。
如在图1(在5℃、25℃和40℃下储存期间在FACBC和FDG洗脱液小瓶中产生的乙酰胺;n = 2-3)和图2(在5℃、25℃和40℃下储存期间在FACBC和FDG洗脱液小瓶中产生的乙酸盐;n = 2-3)中所见,在9个月的储存期期间产生了显著水平(mg/mL)的乙酰胺和乙酸盐。
实施例2:用储存的现有技术洗脱液相比新鲜制备的现有技术洗脱液的[18F]FACBC和[18F]FDG的合成
[18F]FACBC和[18F]FDG的合成用新鲜制备的洗脱液和储存的洗脱液进行试验以研究所产生的乙酰胺和乙酸铵的水平对RCY的影响。
没有加入载体的[18F]氟离子在GE PETtrace 6回旋加速器(Norwegian Cyclotron Centre, Oslo)上经由18O(p,n)18F核反应生成。使用16.5MeV质子使用双电子束30μA电流对具有HAVAR箔片的两个相同的Ag靶进行照射。每个靶含有1.6ml ≥96% [18O]水(Marshall Isotopes)。在照射并传送到热室之后,将各个靶用1.6ml的[16O]水(Merck,用于GR分析的水)洗涤,在3.2ml [16O]水中得到约2-5Gbq。
所有放射化学都在具有单次使用盒的市售GE FASTlabTM上进行。各盒构造在具有25个三通活塞的整体成型的、全部由聚丙烯制成的支管周围。简要地讲,所述盒包括1个5ml反应器(环烯烃共聚物)、一个1ml注射器和两个5ml注射器、用于与5个预填充小瓶连接的尖头、一个水袋(100ml)以及各种SPE柱和过滤器。流体路径用氮气吹扫、真空和这三个注射器控制。该完全自动的系统经设计用于用回旋加速器生成的[18F]氟离子的单步氟化。FASTlab通过软件包对逐步时间依赖性事件顺序如移动注射器、氮气吹扫、真空和温度调节进行编程。对单独的盒定制[18F]FDG和[18F]FACBC的合成,但两种合成都遵循这三个通用步骤:(a) [18F]氟化、(b) 保护基团水解和(c) SPE纯化。
[18F]FDG的现有技术合成
小瓶A含有在79.5% (v/v) MeCN(水性)(825µl)中的K222 (43.7mg,117µmol)、K2CO3(7.8mg,56.7µmol)。小瓶B含有在具有1700ppm水的2.0ml MeCN中的前体(39mg,81.2µmol)。小瓶C含有MeCN (4.1ml)。小瓶D含有2M NaOH (4.1ml)。小瓶E含有2.3M膦酸(4.1ml)。水性[18F]氟离子(1ml,100-200Mbq)通过QMA且进入8O-H2O回收小瓶中。捕集的[18F]氟离子使用来自小瓶A的洗脱液(450µl)洗脱到反应器中且随后通过与乙腈(80µl,小瓶C)共沸蒸馏浓缩以干燥。将来自小瓶B的约1.6ml的前体溶液(相当于31.2mg;65μmol前体)加到反应器中且在125℃下加热2分钟。将反应混合物用水稀释且使其通过tC18柱。将反应器用水洗涤且使其通过tC18柱。将固定在tC18柱上的标记的中间体首先用水洗涤,随后用2M NaOH (2.0ml)温育2分钟。将粗混合物与水(1.5ml)和2.3M膦酸(1.5ml)混合且使其通过HLB和Alumina柱进入由玻璃制成的产品小瓶(30ml)中。随后使水(9ml)通过HLB和Alumina柱且进入产品小瓶中。[18F]FDG的纯化制剂含有15ml的最终体积。放射化学纯度通过ratio-TLC使用MeCN:H2O (95:5)的混合物作为流动相来试验。放射化学产率(RCY)表示为在[18F]FDG级分中的放射性活度的量除以所使用的[18F]氟离子的总活度(经衰减校正)。总合成时间为22分钟。
[18F]FACBC的现有技术合成
小瓶A含有在79.5% (v/v) MeCN(水性)(1105µl)中的K222 (58.8mg,156µmol)、K2CO3(8.4mg,60.8µmol)。小瓶B含有4M HCl (2.0ml)。小瓶C含有MeCN (4.1ml)。小瓶D含有以干燥形式的前体(48.4mg,123.5µmol)(在20℃下储存,直至盒组装)。小瓶E含有2M NaOH (4.1ml)。将30ml产物收集玻璃小瓶用200mM柠檬酸盐缓冲液(10ml)填充。使水性[18F]氟离子(1-1.5ml,100-200Mbq)通过QMA且进入18O-H2O回收小瓶中。随后将QMA用MeCN冲洗并使其废弃。捕集的[18F]氟离子使用来自小瓶A的洗脱液(730µl)洗脱到反应器中且随后通过与乙腈(80µl,小瓶C)共沸蒸馏浓缩以干燥。将约1.7ml的MeCN与小瓶D中的前体混合,从小瓶D中将1.0ml的溶解的前体(相当于28.5mg,72.7mmol前体)加到反应器中且在85℃下加热3分钟。将反应混合物用水稀释且使其通过tC18柱。将反应器用水洗涤且使其通过tC18柱。将固定在tC18柱上的标记的中间体用水洗涤,且随后用2M NaOH (2.0ml)温育5分钟。标记的中间体(没有酯基)使用水从tC18柱洗脱出来进入反应器中。BOC基团通过加入4M HCl (1.4ml)且在60℃下加热反应器5分钟来水解。使具有粗[18F]FACBC的反应器内含物通过HLB和Alumina柱且进入所述30ml产品小瓶中。将HLB和Alumina柱用水(总共9.1ml)洗涤且收集在产品小瓶中。最后,将2M NaOH (0.9ml)和水(2.1ml)加到该产品小瓶中,得到总体积26ml的[18F]FACBC纯化制剂。放射化学纯度通过radio-TLC使用MeCN:MeOH:H2O:CH3COOH (20:5:5:1)的混合物作为流动相来测量。放射化学产率(RCY)表示为在[18F]FACBC级分中的放射性活度的量除以所使用的[18F]氟离子的总活度(经衰减校正)。总合成时间为43分钟。
使用新鲜制备的洗脱液,[18F]FACBC和[18F]FDG的RCY分别为62.5%±1.93 (标准偏差),n = 4;和86.8%±1.25 (标准偏差),n = 9。
当将FACBC洗脱液储存在30℃或40℃下时,如在图3中所示,观察到,随着储存时间增加,RCY减小,图3示出了洗脱液在30℃(●)、40℃(♦)下储存之后[18F]FACBC的RCY和洗脱液在25℃(■)、40℃(▲)下储存之后[18F]FDG的RCY。当FACBC洗脱液在30℃下储存12个月之后,[18F]FACBC的RCY从62.5%降到44.7%,且当FACBC洗脱液在40℃下储存6个月之后,[18F]FACBC的RCY从62.5%降到33.6%。因此,观察到在乙腈变劣与[18F]FACBC的RCY降低之间的负关联。观察到,当将洗脱溶液在50℃下储存3个月(n = 3)之后,对于[18F]FDG,[18F]FDG的RCY从86.8%降到66.7%。
实施例3:用储存的本发明洗脱液相对新鲜制备的本发明洗脱液的[18F]FACBC的合成
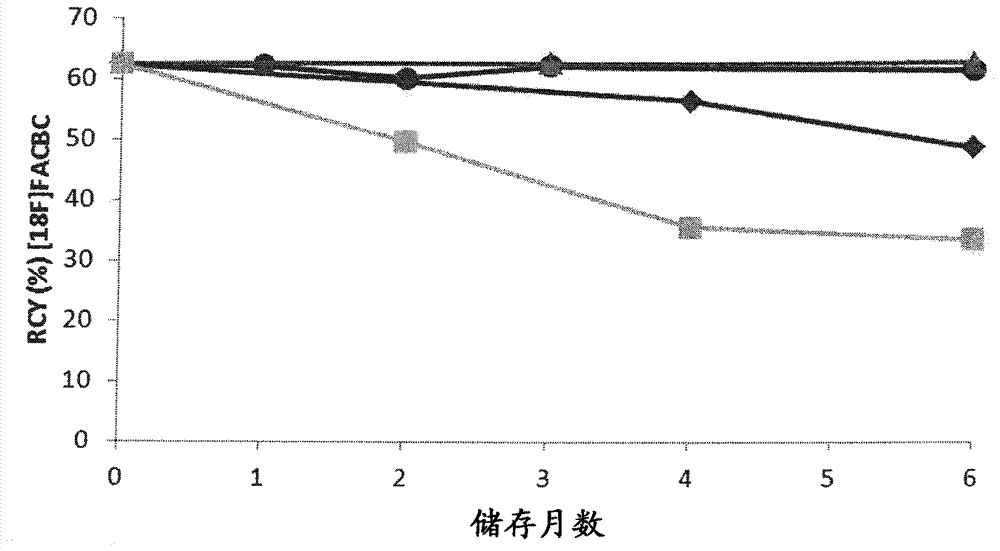
将其中乙腈被甲醇替代的FACBC洗脱液小瓶储存预定的时间点且在[18F]FACBC的合成中进行试验。图4示出了具有甲醇(MeOH)的洗脱液在30℃(▲)、50℃(●)下储存之后[18F]FACBC的RCY及具有MeCN的洗脱液在30℃(♦)、40℃(■)下储存之后[18F]FDG的RCY。虽然基于乙腈的洗脱液引起RCY随储存时间增加而逐渐降低,但在用基于甲醇的洗脱液的情况下,即使在储存在50℃下6个月时,RCY仍然不变。
- 还没有人留言评论。精彩留言会获得点赞!