栽培茄SmHQT基因核心片段及其RNAi表达载体和应用的制作方法
本发明属于基因工程技术领域,涉及栽培茄SmHQT基因和利用该基因构建的RNAi载体及其应用,还涉及该RNAi载体的构建方法。
背景技术:
栽培茄(Solanum melongenaL.)在我国蔬菜市场中占据重要的地位,栽培茄作为经济效益突出的蔬菜,果实的色泽和营养物质含量是决定其商品价值的关键因素,而在果肉中富集合成的绿原酸遇氧被氧化成醌类物质是导致果肉褐化的关键性因素,这些因素严重阻碍了栽培茄营养品质的改良和后期加工。
作为茄科植物中重要的苯丙素类物质,绿原酸在植物中存在广泛的积累,在果实中含量最高(绿原酸含量可占果实多酚含量的70%-90%)。由于绿原酸暴露在空气中极易氧化变为棕褐色的醌类物质,因而产生褐化的现象。而这种褐色物质严重影响了栽培茄的商品价值和后期加工。因此果肉中过多含量的绿原酸是影响栽培茄品质改良的重要因素。
绿原酸在细胞质中从苯丙氨酸经一系列的酶促反应而合成,但是合成途径非常庞杂,控制茄子绿原酸合成的关键酶,现有技术中并不明确。
技术实现要素:
有鉴于此,本发明的目的之一在于提供栽培茄SmHQT基因核心片段,核苷酸序列如SEQ ID No.3所示。
本发明的目的之二在于提供含有SmHQT基因核心片段的重组载体,如为所述SmHQT基因核心片段的RNAi表达载体。
所述RNAi表达载体可以以pBin19载体为骨架载体,在多克隆酶切位点处插入顺序连接的CaMV35S启动子、栽培茄SmHQT基因核心片段的反向序列、PDK内含子、栽培茄SmHQT基因核心片段的反向序列和Nos终止子表达框而构建成。
本发明的目的之三在于提供含有所述RNAi表达载体的微生物转化体,其可以农杆菌为受体而转化得到。农杆菌可为LBA4404。
本发明的目的之四在于提供所述的栽培茄SmHQT基因核心片段、其RNAi表达载体,或所述的微生物转化体,用于下述至少一种用途:
1)降低栽培茄中SmHQT基因的表达水平;
2)降低栽培茄中绿原酸的合成量;
3)降低栽培茄果肉在有氧环境中的褐化程度和/或褐化速度。
或者说,本发明提供了培育SmHQT基因表达水平低、绿原酸合成量低、和/或果肉在有氧环境中褐化程度低的栽培茄的方法,包括,使用所述的栽培茄SmHQT基因核心片段、其RNAi表达载体,或所述的微生物转化体。
所述表达水平或合成量的降低,可表现在栽培茄嫩叶、成熟叶和果实中的至少一处。
本发明目的之五在于提供所述RNAi表达载体的制备方法,包括如下步骤:
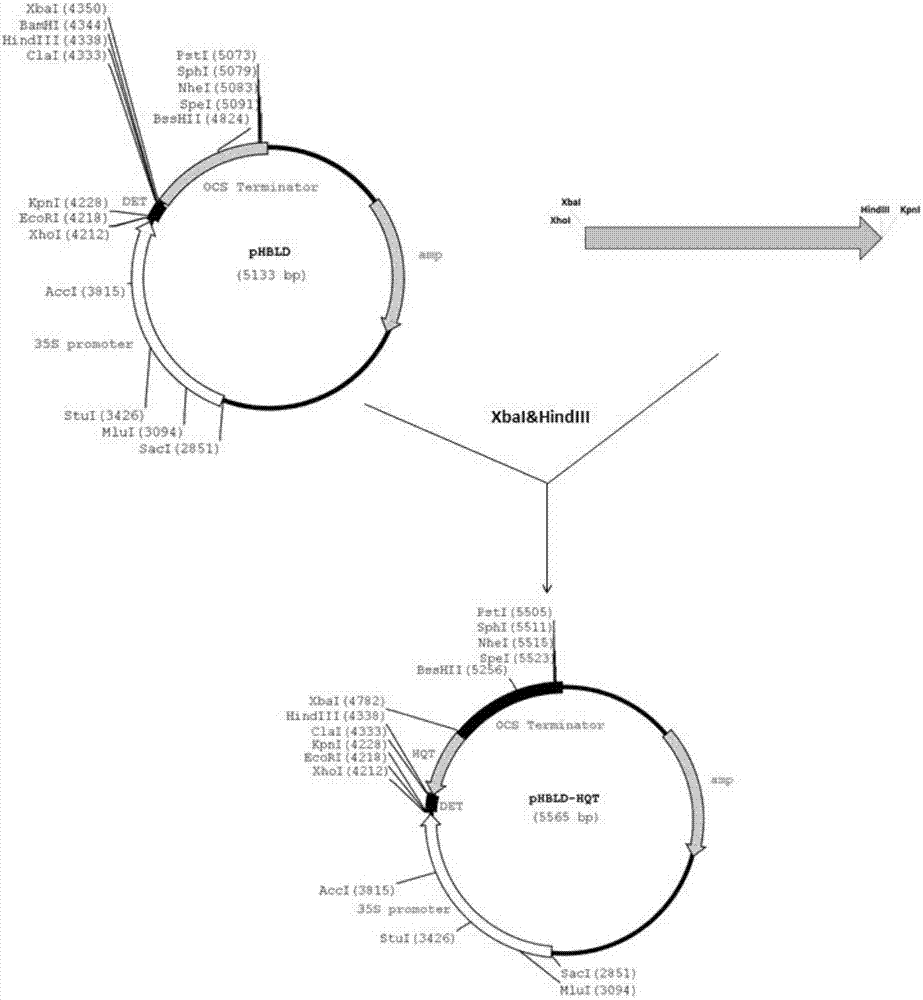
a.以含SEQ ID No.3的重组质粒为模板,以SEQ ID No.2和SEQ ID No.1为引物进行PCR扩增,将扩增产物纯化后用HindIII和Xba I双酶切,再与经同样双酶切的pHBLD载体连接,获得重组质粒pHBLD-SmHQT;
b.按步骤a的方法进行PCR扩增或者直接使用步骤a所得PCR扩增产物,将扩增产物纯化后用Kpn I和Xho I双酶切,再与经同样双酶切的重组质粒pHBLD-SmHQT连接,获得重组质粒pHBLD-SmHQTi;
c.将步骤b所得重组质粒pHBLD-SmHQTi用Sac I和Spe I双酶切,再与经Sac I和Xba I双酶切的pBin19载体连接,得RNAi表达载体。
本发明目的之六在于提供含所述SEQ ID No.3的重组质粒的制备方法,包括:以含栽培茄SmHQT基因序列(如GenBank号为KT259042.1的序列)的cDNA,如栽培茄的cDNA,为模板(比如,提取栽培茄成熟叶总RNA,反转录得到cDNA,再以所得cDNA为模板),以SEQ ID No.2和SEQ ID No.1为引物进行扩增,将扩增产物与pMD-19载体连接,得含SEQ ID No.3的重组质粒。
前述任一发明目的中,栽培茄品种均可为Solanum melongena var.insanum或Solanum melongena L.cv.Sanyueqie。
本发明的有益效果在于:本发明独辟蹊径,通过大量、繁杂的试错和筛选,最终本发明获得了栽培茄SmHQT基因核心片段用于构建栽培茄SmHQT基因沉默的RNAi载体,将该RNAi载体转入栽培茄,所得转基因栽培茄阳性植株中SmHQT基因的表达均较非转基因植株显著降低,植物中各个组织中绿原酸的含量减少,栽培茄果实的褐化程度显著减轻,这对于高等植物基因工程领域的技术人员来说,是非常难以预料的。
附图说明
为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步的详细描述,其中:
图1为栽培茄SmHQT基因扩增产物核心片段的琼脂糖凝胶电泳分析图,其中437bp处为栽培茄SmHQT基因核心片段,M为DNA分子量标准(Marker)。
图2为重组质粒pHBLD-SmHQT构建示意图。
图3为重组质粒pHBLD-SmHQTi构建示意图。
图4为重组质粒pBin19-SmHQTi构建示意图。
图5为SmHQT基因在转基因栽培茄阳性植株中的沉默效果鉴定(WT为非转基因栽培茄,RNAi编号24,36,66为不同的转基因栽培茄阳性株系)。
图6为绿原酸在野生型和转基因栽培茄中的含量分析,WT为非转基因栽培茄,24、36、66为不同的转基因栽培茄阳性株系,YL(young leaf)指嫩叶,ML(mature leaf)指成熟叶,FR(fruit)指其果实,各组试验结果在横轴上均按WT、24、36、66的顺序列出。
图7为野生型和转基因栽培茄果肉褐化程度分析。
具体实施方式
以下将结合附图对本发明进行详细的描述。未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
本发明实施例中使用的栽培茄品种为“Solanum melongena L.cv.Sanyueqie”。pMD19-T载体为TaKaRa公司产品,pHBLD载体、pBin19载体、大肠杆菌DH5α、含有游动质粒pRK2013的大肠杆菌“协助”菌(简称helper)和根癌农杆菌LBA4404为本领域常用材料;RNA提取试剂盒、限制性内切酶、Premix TaqTM(TaKaRaTaqTM Version 2.0)、Max DNA Polymerase均为TaKaRa公司产品。
一、栽培茄SmHQT基因核心片段的克隆
根据SmHQT基因序列(KT259042.1),设计扩增栽培茄SmHQT基因核心片段加酶切位点的特异引物SmHQT-F和SmHQT-R,具体序列如下:
SmHQT-F:TGCACTCGAGTCTAGATTGGAACTTAGGAAACTTATTC(SEQ ID No.1),SmHQT-R:CTGAGGTACCAAGCTTCAACGCCAGATGTGGG(SEQ ID No.2),
提取栽培茄成熟叶总RNA,反转录得到cDNA,以所得cDNA为模板,SmHQT-F和SmHQT-R为引物,PCR扩增栽培茄SmHQT基因核心片段,PCR反应体系为:ddH2O 7μL、100μM的上、下游引物各1.0μL、cDNA模板1.0μL、Taq mix 10μL,共10μL。PCR反应程序为:94℃预变性5分钟;然后94℃变性30秒,60℃退火30秒,72℃延伸1分钟,共35个循环;最后72℃终延伸10分钟。将获得的PCR扩增产物经琼脂糖凝胶电泳鉴定,然后将扩增条带采用纯化试剂盒进行回收纯化,将纯化的栽培茄SmHQT基因核心片段与pMD19-T载体连接,获得重组质粒pMD19-T-SmHQT,所用437bp的栽培茄SmHQT基因核心片段(SEQ ID No.3),电泳鉴定如图1所示。
二、构建含栽培茄SmHQT基因的RNAi表达载体
以重组质粒pMD19-T::SmHQT为模板,以SmHQT-F和SmHQT-R为引物,进行PCR扩增,PCR反应体系为:ddH2O 18μL、Max DNA Polymerase 10μL、上下游引物各0.5μL、质粒模板1.0μL,共20μL,PCR反应条件为:94℃预变性5分钟,然后94℃变性30秒,60℃退火30秒,72℃延伸1分钟,共40个循环;最后72℃终延伸10分钟。扩增PCR产物为两侧带Kpn I/HindIII和Xho I/Xba I酶切位点的SmHQT基因核心片段;纯化后用HindIII和Xba I双酶切,再与经同样双酶切的pHBLD载体在T4DNA连接酶作用下连接,获得重组质粒pHBLD-SmHQT,重组质粒结构图如图2所示;另将上述纯化的PCR产物用Kpn I和Xho I双酶切,再与经同样双酶切的重组质粒pHBLD-SmHQT在T4DNA连接酶作用下连接,获得重组质粒pHBLD-SmHQTi,重组质粒结构图如图3所示。由图3可知,pHBLD-SmHQTi中SmHQT基因核心片段分别正向和反向插入pHBLD载体中PDK内含子的两侧。最后,将重组质粒pHBLD-SmHQTi用Spe I和Sac I双酶切,再与Xba I和Sac I双酶切的植物表达载体pBin19在T4 DNA连接酶作用下连接,获得重组质粒pBin19-SmHQTi,如图4所示。重组质粒pBin19-SmHQTi即为栽培茄SmHQT基因RNAi载体,其含有一个hpRNA表达盒,即顺序连接的CaMV35S启动子、SmHQT基因核心片段(SEQ ID No.3)的正向反向片段、DET内含子、SmHQT基因核心片段(SEQ ID No.3)的反向片段和Nos终止子,并命名为“pBin19-HQTi”。
四、含栽培茄SmHQT基因的RNAi表达载体转化农杆菌
在大肠杆菌Helper帮助下的结合转移技术,我们将沉默载体pBin19::SmHQTi转入农杆菌LBA4404菌株中,具体实验步骤如下:
(1)将农杆菌LBA4404菌株划线于含有50mg/L利福平、500mg/L硫酸链霉素的YEB固体培养基上,倒置放入生化培养箱,在28℃黑暗条件下培养2~3天,直到YEB固体培养基上长出单菌落。
(2)将大肠杆菌Helper菌株,以及含pBin19-SmHQTi质粒的大肠杆菌DH5α菌株分别在含有50mg/L卡那霉素的LB固体培养基上划线。在37℃生化培养箱中培养16小时。
(3)在LB固体培养基上选取一个硬币大小的圆圈,用记号笔标示,挑取以上3种菌菌板上的单菌落,均匀涂布在圆圈内,在生化培养箱中28℃黑暗条件下培养24小时。
(4)挑取上述圆圈内共培养的菌落,在含有50mg/L利福平、500mg/L硫酸链霉素、50mg/L卡那霉素的YEB固体培养基上划线,倒置放入生化培养箱,在28℃黑暗条件下培养2~3天。
(5)挑取上述YEB固体培养基上的单菌落,把挑到的单菌落加入含有50mg/L利福平、500mg/L硫酸链霉素、50mg/L卡那霉素的YEB固体培养基,在28℃黑暗,200rpm震荡培养2.5天,提取质粒,进行酶切验证。
五、农杆菌介导的含栽培茄SmHQT基因的RNAi表达载体转化栽培茄
①农杆菌菌液的制备
将含有pBin19-SmHQTi质粒的农杆菌菌株在含有50mg/L利福平、500mg/L硫酸链霉素、50mg/L卡那霉素的YEB固体培养基上划线,倒置放入生化培养箱,在28℃黑暗条件下培养2~3天,直到其长出单菌落。挑取单菌落接种于30mL含有50mg/L利福平、500mg/L硫酸链霉素、50mg/L卡那霉素的YEB液体培养基中在28℃黑暗、200rpm条件下震荡培养36h。吸取10ml上述培养菌液于100ml含有50mg/L利福平、500mg/L硫酸链霉素、50mg/L卡那霉素的YEB液体培养基中,在28℃黑暗、200rpm条件下震荡培养1.5天,直至OD600=1.8-2.0之间。
②栽培茄外植体的获取
将栽培茄种子在无菌的超纯水中浸泡半个小时,用无菌的超纯水清洗3次,将栽培茄种子在75%的酒精中浸泡1分钟,用无菌的超纯水清洗3次。然后将栽培茄种子在有效氯为1%的次氯酸钠中浸泡15分钟(一直用手摇动),用无菌的超纯水清洗5次,将种子倒入灭菌的超纯水中,放入4℃冰箱24h,放入28℃,200rpm震动培养4-5d,直到栽培茄露白,将露白的栽培茄种子播种与固体MS培养基上,在白天28℃(16小时光照),夜晚18℃(8小时黑暗)条件的光照培养箱中培养至栽培茄的两片子叶展平;切下子叶并把子叶尖部切掉,让每片子叶含有两个伤口。将上述子叶放入含有0.2mg/L 2,4-D、0.1mg/L KT激素的液体MS培养基中浸泡一个小时,然后将浸泡过的子叶伤口朝下平铺于含有1mg/L IAA、1.75mg/L ZT激素的固体MS培养基上,弱光条件下预培养24小时。
③农杆菌浸染栽培茄外植体及转基因苗的获得
将以上获得的农杆菌菌液在6000rpm,室温条件下离心8分钟,倒掉上清液,用YEB液体培养基重悬离心管底部的农杆菌菌体。重悬后的菌液用6000rpm,室温条件下离心8分钟,倒掉上清液,用100Ml MS盐培养基重悬离心管底部的农杆菌菌体;将重悬后的菌体倒入培养皿中,将预培养的栽培茄子叶放入培养皿中的农杆菌菌液中浸泡10分钟,用滤纸吸干栽培茄子叶上的菌液,之后以子叶的伤口面朝上放入原来的MS固体培养基上,在在白天28℃(16小时),夜晚18℃(8小时)条件下弱光培养48小时,培养过后,将子叶插入含有2mg/L玉米素、150mg/L卡那霉素、500mg/L羧苄青霉素的固体MS培养基上,在白天28℃(16小时光照),夜晚18℃(8小时黑暗)条件的光照培养箱中培养直至长出愈伤,然后把愈伤切成小块,插入含有2mg/L玉米素、100mg/L卡那霉素、300mg/L羧苄青霉素的固体MS培养基上,在白天28℃(16小时光照),夜晚18℃(8小时黑暗)条件的光照培养箱中培养直至长出小苗,将含有芽的小苗切下,插入含有50mg/L卡那霉素、200mg/L羧苄青霉素的固体MS培养基中,在白天28℃(16小时光照),夜晚18℃(8小时黑暗)条件的光照培养箱中培养直至生根。
六、转基因栽培茄阳性植株的筛选
qPCR检测SmHQT基因在转基因栽培茄植株中的表达
根据栽培茄SmHQT基因序列和栽培茄内参基因序列,设计如下引物:
qSmHQT-F:CGGCTACACCAATGGCTACATC(SEQ ID No.4)
qSmHQT-R:CGAATCAGGGTTGATAGGTCAGG(SEQ ID No.5)
qSmCAC-F:CCTGATCTGAAGTTGGGCTTAAATG(SEQ ID No.6)
qSmCAC-R:TGGTGGAAAGTAACATCATCGAGC(SEQ ID No.7)
分别摘取野生型栽培茄成熟叶和转基因栽培茄成熟叶,提取成熟叶总RNA,将总RNA反转录为cDNA,再以所得cDNA为模板,分别以qSmHQT-F和qSmHQT-R,qSmCAC-F和qSmCAC-R为引物进行qPCR,检测SmHQT基因在栽培茄成熟叶中的表达水平。排除假阳性植株,结果如图5所示,转基因栽培茄阳性株系,基因沉默效率较高。
七、转基因栽培茄阳性植株的表型分析
将上述沉默效率较高的栽培茄株系和野生株系栽入土壤中进行培养,用50%甲醇分别提取栽培茄嫩叶、成熟叶、果实中的绿原酸,用高效液相色谱法分析各组织中绿原酸含量,结果如图6。把果肉切成小块暴露于空气中2小时,果肉褐化情况如图7(图中展示的是5个以上重复样品的代表性结果,左侧2个为野生型栽培茄样品,右侧2个为转基因样品)。
以上结果表明,转基因栽培茄各个组织中绿原酸的含量普遍降低,栽培茄果实褐化程度变弱,成功达到减轻栽培茄褐化的目标。
序列表
<110> 郑州大学
<120> 栽培茄SmHQT基因核心片段及其RNAi表达载体和应用
<160> 7
<170> SIPOSequenceListing 1.0
<210> 1
<211> 38
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
tgcactcgag tctagattgg aacttaggaa acttattc 38
<210> 2
<211> 32
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ctgaggtacc aagcttcaac gccagatgtg gg 32
<210> 3
<211> 437
<212> DNA
<213> 栽培茄(Solanum melongena L .cv .Sanyueqie)
<400> 3
ttggaactta ggaaacttat tcctagtgtt caaactaatg gagatatctc aaccttccca 60
ctcgtaatat tccaggttac tcgttttagc tgtggcggag tcgctcttgg cgggggagtg 120
ttccacacgt tatctgatgg tctttcatcc atccacttta tcaacacgtg gtcggacatc 180
actcgtggcc tatccgtcgc gatcccacca ttcatcgatc ggaccctcct tcgtgcacgg 240
gacccgccaa cgccttcttt tgagcatgtc gagtatcatc ctccacctac cctcaactca 300
tcgaaaaacc atgagtccac gggcccaaag cccaatacca cggccatgtt gaaattctcg 360
actgaacaac tcgcgcttct taagtccaag tacgagggta gcacttatga aatccttgcg 420
gcccacatct ggcgttg 437
<210> 4
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
cggctacacc aatggctaca tc 22
<210> 5
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
cgaatcaggg ttgataggtc agg 23
<210> 6
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
cctgatctga agttgggctt aaatg 25
<210> 7
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
tggtggaaag taacatcatc gagc 24
- 还没有人留言评论。精彩留言会获得点赞!