基于POCT模式的CYP3A5*3基因型快速检测试剂盒的制作方法
本发明涉及分子生物学领域,具体地说,涉及一种基于poct模式的cyp3a5*3基因型快速检测试剂盒。
背景技术:
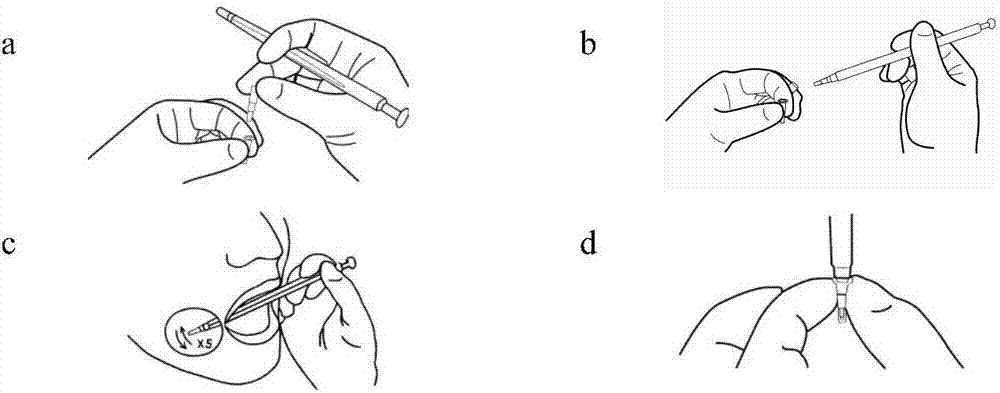
:cyp3a5是细胞色素p450(cyp)基因超家族成员,主要在肝脏、前列腺、小肠和大肠中表达,是一种参与外来化合物代谢、胆固醇及类固醇合成的单氧酶。研究表明,cyp3a5基因的遗传多样性是导致cyp3a5蛋白功能改变的主要原因。cyp3a5基因存在多个突变位点,其中,命名为cyp3a5*3(6986a>g,rs776746)的单核苷酸突变会导致该基因在转录为mrna时被过早剪切,最终形成不完整的蛋白,使其丧失功能。1000genomeprojectphase3提供的数据表明,cyp3a5*3等位基因在中国西双版纳傣族人群中出现的频率占68.82%;中国北京汉族人群中cyp3a5*3等位基因的频率占68.93%;在中国南方汉族人群中cyp3a5*3等位基因的频率占72.86%。由于cyp3a5是众多药物在人体中代谢的重要代谢酶,因此携带cyp3a5*3等位基因的患者在临床药物治疗过程中的表现与野生型等位基因cyp3a5*1携带者大相径庭。例如,用于预防和治疗器官移植后排异反应的免疫抑制剂他克莫司(tacrolimus,fk506)的代谢就是由cyp3a5编码的代谢酶完成,从而发挥其免疫抑制作用。研究表明,携带cyp3a5*3等位基因的患者的血浆fk506浓度远远大于携带cyp3a5*1野生型等位基因的正常代谢者,导致诸如肾毒性、神经毒性、高血压和胃肠道紊乱等一系列药物毒副作用。据文献统计,在我国69%~73%的人群面临cyp3a5相关代谢药物的用药风险,因此快速、准确的cyp3a5基因分型检测对器官移植病人的术后个体化用药有着重大的临床意义。目前,检测cyp3a5*3的方法主要有测序法、基因芯片法和荧光定量pcr法。测序法和基因芯片法对检测结果具有很高的精度,其依赖大型精密仪器设备、固定实验室以及专业操作人员,因此,这两种检测方法成本高,步骤繁琐并且耗时长,在临床上很难进行推广。虽然降低了测序法和基因芯片法中的仪器和试剂的成本,但其操作复杂,步骤繁多,也不适用于临床。cn105274221a公开了一种等位基因特异扩增法(arms-pcr),该方法在pcr反应后需要使用凝胶电泳分析结果。这种开放式的操作很容易导致环境污染,影响结果的准确性,不适合临床推广。目前常规的检测技术难以满足国内携带cyp3a5*3突变基因的人群对cyp3a5基因检测快速、准确的要求。技术实现要素:本发明的目的是提供一套用于检测cyp3a5*3(rs776746)基因型的荧光定量pcr引物和探针。本发明的另一目的是提供一种基于poct模式的cyp3a5*3(rs776746)基因型快速检测试剂盒。为了实现本发明目的,本发明提供一套用于检测cyp3a5*3(rs776746)基因型的荧光定量pcr引物和探针,包括上游引物、下游引物、野生型探针和突变型探针,它们的核苷酸序列分别如下(seqidno:1-4):上游引物:5’-acccagcttaacgaatgctctac-3’下游引物:5’-cacccaaggcttcatatgatgaag-3’野生型探针:5’-f1-tgtctttcaatatctc-q-3’突变型探针:5’-f2-tgtctttcagtatctc-q-3’优选地,所述探针如下:野生型探针:5’-f1-tgtctttcaa+t+atctc-q-3’突变型探针:5’-f2-tgtctttcag+tatctc-q-3’其中,+表示lna修饰碱基;f1和f2为不同的荧光报告基团,q为荧光淬灭基团。例如,f1为fam,f2为texasred,q为mgb。本发明还提供含有所述引物和探针的检测试剂或试剂盒。本发明还提供一种用于荧光定量pcr检测cyp3a5*3基因型的反应体系,所述反应体系包括seqidno:1-4所示引物和探针、dna聚合酶、dntps、mg2+、反应缓冲液和细胞裂解液;其中,所述细胞裂解液由十二烷基硫酸钠和聚乙二醇辛基苯基醚组成。所述反应体系中各组分的终浓度为:0.5-1.5×pcr反应缓冲液、dna聚合酶0.04-0.1u/μl、dntps0.1-0.5mm、上游引物0.2-0.7μm、下游引物0.2-0.7μm、野生型探针0.2-0.7μm、突变型探针0.2-0.7μm、mg2+1-2.5mm和细胞裂解液;其中,所述反应体系中十二烷基硫酸钠和聚乙二醇辛基苯基醚的终浓度为0.0005-0.015%w/v和0.001-0.03%w/v。优选地,所述反应体系的总体积为23.5μl,各组分的终浓度或用量为:1.1×pcr反应缓冲液、taqdna聚合酶1.25u、dntps0.2mm、上游引物0.4μm、下游引物0.4μm、野生型探针0.5μm、突变型探针0.4μm、mg2+2.5mm和细胞裂解液;所述反应体系中十二烷基硫酸钠和聚乙二醇辛基苯基醚的终浓度为0.005%w/v和0.01%w/v,或0.009%w/v和0.01%w/v,或0.005%w/v和0.02%w/v,或0.005%w/v和0.001%w/v,或0.015%w/v和0.003%w/v,优选0.005%w/v和0.01%w/v。本发明还提供一种基于poct模式的cyp3a5*3基因型快速检测试剂盒,所述试剂盒至少含有seqidno:1-4所示引物和探针以及细胞裂解液;其中,所述细胞裂解液由十二烷基硫酸钠和聚乙二醇辛基苯基醚组成。在配制的pcr反应体系中十二烷基硫酸钠和聚乙二醇辛基苯基醚的终浓度为0.0005-0.015%w/v和0.001-0.03%w/v。优选地,在配制的pcr反应体系中十二烷基硫酸钠和聚乙二醇辛基苯基醚的终浓度为0.005%w/v和0.01%w/v,或0.009%w/v和0.01%w/v,或0.005%w/v和0.02%w/v,或0.005%w/v和0.001%w/v,或0.015%w/v和0.003%w/v,优选0.005%w/v和0.01%w/v。本发明所述试剂盒中还包括dntps、dna聚合酶、mg2+、反应缓冲液、标准阳性模板、采样棒(例如,一次性口腔拭子)、样品收集管等中的至少一种。优选地,所述dna聚合酶为热启动taqdna聚合酶。与本发明所述试剂盒配套的荧光定量pcr反应体系中各组分的终浓度为:0.5-1.5×pcr反应缓冲液、taqdna聚合酶0.04-0.1u/μl、dntps0.1-0.5mm、上游引物0.2-0.7μm、下游引物0.2-0.7μm、野生型探针0.2-0.7μm、突变型探针0.2-0.7μm、mg2+1-2.5mm和细胞裂解液。其中,所述反应体系中十二烷基硫酸钠和聚乙二醇辛基苯基醚的终浓度为0.0005-0.015%w/v和0.001-0.03%w/v。优选地,所述反应体系的总体积为23.5μl,各组分的终浓度或用量为:1.1×pcr反应缓冲液、taqdna聚合酶1.25u、dntps0.2mm、上游引物0.4μm、下游引物0.4μm、野生型探针0.5μm、突变型探针0.4μm、mg2+2.5mm和细胞裂解液。其中,所述反应体系中十二烷基硫酸钠和聚乙二醇辛基苯基醚的终浓度为0.005%w/v和0.01%w/v,或0.009%w/v和0.01%w/v,或0.005%w/v和0.02%w/v,或0.005%w/v和0.001%w/v,或0.015%w/v和0.003%w/v,优选0.005%w/v和0.01%w/v。。优选地,与本发明所述试剂盒配套的荧光定量pcr反应程序为:95℃5min;95℃8s,60℃35s,50个循环。将本发明的试剂盒应用于实际样本检测,所述检测样本可以来自口腔内壁、舌头、手掌、耳朵等部位,来自上述位置的脱落细胞经裂解液裂解后释放出的dna均可用于该试剂盒的基因检测,由于刮取口腔内壁样本方法简便快捷,且样本量适中,因此选取口腔样本为最优。一般情况下在20秒内即可完成取样和加样步骤。(1)取样前准备取样前患者须用清水漱口2次,每次不少于5秒,漱口后吞咽2-3次,尽量避免口腔内壁残留唾液。取样者须穿戴手套、口罩。待上述准备完成后,方可进行取样。(2)取样与加样采样工具为一次性口腔拭子。具体采样过程如下:1)分别从试剂盒与拭子包装袋中取出反应液与拭子,然后拔掉试剂塞(图1-a);2)取下拭子端盖,该过程中注意勿接触试剂塞(图1-b);3)使拭子端部近90°接触口腔内腮壁,均匀刮拭5次(上下为1次),力度以腮部微突为宜(图1-c);4)取样后立即将拭子插入反应液中,按压使其与试剂管密封,避光暂存(如1-d)。检测结果分析:反应结束后经过分析系统可直观准确地对检测结果进行分析和解读,一共可产生以下三种结果。①野生纯合型该检测结果在分析系统中表现为有且仅有绿色荧光曲线呈指数增长趋势,并且有且仅有绿色荧光通道产生ct值(cyclethreshold,指每个反应管内的荧光信号达到设定的阈值时所经历的循环数)。(图2)②突变纯合型该检测结果在分析系统中表现为有且仅有红色荧光曲线呈指数增长趋势,并且有且仅有红色荧光通道产生ct值。(图3)③杂合型该检测结果在分析系统中表现为绿色荧光曲线和红色荧光曲线均呈指数增长趋势,并且绿色荧光通道和红色荧光通道均产生ct值。(图4)借由上述技术方案,本发明至少具有下列优点及有益效果:(一)可实现即时检测,无需dna提纯,可将样本直接加入试剂中进行pcr反应,1小时内即可得到对应基因位点的检测信息;故可在第一时间给医生提供用药依据,从而避免患者用药错误。(二)在试剂反应体系中加入了细胞裂解液,可直接裂解细胞并释放出细胞核中dna,使样本加入、dna提取与pcr反应在同一支试剂管里闭管进行。(三)本试剂盒样本(dna或口腔细胞)检测准确率达99%以上。(四)本发明检测方法,取样过程无痛无创,操作简便,单次取样加样20s内即可完成。(五)检测灵敏度高,可以准确检测低至0.125ng的基因组dna。对于保存时间过长以及口腔拭子等dna含量较低的样本能准确检测。(六)本试剂盒在常温下至少可放置72h,2-8℃至少可放置15天,-20℃至少可放置12个月。(七)本发明采用了新颖的加样至结果一步化的操作方式,免去了繁琐的中间环节,1小时内即可出检测结果,解决了紧急病人治疗迫切的问题。单一步骤,单管试剂,闭管操作,大幅度降低了环境污染的可能性。(八)本发明还配套使用了智能分析程序,可直接对数据进行自动分析,即刻得出无偏性的基因型检测结果和用药指导报告,摆脱了实验室束缚,对环境和操作人员没有特殊要求。(九)本发明采用了有着mgb(minorgroovebinding)和lna(locknucleicacid)双重修饰的taqman探针(检测方法不仅限于taqman探针,还包括分子信标的方法),不仅大大降低了本底信号强度,并且进一步提高了探针的特异性、灵敏度和准确性。(十)本发明还采用了热启动酶,通过优化试剂体系,使其能够包容口腔杂质和环境温度变化带来的风险。附图说明图1为利用本发明试剂盒进行检测过程中取样及加样操作流程图。图2为本发明cyp3a5*3rs776746位点野生纯合子检测结果图。图3为本发明cyp3a5*3rs776746位点突变纯合子检测结果图。图4为本发明cyp3a5*3rs776746位点杂合子检测结果图。图5为本发明实施例1中加裂解液和不加裂解液三种基因型ct值统计柱状图。图6为本发明实施例1中加裂解液和不加裂解液三种基因型epf值统计柱状图。图7为本发明实施例2中三种基因型ct值统计柱状图。注:各组间均为差异不显著(p>0.05)。图8为本发明实施例2中三种基因型终点荧光值(epf)统计柱状图。图9为本发明实施例3中浓度一、二、三对应的三种基因型ct值统计柱状图。图10为本发明实施例3中浓度一、二、三对应的三种基因型epf统计柱状图。图11为本发明实施例3中三种基因型ct值统计柱状图。图12为本发明实施例3中三种基因型终点荧光值(epf)统计柱状图。图13为本发明实施例7中不同检测环境对试剂盒检测正确率的影响数据统计图。图14a-图14c分别为本发明实施例8中a、b、c组三种基因型ct值统计图图15a-图15c分别为本发明实施例8中a、b、c组三种基因型终点荧光值(epf)统计图。图16为本发明实施例9中8对引物的pcr扩增结果。图17a-图17c为本发明实施例9中探针p1wp1m的qpcr检测结果;其中,a为突变纯合子检测结果,b为野生纯合子检测结果,c为杂合子检测结果。图18a-图18c为本发明实施例9中探针p2wp2m的qpcr检测结果;其中,a为突变纯合子检测结果,b为野生纯合子检测结果,c为杂合子检测结果。图19a-图19c为本发明实施例9中探针p3wp3m的qpcr检测结果;其中,其中,a为突变纯合子检测结果,b为野生纯合子检测结果,c为杂合子检测结果。图5-图12和图14-图15中,“*”表示与对照组相比,该组数据差异显著(p≤0.05);“**”表示差异极显著(p≤0.01);未标示的表示与对照组相比,该组数据差异不显著(p>0.05)。“g”表示绿色荧光通道,“r”表示红色荧光通道。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。以下实施例中使用的基于poct模式的cyp3a5*3基因型快速检测试剂盒,至少含有seqidno:1-4所示引物和探针以及细胞裂解液,此外还可包括dntps、dna聚合酶、mg2+、pcr反应缓冲液、标准阳性模板、一次性口腔拭子、样品收集管等。本发明中,涉及的野生型探针对应的荧光报告基团为fam,淬灭基团为mgb,突变型探针对应的荧光报告基团为texasred,淬灭基团为mgb。实施例1细胞裂解液性能测试pcr是一种极其灵敏的微量dna检测技术。目前临床上无痛无创检测方法的主要样本有口腔拭子、毛发、指甲、口腔唾液及体腔液等,这些样本均需专业人员在专业实验室使用专业的仪器设备,通过复杂的操作流程将其中所含的dna提取纯化后,才可加入pcr反应体系进行反应,需要耗费大量的人力、物力、财力。为了解决这个问题,同时考虑到直接加入细胞后扩增效果不理想,不适合临床检测,发明人尝试加入了一定浓度的细胞裂解液。并且进行加细胞裂解液与不加细胞裂解液的比较实验。(注:以脱落细胞为模板)试剂配方见表1-1,3种不同表型各配制100支重复,反应程序见表1。表1-1不同样本实验pcr反应总体系配方表组成浓度一浓度二5×promegacolorlessreactionbuffer1.1×1.1×dntp(10mm)0.2mm0.2mmmgcl2(25mm)2.5mm2.5mm200×细胞裂解液1×-cyp3a5*3上游引物(100μm)0.4μm0.4μmcyp3a5*3下游引物(100μm)0.4μm0.4μmcyp3a5*3野生型探针0.5μm0.5μmcyp3a5*3突变型探针0.4μm0.4μmdna聚合酶(5u/μl)1.25u1.25u口腔细胞++补加超纯水至总体积23.5μl23.5μl上述pcr反应体系中十二烷基硫酸钠和聚乙二醇辛基苯基醚的终浓度为0.005%w/v和0.01%w/v。表1两步法反应程序实验结果:(1)ct值统计结果见表1-2和图5:表1-2ct值统计表(2)epf值统计结果见表1-3和图6:表1-3三种基因型终点荧光值(epf)统计表加裂解液与否对三种基因型检测准确率影响的统计见表1-4。表1-4加裂解液与否对三种基因型检测准确率影响的统计表比较加细胞裂解液与不加细胞裂解液的ct值可看出,不加细胞裂解液的试剂阳性通道ct值极显著大于加入细胞裂解液的阳性通道ct值(p≤0.01);从两者荧光值比较结果分析,加入细胞裂解液后荧光值极显著高于不加细胞裂解液荧光值(p≤0.01)。从两者的准确率来看,加入裂解液后准确率可以达到99%以上,而未加裂解液检测结果的准确率低于90%。说明加入细胞裂解液后,细胞裂解液裂解了细胞,使其释放了更多的dna,从而使结果中ct值显著降低,荧光值升高,因此pcr反应体系中,使用裂解液更优,避免了需要专业人员及特定实验室对dna进行抽提和纯化的问题。实施例2lna修饰探针提高分型正确率lna是一种寡核苷酸衍生物,与dna/rna具有相似的结构,因此能够对dna和rna进行有力的识别和结合。lna用于寡核苷酸的修饰后,能够增加引物或探针的热稳定性,提高其退火温度3~8℃。本试剂盒开发的探针采用lna修饰,经软件预测,修饰后的野生型探针和突变型探针与模板结合的tm值均提高了4℃左右。为了充分表明lna修饰探针和未经lna修饰探针的差异,进行下列对比实验,pcr体系见表2-1,分别检测野生纯合子、杂合子和突变纯合子,每个基因型做三支重复,反应程序见表1。所用引物和探针序列如下:上游引物:5’-atgatgaagggtaatgtggtcca-3’下游引物:5’-aacgaatgctctactgtcatttctaa-3’野生型探针:5’-fam-tgtctttcaa+t+atctc-mgb-3’突变型探针:5’-f2-texasred-tgtctttcag+tatctc-mgb-3’野生型未经lna修饰探针:5’-fam-tgtctttcaatatctc-mgb-3’突变型未经lna修饰探针:5’-texasred-tgtctttcagtatctc-mgb-3’其中,+表示lna修饰碱基。表2-1pcr反应体系配方1配方2反应组分终5×promegacolorlessreactionbuffer5×promegacolorlessreactionbuffer1.1×dntp(10mm)dntp(10mm)0.2mmmgcl2(25mm)mgcl2(25mm)2.5mm细胞裂解液(200×)细胞裂解液(200×)1×cyp3a5*3上游引物(100μm)cyp3a5*3上游引物(100μm)0.4μmcyp3a5*3下游引物(100μm)cyp3a5*3下游引物(100μm)0.4μmcyp3a5*3野生型lna修饰探针cyp3a5*3野生型未经lna修饰探针0.5μmcyp3a5*3突变型lna修饰探针cyp3a5*3突变型未经lna修饰探针0.4μmdna聚合酶(5u/μl)dna聚合酶(5u/μl)1.25udna(10ng/μl)dna(10ng/μl)1μl补加超纯水至总体积23.5μl23.5μl上述pcr反应体系中十二烷基硫酸钠和聚乙二醇辛基苯基醚的终浓度为0.005%w/v和0.01%w/v。实验结果:(1)ct值统计结果见表2-2和图7:表2-2三种基因型ct值统计从表2-2和图7可以看出,未经lna修饰探针组的野生纯合子和杂合子的绿色荧光通道无ct值,软件判定为分型失败,而经lna修饰探针组有相应的ct值,软件可以根据此进行很好的分型,得出准确的实验结果。因此经过lna修饰后的探针更确保了结果的正确性。(2)三种基因型终点荧光值统计结果见表2-3和图8:表2-3三种基因型的终点荧光值(epf)统计从表2-3和图8可以看出,经lna修饰探针组三种基因型检测结果中epf值极显著大于未经lna修饰探针组(p≤0.05)。实验结果表明,当探针经lna修饰后,有利于探针与靶序列的结合,提高了探针检测准确性。实施例3引物探针最佳比例优化实验特异的引物和探针筛选确认后,需对引物和探针在pcr反应体系中的浓度进行优化(以口腔细胞为模板)。引物探针浓度对应的pcr反应体系如下表3-1所示。表3-1引物探针浓度实验pcr反应总体系配方表实验结果:(1)引物浓度梯度实验(浓度一、浓度二、浓度三)a.ct值统计结果见表3-2和图9:表3-2ct值统计表b.epf值统计结果见表3-3和图10:表3-3三种基因型终点荧光值(epf)统计表c.杂合型绿通道终点荧光值和红通道终点荧光值的比值(g/rratio)统计结果见表3-4:表3-4杂合型g/rratio终浓度g/rratio(杂合型)浓度一0.84浓度二0.95浓度三0.87(2)探针浓度梯度实验考虑到杂合型g/rratio尽量接近于1(杂合型g/rratio越接近于1,杂合分型错误的机会越低),故对探针浓度进行了调整。a.ct值统计结果见表3-5和图11:表3-5ct值统计表b.终点荧光值(epf)统计结果见表3-6和图12:表3-6三种基因型终点荧光值(epf)统计表c.杂合型绿通道终点荧光值和红通道终点荧光值的比值(g/rratio)统计如下:表3-7杂合型g/rratio终浓度g/rratio(杂合型)浓度四1.01浓度五1.21通过引物三个浓度梯度配制的试剂ct值比较发现,浓度一和浓度二ct值差异均不显著(p>0.05),浓度三ct值显著大于浓度一和浓度二的ct值(p≤0.05),说明相较于浓度三来说,浓度二和浓度一引物扩增效率更高,所以该体系下,试剂检测灵敏度更高。通过三个浓度梯度配置的试剂终点荧光值可看出,浓度二的终点荧光值显著高于浓度一和三的终点荧光值(p≤0.05)。说明在相同探针浓度条件下,浓度二扩增的可参与pcr反应的有效产物量最高。探针正确匹配的量越多,试剂也就越稳定。由绿红通道终点荧光值比值(g/rratio)可看出,浓度二的绿红通道终点荧光值比值(g/rratio)更接近于1,说明检测杂合子基因型时,结果更准确可靠。通过探针两个浓度梯度配制的试剂终点荧光值和绿红通道荧光比值(g/rratio)比较发现,浓度四的终点荧光值显著高于浓度五的终点荧光值(p≤0.05),浓度四绿红通道荧光比值(g/rratio)更接近于1,该试剂盒在该浓度下灵敏度更高,检测结果更准确。此例是为了证明cyp3a5*3基因型快速检测试剂盒所用的反应体系灵敏度高,稳定性好,结果准确可靠。实施例4准确性测试本试剂盒采用口腔黏膜脱落细胞作为扩增样本,由于被检测人员生活习惯及个体基因序列的多样性可能造成试剂在分型时受到干扰,为了验证本试剂盒分型的准确度,本实验采用三个基因型不同人员的口腔黏膜脱落细胞进行测试(其中测试人员的基因型均经过测序法确证),操作方法参照图1操作流程,样本总数为300例,试剂配方如表4-1所示。表4-1pcr反应总体系配方表上述pcr反应体系中十二烷基硫酸钠和聚乙二醇辛基苯基醚的终浓度为0.005%w/v和0.01%w/v。实验结果见表4-2:表4-2三种基因型的正确率统计从表4-2可以看出,在300例样本测试中,本试剂盒的检测准确率可以达到99%以上。初步表明在按照图1操作流程进行测试的情况下,该试剂具有一定的准确度,可以达到99.7%。实施例5检测灵敏度测试验证cyp3a5*3基因型快速检测试剂盒的灵敏度,将样品dna(杂合型)加入总量分别以:1ng、0.5ng、0.25ng、0.125ng和0.1ng五个浓度梯度按照上述方法进行检测,以上每次检测至少进行两次以上重复,结果如表5-1所示:表5-1用cyp3a5*3基因型快速检测试剂盒检测不同样品浓度的检测结果dna加入量1ng0.5ng0.25ng0.125ng0.1ng合计检测数100100100100100100正确数10010010010099100准确率100%100%100%100%99%100%以上结果显示,样品dna浓度分别以1ng、0.5ng、0.25ng和0.125ng四个浓度梯度用cyp3a5*3基因型检测试剂盒进行检测,其准确率均达到100%,当dna浓度为0.1ng时,正确率为99%。因此可以判断本发明的cyp3a5*3基因型快速检测试剂盒只需35个拷贝数的dna模板量就能确保正确分型。实施例6抗干扰能力检测由于本试剂盒采用口腔黏膜脱落细胞直接扩增的方式进行检测,因此口腔进食后的残留物是否会干扰试剂检测结果,急需进行研究。本实验在取样操作前对被取样人员(其基因型经测序法确证)进行要求,以取样前30min禁食后取样作为标准,以吃甜食、喝碱性茶、吃酸性食物、麻辣食品和喝中药以后立即取样作为处理组,用同一批试剂对所有样品进行分别检测,每组样品中野生纯合子120例,杂合子120例,突变纯合子60例,试剂配方如表4-1所示,检测结果如表6-1所示:表6-1试剂抗干扰能力正确率测试结果以上结果可以看出,和禁食取样的检测正确率相比,吃甜食、喝碱性茶、吃酸性食物、麻辣食品和喝中药以后的正确率都有降低趋势,说明食用以上食物后对pcr反应有一定的抑制作用。吃甜食、碱性茶和中药后,检测的正确率均在80%-90%范围,与禁食相比,正确率下降范围在10%以内,说明吃甜食、碱性茶和喝中药后,降低了检测的准确率;吃酸性食物和麻辣食物后,检测的正确率均在70%-80%范围,与禁食相比,正确率下降范围在10%-20%范围,说明吃酸性食物和麻辣食物后,与以上方式比最大程度的降低了检测准确率。因此为了提高试剂盒的检测准确性,吃完这些食物后,最好在30min后进行漱口取样。由于本实验取样有限,在进行临床检测时仍应该在禁食30min后进行取样检测。实施例7环境对检测试剂盒的影响试验由于本发明试剂盒旨在应用于临床检测,因此为了验证cyp3a5*3基因型快速检测试剂盒的检测结果是否受环境因素的影响,分别在日常办公区(总面积为200平方米,共容纳50人,不限制他们的活动(可随意走动或说话等),环境温度为27℃,湿度为77%)和空气洁净度等级为一百万级的洁净室对多个受试者(其基因型经测序法确证)进行取样,每个受试者在两个区域分别进行两次重复实验,试剂配方参照表4-1,检测结果统计如表7-1和图13所示。表7-1两个取样区的基因型检测结果正确率统计以上结果可以看出,办公区和洁净区取样的检测正确率均能达到96%以上,表明环境因素对检测的结果没有较大影响。此次试验为试剂盒在医院的应用便利性提供了数据,为今后在基层医院的推广和使用提供了有力数据支撑。实施例8试剂盒在不同温度条件下(常温、2-8℃、-20℃)放置的稳定性检测本试剂盒是基于poct模式开发的,医院床旁检测,低温储存以及低温操作难以实现,所以需检测试剂在常温下放置一定时长后,是否会对检测结果产生不良影响。配制大批试剂,随机分成3个温度条件组共24个处理组,分组情况见表8-1,其中对照组为:配置后立即上机检测(2-8℃配制,30min内完成108支样品的取样上样上机程序),每个处理组共108支试剂,每种基因型检测36支。待完成试剂处理后,按照sop操作,采集被取样者(其cyp3a5*3基因型经测序法确证)的口腔样品,野生纯合子、突变纯合子、杂合子各取36支。统一按照表一进行荧光pcr反应。表8-1试剂放置条件和放置时长分组情况表实验结果:ct值和终点荧光值(epf)均值统计结果分别见图14a-图14c和图15a-图15c。三种基因型分型正确率统计结果见表8-2。表8-2三种基因型分型正确率统计表由图14和图15可以看出,不同处理组的ct值、epf值与对照组相比,各放置条件,处理的时间越长,出现显著差异的情况越多。证明常温放置、2-8℃放置、-20℃放置时间过久会对ct值和epf值产生影响。但从表8-2可以看出,各处理组108例数据,a/b/c三个温度条件的1~7组分型正确率为100%,到a/b/c三个温度条件的第8组时,出现分型错误的情况。说明常温条件下放置试剂至少7天,不会影响试剂的分型结果;2-8℃条件下放置试剂至少15天,不会影响试剂的分型结果;-20℃条件下放置试剂至少12个月,不会影响试剂的分型结果。综上所述,可证明本试剂盒的cyp3a5*3试剂有良好的稳定性,在医院进行检测使用时,短暂(常温5天内)的非低温环境放置,不会影响分型准确性,完全可以满足poct模式。实施例9荧光定量pcr引物和探针的筛选1、引物筛选根据genbank公布的rs776746snp位点所在核酸序列,设计如下8对引物:pair1432-554上游引物:acccagcttaacgaatgctctac下游引物:cacccaaggcttcatatgatgaagpair2463-561上游引物:atgatgaagggtaatgtggtcca下游引物:aacgaatgctctactgtcatttctaa(seqidno:1-2)pair3398-537上游引物:ggagagtggcataggagata下游引物:gatgaagggtaatgtggtccpair4454-604上游引物:ctgtcatttctaaccataatc下游引物:ggttctagttcattagggpair5417-626上游引物:acccacgtatgtaccaccca下游引物:tgtacgacacacagcaacctpair6403-573上游引物:gtggcataggagatacccacg下游引物:aagagtctcacacaggagccpair7421-628上游引物:acgtatgtaccacccagctt下游引物:gttgtacgacacacagcaaccpair8404-626上游引物:tggcataggagatacccacg下游引物:tgtacgacacacagcaaccttpcr反应体系:表9-1引物筛选反应体系组成浓度一5×promegacolorlessreactionbuffer1.1×dntp(10mm)0.2mmmgcl2(25mm)2.5mm200×细胞裂解液1×上游引物(100μm)0.4μm下游引物(100μm)0.4μmevergreen0.5μmdna聚合酶(5u/μl)1.25u口腔细胞+补加超纯水至总体积23.5μlpcr反应程序:表9-2反应程序按照以上反应体系和反应程序进行普通pcr反应(以口腔黏膜上皮细胞为模板)。pcr产物进行琼脂糖凝胶电泳,根据8对引物各自对应的扩增产物条带的亮度来筛选最佳的引物,结果如图16所示。从图16可以看出,引物pair2扩增效果最佳。因此,将pair2作为qpcr的引物。2、探针筛选以上述筛选的pair2为qpcr引物,分别设计如下3对探针:p1wp1m:野生型探针:5’-fam-tctttca+a+tatctct-mgb-3’突变型探针:5’-texasred-tctttca+gtatctct-mgb-3’p2wp2m:野生型探针:5’-fam-tgtctttca+a+tatctct-mgb-3’突变型探针:5’-texasred-gtctttca+g+tatctct-mgb-3’p2wp3m:野生型探针:5’-fam-tgtctttca+a+tatctc-mgb-3’突变型探针:5’-texasred-gtctttca+g+tatctct-mgb-3’(seqidno:3-4)qpcr反应体系:表9-3引物筛选反应体系qpcr反应程序:表1两步法反应程序按照以上反应体系和反应程序进行qpcr反应。3对探针对应的检测结果分别如图17-图19所示。从图中可以看出,三组探针均能正确分型,但p3wp3m曲线平滑,增量最高,且杂合型红绿通道终点荧光值接近。另外,对探针进行lna修饰既能够提高反应tm值,增强反应特异性,又可有效地防止发卡结构的形成。由此,最终将引物pair2和探针p3wp3m组合作为检测rs776746位点的qpcr引物和探针。3、引物pair2设计所依据的dna模板信息如下:agcttaacgaatgctctactgtcatttctaaccataatctctttaaagagctcttttgtctttcaa/gtatctcttccctgtttggaccacattacccttcatcatatgaagc其中,灰色区域分别为上游引物和下游引物所在位置,a/g加粗的大写字母为待测snp位点。该扩增区域内不含有其他snp位点,因此检测时不会产生旁侧snp的干扰。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。序列表<110>重庆京因生物科技有限责任公司<120>基于poct模式的cyp3a5*3基因型快速检测试剂盒<130>khp181110936.0<160>4<170>siposequencelisting1.0<210>1<211>23<212>dna<213>人工序列(artificialsequence)<400>1atgatgaagggtaatgtggtcca23<210>2<211>26<212>dna<213>人工序列(artificialsequence)<400>2aacgaatgctctactgtcatttctaa26<210>3<211>16<212>dna<213>人工序列(artificialsequence)<400>3tgtctttcaatatctc16<210>4<211>16<212>dna<213>人工序列(artificialsequence)<400>4tgtctttcagtatctc16当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1