利用红色糖多孢菌发酵生产红霉素的新型方法与流程
本发明属于生物工程领域,更具体地,本发明涉及利用红色糖多孢菌发酵生产红霉素的新型方法。
背景技术:
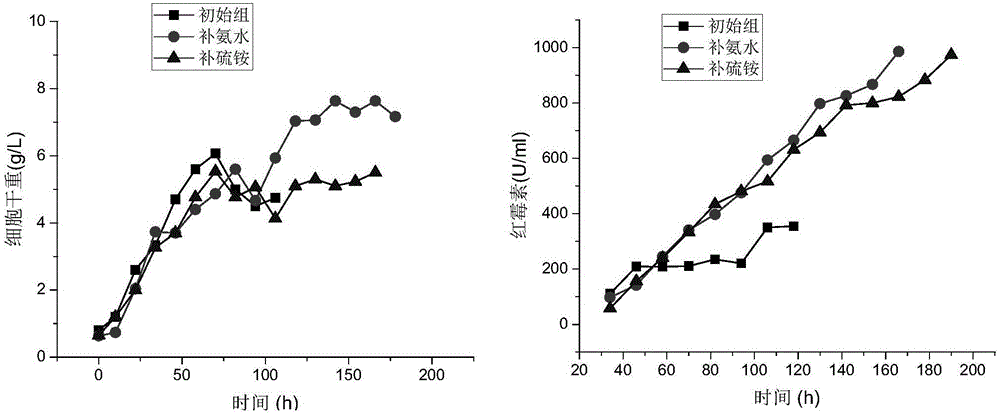
:目前红霉素的工业生产都采用复合培养基,虽然复合培养基有黄豆饼粉和淀粉等碳氮源,可被菌体吸收和利用,但这些固体颗粒也造成发酵液度高,又由于红色糖多孢菌属于高耗氧菌,所以在红霉素发酵过程中高罐压和通气量才能保证菌体的供氧,这对发酵罐和空压机设备要求较高,增加了成本。现阶段国家政府对企业环保的要求增多,处罚力度加大,这也迫使抗生素生产企业增加对发酵液和污水处理的投入。所以去掉培养基中像黄豆饼粉这样的培养基成分,使红霉素发酵的培养基成分越来越简单明确,越来越趋于合成培养基,就如青霉素的培养基一样,是红霉素发酵优化的一个方向。所以合成培养基的优化是实现培养基成分越来越简单明确的第一步,最终实现工业价值。而且合成培养基成分明确简单,便于检测细胞内外的一些重要的中间代谢物,研究红色糖多孢菌中的代谢途径和通量,还可以研究某些物质对红霉素发酵过程的影响,进行机理的研究。目前关于红色糖多孢菌合成培养基研究并不多。patrickcaffrey等人利用简单的基础合成培养基研究合成红霉素的聚酮合酶的三个多肽(debs1、debs2和debs3)的鉴定,文中只是提取纯化了各种蛋白,但没有对培养基中红霉素的产量进行研究。meflores等人用合成培养基研究铵根离子对红霉素合成的影响,发现初始培养基中加入100mm的nh4cl抑制红霉素的合成,而且分别加硝酸铵和硫酸铵获得相似的结果,从而得到铵根离子有抑制红霉素合成的作用,此合成培养基中红霉素产量最高仅达到10u/ml,难以排斥检测误差对实验结果的影响。ribeiromhl等利用简单的全合成培养基进行批发酵研究红霉素的提取方法,用选择性吸附方法来分离提取红霉素,然而提取出的红霉素只有120μg/ml。综上,目前红色糖多孢菌合成培养基的红霉素产量很低,不利于有关红霉素合成的各种机理的研究,其工业应用价值更低。本领域需要进行进一步的技术改进,来提高培养基的红霉素产量。技术实现要素:本发明的目的在于提供利用红色糖多孢菌发酵生产红霉素的新型方法。在本发明的第一方面,提供一种生产红霉素的方法,所述方法包括:以葡萄糖为碳源、氨基酸为氮源,发酵培养红色糖多孢菌,在残糖量低于3~6g/l时,补加葡萄糖,同时补加硫酸铵,补加量以维持发酵液内二氧化碳释放速率(cer)为7~10mmol/(l*h)为准。在一个优选例中,在残糖量低于3~5g/l时,补加葡萄糖,维持残糖量为3~5g/l。在另一优选例中,补加硫酸铵后,维持发酵液内二氧化碳释放速率为7~8mmol/(l*h)。在另一优选例中,所述的氨基酸包括:丙氨酸,精氨酸,半胱氨酸,丝氨酸。在另一优选例中,氨基酸的含量为:在另一优选例中,氨基酸的含量为:在另一优选例中,初始发酵时,葡萄糖的含量为19~25g/l;较佳地为20~24g/l。在另一优选例中,初始发酵时,培养基中还包括:在另一优选例中,上述各组分为:在另一优选例中,所述的培养基的ph值为7±0.2。在另一优选例中,所述的培养基的ph值为7±0.1。在另一优选例中,所述的方法还包括:发酵结束后,从发酵液中分离出红霉素。在另一优选例中,所述的红霉素为红霉素a。本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。附图说明图1、初始组、补氨水策略组、补硫酸铵策略组发酵过程产量和细胞干重增长的测定结果。左图,各组发酵过程细胞干重的变化图;右图,各组发酵过程红霉素产量的变化图。图2、初始组、补氨水策略组、补硫酸铵策略组发酵过程中离线参数的测定结果。(a)各组发酵过程中利用葡萄糖的情况;(b)各组发酵过程中发酵液中氨基氮的变化情况;(c)各组发酵过程中发酵液中溶磷的变化情况。图3、初始组、补氨水策略组、补硫酸铵策略组发酵过程中补率的影响。左图,各组的补糖率的变化曲线;右图,各组的补氮率的变化曲线。图4、初始组、补氨水策略组、补硫酸铵策略组发酵过程中补率的测定结果。图5、补氨水策略组、补硫酸铵策略组产生色素的情况。a、补硫酸铵策略组的150h时发酵液颜色;b、补氨水策略组的150h时发酵液颜色。图6、实施例8中40h补加后的菌丝形态。图7、第80小时(左图)和100小时(右图)补加硫酸铵后的菌丝形态。具体实施方式本发明人以高效生产红霉素、促进环境友好、降低培养成本为目标,对红色糖多孢菌发酵生产红霉素的方法进行了优化,在此基础上提供了一种利用红色糖多孢菌发酵生产红霉素的新型方法,该方法以葡萄糖为碳源、氨基酸为氮源,发酵培养红色糖多孢菌,在适当的发酵阶段补加碳源以及硫酸铵,使得菌体高效生长和生产红霉素。如本文所用,所述的“含有”,“具有”或“包括”包括了“包含”、“主要由……构成”、“基本上由……构成”、和“由……构成”;“主要由……构成”、“基本上由……构成”和“由……构成”属于“含有”、“具有”或“包括”的下位概念。本发明的方法与以往的培养方式相比,做了很大的改变,在培养体系中去除了黄豆饼粉和淀粉等成分复杂、不利于环境友好的成分,而是运用了成本明确、可控,且环境友好的成分。为了使得红霉素高效生产,本发明人长期研究和观测培养和发酵过程,研究对于红色糖多孢菌的最为合适的营养给予方式,以实现整个发酵过程菌体增殖、生长过程良好,不发生大比例的菌体自溶,高产红霉素。基于本发明人的新发现,提供了一种生产红霉素的方法,所述方法包括:以葡萄糖为碳源、氨基酸为氮源,发酵培养红色糖多孢菌,在残糖量低于3~6g/l时,补加葡萄糖,同时补加硫酸铵,补加量以维持发酵液内二氧化碳释放速率(cer)为7~10mmol/(l*h)为准。在本发明的优选方式中,初始发酵时,作为碳源的葡萄糖的含量为19~25g/l;较佳地为20~24g/l。优选地,在残糖量低于3~5g/l时,补加葡萄糖,维持残糖量为3~5g/l。本发明人观察到,在这一时机给予葡萄糖补料,能够使得菌体维持良好的增长。本发明人对比发现,合适的硫酸铵补加时机对于高效发酵是比较重要的,若是选择的时机不理想,则对于整个发酵而言,会发生极为显著的菌体生长不良以及红霉素产量低。因此,本发明人选择在发酵进行到残糖量低于3~6g/l、优选地3~5g/l时,补加硫酸铵。在本发明的优选方式中,补加硫酸铵开始后,维持发酵液内二氧化碳释放速率为7~8mmol/(l*h),如8mmol/(l*h)。过高或过低的硫酸铵补加量并不利于菌体生长和产物生产,过高的情况下,会使得菌体短期内大量增殖,发生自溶;而过低则不能长足生长。同时,在本发明的优选方式中,初始培养基中,应用的氨基酸包括:丙氨酸,精氨酸,半胱氨酸,丝氨酸。在该优选方式中,运用了较为少量的氨基酸作为初始氮源,有效控制了发酵的成本。这些氨基酸的较佳用量和更佳用量如下表1。表1较佳用量更佳用量丙氨酸0.4~0.75g/l0.5~0.7g/l精氨酸0.4~0.6g/l0.5~0.58g/l半胱氨酸0.5~0.7g/l0.55~0.65g/l丝氨酸0.45~0.65g/l0.5~0.6g/l在本发明的优选方式中,初始发酵时,培养基中还包括:磷酸氢二钾、磷酸二氢钾、硫酸镁、柠檬酸三钠、氯化钴、硼酸钠、三氯化铁、氯化铜、钼酸铵。更优选地,这些成分的较佳用量和更佳用量可以如下表2。表2较佳用量更佳用量磷酸氢二钾0.8~2g/l1~1.5g/l磷酸二氢钾0.4~2g/l0.8~1.2g/l硫酸镁0.5~2g/l0.8~1.5g/l柠檬酸三钠1~3g/l1.5~2.5g/l氯化钴0.006~0.015g/l0.008~0.01g/l硼酸钠0.002~0.01g/l0.004~0.008g/l三氯化铁0.004~0.01g/l0.005~0.008g/l氯化铜0.0001~0.0004g/l0.0001~0.0004g/l钼酸铵0.001~0.004g/l0.002~0.003g/l在本发明的优选实施例中,补氨水策略和补硫酸铵策略采用的培养基为m2,相对优化前的m1培养基,m2的氨基酸总量降低20%。在发酵过程中,发现m1培养基配合后续不补加氮源的情形,发酵不理想,菌体尽管前期大量生长但会发生自溶;而采取m2且在发酵过程中补加硫酸铵的方式进行发酵,效果特别理想。发酵结束后,还包括从发酵液中分离出红霉素。红霉素的分离可以采用本领域已知的方法。对分离获得的红霉素,本发明人进行进一步的分析还发现,本发明的方法获得的产物中,红霉素a的占比非常高,为99%以上,这对于生产以及纯化均是非常有利的。目前现有技术的培养方法,采用合成培养基的氨基酸较容易吸收利用,由于缺少氮源菌体易化稀,造成发酵时间较短,产量不高,而且除红霉素a以外的红霉素c和红霉素b等杂质较多。本发明的方法有效地改变了这一发酵现状。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。实验菌株红色糖多孢菌(saccharopolysporaerythredema)hl3168e3菌株(参见廖建国,洪铭,储炬;运用高通量筛选技术优化红霉素a发酵的合成培养基;中国抗生素杂志;2018:1),保存于-80℃冰箱的50%甘油管中。斜面培养基(g/l)淀粉10,玉米浆13,氯化钠3,硫酸铵3,碳酸钙3,琼脂20,ph=7。种子培养基(g/l)淀粉40,蛋白胨20,磷酸二氢钾0.2,硫酸镁0.25,糊精20,葡萄糖10,豆油1.0,氯化钠4,碳酸钙6,消泡剂0.02,ph=7。发酵罐培养基发酵全合成培养基m1(g/l):葡萄糖22.0,磷酸氢二钾1.2782,磷酸二氢钾0.6391,硫酸镁1.0,丙氨酸0.8575,精氨酸0.684,半胱氨酸0.7814,丝氨酸0.7338,柠檬酸三钠2.2841,氯化钴0.009,硼酸钠0.006,三氯化铁0.0068,氯化铜0.00027,钼酸铵0.0027,ph=7。发酵全合成培养基m2(g/l):葡萄糖22.0,磷酸氢二钾1.2782,磷酸二氢钾0.6391,硫酸镁1.0,丙氨酸0.686,精氨酸0.5472,半胱氨酸0.6251,丝氨酸0.587,柠檬酸三钠2.2841,氯化钴0.009,硼酸钠0.006,三氯化铁0.0068,氯化铜0.00027,钼酸铵0.0027,ph=7。实施例1、发酵培养本实施例中,采用5l发酵罐进行发酵,采用本发明优化的合成培养基作为发酵培养基。1、清洗、接种及培养接种前,对菌种进行清洗。为了孢子快速萌发和菌丝的生长,所以种子培养基为复合培养基,菌体用生理盐水进行清洗。首先,将生理盐水、空的500ml的摇瓶和足量的空的50ml离心管灭菌后,放入超净工作台中。将培养了48h的种子摇瓶用酒精棉擦拭一遍,放入超净工作台中。然后,将种子摇瓶里的培养基倒入空离心管中,盖紧盖子,在3000rpm下离心10min。取出离心管后,用酒精棉擦拭一遍管壁,放入超净工作台中,轻轻倒出上清(避免将下层沉淀中的菌丝倒出),再用5ml的移液枪将30ml生理盐水加入离心管中,拧紧盖子,放在漩涡震荡仪上,将菌体重悬后,在3000rpm下离心10min,如此操作将菌体清洗三次,最后将重悬获得菌丝液倒入500ml的摇瓶,用生理盐水定容到300ml,待接种。在罐压为0.02mpa左右,用火焰圈保护进行接种。培养过程中,使用溶氧电极和ph电极进行在线检测溶氧和ph,控制溶氧在30%左右,ph为7。温度维持在34℃,通气量和罐压分别保持在0.5vvm和0.03mpa。每12h取一次样,进行各参数进行检测,从而对发酵罐进行调控,使菌体处于最佳的产素状态。2、在线检测方法通过软件biostar监测在线参数(ph,od,温度,罐压,尾碳,尾氧,通气量)和在线计算参数(氧气摄取速率our和二氧化碳释放速率cer,呼吸熵rq)。在线参数分析可以反映出菌体所处的宏观的外部环境,而在线计算参数通过宏观参数计算反映菌体内部代谢强度,通过多参数和多尺度分析从而对发酵罐参数和补料流加速率进行调控,使菌体处于最佳的产红霉素状态。3、葡萄糖检测葡萄糖检测使用生物传感分析仪,采酶膜法将酶反应转化为电信号与试剂盒相比能够实现葡萄糖的快速检测。4、红霉素化效检测方法化效检测采用磷酸法,由于文献中反应体系较大所以对此方法进行改良。具体方法如下:(1)试剂准备10mol/l的磷酸(根据浓磷酸的浓度进行稀释,如85.11%的浓磷酸的物质的量的浓度为14.63mol/l),无水乙醇(分析纯)。(2)标品的配制称取红霉素标准品(标准品效价1000μg/ml)0.05g置50ml容量瓶内,加入5ml甲醇溶解后,用去离子水稀释至刻度,即得1000μg/ml的红霉素样品液吸取红霉素样品液(1000ug/ml)1ml、2ml、3ml、5ml、8ml,分别置于5个10ml容量瓶中,加水至10ml,即得100μg/ml、200μg/ml、300μg/ml、500μg/ml和800μg/ml的红霉素标准液。(3)发酵液的处理取离心后的上清1ml进行稀释,估计效价在300-500μg/ml,即得供试品溶液。(4)标准曲线的绘制分别吸取不同浓度的红霉素标准液0.8ml(对照是吸取0.8ml的去离子水,其它操作都相同)置于10ml比色管中,各加入10mol/l磷酸溶液4ml摇匀,放入82℃的水浴锅中水浴3min,取出放入水中冷却,再用10mol/l磷酸溶液稀释至刻度,摇匀,用紫外分光光度计在485nm处测定吸光度值(用对照调零),以吸光度值对红霉素浓度(μg/ml)绘制标准曲线,得回归方程为y=ax+b(每配制一次10mol/l磷酸溶液,重新做一次标曲)。(5)发酵液效价的测量用移液枪吸取稀释好的发酵液0.8ml置于10ml比色管中,各加入10mol/l磷酸溶液4ml摇匀,放入82℃的水浴锅中保温3min,取出放入水中冷却,再用10mol/l磷酸溶液稀释至刻度,摇匀(对照组吸取同样的稀释好的发酵液0.8ml,不水浴,测吸光度时再直接加10mol/l磷酸溶液定容至10ml,作为对照调零。注:虽然没有水浴但对照组会与磷酸缓慢反应,所以对照组测吸光度时再加磷酸,然后立刻测样,减少因反应产生的影响,用分光光度计在485nm处测定吸光度值(用对照调零)。(6)发酵效价的计算化学效价(μg/ml)=(ax+b)*n*px:测得的吸光度。n:稀释倍数。p:红霉素标品的纯度。5、红霉素组分的检测(1)标品的配制精密称取红霉素标品0.15mg(由公司提供),用10ml乙腈(色谱纯)溶解,用流动相定容至50ml,摇匀备用(标准液密封后放入4℃冰箱保存,有效期3天)。(2)样品的处理首先将发酵液的上清在密封条件下摇匀(不要剧烈振摇,来回倒置几次,以免产生泡沫影响取样体积);摇匀后用移液枪吸取5ml上清,置于50ml离心管中,加入10ml甲醇(色谱纯),边加边摇使充分混合,然后超声5min。冷却后,再加入10ml甲醇,在3000rpm离心10min,取上清1ml用0.22μm的滤膜过滤作为待测样品。(3)检测条件watersxbridgec18色谱柱(4.6mm×250mm,5μm,waterscorporation,ireland);流动相为5.7g/l磷酸氢二钾溶液:乙睛=60:40;流速0.9ml/min,柱温35℃,紫外检测器波长215nm,进样量20μl。6、菌体干重的检测菌体干重(dcw)是一种比较准确反映菌体生物量的一种方法,常见于全合成培养基发酵参数中。菌体干重比pmv更加准确菌体量。现将0.8μm的滤纸在70℃的烘箱里烘24h,在万分之一天平上称量(m1);将发酵液摇匀(防止菌丝体沉在底部,造成干重检测误差大)用移液枪吸取5ml发酵液,在放有滤纸的砂芯过滤装置缓慢打出,再用去离子水清洗两遍(洗去结晶的盐粒子和其它杂质)。最后将滤纸放有滤纸玻璃平板放入70℃烘至恒重,进行称量(m2)带入下列公式计算:不同补料策略对红霉素发酵的影响(1)不补料(初始组)初始培养基为m1,培养基中的氨基酸含量较高,较易于吸收利用,理论上可以使得细胞大量增长,细胞干重得到快速提升。后续不再补料。在发酵进行过程中监测残糖量,在残糖量低于5g/l时,流加葡萄糖至5g/l。该发酵体系通过氢氧化钠调节ph7.0。(2)补氨水策略初始培养基为m2,氨水的补量为闭环控制,控制ph为7。在发酵进行过程中监测残糖量,在残糖量低于5g/l时,流加葡萄糖,葡萄糖补料量为达到约5g/l的终浓度;流加葡萄糖的同时流加氨水,氨水补料量根据ph定,满足ph维持在7±0.1。(3)补硫酸铵策略初始培养基为m2,硫酸铵的补量根据二氧化碳释放速率(cer),在次级代谢阶段维持cer为8mmol/(l*h)。在发酵进行过程中监测残糖量,在残糖量低于5g/l时,流加葡萄糖,葡萄糖补料量为达到约5g/l的终浓度;流加葡萄糖的同时流加硫酸铵,硫酸铵补料量为维持cer为8mmol/(l*h)。实施例2、发酵过程红霉素产量和细胞干重的研究用0.5l摇瓶作为种子摇瓶,初始组为应用原始培养基(m1);补氨水策略组的策略为将原始培养基中的氨基酸总量降低20%(m2),过程中补加氨水作氮源;补硫酸铵策略组的策略为采用培养基m2,过程补入硫酸铵作氮源。见图1左图,就细胞干重来说,由于初始组的基础培养基中氨基酸含量较高,所以30-60h的细胞干重较高。但本发明人也注意到,尽管细胞干重的增长较快,但伴随着氮源消耗后的菌体迅速自溶。也即细胞干重迅速增长后又出现一个细胞干重迅速下降。补氨水策略组中,使用闭环策略进行氨水补料,用氨水调控ph,在100h后,细胞干重从5g/l快速上升到7g/l,120h后干重维持在7.2g/l。补硫酸铵策略组中,补硫酸铵使用开环控制,以维持cer为调控准则,所以相对而言补硫酸铵策略组中细胞干重维持在较稳定的水平。见图1右图,相对于初始组来说,补氨水策略组和补硫酸铵策略组的红霉素产量能够持续增长。100小时(h)后,补氨水策略组红霉素产量略高于,但其自溶早于补硫酸铵策略组,所以最终补氨水策略组和补硫酸铵策略组产量都达到约1000u/ml,而初始组增长缓慢,红霉素产量不高,仅有350u/ml。实施例3、发酵过程中葡萄糖、磷、氮源的利用发酵过程中利用葡萄糖的情况如图2(a),从前40h的残糖来看,初始组的耗糖速率最快,补氨水策略组和补硫酸铵策略组的耗糖速率基本相同,但40h后,补硫酸铵策略组的残糖整体高于补氨水策略组,这可能与硫铵补加量较低有关。补氨水策略组的残糖在118h由于补氨水较多,葡萄糖耗尽,所以118h后残糖都为零。发酵过程中利用氨基氮的情况如图2(b),100h之前,初始组、补氨水策略组和补硫酸铵策略组整体氨基氮变化趋势一致,118h由于补氨水较多,造成氨基氮上升,氨水被利用后又下降。发酵过程中利用氨基氮的情况如图2(c),虽然前期初始组耗磷较快,但后期氮源耗尽,初始组的磷消耗就停止。补氨水策略组和补硫酸铵策略组后期溶磷一直在降低,150h后补氨水策略组逐渐自溶,溶磷维持不变。实施例4、发酵过程中补率的变化从图3左图补糖率的变化曲线可知,在80h之前,初始组的补糖率高于补氨水策略组和补硫酸铵策略组,因为初始组在此期间主要吸收利用氨基酸,菌体生长较快所以菌体耗糖较快,需要补入更多的葡萄糖。80h之后由于初始组菌体迅速自溶,耗糖较少,补糖量降低。补氨水策略组的补糖率整体高于补硫酸铵策略组,这可能因为补氨水策略组中耗糖较高,补糖量相对补硫酸铵策略组较高。请见图3右图,由于初始组不补加氮源,所以右图中只有补氨水率和补硫酸铵率的变化。从补率来看,两种策略中,氨水的补率整体高于硫酸铵的补加量,由于氨水的补加是闭环控制,用氨水调控ph,由于在100h左右提高葡萄糖的补加速率后,葡萄糖代谢导致ph持续下降,为了将ph维持在7左右,补入的氨水量增加,氮源的补入又进一步加快葡萄糖的利用,直至残糖为零时,氨水补加量才下降,细胞干重也由于补入过多的氨水而快速积累。所以补氨水策略组的闭环控制容易导致发酵过程中体系不稳定,不利于发酵各参数的调控。补硫酸铵策略组根据cer的变化来调控硫酸铵的补加量,更加平稳,易于各参数的调控,菌体不易自溶。实施例5、发酵过程中在线参数的变化从图4可知,初始组由于氨基酸总量较高,所以在75h之前初始组的cer明显高于补氨水策略组和补硫酸铵策略组。75h后,初始组逐渐自溶。补氨水策略组中,在100h-125h之间补糖率提高,补氨水量增加,造成cer的突然飙升,直到葡萄糖耗尽,cer才恢复到正常值。160h时补氨水量的增加也造成cer的升高。补硫酸铵策略组在150h以后提高硫酸铵的补率,cer的值也逐渐上升。对比三种策略可知,在合成培养基中氮源的补加是造成cer波动的主要原因。实施例6、氨水对红色色素产生的影响s.erythraea中红色色素是由丙二酰-coa产生,红色色素是甲基丙二酰-coa变位酶催化的产物,在以碳水化合物为基础的培养基,由甲基丙二酰-coa形成红色色素,这造成流向红霉素产生的甲基丙二酰-coa的流量减少,不利于红霉素的产生。图5中,a为补硫酸铵策略组的150h时发酵液颜色为黄色,b为补氨水策略组的150h时发酵液颜色为红色,由图5发酵液颜色可知,补氨水策略组过程中产生了红色色素,这说明有部分的甲基丙二酰-coa形成红色色素,而甲基丙二酰-coa作为形成红霉素的其中一个前体流向红霉素合成方向的就会减少,造成红霉素产量的降低。而补硫酸铵策略过程中发酵液的颜色为正常的黄色,没有红色色素的产生,更有利于红霉素产生。实施例7、硫酸铵对降低红霉素杂质组分的作用本实施例中进一步验证、探究硫酸铵降低杂质组分的作用是否为nh4+的作用。本发明人通过hplc对产物红霉素中的各组分进行分析,如表3所示,氨水为氮源中杂质红霉素c含量高达17.1%,而以硫酸铵为氮源杂质红霉素c含量仅有0.7%。两种补氮策略的产物中均未发现红霉素b,可能因为红霉素b由次要途径产生产量太低,在hplc的检测限以下。补硫酸铵策略组中主产物红霉素a纯度高达99.3%,而补氨水策略组中红霉素a仅有82.9%。总之,通过实验验证硫酸铵确实有降低红霉素杂质组分和提高红霉素a的目的,也证明了nh4+没有降低杂质组分的作用。该结果提示,硫酸铵降杂质组分的作用与so42+有关。表3、不同氮源对红霉素各组分的影响实施例8、硫酸铵在不同发酵时间段补加的影响本实施例中,考察在发酵起始后的不同时间段补加硫酸铵,观测对于红霉素产量的影响。本发明人采用的补硫酸铵策略如下:初始培养基为m2,在发酵进行到第20小时(残糖量约15~17g/l)、第40小时(残糖量约5g/l)、第80小时(残糖量约5g/l)、第100小时(残糖量约5g/l)、补加硫酸铵。此发酵过程,在发酵进行过程中监测残糖量,在残糖量低于5g/l时,流加葡萄糖。结果发现,第20小时时流加硫酸铵,cer约为9mmol/(l*h),而且有不断上升的趋势,还处于菌体积累的初级代谢阶段。氨基氮为0.4g/l,此时补加硫酸铵造成氮源累积,无法从初级代谢转入次级代谢,红霉素产生缓慢,产量较低。第40小时,此时残糖量降低到约5g/l,氨基氮为0.23g/l,此时菌体从初级代谢转入次级代谢,开始大量产生红霉素。本发明人发现,此时流加硫酸铵提供氮源,避免了菌体自溶。40h补加后的菌丝形态良好,如图6。第80和100小时补加硫酸铵,此时菌体发生断裂自溶,尽管补加硫酸铵,但维持菌体活性仍然不理想,菌丝形态如图7(左图为80h补加,右图为100h补加)。上述结果显示,发酵开始后,在第40小时,残糖量从初始的22g/l降低到约5g/l时,补加硫酸铵,之后保持流加,效果最为理想。实施例9、硫酸铵在不同cer数值时补加的影响本实施例,在发酵起始后当残糖量低于5g/l时流加葡萄糖(流加量根据残糖量来确定)和硫酸铵。硫酸铵补量根据二氧化碳释放速率(cer),在次级代谢阶段维持cer分别为6、8、10、12、15mmol/(l*h),观测对于红霉素产量的影响。结果发现,cer维持在6mmol/(l*h)时不需要流加硫酸铵,菌体活性弱,很快自溶。流加硫酸铵使cer维持在8~10mmol/(l*h)时,效果较理想。流加硫酸铵使cer维持在12~15mmol/(l*h)时,菌体又进入初级代谢不利于红霉素的产生。上述结果显示,补加硫酸铵,维持cer为8~10mmol/(l*h)流加,效果较为理想。实施例10、发酵初始培养基的配方研究本实施例中,小幅调整初始培养基的各组分用量,并且采用如实施例1相同的补硫酸铵策略,观测红霉素的产量。培养基m3:葡萄糖20.0,磷酸氢二钾1.4,磷酸二氢钾0.6,硫酸镁1.1,丙氨酸0.7,精氨酸0.5,半胱氨酸0.58,丝氨酸0.6,柠檬酸三钠2.4,氯化钴0.01,硼酸钠0.005,三氯化铁0.007,氯化铜0.00022,钼酸铵0.0022,ph=7。培养基m4:葡萄糖24,磷酸氢二钾1.2,磷酸二氢钾0.7,硫酸镁0.95,丙氨酸0.6,精氨酸0.58,半胱氨酸0.64,丝氨酸0.55,柠檬酸三钠2.1,氯化钴0.008,硼酸钠0.007,三氯化铁0.006,氯化铜0.0003,钼酸铵0.003,ph=7。采用上述两种培养基,发酵结果显示,红霉素的产量约1000u/ml。综上,本发明人选择用0.5l摇瓶做种子摇瓶,将原始培养基中的氨基酸总量降低20%,采用过程补加氮源的方式进行发酵。本发明选择分别流加氨水和硫酸铵作为氮源,氨水为碱性,既可以作为氮源,又可以调ph。虽然这两种补料策略最终产量都达到了1000u/ml,补氨水策略组的闭环控制容易导致发酵过程中体系不稳定,不利于发酵各参数的调控。补硫酸铵策略组根据cer的变化来调控硫酸铵的补加量,更加平稳,易于各参数的调控,菌体不易自溶。而且补氨水策略组过程中产生了红色色素,这说明有部分的甲基丙二酰-coa形成红色色素,造成红霉素产量的降低。就红霉素的组分来说,通过补氨水策略组和补硫酸铵策略组红霉素组分的对比,硫酸铵确实有降低红霉素杂质组分和提高红霉素a的目的,也证明了nh4+没有将杂质组分的作用。硫酸铵降杂质组分的作用可能与so42+有关,但需要进一步的实验验证。总而言之,补硫酸铵策略既提高了合成培养基发酵红霉素的产量达到1000u/ml,又极为显著地提高了红霉素a的纯度,使之达到99.3%,所以效果更好。而补氨水策略组为闭环控制体系不稳定,容易失控,还有色素产生,红霉素a纯度较低。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1