本发明提供了能够与肺炎支原体阳性血清特异结合的多肽,以及基于多肽的诊断试剂盒,更涉及了一种基于噬菌体展示多肽的肺炎支原体诊断试剂盒,属于生物制剂领域。
背景技术
肺炎支原体(mycoplasmapneumoniae,mp)是介于病毒和细菌之间的原核细胞型生物,由其感染引起的病理改变以间质性肺炎为主,约占人和动物非细菌性肺炎的1/2。mp传染性强,尤其易传播于儿童,是社区获得性肺炎的主要病原,因此mp肺炎的早期确诊极为重要。目前肺炎支原体感染主要采用mp的分离培养、血清学检测、pcr检测及物理诊断等方法进行诊断,尚缺乏灵敏、特异的诊断抗原用于mp感染的血清学诊断。有研究采用生物信息学方法预测肺炎支原体p1蛋白c端作为抗原并进行了血清学探索;stevenp等研究表明肺炎支原体p40和p90具有较强的抗原性;另外,有研究表明肺炎支原体p30蛋白的n端含有重要的表位。以往这些研究都是基于传统的蛋白表达与纯化,其操作繁琐、成本高昂且特异性较低。而长的肽段多以空间构象形式存在,其中的优势表位一般只含有5-7个氨基酸或单糖残基,是抗原与抗体结合的关键位点,因此筛选病原体的优势表位成为近年来血清学与疫苗学研究的重点。
表位(epitope)又叫抗原决定簇(antigenicdeterminant),通常只有位于抗原表面的表位易与抗体结合,称之为功能性表位,模拟表位则是构象表位上不连续的氨基酸通过空间构象形成的结构,其序列可能与病原体本身蛋白有一定同源性,也可能不具有相似性。筛选优势模拟表位不仅可以避免合成长肽段和表达纯化重组蛋白时的繁琐,而且能克服长链氨基酸因螺旋或折叠导致其与抗体的亲和性不高等缺点,因此成为表位研究的重点,广泛应用于诊断制剂、疫苗研制和蛋白质相互作用关键结合位点的确定等领域。
1985年,smith首次创建了噬菌体展示技术。1990年,scott等将噬菌体随机肽库技术应用于筛选抗原表位,获得了与原始抗原性质、结构完全不同,但保留了其免疫原性和免疫反应性的模拟表位。利用该技术不但可以揭示抗原分子的结构和功能、制备广谱疫苗,也可筛选具有高亲和性的优势抗原表位,以优化设计灵敏、特异的elisa试剂盒,为病原体感染的血清学诊断提供基础。
技术实现要素:
本发明解决了背景技术中的不足,提供了一种能够与肺炎支原体阳性血清特异结合的多肽和展示该多肽的核心噬菌体,所述多肽和其相应的核心噬菌体的灵敏度和特异度高,具有良好的临床诊断价值。
实现本发明上述目的所采用的技术方案为:一种与肺炎支原体阳性血清特异结合的多肽,其特征在于:所述的多肽的氨基酸序列如seqidno:1所示:t-v-n-f-k-l-y。
本发明还提供了一种肺炎支原体血清学诊断试剂盒,该试剂盒中至少包括包被液、洗涤液、封闭液和终止液,所述试剂盒中含有上述与肺炎支原体阳性血清特异结合的多肽。
本发明还进一步提供了一种基于噬菌体展示多肽的肺炎支原体诊断试剂盒,该试剂盒中至少包括包被液、洗涤液、封闭液和终止液,试剂盒中还包含有核心噬菌体,其中核心噬菌体为展示上述多肽的噬菌体。
以上试剂盒中,所述包被液为0.05m的碳酸盐缓冲液,ph为9.6,所述的洗涤液为含0.05%tween-20的tbst缓冲液,其ph为7.6,所述封闭液为含5%bsa的tbs缓冲液,所述的终止液为2mol/l的h2so4溶液。
将本发明所提供的噬菌体及其相应的多肽进行elisa反应,结果表明:代表性噬菌体克隆均能与肺炎支原体阳性血清发生特异结合,展示多肽序列的核心噬菌体p1能与不同的临床血清发生结合;固相合成的多肽与不同的临床血清发生反应,其灵敏度为90.1%,特异度为94.3%,roc曲线下的面积auc=0.96;auc值大于0.9,表示准确性较高,elisa结果可信度较高,具有较好的临床诊断价值。
与现有技术相比,本发明中将噬菌体应用于血清学诊断具有以下显著的优势:本发明利用噬菌体展示随机肽库筛选能与肺炎支原体阳性血清特异结合的噬菌体,获得mp的优势模拟表位,从噬菌体展示随机7肽库中筛选到的多肽可能为mp的模拟表位,能与mp阳性血清特异结合,可用于mp感染的血清学诊断。
噬菌体侵染大肠杆菌,繁殖速度快,易于实现大批量生产;噬菌体结构紧密,耐恶劣环境强,对检测的条件要求不高,使试验易于操作;敏感度和特异度高,能够达到快速、灵敏的诊断要求。因此,将噬菌体用于肺炎支原体的血清学诊断,对提高肺炎支原体感染的临床诊断效率具有重要意义。
附图说明
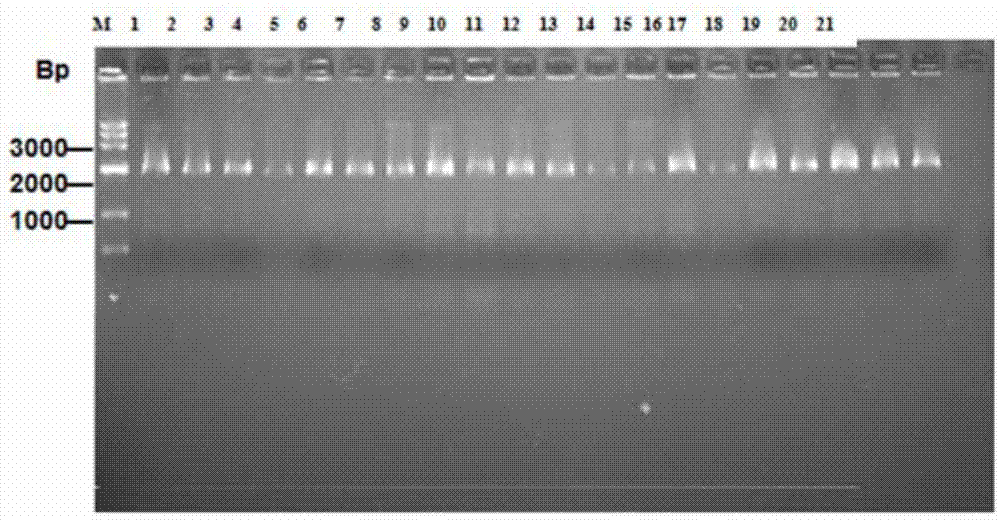
图1为琼脂糖凝胶电泳分析提取的部分噬菌体单链dna图;
图2为噬菌体克隆与肺炎支原体感染阳性血清、健康者血清及牛血清白蛋白的elisa反应性图;
图3为斑点免疫印迹法检测噬菌体与肺炎支原体阳性血清的特异结合图;
图4为合成的多肽和不同的临床血清的elisa反应图;
图5为合成的多肽和不同临床血清elisa反应的roc曲线图。
具体实施方式
下面结合具体实验步骤对本发明做详细具体的说明,但是本发明的保护范围并不局限于以下实施例。
下述实验中利用纯化的肺炎支原体阳性混合血清为靶分子,对噬菌体展示随机7肽库进行生物淘选,筛选到能与肺炎支原体阳性混合血清特异结合的噬菌体,并以固相合成的7肽当做包被抗原,检测噬菌体以及外源多肽与不同临床血清的反应情况,以证明该噬菌体及其多肽在肺炎支原体血清学诊断中的应用价值。
材料与方法:将肺炎支原体感染者的阳性混合血清和阴性混合血清(来自郴州市第一人民医院)分别用饱和(nh4)2so4法进行纯化:往血清中加入等体积生理盐水,混匀后缓慢滴加2倍体积的饱和(nh4)2so4,经离心后用生理盐水溶解沉淀物;缓慢滴加2/3体积的饱和(nh4)2so4,再次离心弃上清,用生理盐水溶解沉淀物;加入1/2体积的饱和(nh4)2so4,离心后用2ml生理盐水溶解沉淀物;用millipore超滤离心管进行浓缩并去除无机盐离子;bca法测蛋白浓度后-80℃保存备用。
最终获得纯化的阳性血清约2.96mg,阴性血清约3.02mg。
噬菌体展示随机肽库的淘选:对噬菌体展示七肽库进行4轮生物淘选,步骤简述如下:第一轮以100μl纯化的阳性血清(100μg/ml)包被elisa板,经封阻、结合、洗涤(0.1%tbst)、洗脱(0.2m甘氨酸-hcl,ph=2.2)、中和(1mtris-hcl,ph=9.1)等步骤收集噬菌体,再用空的elisa板进行反向吸附,以排除与elisa板吸附的非特异噬菌体,然后用纯化的阴性血清为包被抗原,经封闭、吸附、收集未吸附的噬菌体,以排除可能与阴性血清结合的噬菌体,对噬菌体进行滴度测定后,取1μl进行扩增。随后以此方法对其进行第二到第四轮生物淘选,淘选的基本步骤与第一轮相似,但降低阳性血清的包被浓度(60μg/ml),升高洗涤液的浓度(0.3%tbst),以尽量排除非特异性吸附,根据产出与投入的噬菌体滴度,计算每轮生物淘选的产率,结果如表1所示。
表1亲和淘选的产出与投入比
dna测序与分析:为了确定经生物淘选后而富集的特异噬菌体的外源性氨基酸序列,将第4轮淘选后的产物进行滴度测定,将第4轮淘选后的产物进行铺板培养,从噬菌斑小于100个的平板上随机挑取40个克隆,提取单链dna进行琼脂糖凝胶电泳。结果如图1所示:噬菌体dna条带均出现在约3000bp处(图1仅展示了其中20个样本的dna提取情况,图1中m:dna-ladder;1-20:从随机挑取的噬菌体克隆中提取的单链dna;21:空白对照)。
用琼脂糖凝胶电泳验证单链dna提取成功后,送往上海生工生物技术有限公司进行测序。共有30份标本测序成功,将测得的外源性dna序列翻译成相应的氨基酸序列(见表2),结果一共出现5种不同的序列(分别对应5个不同的代表性噬菌体),其中七肽1(t-v-n-f-k-l-y)和七肽2(l-p-q-r-l-r-t)重复出现的次数较多,七肽1共重复出现20次,七肽2重复出现5次,表明这两条7肽对应的噬菌体与mp感染阳性血清可能存在相对较高的亲和性。
表2噬菌体测序后筛选出的多肽
elisa检测代表性噬菌体与纯化阳性血清的特异结合:用间接elisa检测代表性噬菌体能否与纯化阳性血清特异结合。步骤简述如下:代表性噬菌体经扩增后测定滴度,取200μl纯化的阳性血清(100ug/ml)包被elisa板4℃过夜,设置阴性血清对照组和bsa对照组;用5%的脱脂牛奶封闭3h,0.5%pbst洗涤5次,加入50μl不同稀释度的待测噬菌体,37℃孵育2h,0.5%pbst洗涤5次后,加入1:5000的hrp-labeledanti-m13piiimonoclonalantibody(neb,beverly,ma,usa))37℃孵育15min,洗涤,显色10min,终止反应,用酶标仪检测波长为450nm时的od值。
结果如图2所示,图2中,以mp阳性血清包被elisa板,封闭并洗涤后分别加入代表性噬菌体,孵育并洗涤后加入hrp标记的抗m13噬菌体的抗体,经显色后测定od450值,同时设置阴性血清及bsa对照。1-5分别表示5种代表性噬菌体。图2中结果表明:5个代表性噬菌体均能与纯化的阳性血清特异结合,其中代表性噬菌体1和2与阳性血清的od值最高,说明其具有较好的结合力,且这两个噬菌体具有较高的重复次数,因此,选择代表性噬菌体1和2进行后续实验。
斑点免疫印迹实验验证噬菌体与阳性血清的特异结合:用斑点免疫印迹实验进一步验证噬菌体能否与阳性血清特异结合,简述如下:分别取1μl扩增的噬菌体上清依次点在pvdf膜的小方格上,以等量肺炎支原体感染病人血清作阳性对照,bsa、肺炎支原体阴性血清和野生型vcsm13噬菌体分别作阴性对照,待液体被pvdf膜吸收后,将pvdf膜于4℃封闭过夜;用tbst漂洗4次,每次30min;用1:100的混合肺炎支原体感染阳性血清于室温孵育2h;tbst洗膜4次,每次30min;再与1:5000的hrp标记的羊抗人igg于室温孵育1h;用tbst洗膜4次,每次20min;最后进行mb显色反应,显影、定影,观察印迹效果。
结果如图3所示,图3中,分别将扩增的代表性噬菌体依次点在pvdf膜的小方格上,4℃封闭过夜,漂洗后用纯化的肺炎支原体感染阳性血清孵育,tbst洗膜后加入hrp标记的羊抗人igg孵育,洗膜后显影定影。同时用肺炎支原体感染病人血清作阳性对照,bsa、肺炎支原体阴性血清和野生型vcsm13噬菌体分别作阴性对照。图3中,a1:空白对照;b1:纯化的肺炎支原体阳性血清;c1:纯化的肺炎支原体阴性血清;a2:野生型m13噬菌体阴性对照;b2:代表性噬菌体1;c2:代表性噬菌体2。
从图3中可以看出,代表性噬菌体1、2和阳性对照处均出现了清晰的斑点,而阴性对照处没有斑点出现,说明代表性噬菌体1和2均能与肺炎支原体阳性血清发生特异结合。
多肽的固相合成与亲和性验证:委托上海吉尔生化公司采用固相法合成重复次数较多的代表性噬菌体所展示的外源性7肽(7肽1和7肽2),并用反相高效液相色谱法进行纯化后经质谱分析对其进行鉴定。检测结果显示7肽1的主峰出现在保留时间为10.907min处,其峰的面积占整个面积的98.8184%,即其相对浓度约为98.8184%。7肽2的主峰出现在保留时间为6.848min处,其峰的面积占整个面积的95.15%,说明其相对浓度约为95.15%。这些结果说明合成肽7肽1和7肽2得以成功纯化,纯度均高达95%以上。
以此多肽为包被蛋白(100μg/ml),采用棋盘法探索建立间接elisa法的多肽包被浓度、血清稀释倍数、酶标抗体浓度和孵育时间等,检测合成的7肽与肺炎支原体感染阳性血清和健康人血清的反应情况。棋盘法最终确定:以200μl20μg/ml的7肽包被elisa板4℃过夜,5%的脱脂牛奶封闭3h,加入50μl10倍稀释的待测血清于37℃孵育45min,0.5%pbst洗涤5次后加入羊抗人igg抗体(1:5000)37℃孵育20min,洗涤,显色10min,终止反应后测波长为450nm时的od值。
应用血清学评价法分析基于固相合成的多肽而建立的elisa法的灵敏度和特异度。灵敏度=真阳性人数/(真阳性人数+假阴性人数)×100%;特异度=真阴性人数/(真阴性人数+假阳性人数)×100%。利用graphpadprism软件制作roc曲线,分析灵敏度与特异度之间的关系:auc为roc曲线下面积,当auc<0.5时,说明elisa结果不可靠;当0.5<auc<0.7时,表示elisa结果的可信度较低;当0.7<auc<0.9时,表示准确性较高,elisa结果可信度较高;当auc>0.9时,说明准确性非常高,elisa结果具有较大的参考意义。另外,采用medcal计算其灵敏度和特异度,以离roc曲线左上角(100,0)坐标最近的点为判断标准。
检测结果如表3、图4和图5所示。表3:合成7肽的elisa反应结果
图4中将合成的7肽包被elisa,封闭后加入经10倍稀释的待测血清,孵育并洗涤后,与羊抗人igg抗体孵育,显色后测量od450值。图4中左图为7肽1分别与80份阳性血清和36份阴性血清elisa反应检测od450值;右图为7肽2分别与80份阳性血清和36份阴性血清elisa反应检测od450值。图5中左图为合成的7肽1与临床血清反应的roc曲线,右图为合成的7肽2与临床血清反应的roc曲线。
由上述结果可以看出,基于7肽1而建立的间接elisa法的灵敏度为90.1%,特异度为94.3%,roc曲线下的面积auc=0.96;基于7肽2而建立的间接elisa法的灵敏度为80.00%,特异度为97.1%,roc曲线下的面积auc=0.94,二者的auc值均大于0.9,表示准确性较高,elisa结果可信度较高,具有较好的临床诊断价值。
序列表
<110>郴州市第一人民医院
<120>与肺炎支原体阳性血清特异结合的多肽以及诊断试剂盒
<160>1
<170>siposequencelisting1.0
<210>1
<211>7
<212>prt
<213>人工序列(artificialsequence)
<400>1
thralaasnphelysleutyr
15