基于磁性功能化微流控芯片的单核苷酸多态性分析方法与流程
本发明涉及一种基于磁性功能化微流控芯片的单核苷酸多态性分析方法,属于微流控芯片技术领域。
背景技术
单核苷酸多态性(snps)是遗传位点上与人类各种基因疾病密切相关的单碱基变异。它是人类可遗传的变异中最常见的一种。micrornas(mirna)是一组长度为18-25个核苷酸的内源小的非编码rna。mirna作为一种重要的转录后调控因子,参与动物和植物的各种发育和生理过程,在疾病中也发挥重要作用。mirna可以作为癌基因或肿瘤抑制因子,调节人类约三分之一基因的表达。mirna影响癌症风险,相关基因的变异将会影响mirna的功能,从而影响多种生物过程。因此,检测mirna中的snps是必要的。到目前为止,有许多方法和技术用于snps鉴定,其中包括特异的聚合酶链反应、微阵列、聚合酶链反应限制片段长度多态性等等,这些技术大多可以检测到snps,但由于复杂的程序、昂贵的试剂和冗长的操作时间而受到限制。因此,发展分离和检测snps的简单、快速、低成本的技术具有重要意义。
微流控芯片电泳是微型化的毛细管电泳技术,不仅包括了毛细管电泳的基本功能,而且,微流控芯片具有尺寸小、试剂消耗量少、分析速度快、易实现多通道平行分析以及能和其它操作单元整合的特点,特别适用于生物样品的微量分析及功能研究,是分离分析的理想平台。常用的微流控芯片一般是以聚二甲基硅氧烷(pdms)制备得到,pdms微芯片具有制作方便、快速且易于封合等优点,但其表面疏水性强、容易吸附被测物、电渗流不稳定,限制了pdms微芯片在分离方面的应用。采用合适的方法对微芯片通道进行改性处理,可有效抑制非特异性吸附,提高分离效率及分离重现性。二维纳米片具有很强的区分单链dna(ssdna)和双链dna(dsdna)的能力。氧化石墨烯(go)具有诸如大的比表面积、容易大量获得、在水中具有良好分散性、高生物相容性以及在纳米片表面上包含一系列含氧官能团使得其易被功能化这些独特的特性受到广泛关注。go的磁性纳米复合材料(go@fe3o4)具有go和fe3o4两种组分的优点,将go的高吸附容量和fe3o4磁性材料的易分离特性结合起来,使得go@fe3o4一方面具有良好的磁性能,可实现在pdms微芯片通道内的可控固定,大大节约了修饰时间,还提高了微芯片的重复利用率;另一方面,go@fe3o4具有良好的生物相容性和亲水性,有利于保持固定化生物分子的生物活性。然而基于go@fe3o4功能化微流控芯片的单核苷酸多态性分析方法尚未见报道。
技术实现要素:
本发明旨在提供一种基于磁性功能化微流控芯片的单核苷酸多态性分析方法,具有简单、快速且分离效率高的特点。
本发明通过如下技术方案实现:
基于磁性功能化微流控芯片的单核苷酸多态性分析方法,包括以下步骤:
(1)制备go@fe3o4纳米复合材料,利用go@fe3o4的良好磁性能,在外加磁铁的作用下将go@fe3o4固定于pdms微流控芯片分离通道内,制成go@fe3o4功能化pdms微流控芯片分离通道;
(2)设计一条用亚甲基蓝标记的单链dna,使得其与microrna-21序列完全互补的同时还与microrna-21单碱基错配序列sm-microrna-21部分互补,将该单链dna分别与microrna-21及microrna-21单碱基错配序列sm-microrna-21杂交形成完全互补的稳定的dna/microrna-21异源双链体和单碱基错配的松散结构的dna/sm-microrna-21异源双链体,之后,将dna/microrna-21和dna/sm-microrna-21混合,制得混合样品;
(3)以高压电源作为流体驱动装置,在pdms微流控芯片的分离通道两端施加1000v的分离电压,将通道用运行缓冲溶液冲洗10min;将混合样品加入到pdms微流控芯片的样品池,通过高压电源在样品池和废液池之间施加800v进样电压5s将混合样品驱动到pdms微流控芯片的样品通道与分离通道的十字交叉处,之后,再切换高压电源,在分离通道两端施加1000v的分离电压驱动样品流经pdms微流控芯片分离通道,而流经go@fe3o4功能化pdms微流控芯片分离通道后,混合样品内的dna/microrna-21和dna/sm-microrna-21得到分离,再结合以碳纤维作为工作电极、铂丝作为对电极、ag/agcl作为参比电极构建的三电极系统,检测标记在dna上的亚甲基蓝的电化学信号,根据亚甲基蓝的电化学信号的保留时间判断dna/microrna-21和dna/sm-microrna-21的分离程度,此外,还可根据亚甲基蓝的电化学信号的强度判断microrna-21和sm-microrna-21的浓度,实现go@fe3o4功能化pdms微流控芯片对单核苷酸多态性的分离和检测。
上述方法中,步骤(2)所述的杂交是在杂交缓冲溶液中进行,而杂交缓冲溶液的组成为20mmph7.4的三羟甲基氨基甲烷盐酸盐缓冲溶液,并含500mmnacl和100mmmgcl2;步骤(3)中所述的运行缓冲溶液是浓度为20mm,ph为7.17的磷酸盐缓冲溶液。
本发明中,go@fe3o4功能化pdms微流控芯片分离通道按以下方法制备:
(1)制备氧化石墨烯:将0.5g石墨粉和0.5gnano3加入到23ml的浓h2so4中,冰浴条件下缓慢加入3gkmno4,充分搅拌使其混合均匀后,把溶液转移到35℃的水浴中搅拌1h,形成灰褐色糊状物,加入40ml超纯水,室温下搅拌30min,再加超纯水稀释至140ml,逐滴加入3ml30%的h2o2,溶液从深棕色变成亮黄色,将得到的产物趁热过滤,用超纯水以8000r/min离心2min,之后,清洗离心产物至上层清液为中性,得到氧化石墨烯go;
(2)制备go@fe3o4纳米复合材料:将40mg步骤(1)制备的go溶解到20ml超纯水中,超声分散3h,然后在通入n2的条件下加热至70℃并保持30min,再加入21mgfecl3·6h2o和72mgfecl2·4h2o,搅拌40min;再逐滴加入1.0mlnh3·h2o并剧烈搅拌40min;反应溶液冷却至室温后,将产物用磁铁分离,并用超纯水清洗,将得到的产物go@fe3o4分散到超纯水中,制成1mg/ml的go@fe3o4溶液;
(3)制备go@fe3o4功能化pdms微流控芯片分离通道:先将pdms微流控分离通道用超纯水冲洗5min,然后在芯片的上下方各放置一块长度为2cm的永久磁铁,用真空泵将步骤(2)制备的go@fe3o4溶液抽入分离通道中,go@fe3o4被固定于pdms微流控分离通道内磁铁所在的位置,将修饰后的微流控芯片放置1h,用运行缓冲溶液连续冲洗分离通道5min,制成go@fe3o4功能化pdms微流控芯片分离通道。
本发明的原理是:
dna/microrna-21和dna/sm-microrna-21的混合物中,go@fe3o4对单碱基错配的松散结构的dna/sm-microrna-21异源双链体的吸附作用较强,而对完全互补的稳定的dna/microrna-21异源双链体的吸附作用较弱,导致dna/sm-microrna-21在go@fe3o4功能化pdms微流控芯片分离通道内的保留时间长,而dna/microrna-21在go@fe3o4功能化pdms微流控芯片分离通道内的保留时间短,保留时间的差异使得dna/microrna-21和dna/sm-microrna-21在go@fe3o4功能化pdms微流控芯片分离通道内得到分离,根据标记在dna上的亚甲基蓝的电化学信号的保留时间判断dna/microrna-21和dna/sm-microrna-21的分离程度;此外,亚甲基蓝的电化学信号的强度随着dna/microrna-21和dna/sm-microrna-21浓度的增大而增强,根据亚甲基蓝的电化学信号的强度即可判断microrna-21和sm-microrna-21的含量。
本发明相较于现有技术,其有益效果是:
1、基于氧化石墨烯对完全互补链双链和错配双链的吸附能力的差异,在go@fe3o4功能化pdms微流控芯片分离通道内实现了对单核苷酸多态性的良好分离和检测;
2、本发明方法制备的go@fe3o4纳米复合材料兼具go和fe3o4的优点,合成方法简单,且具有的良好的生物相容性和亲水性,有利于保持生物分子的活性,实现了单核苷酸多态性的简单、快速、高效的分离和检测。
附图说明
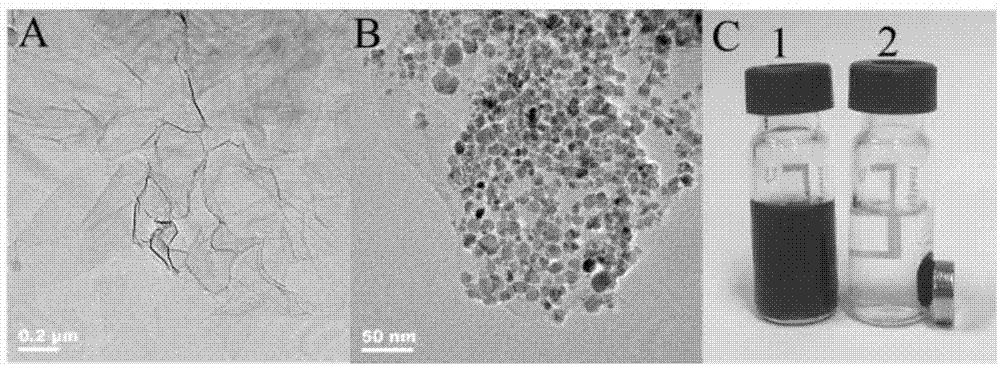
图1是(a)go和(b)go@fe3o4的透射电镜图。(c)为go@fe3o4在(1)无和(2)有外加磁场条件下的照片。
图2是(a)go、(b)fe3o4和(c)go@fe3o4的傅里叶变换红外光谱图。
图3是(a)裸芯片、(b)go和(c)go@fe3o4功能化pdms芯片接触角表征图。
图4是运行缓冲溶液ph(4.83-9.18)对(a)pdms微芯片和(b)go@fe3o4功能化pdms微芯片eof的影响。
图5是(a)p1t1+p1m1在pdms微芯片上的电泳分离图;(b)p1t1、(c)p1m1和(d)p1t1+p1m1在go@fe3o4功能化pdms微芯片上的电泳分离图。
图6是go@fe3o4功能化pdms微芯片用于分析mir-21和sm-mir-21。
具体实施方式
下面结合附图和具体实施例对本发明作进一步阐述,本发明并不限于此;
实施例1
(1)制备氧化石墨烯:将0.5g石墨粉和0.5gnano3加入到23ml的浓h2so4中,冰浴条件下缓慢加入3gkmno4,充分搅拌使其混合均匀后,把溶液转移到35℃的水浴中搅拌1h,形成灰褐色糊状物,加入40ml超纯水,室温下搅拌30min,再加超纯水稀释至140ml,逐滴加入3ml30%的h2o2,溶液从深棕色变成亮黄色,将得到的产物趁热过滤,用超纯水离心清洗产物至上层清液为中性,在8000r/min下离心2min,得到氧化石墨烯(go)。
(2)制备go@fe3o4纳米复合材料:将40mggo溶解到20ml超纯水中,超声分散3h,然后在通入n2的条件下加热至70℃并保持30min,再加入21mgfecl3·6h2o和72mgfecl2·4h2o,搅拌40min;再逐滴加入1.0mlnh3·h2o并剧烈搅拌40min;反应溶液冷却至室温后,将产物用磁铁分离,并用超纯水清洗,得到产物go@fe3o4,将go@fe3o4分散于超纯水中,制成1mg/ml的go@fe3o4溶液。
将go和制得的go@fe3o4纳米复合材料分别进行电镜扫描,如图1a、b所示,而制得的go@fe3o4纳米复合材料有无外加磁场结果如图1c所示。由图1a可以看出,go是薄而透明的纳米片状结构。负载了fe3o4纳米粒子后的go表面有大量粒径均匀的纳米粒子,平均粒径为10nm,且未见明显的团聚现象(图1b)。从图1c可以看出,go@fe3o4的悬浮液分散均匀且呈棕黑色(瓶1),当在该悬浮液附近放置一块磁铁时,go@fe3o4迅速朝向磁铁方向移动,在磁铁附近形成一个棕黑色的go@fe3o4斑点,而溶液则澄清透明(瓶2)。以上实验结果表明,本方法制备的go@fe3o4具有很好的水溶液分散性,而且负载于go表面的fe3o4纳米粒子仍然保持了良好的磁性能,这使得仅仅在外磁场作用下就可以很好地实现go@fe3o4在pdms微芯片通道内的固定。
将go、fe3o4和go@fe3o4分别利用傅里叶变换红外光谱进行结构表征,结果如图2所示。从图2可以看出,fe3o4nps在571cm-1处出现了fe-o官能团的特征吸收峰(曲线a)。go在3438cm-1处有-oh的伸缩振动吸收峰,1735cm-1处有羰基和羧基中c=o的伸缩振动吸收峰,1618cm-1处有c=c以及1229cm-1处有c-oh伸缩振动峰(曲线b)。在go@fe3o4红外光谱中,go在1735cm-1处c=o的伸缩振动峰移动到1585cm-1,fe-o在571cm-1处的吸收峰移动到588cm-1,表明fe3o4与go上的羧基发生了相互作用,将fe3o4纳米粒子负载于go表面(曲线c)。
实施例2
制备go@fe3o4功能化pdms微流控芯片分离通道:先将pdms微流控分离通道用超纯水冲洗5min,然后在芯片的上下方各放置一块长度为2cm的永久磁铁,用真空泵将实施例1制备的go@fe3o4溶液抽入分离通道中,go@fe3o4被固定于pdms微流控分离通道内,将修饰后的微流控芯片放置1h,用运行缓冲溶液连续冲洗分离通道5min,制成go@fe3o4功能化pdms微流控芯片分离通道。
将制得的go@fe3o4功能化pdms微流控芯片进行接触角表征,并以pdms裸芯片和go修饰后的pdms芯片作对照,结果如图3所示。由图3a可见,pdms微芯片的接触角为106°,呈明显的疏水性;go修饰后的pdms微芯片的接触角降低为11.7°(图3b);go@fe3o4功能化pdms微芯片表面的接触角为29°(图3c)。与pdms微芯片相比,经go@fe3o4修饰的pdms微芯片的亲水性得到大大改善。
观察制得的go@fe3o4功能化pdms微流控芯片以及pdms裸芯片在不同ph的运行缓冲溶液中电渗流(eof)变化情况,结果如图4所示。从图4可以看出,由于pdms微芯片的表面疏水性强,eof显示出强烈的ph依赖性,且稳定性差,不利于电泳分离(图4a)。而在go@fe3o4功能化pdms微芯片上,eof随ph的增大变化不大(图4b),而且重现性好。在go@fe3o4功能化pdms微芯片上,eof在ph7.17时测量的相对标准偏差为0.51%(n=5),约为pdms芯片的七分之一,进一步表明go@fe3o4功能化pdms微芯片表面的稳定性和重现性好,有利于其生物分析应用。
实施例3
go@fe3o4功能化pdms微流控芯片对单核苷酸多态性的分析
设计一条与mircorna-21(t1,5′-uagcuuaucagacugauguuga-3′)完全互补的亚甲基蓝标记的探针dna(p1,5′-methyleneblue-tcaacatcagtctgataagcta-3′),p1与t1杂交形成完全互补双链(p1t1),p1与t1的单碱基错配链sm-mircorna-21(m1,5′-uagcuuauaagacugauguuga-3′)杂交形成单碱基错配双链(p1m1)。将不同浓度的t1、50μl2.5μm的p1与20μl杂交缓冲溶液(20mmtris-hcl缓冲溶液,ph7.4)混合,加超纯水使溶液的终体积为200μl,于37℃杂交反应2.5h。m1与p1的杂交反应按上述相似的步骤进行。不同浓度的t1和不同浓度的m1与0.5μmp1的杂交反应按照上述步骤进行。
以高压电源作为流体驱动装置,在pdms微流控芯片分离通道两端施加1000v的电压,将通道用运行缓冲溶液冲洗10min,再将p1t1和p1m1混合物加入到pdms微流控芯片的样品池,通过高压电源在样品池和废液池之间施加800v进样电压5s,将样品驱动到pdms微流控芯片的样品通道与分离通道的十字交叉处,再切换高压电源,在分离通道两端施加1000v的分离电压,驱动样品流经pdms微流控芯片分离通道。运用碳纤维工作电极、铂丝对电极以及ag/agcl参比电极构建的三电极系统,采用安培检测模式在+0.6v的检测电位下记录i-t曲线,检测标记在dna上的亚甲基蓝的电化学信号,根据亚甲基蓝的电化学信号的保留时间判断p1t1和p1m1的分离程度,此外,亚甲基蓝的电化学信号的强度随着p1t1和p1m1浓度的增大而增强,根据亚甲基蓝的电化学信号的强度判断microrna-21和sm-microrna-21的含量,实现go@fe3o4功能化pdms微流控芯片对单核苷酸多态性的分离和检测。
将制得p1t1、p1m1、p1t1和p1m1混合物在go@fe3o4功能化pdms微芯片上进行电泳实验,并以p1t1和p1m1在pdms微芯片上的电泳结果作为对照,结果如图5所示。由图5可见,p1t1和p1m1混合物在pdms芯片上无法达到基线分离,且峰电流较低,这是由于pdms芯片表面的强疏水性导致对生物分子产生严重的非特异性吸附(曲线a)。从p1t1(曲线b)和p1m1(曲线c)在go@fe3o4功能化pdms微流控芯片上的峰电流强且出峰时间不一样,这是由于go@fe3o4改善了pdms微芯片表面的疏水性,抑制了对生物分子的非特异性吸附,此外,go@fe3o4对p1t1和p1m1的作用力不同导致它们的迁移时间产生差异。go@fe3o4对单碱基错配的松散结构的p1m1的吸附作用较强,而对完全互补的稳定的p1t1的吸附作用较弱,导致p1m1在go@fe3o4功能化pdms微流控芯片分离通道内的保留时间长,而p1t1在go@fe3o4功能化pdms微流控芯片分离通道内的保留时间短,保留时间的差异使得p1t1和p1m1在go@fe3o4功能化pdms微流控芯片分离通道内得到分离。因此,p1t1和p1m1混合物在go@fe3o4功能化pdms微芯片上的分离效果得到显著改善,在1min内即获得了良好的基线分离,分离度为2.01(曲线d),不仅p1t1和p1m1峰电流高,而且二者的分离效率也得到了极大提高,非特异性吸附也得到了有效抑制。以上结果表明,本发明制备的go@fe3o4功能化pdms微流控芯片分离通道可用于单核苷酸多态性的分析。
(3)go@fe3o4功能化pdms微芯片分析mir-21和sm-mir-21
单核苷酸多态性的检测对于医学诊断和疾病预防至关重要,为了验证本发明方法在单核苷酸多态性分析中的性能,研究了不同比例的m1/(m1+t1)(0,10%,20%,40%,60%,80%和100%)在go@fe3o4功能化pdms微流控芯片分离通道中的分析效果,结果如图6所示。随着m1含量的增加,p1t1的峰电流逐渐减小(左峰),而p1m1的峰电流强度逐渐增大(右峰),六次重复测量的相对标准偏差分别为2.9%和2.3%。结果表明,本方法可成功应用于单核苷酸多态性的识别检测,即使m1含量低至10%时仍可识别检测。
- 还没有人留言评论。精彩留言会获得点赞!
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺
- 一种用于评估皮肤防御情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤防晒情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤抗皱情况的引物和探针及试剂盒的制作方法
- 人PLIN1基因rs2289487位点多态性检测方法及试剂盒的制作方法
- 测定人NEFM基因rs12515位点多态性的方法及试剂盒的制作方法
- 一种人TERF1基因rs3863242位点多态性检测技术的制作方法
- 测定人CCNH基因rs3093816位点多态性的方法及试剂盒的制作方法
- 测定人NEFL基因rs2979704位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs854560位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs662位点多态性的方法及试剂盒的制作方法