基于基因编辑技术增加SMN蛋白表达的方法及其在SMA治疗中的应用与流程
本发明属于基因工程领域,更具体地,本发明涉及基于基因编辑技术增加smn蛋白表达的方法及其在sma治疗中的应用。
背景技术:
脊髓性肌萎缩症(spinalmuscularatrophy;sma)是一种常染色体隐性遗传病,主要累及脊髓前角,临床上主要表现为四肢进行性萎缩及无力,死亡率及致残率极高。在婴幼儿致死性遗传病中排名第一位,每6000名新生儿中就有一位发病。
sma的致病基因是运动神经元生存基因(survivalmotorneuron,smn),人类有两种高度同源的smn基因,分别为端粒侧的smn1和着丝粒侧的smn2,smn1编码全长的smn蛋白为功能性smn蛋白,而smn2主要编码截短的smn蛋白。95%的sma病人纯合缺失smn1基因,导致了smn蛋白的缺乏,引起sma相关的临床症状。
smn1与smn2这两个基因高度相似,最重要的差异点是位于7号外显子上的c.840c>t。这种差异导致smn2在转录过程中7号外显子大多被跳跃了(详见图1),产生截短的蛋白,这种蛋白是低效能的,且很快被降解。有研究发现,在smn2基因7号内含子中存在一个剪接沉默子(intronicsplicingsilencer,iss)-n1即iss-n1,这是造成7号外显子跳跃的原因之一。另一个重要的剪接抑制元件为smn2基因7号内含子的iss+100,它由smn2与smn1在7号内含子的一个差异点导致(a100g)。2011年,美国冷泉港实验室的研究人员设计了一种反义寡核苷酸(antisenseoligonucleotides,aso)smn-rx来掩蔽这个iss-ni位点,从而能够调节smn2的剪接并提高smn蛋白的表达。然而,其制备的aso在细胞内会降解,功能性smn蛋白的表达是短期的。以临床sma治疗为例,维持smn蛋白表达需要定期不断补充aso,这需要通过腰椎穿刺鞘内注射给药,病人难以接受,这限制了该方法的相关应用。此外,目前的aso在美国定价每人第一年高达75万美金,以后每年37.5万美金,需要一直治疗价格高昂。
因此,亟需探究安全有效、经济实用的增加smn蛋白表达的方法,并探索其在smn治疗中的应用。
技术实现要素:
本发明的目的在于提供一种利用基因编辑技术缓解或治疗脊髓性肌萎缩症的方法。
在本发明的第一方面,提供一种增加功能性smn蛋白表达的方法,包括:利用crispr/cas9技术破坏smn2基因7号内含子上的剪接沉默子iss-n1或iss+100。
在一个优选例中,所述crispr/cas9技术包括:采用的特定sgrna靶向于smn2基因7号内含子上的剪接沉默子iss-n1或iss+100;优选地,该特定sgrna的序列如seqidno:1、seqidno:2或seqidno:3所示。
在另一优选例中,利用基于所述特定sgrna的crispr/cas9技术能在smn2基因7号内含子上的剪接沉默子iss-n1和/或iss+100处引入随机的插入或缺失或者插入和缺失;优选地,在iss-n1的两个调节区域cag和aaag中的至少一个引入插入、缺失、或插入和缺失的组合。
在另一优选例中,所述方法应用于人诱导性多能干细胞(hipscs),包括:提供针对smn2基因7号内含子上的剪接沉默子iss-n1和/或iss+100位点的sgrna,构建靶向质粒,对hipsc进行打靶,挑选出发生基因编辑的细胞株。
在另一优选例中,所述方法应用于受精卵,包括:提供针对smn2基因7号内含子上的剪接沉默子iss-n1或iss+100位点的sgrna,对受精卵显微注射sgrna和cas9mrna(包括spcas9和sacas9)。
在另一优选例中,所述方法应用于小鼠成体治疗,包括:提供针对smn2基因7号内含子上的剪接沉默子iss-n1或iss+100位点的sgrna,构建体内干预aav载体质粒,对进行侧脑室和鞘内注射。
在另一优选例中,所述的增加功能性smn蛋白表达的方法为非治疗性、非诊断性的方法。
在本发明的另一方面,提供增加功能性smn蛋白表达的试剂在制备缓解或治疗脊髓性肌萎缩症的药物中的用途;所述的增加smn蛋白表达的试剂是藉由crispr/cas9技术破坏smn2的7号内含子上的剪接沉默子iss-n1或iss+100的试剂。
在一个优选例中,所述的增加功能性smn蛋白表达的试剂通过crispr/cas9介导的非同源末端接合(nhej)破坏smn2的7号内含子上的剪接沉默子iss-n1或iss+100;较佳地,破坏smn2的7号内含子上的剪接沉默子iss-n1中两个调节区域cag和aaag中至少一个;较佳地,所述的增加功能性smn蛋白表达的试剂包括:靶向于7号内含子上的剪接沉默子iss-n1的sgrna1或sgrna2,或靶向于7号内含子上iss+100的sgrna3,该sgrna1、2和3的序列分别如seqidno:1,2和,3。
在另一优选例中,所述的sgrna位于表达质粒上;在与cas9酶的编码序列(较佳地,其也包含在表达质粒上)共同被引入细胞后,sgrna引导cas9核酸内切酶产生dna双链断裂,通过细胞内源性非同源末端接合的修复方式引入的随机插入或缺失,对内含子剪接沉默子iss-n1或iss+100进行破坏。
在本发明的另一方面,提供一种制备细胞的方法,所述的细胞中功能性smn蛋白高表达,所述方法包括:将增加smn蛋白表达的试剂引入到细胞内,所述的增加smn蛋白表达的试剂是藉由crispr/cas9基因编辑法破坏smn2的7号内含子上的剪接沉默子iss-n1或iss+100的试剂;较佳地,所述的细胞包括:体组织细胞,诱导性多能干细胞(如商品化的smahipsc细胞系:gm24468和smapatient-derivehipsc),胚胎细胞(如商品化或已建系的胚胎细胞),受精卵细胞。
在一个优选例中,所述的制备细胞的方法为“非治疗目的”的方法。
在本发明的另一方面,提供一种细胞,所述的细胞中功能性smn蛋白高表达,所述细胞的中含有外源的增加smn蛋白表达的核酸,所述的增加smn蛋白表达的核酸是藉由crispr/cas9技术破坏smn2的7号内含子上的剪接沉默子iss-n1或iss+100的sgrna;较佳地,所述的sgrna的序列如seqidno:1、seqidno:2或seqidno:3所示;较佳地,所述细胞中还包括外源的cas9酶的编码序列;较佳地,所述的细胞包括:体组织细胞,诱导性多能干细胞,胚胎细胞(如商品化或已建系的胚胎细胞),受精卵细胞。
在本发明的另一方面,提供一种用于缓解或治疗脊髓性肌萎缩症的药物组合物,所述的药物组合物含有能够形成iss-n1或iss+100位点切割的sgrna或构建物;较佳地,该能够形成iss-n1或iss+100位点切割的sgrna的核苷酸序列如seqidno:1、seqidno:2和seqidno:3所示。。
在另一优选例中,所述的药物组合物含有能够形成该sgrna的构建物;该构建物上还包含cas9酶(包括spcas9和sacas9)的编码序列。
在另一优选例中,所述的构建物为表达质粒,包括:病毒质粒或非病毒质粒。较佳地,为病毒质粒,例如但不限于:腺相关病毒质粒(aav),慢病毒质粒(lentivirus)。
在本发明的另一方面,提供sgrna,其靶向于iss-n1或iss+100,较佳地,所述sgrna的核苷酸序列如seqidno:1、seqidno:2或seqidno:3所示。
在本发明的另一方面,提供一种表达构建物,所述表达构建物含有形成sgrna的序列,该sgrna的核苷酸序列如seqidno:1、seqidno:2或seqidno:3所示;较佳地,所述的表达构建物还含有cas9酶(包括spcas9和sacas9)的编码序列。
在本发明的另一方面,提供一种用于缓解或治疗脊髓性肌萎缩症的药盒,所述的药盒包括所述的药物组合物;或包括所述的sgrna;或包括所述的表达构建物。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
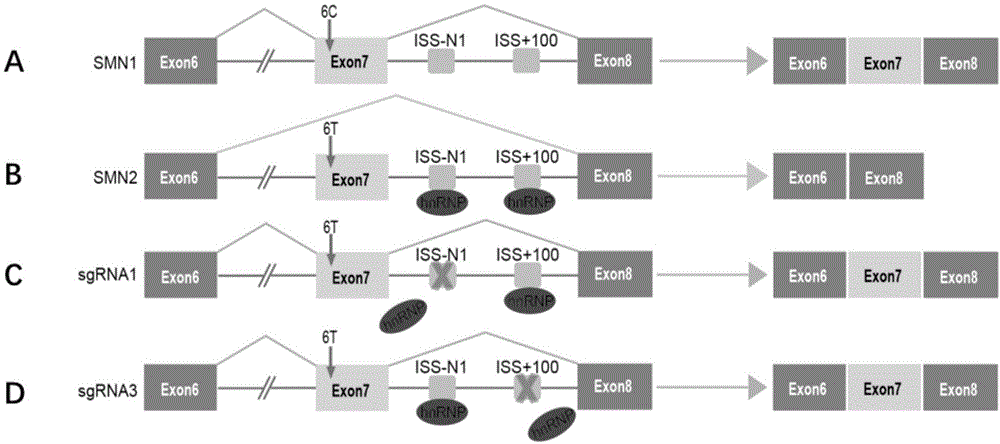
图1、smn基因剪接以及本发明的crispr/cas9编辑策略的示意图。
a.smn1基因的的正常剪接模式。7号外显子中的剪接增强子招募并结合剪接因子2/选择性剪接因子(sf2/asf),剪接产生包含7号外显子的smn全长转录本。
b.smn2基因的异常剪接模式。7号外显子第6位碱基由c突变成t,剪接增强子变成剪接沉默子,7号内含子剪接沉默子(iss-n1)招募并结合核不均一核糖核蛋白(hnrnp),使7号外显子剪接时被跳跃,产生缺乏7号外显子的smn截短转录本。
c.本发明利用crispr/cas9的定点切割作用,特异性地破坏smn2基因的iss-n1,使hnrnp无法结合,7号外显子剪接时不被跳跃,形成正常的剪接模式,产生包含7号外显子的smn全长转录本。
d.本发明利用crispr/cas9的定点切割作用,特异性地破坏smn2基因的iss+100,使hnrnp无法结合,7号外显子剪接时不被跳跃,形成正常的剪接模式,产生包含7号外显子的smn全长转录本。
图2、利用crispr/cas9在人诱导多能干细胞(hipscs)水平破坏iss-n1或iss+100的流程示意图。
图3、在细胞水平破坏iss-n1、iss+100后smn2基因剪接及smn蛋白表达情况。
a.各组hipscsrna的逆转录pcr(rt-pcr),从左到右:健康对照,i型sma病人(阴性对照1),i型sma病人(阴性对照2),第10代和第30代修复后i型细胞株1(实验组),修复后i型细胞株2(实验组),修复后i型细胞株3(实验组)。较大条带为smn全长转录本(smn-fl),较小条带为smn截短转录本(delta7-smn)。
b.各组hipscs(分组同图3a)smn蛋白的westernblot结果分析,比较smn蛋白条带灰度值(imagej计算)统计分析图(单因素anova检验,*p<0.05)。
c.iss-n1破坏的smaipsc细胞株2株和iss+100破坏的smaipsc细胞株2株基因型示意图。
d.各组hipscs诱导分化成运动神经元后smn蛋白的westernblot结果,比较smn蛋白条带灰度值(imagej计算)统计分析图(单因素anova检验,**p<0.01)。
图4、在动物水平破坏iss-n1后改善f0小鼠表型。
a.sma小鼠繁殖及卵注示意图,蓝色序列为iss-n1,红色箭头标记了sgrna1和sgrna2的序列,bh杂合子品系(bh-heter,敲除1拷贝鼠源smn基因)与smaiii型小鼠(smaiii,敲除2拷贝鼠源smn基因,敲入4拷贝人源smn2基因)交配,获得的受精卵进行cas9mrna与sgrna注射,可产生50%杂合子代(heter)和50%纯合子代(sma),产生的第一代小鼠称为f0小鼠。
b.spcas9和sacas9对sma小鼠进行干预后出生小鼠情况。
c.sc-sp-smaf0小鼠生存曲线图,三组分别为实验组(sc-sp-sma,编辑过的smai型小鼠,n=12)、同窝注射后出生杂合子对照组(sc-het,同窝杂合子小鼠,n=19)、对照组(het,正常杂合子小鼠,n=10)和阴性对照组(smai,未编辑过sma型小鼠,n=35),显示随着天数延长存活小鼠的百分比变化情况。
d.sc-sp-smaf0小鼠体重曲线图,显示四组小鼠(sc-sp-sma小鼠n=20,sc-het小鼠n=19,het小鼠n=8和sma小鼠n=15)随着天数延长体重的变化情况。
e.sc-sp-sma出生后第9天,f0小鼠外观比较。
f.sc-sp-smaf0小鼠翻转反射时间统计图,显示四组小鼠(sman=15,sc-hetn=12,sc-sp-sman=11和hetn=12)随着天数延长翻转反射所需时间的变化情况。
g.sc-sp-smaf0小鼠肌力大小统计图,两组分别为实验组(sc-sp-sma,编辑过的sma型小鼠,n=7)、阳性对照组(sc-het,正常杂合子小鼠,n=12),显示随着天数延长肌肉力量大小的变化情况。
h.sc-sp-sma出生第9天(p9)f0小鼠的各组织rna的rt-pcr,上方条带为smn全长转录本(fl),下方条带为smn截短转录本(△7),incl%=fl/(fl+△7)。
i.sc-sp-smaf0小鼠出生第9天(p9)的脑和脊髓的smn蛋白的表达情况。
j.spcas9和sacas9破坏的iss-n1小鼠基因型示意图。
k.sc-sa-smaf0小鼠生存曲线图,三组分别为实验组(sc-sa-sma,sacas9编辑过的sma型小鼠,n=7)、同窝注射后出生杂合子对照组(sc-het,同窝杂合子小鼠,n=20)、和阴性对照组(sma,未编辑过sma型小鼠,n=11),显示随着天数延长存活小鼠的百分比变化情况。
l.sc-sa-smaf0小鼠体重曲线图,显示四组小鼠(sman=7,sc-hetn=12和sc-sp-sman=11)随着天数延长体重的变化情况。
m.sc-sa-sma出生第9天(p9)f0小鼠的各组织rna的rt-pcr。
图5、sc-sp-smaf1小鼠(f0小鼠产生的纯合编辑子代)iss-n1破坏类型及smn2基因剪接情况分析。
a.sc-sp-sma可以正常的生育后代示意图。
b.sc-sp-sma小鼠生育的f1小鼠基本情况。
c.破坏iss-n1得到的三种碱基插入缺失类型示意图。最上方为正常smn2基因序列的一部分,蓝色字体为iss-n1的碱基序列,下方三组分别为得到的cag缺失组、aaag缺失组及cag+aaag缺失组。
d.sc-sp-smaf1小鼠体重曲线图,显示四组小鼠(三组n都为9)随着天数延长体重的变化情况。
g.sc-sp-smaf1小鼠肌力大小统计图,两组分别为实验组(f1-sc-sp-sma,编辑过的sma小鼠,n=9)、阳性对照组(sc-het,正常杂合子小鼠,n=10),显示随着天数延长肌肉力量大小的变化情况。
f.出生第9天(p9)sc-sp-smaf1小鼠各组织rna的rt-pcr。
图6、本方法与反义核苷酸法阻止sma的对比效果。
a.aso(mopholino)电转smai-2ipsc细胞后全长smn2转录分析,如图显示的是wt,sma组(smai-1、smai-2)与smai-2经aso(mopholino)电转后的smn2表达情况。p1d1代表第一代第一天,p1d5代表第一代第五天。
b.crispr/cas9介导的iss破坏方法,全长smn2转录情况随着传代的变化。如图显示的是wt,sma组(smai-1、smai-2)与smai-2isss经crispr/cas9破坏后的smn2表达情况。
具体实施方式
本发明针对smn2基因7号内含子上的iss-n1或iss+100区域,首次利用crispr-cas9在该区域中引入随机的插入或者缺失,从而增加功能性smn蛋白的表达。
术语
如本文所用,所述的“sgrna”即“单一引导rna(single-guiderna,sgrna)”,其是基于“目标基因上的靶位点”设计,其包含的序列足以与内切核酸酶cas9协同作用,引导发生cas9介导的靶位点上dna双链断裂。
如本文所用,所述“动物(mammal)”没有特别的限制,只要其细胞具有一般意义上的基因组,且crispr/cas9体系在其细胞内具有活性。例如,所述的动物可以是哺乳纲的动物,包含人、非人灵长类动物(猴、猩猩)、家畜与农畜(例如,猪、绵羊、牛),鼠(小鼠),以及啮齿动物(例如,小鼠、大鼠、兔)等等。较佳地,所述的动物的细胞表达smn蛋白。
如本文所用,所述“细胞”是指能够表达smn蛋白的细胞,且crispr/cas9体系在其内具有活性。所述“细胞”包括但不限于:体组织细胞,诱导性多能干细胞,受精卵细胞。
如本文所用,所述的“可操作地连接(相连)”或“操作性连接(相连)”或“可操作性地构建”是指两个或多个核酸区域或核酸元件的功能性的空间排列。例如:启动子区被置于相对于目的基因核酸序列的特定位置,使得核酸序列的转录受到该启动子区域的引导,从而,启动子区域被“可操作地连接”到该核酸序列上。
如本文所用,所述的“外源”或“异源”是指来自不同来源的两条或多条核酸或蛋白质序列之间的关系,或来自不同来源的核酸与宿主细胞之间的关系。例如,如果核酸与宿主细胞的组合通常不是天然存在的,则核酸对于该宿主细胞来说是异源的。特定序列对于其所插入的细胞或生物体来说是“外源的”。
如本文所用,所述的“元件”是指一系列功能性的核酸序列,本发明中,所述的“元件”被系统地构建以形成一种构建物(构建体)。所述的“元件”的序列可以是本发明中所提供的那些,也包括它们的变体,只要这些变体基本上保留了所述“元件”的功能,其通过插入或删除一些碱基(如1-50bp;较佳地1-30bp,更佳地1-20bp,更佳地1-10bp),或进行随机或定点突变等来获得。
如本文所用,所述的“构建物”包括“质粒”、“体外转录产物”或病毒载体。
提高smn蛋白表达的方法
smn2是和smn1高度相似的基因,但是由于smn2基因7号外显子上c6t的变异导致其在剪接过程当中7号外显子被跳过,形成了缺少7号外显子的转录本,翻译产生了截短的smn蛋白。为此,本发明人利用crispr/cas9靶向于剪接沉默子iss-n1或iss+100,破坏其结构,以期阻止这种外显子跳跃。iss-n1序列包括ccagcauuaugaaag(+10到+24)(seqidno:5),里面包含两个主要的调节元件,分别为5’端的cag和3’端的aaag。iss+100序列包括uguuagaaaguugaaaggu(+95到+113)(seqidno:6)。
一方面,本发明提供了一种制备smn蛋白高表达的细胞的方法,所述方法包括:将增加smn蛋白表达的试剂引入到细胞内,所述的增加smn蛋白表达的试剂是藉由crispr/cas9基因编辑法破坏smn2的7号内含子上的剪接沉默子(iss-n1)或(iss+100)的试剂。
另一方面,本发明提供了一种制备基因组发生基因编辑的动物的方法,所述方法包括:(1)将增加smn蛋白表达的试剂引入到动物受精卵中,所述的增加smn蛋白表达的试剂是藉由crispr/cas9基因编辑法破坏smn2的iss-n1或iss+100的试剂;(2)使(1)的动物受精卵发育,获得基因组的待编辑基因区域发生编辑的动物。
crispr/cas9系统是一种rna引导的基因工程工具,它能够引起靶点特异性的dna双链断裂,这种断裂能够激发内源性的dna修复机制,包括nhej和同源重组(homologydirectedrepair,hdr)等。nhej是一种低保真度的dna修复,断裂的dna修复重连的过程中会发生碱基随机的插入或丢失,造成iss-n1或iss+100失效,实现剪接的改变。nhej的过程中,需要sgrna来引导cas9酶对特定位置的dna双链进行断裂,所述的sgrna靶向于smn2的iss-n1或iss+100区域。作为本发明的优选方式,所述的靶向于iss-n1或iss+100的sgrna的序列如seqidno:1、seqidno:2和seqidno:3所示;经过反复筛选,本发明人确定该序列所导向的位置是非常合适的,能够高效地引导cas9酶进行dna双链的断裂,引发iss-n1功能受损。更特别地,所述的sgrna能够产生cag和aaag两个调节区域之一或同时发生破坏,或破坏cag和aaag与周围结构的联系。
应用
本发明提供了一种基于基因编辑技术增加smn蛋白表达的方法功能性smn蛋白表达的增加是利用crispr/cas9(crispr:clusteredregularlyinterspacedshortpalindromicrepeats,cas:crisprassociated)技术破坏smn2基因7号内含子上的剪接沉默子iss-n1或iss+100而实现的。crispr/cas9技术中采用的特定引导rna(singleguiderna,sgrna)靶向于smn2基因7号内含子上的剪接沉默子iss-n1或iss+100;优选地,特定sgrna的序列如seqidno:1、seqidno:2和seqidno:3所示。特定sgrna的crispr/cas9技术可以在smn2基因7号内含子上的剪接沉默子iss-n1或iss+100处引入随机的插入或缺失或者插入和缺失;优选地,在对于iss-n1的的破坏中两个调节区域cag和aaag中的至少一个引入插入或缺失或者插入和缺失。
基于基因编辑技术增加smn蛋白表达的方法:(1)应用于hipsc的主要步骤为针对smn2基因7号内含子上的剪接沉默子iss-n1或iss+100位点设计特异的sgrna,构建相应的质粒,对hipsc进行基因编辑,挑选出修正的细胞株,进行功能验证;(2)应用于sma小鼠受精卵的主要步骤为:针对iss-n1位点设计特异的sgrna(sgrna1和/或sgrna2),并对spcas9及sacas9和相应的sgrna进行体外转录,对sma小鼠的受精卵显微注射sgrna和cas9mrna(包括spcas9和sacas9);(3)应用于sma小鼠受精卵的主要步骤为:针对iss-n1或iss+100位点设计特异的sgrna,构建体内干预aav载体质粒,对sma小鼠侧脑室和鞘内进行注射,观察生存和功能。
本发明还提供了基于基因编辑技术增加smn蛋白表达的方法在sma治疗中的应用,相关应用是基于利用crispr/cas9技术破坏smn2基因的7号内含子上的剪接沉默子iss-n1或iss+100来增加功能性smn蛋白表达而实现的。crispr/cas9技术中采用的特定sgrna靶向于smn2基因7号内含子上的剪接沉默子iss-n1或iss+100,优选地,特定sgrna的序列如seqidno:1、seqidno:2和seqidno:3所示;所述特定的sgrna可以在iss-n1或iss+100处引入随机的插入或缺失或者插入和缺失,优选地,在iss-n1的两个调节区域cag和aaag中的至少一个引入插入或缺失或者插入和缺失。相关应用包括基因编辑的特定sgrna序列,基因编辑试剂,基因编辑质粒,基因编辑细胞及其制备方法,基因编辑动物制备方法,基因编辑药物。
其中,所述基因编辑试剂包含特定sgrna序列。
其中,所述基因编辑质粒为含有特定sgrna和cas9酶(包括spcas9和sacas9)编码序列的表达质粒。
其中,所述基因编辑细胞制备方法为将含有特定的sgrna和cas9酶的编码序列的表达质粒引入到细胞内表达,获得smn2基因发生编辑后功能性smn蛋白表达增加的细胞的方法;所述基因编辑细胞为经由基因编辑细胞制备方法获取的smn2基因发生编辑后功能性smn蛋白表达增加的细胞。
其中,所述细胞包括体组织细胞,诱导性多能干细胞,受精卵细胞和胚胎细胞。
其中,所述基因编辑动物制备方法为将含有特定的sgrna和cas9酶(包括spcas9和sacas9)的编码序列的表达质粒引入到受精卵内表达,受精卵中smn2基因发生编辑后功能性smn蛋白表达增加;同时受精卵正常发育获得功能性smn蛋白合理表达动物的方法。
其中,所述药物含有特定的sgrna或能够形成该特定的sgrna的构建物;优选地,该特定的sgrna的核苷酸序列如seqidno:1、seqidno:2和seqidno:3所示。
本发明基于基因编辑技术提供了安全有效且经济实用的增加smn蛋白表达的方法。通过crispr/cas9介导的基因编辑,可以在dna水平上破坏smn2基因7号内含子上的剪接沉默子iss-n1或iss+100,从而持续维持功能性smn蛋白的表达。此外,本发明所提供了增加smn蛋白新方法在sma治疗中的系列应用,包括基因编辑的特定sgrna序列,基因编辑试剂,基因编辑质粒,基因编辑细胞及其制备方法,基因编辑动物制备方法,基因编辑药物。
smn蛋白高表达的细胞
基于本发明的方法,本发明还提供了一种smn蛋白高表达的细胞,所述细胞中含有外源的增加smn蛋白表达的核酸,所述的增加smn蛋白表达的核酸是藉由crispr/cas9基因编辑法破坏smn2的iss-n1或iss+100的sgrna。作为本发明的优选方式,所述的sgrna的序列如seqidno:1、seqidno:2和seqidno:3所示;较佳地,所述细胞中还包括外源的cas9酶(包括spcas9和sacas9)的编码序列。
为了便于引入细胞,能在细胞内形成sgrna的核酸序列以及能在细胞内表达形成cas9酶的核酸序列可以被包含在同一个表达构建物中,或被分别包含在两个表达构建物中,从而通过转化被引入到细胞中。
本发明人将这个策略应用在病人诱导的多能干细胞和sma转基因小鼠上,都检测到了全长smn2转录本和smn蛋白的提升。在本发明的具体实施例中,利用本发明的方法,在sma病人来源的ipsc细胞和sma小鼠上成功地破坏了smn2iss-n1或iss+100的结构,从而实现了基因修复。经修复过的ipsc细胞株及sma小鼠在全长smn2转录本和smn蛋白两方面均有显著的提升。
制药用途
脊髓性肌萎缩症是导致婴幼儿死亡的遗传性疾病,主要由于smn1基因的突变或者缺失导致smn蛋白缺失所致。
基于本发明的新发现,本发明提供了一种增加smn蛋白表达的试剂在制备缓解或治疗脊髓性肌萎缩症中的用途;所述的增加smn蛋白表达的试剂是藉由crispr/cas9基因编辑法破坏smn2的iss-n1或iss+100的试剂。
进一步地,本发明提供了一种用于缓解或治疗脊髓性肌萎缩症的药物组合物,所述的药物组合物含有sgrna或能够形成该sgrna的构建物;该sgrna的核苷酸序列如seqidno:1、seqidno:2和seqidno:3所示。
作为本发明的优选方式,所述的sgrna位于表达质粒上;在与cas9酶的编码序列(较佳地,其也包含在表达质粒上)共同被引入细胞后,sgrna引导cas9产生dna双链断裂,从而引发nhej。
作为本发明的优选方式,所述的药物组合物含有能够形成该sgrna的构建物;该构建物上还包含cas9酶的编码序列。所述的构建物可以为表达质粒,包括:病毒质粒或非病毒质粒。较佳地,为病毒质粒,例如但不限于:腺相关病毒质粒(aav),慢病毒质粒(lentivirus)等。
所述的药物组合物中,还可含有药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。活性成分的给药量是治疗有效量。本发明的药物制剂还可制成缓释制剂。
本发明还提供了一种用于缓解或治疗脊髓性肌萎缩症的药盒,所述的药盒包括本发明所述的药物组合物;或包括本发明所述的sgrna;或包括本发明所述的表达构建物。
在本发明的具体实施例中,本发明人对sma小鼠(smn-/-,smn2tg/-)的受精卵注射了cas9mrna和sgrna,出生后编辑过的sma小鼠的平均寿命大于100天,相比之下未被编辑过的sma小鼠的平均寿命为12天。并且可以观察到编辑过的sma小鼠体重明显增加,全长smn2转录本和smn蛋白明显提高。
因为临床上所有的病人都携带有smn2基因,所以本发明人的这个策略适合临床所有的sma病人。
比起其它的基因沉默技术如反义核苷酸技术,通过crispr/cas9介导的基因编辑,可以在dna水平上破坏iss-n1或iss+100,并直接阻止hnrnpa1/a2与iss-ni或iss+100结合。重要的是,这种阻止是持续的,也许还是一劳永逸的。为了恢复smn蛋白的表达,只需要设计单个通用sgrna。该策略的另一个优点是仅仅使用单个sgrna就拥有治疗所有sma患者的潜力。在基因治疗愈加进步的将来,藉由腺病毒aav9,本发明的高效的crispr/cas9干预方法,可实现体内的iss-n1或iss+100破坏。
总之,通过crispr/cas9介导的基因编辑的方法,可以在sma患者来源的ipsc和sma小鼠中恢复smn蛋白的表达。更重要的是,该方法有望成为sma和其他剪接疾病的干预策略。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
实施例1、crispr/cas9介导的基因编辑
smn2是和smn1高度相似的基因,但是由于smn2的7号外显子上c6t的差异导致其在剪接过程当中7号外显子被跳过,如图1a~b所示。内含子剪接沉默子iss-n1和iss+100位于7号内显子,为了阻止这种外显子跳跃,本发明人利用crispr/cas9靶向于iss-n1或iss+100,试图破坏其结构。基因剪接情况以及本发明的crispr/cas9编辑的策略如图1所示。
为了破坏iss-n1或iss+100,本发明人在iss-n1或iss+100邻近的位置或者内部设计sgrna。根据位置差异,本发明人制备了大量sgrna以筛选合适的sgrna,经过反复研究筛选,找到了适合用于破坏iss-n1或iss+100的grna。所述sgrna的序列如下:
用于靶向iss-n1的sgrna:
sgrna1:5’-aagattcactttcataatgc-3’(seqidno:1);
sgrna2:5’-aagtctgccagcattatgaaa-3’(seqidno:2);
用于靶向iss+100的sgrna:
sgrna3:5’-tcagatgttagaaagttgaa-3’(seqidno:3);
sma病人成纤维细胞重编程的hips细胞株gm24468被用于验证sgrna的切割效率;gm24468购买于atcc公司。为了在sma病人诱导的hipsc中破坏iss-n1或iss+100,本发明人设计了包含cas9和靶向于iss-n1和iss+100的sgrna的质粒,命名为lp92。lp92的建立方法:lp92骨架来自于px458:addgene#48138,将px458用bbsi酶切后回收大片段。相应的sgrna正反义链送华津生物合成,正反义链退火,t4连接进上述回收的片段。
用lp92电转染gm24468,2天后用流式分选绿色荧光的细胞,绿色荧光占比20%。将分选出的细胞低密度铺于10cm盘中,9天后挑选单克隆种于24孔板内,用于后续的pcr扩增和测序。
上述操作的一部分实验流程示意图如图2。对sma病人活检取得肌肉组织,培养成成纤维细胞,重编程获得hipscs,这些细胞直接诱导分化为运动神经元时只能产生少量的smn全长转录本,翻译不稳定的smn蛋白。本发明利用crispr/cas9破坏smn2基因的iss-n1或iss+100,以期得到修复后的hipscs,诱导分化成运动神经元,增加smn全长转录本的产生,翻译稳定的smn蛋白。
实施例2、破坏iss-n1或iss+100的ipsc细胞株sc-sma的剪接模式被调节改变
在实施例1获得的单克隆细胞株内,本发明人检测到两株iss-n1破坏的细胞株,分别命名为sc-smai-2-1(由sgrna1引导基因编辑),sc-smai-2-2(由sgrna1引导基因编辑);以及,一株iss+100破坏的sc-smai-2-3细胞株(由sgrna3引导基因编辑),并且没有支原体。本发明人对其进行rt-pcr分析和qpcr分析,确定细胞水平破坏iss-n1或iss+100后smn2基因剪接及smn蛋白表达情况。
结果见图3。rt-pcr分析结果,能显著看到全长smn2(smn-fl)转录本的提升(图3,a)。并且,westernblot结果显示,smn蛋白是未编辑前的1.7倍(图3,b)。
实施例3、crispr/cas9介导的基因编辑能够阻止sma的发生
1、获得iss-n1显著破坏的小鼠
iii型小鼠包含有4拷贝的smn2基因,没有小鼠的smn基因(smn-/-;smn2tg/tg)。iii型小鼠不会发展成sma的表型,但是会在一个月左右发生耳朵的坏死和尾巴变短的情况。
本发明人用spcas9、sacas9mrna及其相应的sgrna(sgrna1、sgrna2)注射由iii型小鼠(smn-/-;smn2tg/tg)和bh杂合小鼠(smn-/+)合笼得到的受精卵(图4,a)。结果,有50%的可能得到i型sma小鼠(smn-/-;smn2tg/-)和50%可能得到杂合小鼠(smn+/-;smn2tg/-)(图4,a)。
sma小鼠的平均生存天数为12天(n=35)。本发明人应用crispr/cas9基因编辑技术在sma小鼠受精卵层面上对smn2的剪接进行干预,将spcas9mrna和sgrna1注入到iii型小鼠(smn-/-;smn2tg/tg)和bh杂合小鼠(smn-/+)合笼得到的受精卵中,试图在受精卵层面破坏剪接抑制元件iss-n1(图4,a)。在胚胎的发育过程中,smn2基因上iss-n1可以因为crispr/cas9介导的nhej而被破坏。79只出生的小鼠中有36只为sma小鼠(46.0%),其中有明显的iss-n1破坏的小鼠为20只,占比56%(命名为sc-sp-sma小鼠),其中寿命大于100天的有17只(85%)。
除此之外,本发明人还应用了sacas9mrna和其相应的sgrna(命名为sgrna2)采用上述方法在受精卵层面对sma小鼠的iss-n1位点进行破坏。本发明人发现,相比于该位点的spcas9和sgrna1的注射,sacas9和sgrna2的配比表现出更为高效的基因编辑效率,表现为:注射出生的20只小鼠中,共有7只sma小鼠,这7只(100%)小鼠的iss-n1位点全都被破坏了(这种小鼠命名为sc-sa-sma),且寿命全部都在100天以上(100%)(图4,b)。
2、破坏iss-n1能显著提高sma小鼠的寿命和体重
养育小鼠的结果显示,sc-sp-sma小鼠的平均寿命>400天,最多的已经超过600天,而未被编辑的sma小鼠只有12天(图4,c)。在20天的时候,所有的sc-sp-sma小鼠都活着,而其中有85%活到了100天(图4,c)。除此之外,sc-sp-sma小鼠的体重也相应的提升了(图4,d)。在12天的时sma小鼠已经表现的奄奄一息并且极小于同窝杂合的小鼠。相较于杂合的小鼠而言,sc-sp-sma小鼠表现出极为相似的外形,体重也只是稍轻于杂合小鼠(图4,e)。这些数据都表明,crispr/cas9介导的sma小鼠的受精卵基因编辑能够阻止sma的发生,增加sma小鼠的寿命和体重。
3、破坏iss-n1能够改善运动功能
如前所述,sma小鼠会发展成逐渐对称的肌无力。为了进一步确定小鼠sc-sp-sma的表型改善,本发明人采用两个试验来评估sc-sp-sma小鼠的行为。每两天分析一次实验组和阴性/阳性对照组的运动功能,两项试验均在白天同期进行。在出生后第7天到第11天,本发明人应用翻正反射作行为实验之一,其目的是定性分析运动活力和全身肌肉运动能力。将测试的幼仔背部平放在桌上,记录它们转向俯卧位的时间。所有的杂合子(n=7)都可以在5秒钟内从仰卧位置变为俯卧位。在生后第7天,也就是新生儿早期,sc-sp-sma小鼠(n=9)的翻正时间与杂合子以及未治疗的smai小鼠没有差异。但是在第7天后,sc-sp-sma小鼠能够成功自行完成试验,而未经治疗的sma小鼠(n=5)显示出更长的翻正时间,甚至超过60秒。sc-sp-sma小鼠与未经编辑的sma小鼠相比,翻正时间明显降低。治疗组和未治疗组之间的翻正时间差异显著(p<0.05)(图4,f)。
为了评估4周到5周小鼠的四肢力量,本发明人进行了另一个行为实验。因为严重的sma小鼠存活不超过15天,所以该测试仅适用于sc-sp-sma小鼠及正常小鼠。将测试的小鼠的四肢放置在测力计的丝网上,并将其尾巴水平地拉回。每只小鼠连续测试5次,记录最大的抓握强度。从生后23天开始,实验组(n=7)和阳性对照组(n=7)组均显示出逐渐上升的握力趋势。分析结果显示,sc-sp-sma小鼠的抓握强度几乎与杂合子的抓握强度相似,这表明破坏iss-n1可显著改善sma小鼠的肌肉力量(图4,g)。此外,几乎所有存活的sc-sp-sma小鼠(>2个月)都具有完全正常的活动能力。
sc-sp-sma小鼠的这些运动功能和行为改善可进一步证实,crispr/cas9介导的iss-n1破坏显著改善sma小鼠表型。上述两项测试的观察者对所测试的每只小鼠的基因型都是未知的。
4、破坏iss-n1能够提高全长smn2的转录和smn蛋白的表达
本发明人收集了sma、sc-sp-sma和同窝杂合子小鼠的脊髓、脑、心、骨骼肌、肝和肾脏的rna和蛋白。在上述的这些组织中,rt-pcr分析结果显示,sc-sp-sma小鼠中包含7号外显子的转录本明显的高于未被处理的sma小鼠(~50%vs~7%)(图4,h)。并且sc-sp-sma小鼠各组织smn蛋白的也大幅提升(图4,i)。
5、sc-sp-sma小鼠正常生育,并且生育的后代表型大部分正常
本发明人将得到的嵌合sc-sp-sma小鼠和杂合bh小鼠交配,并成功地得到了纯合的后代(图5,a)。在以往的研究当中并未有sma小鼠成功生育的报道。本发明人得到了30只f1代小鼠,其中sma小鼠的有10只,其中编辑的占9只,未编辑的一只。编辑过的后代也具有正常的寿命、体重和运动功能(图5,b~e)。
值得一提的是,sc-sp-smaf1代小鼠因为携带纯合的iss-n1破坏,其smn2全长mrna的表达叫f0代的sc-sp-sma显著提高,表现为smn27号外显子的包含率都在90%左右(图4,f)。
6、sc-sa-sma小鼠寿命和体重大幅增长,并且全长smn2的转录明显提升
7只sc-sa-sma寿命均大于100天,编辑效率相对于同位点的spcas9高(图4,k);这些小鼠的体重也有相应的增加(图4,l)。值得一提的是,sc-sa-sma小鼠个组织全长smn2的转录相较于sc-sp-sma明显增高(~90%vs~50%)(图4,m)。
实施例4、本方法与反义核苷酸法阻止sma的对比效果
反义寡核苷酸(antisenseoligonucleotides,aso)是一种治疗性的rna分子,它靶向结合在目标内含子和外显子的互补序列上,提高或扰乱目标剪接事件。nusinersen(ionis-smnrx,商品名称spinraza)成为第一个被fda和ema批准用于治疗sma的药物,这是一种鞘内注射来改变smn2剪接的反义寡核苷酸药物。该药物靶向于smn2基因的iss-n1(intronicsplicingsilencer-n1,iss-n1),阻止hnrnpa1/a2与iss-n1结合,从而增强7号外显子的剪接。但是这个药物非常昂贵,第一年的治疗费用需要75万美元,以后每年37.5万美元;虽然修饰后的反义核酸药物相对稳定,但也需要一年4次治疗,并且患者很难接受反复腰椎穿刺这样的给药方式。
本文用二胺吗啉基修饰(phosphorodiamidatemorpholino,pmo)修饰的aso(mopholino)(序列为:ccagcauuaugaaagugaat(seqidno:4))电转smai-2ipsc细胞系,对其进行不断的传代,并提取每代smai-2ipsc细胞系的rna(第一代到第5代),对其进行全长smn2转录的分析。结果显示,经mopholino电转smai-2ipsc细胞系全长smn2转录可以达到100%,但是随着传代全长smn2转录不断下降,到了第5代的时候就只剩44%了(图6,a)。而前述的crispr/cas9介导的iss-n1破坏方法,全长smn2转录不会随着传代而下降,如图可见第10代和第30代的全长smn2转录没有明显的差异(图6,b)。
综上,本发明中通过crispr/cas9破坏位于smn2内含子7的剪接沉默子iss-n1或iss+100来干预sma。使用单个sgrna引导的cas9产生dna双链断裂,从而引发nhej。在nhej的修复过程中,可以通过随机的插入或者缺失来破坏剪接沉默子iss-n1或iss+100。本发明人在sma患者成纤维细胞重编程的ipsc和sma小鼠上验证了这个思路。本发明的结果表明,在sma患者来源的ipsc中,iss-n1或iss+100的破坏可以增加全长smn2的转录,并恢复smn蛋白的水平。并且与aso相比,本方法提高的全长smn2的转录不会随着时间的增加而下降,而用aso干预的方法效果会随着时间的下降而下降。这正是本方法最大的优势所在,基因编辑的方法效果是持久的,并且有可能是一劳永逸的。由sc-smahipscs诱导分化成的运动神经元的smn蛋白水平和核内gems颗粒的数量都有明显的提升。此外,增长的寿命和体重显示了该方法在治疗严重sma小鼠的有效性。由于所有患者都携带有smn2,因此破坏smn2中iss-n1的方法有可能应用于所有sma患者,本发明的方法可以提高全长的smn蛋白。除此之外,该方法首次报道了严重型sma小鼠可以活到成年,并且正常的生育,生育的后代的小鼠很大程度是健康的。从优生优育的角度看,这种胚胎基因编辑的方法能够得到更多剪接纠正的胚胎,提高生育正常后代的概率,永久的纠正smn1纯合缺失的基因缺陷。
此外,用cripsr/cas9介导的方法干预出生的同窝杂合子对照鼠(sc-het)的寿命和体重和未处理的杂合子相比无明显区别,证明了这种方法的安全性。而后我们应用digenome-seq的方法对sgrna1和sgrna3进行脱靶检测,两个sgrna本发明人没有发现任何脱靶,这进一步的验证了本方法的安全性。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>福建医科大学附属第一医院
中国科学院上海生命科学研究院
<120>基于基因编辑技术增加smn蛋白表达的方法及其在sma治疗中的应用
<130>180568
<160>6
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(20)
<223>sgrna
<400>1
aagattcactttcataatgc20
<210>2
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>sgrna
<400>2
aagtctgccagcattatgaaa21
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(20)
<400>3
tcagatgttagaaagttgaa20
<210>4
<211>20
<212>dna/rna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(20)
<223>aso
<400>4
ccagcauuaugaaagugaat20
<210>5
<211>15
<212>dna/rna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(15)
<223>iss-n1序列片段
<400>5
ccagcauuaugaaag15
<210>6
<211>19
<212>dna/rna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(19)
<223>iss+100序列片段
<400>6
uguuagaaaguugaaaggu19
- 还没有人留言评论。精彩留言会获得点赞!