一种菝葜皂苷元衍生物及其制备方法和应用与流程
本发明涉及药物领域,具体涉及一种菝葜皂苷元衍生物或其药学上可接受的盐、溶剂化合物、光学异构体和立体异构体,及其制备方法和应用。
背景技术:
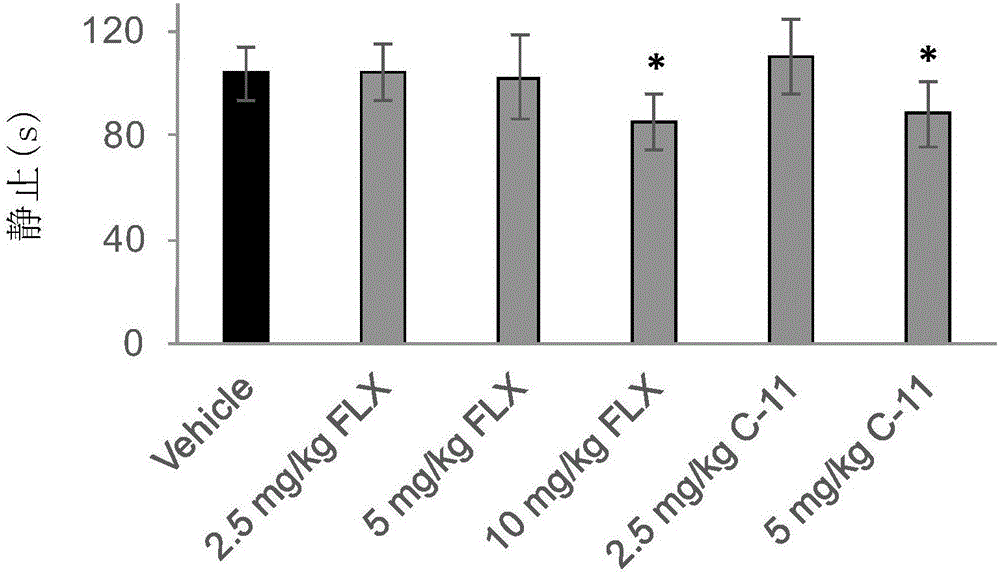
:抑郁症是危害人类健康的常见病和多发病。在我国,情感性精神病的发病率为0.76%。抑郁症的发病率很高,但现在对它的发病原因仍不十分清楚。传统观点认为,抑郁症的发病机理与脑内单胺类神经递质异常有关,其中包括5-羟色氨、乙酰胆碱和儿茶酚胺类,去甲肾上腺素和肾上腺素。临床上当前应用较为常用的抗抑郁药物有:三环和四环类抗抑郁药、单胺氧化酶抑制剂、选择性5-ht重吸收抑制剂(ssri)、非典型抗抑郁药和锂盐等。中医认为,抑郁症多因忧思过度,劳伤心脾为病,治疗应以宁心安神,养血滋阴为主。因此,在大部分用于中医治疗抑郁症的处方中,知母也是一味较为常用的中药材。阿尔兹海默病(alzheimer’sdisease,ad)是老年痴呆症的主要类型。ad的临床主要表现为进行性的认知衰退及情绪紊乱的加重等一系列症状,包括短时记忆、言语功能、生活习惯及注意力等。目前ad的发病机制不清,因此,迄今为止,可供选择的ad药物治疗手段是十分有限的,且用于治疗ad的药物主要针对认识行为症状的改善,其中主要包括:(1).改善胆碱能神经传递,其中主要是胆碱酯酶抑制剂;(2).n-甲基-d-天冬氨酸(nmda)受体拮抗剂:如美金刚。临床一线非常缺乏有效治疗ad的药物。中药材知母主要的化学成分有甾体皂苷、双苯吡喃酮类、多糖类和木质素类等,如:知母皂苷(甙)(timosaponin)a-ⅰ、a-ⅱ、a-ⅲ、a-ⅳ、b-ⅰ、b-ⅱ和b-ⅲ,其中,知母皂苷a-ⅱ、a-ⅳ结构尚不明;以及知母皂苷(amemarsaponin)a2,即马尔考皂苷元-3-o-β-d-吡喃葡萄糖基(1→2)-β-d-吡喃半乳糖苷b(marlogenin-3-o-β-d-glucopyranosy(1→2)-β-d-galactopyranosideb)、去半乳糖替告皂苷(desgalactotigonin)、f-芰脱皂苷(f-gitonin)和异菝葜皂苷(smilageninoside)等。此外,还含有知母多糖(anemaran)a/b/c/d、顺-扁柏树脂酚(cis-hinokiresinol)、单甲基-顺-扁柏树脂酚(monomethyl-cis-hinokiresinol)、氧化-顺-扁柏树脂酚(oxy-cis-himokiresinol)、2,6,4'-三羟基-4-甲氧基二苯甲酮(2,6,4'-trihydroxy-4-methoxybenzophenone)、对-羟苯基巴豆油酸(p-hydroxyphenylcrotonicacid)、二十五烷酸乙烯脂(pentacosylvinylester)、β-谷甾醇(β-sitosterol)、芒果苷(mangiferin)、烟酸(nicotinicacid)、烟酰胺(nicotinamide)及泛酸(pantothenicacid)等。近来相关研究还表明,知母皂苷在抗老年痴呆症状、抗衰老、抗抑郁等方面有一定的作用。知母总皂在多种抑郁模型上具有抗抑郁作用,可能与其增强去甲肾上腺素能及5-羟色胺能神经系统有关(中药新药与临床药理,2007,18,29)。通过动物实验验证,知母中所含有的菝葜皂苷元对小鼠实验性抑郁有一定作用,可以影响小鼠脑内多巴胺和单胺氧化酶的活性,而使该类皂苷元具有抗抑郁活性(biol.pharm.bull.,2006,29,2304-2306)。伊佳等人的研究发现,知母皂苷b-ⅱ具有抗抑郁活性,其作用机制可能与增强脑内5-ht和da神经系统作用有关(cn101214253a;药学实践杂志,2010,28,283-287)。本领域还需要对抗抑郁化合物进行深入研究和开发。技术实现要素:本发明的目的在于提供一种菝葜皂苷元衍生物及其药学上可接受的盐。本发明的第一方面,提供一种式i所示的化合物,或其药学上可接受的盐、溶剂化物、光学纯异构体、立体异构体或它们的混合物,所述式i所示的化合物由以下片段a和片段b连接而成,其中,r1、r2、r3各自独立地选自氢、烷基、取代的烷基、芳基烷基、取代的芳基烷基、环烷基、取代的环烷基、链烯基、取代的链烯基、炔基、取代的炔基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环、取代的杂环,或者r1、r2、r3中的任两个与相连的n形成含有1-3个n、0-2个o和/或0-2个s原子的3-7元饱和或不饱和杂环,所述“杂环”未取代或者被以下基团单取代或者多取代:氢、烷基、取代的烷基、环烷基、取代的环烷基、链烯基、取代的链烯基、炔基、取代的炔基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环基、取代的杂环基、烷酰基、取代的烷酰基、烷氧基羰基、芳基烷氧基羰基、烷基磺酰基、烷基亚磺酰基、芳基磺酰基、芳基烷基磺酰基、氨基甲酰基、取代的氨基甲酰基、羧基、酰胺、取代的酰胺、磺酰胺基、取代的磺酰胺基,表示单键或者双键r6a、r6b、r6c、r6d、r6e、r6f、r7a、r7b、r8a、r8b、r9a、r9b、r10a、r10b各自独立地选自无、氢、卤素、烷基、取代的烷基、羟基、巯基、烷基巯基、烷氧基、取代的烷氧基、氨基、取代的氨基、烷基氨基、取代的烷基氨基、二取代的氨基、烷基酰氧基、芳基酰氧基、杂芳基酰氧基、糖基,或者r6a、r6b两两之间和/或r7a、r7b两两之间和/或r8a、r8b两两之间和/或r9a、r9b两两之间和/或r10a、r10b两两之间合并成羰基;x1为o、s或nr5,r5选自氢、烷基、氰基、羟基、烷氧基,“---”表示单键或者无;当“---”为单键时,x2为o或nh,r4a、r4b各自独立地选自氢、羟基、烷基、取代的烷基、链烯基、取代的链烯基、炔基、取代的炔基,或者r4a、r4b与相连的c形成含有0-3个n、0-2个o和/或0-2个s原子的3-7元饱和或不饱和杂环,所述“杂环”未取代或者被以下基团单取代或者多取代:氢、羟基、烷基、取代的烷基、链烯基、取代的链烯基、炔基、取代的炔基;当“---”为无时,x2为orh、n(ri)(rj),r4a、r4b与连接的碳共同形成-xark,xa为ch2或者c=o,rh、ri、rj、rk各自独立选自氢、烷基、取代的烷基、环烷基、取代的环烷基、烷酰基、取代的烷酰基、烷氧基羰基、烷氧基羰基、烷胺基羰基、芳基烷氧基羰基、烷基磺酰基、芳基磺酰基、芳基烷基磺酰基、氨基甲酰基、取代的氨基甲酰基、羧基、酰胺、取代的酰胺;各*独立地表示消旋、s或r构型。在另一优选例中,r2为氢时,r3为烷基、取代的烷基、环烷基、取代的环烷基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环、取代的杂环基;或者r2、r3与相连的n形成以下结构:其中,x3为c=o、ch2、o或nr11,r11选自烷基、取代的烷基、芳基烷基、取代的芳基烷基、环烷基、取代的环烷基、链烯基、取代的链烯基、炔基、取代的炔基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环、取代的杂环、烷酰基、取代的烷酰基、烷氧基羰基、芳基烷氧基羰基、氨基甲酰基、取代的氨基甲酰基、羧基、烷基磺酰基、烷基亚磺酰基、芳基磺酰基、芳基烷基磺酰基、酰胺、取代的酰胺、磺酰胺基、取代的磺酰胺基;n=0、1或2。在另一优选例中,r2、r3各自独立地选自氢、环烷基、取代的环烷基、杂环基、取代的杂环基、芳基、取代的芳基、-mx3px5q,其中,m为亚烷基、取代的亚烷基、亚环烷基、取代的亚环烷基,x3选自o、s、(ch2)r、nra或者无,ra选自氢、烷基、取代的烷基、链烯基、取代的链烯基、炔基、取代的炔基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环、取代的杂环,r=1、2、3、4或5;p为c=o、c=s、c=nrb、c=c(rc)(rd)或者无,rb选自氢、羟基、烷氧基、氰基、硝基,rc、rd独立选自氢、烷基、羟基、烷氧基、氰基、硝基,x5选自o、s、(ch2)m、nre或者无,re选自氢、烷基、取代的烷基,m=1、2、3、4或5,q为氢、羟基、烷氧基、芳氧基、nrfrg、烷基、取代的烷基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环基、取代的杂环基,rf、rg相互独立,为氢、羟基、烷基、烷氧基、取代的烷基、链烯基、取代的链烯基、炔基、取代的炔基、烷氧基羰基,或者rf、rg两两之间形成含有0-3个n、0-2个o和/或0-2个s原子的3-7元饱和或不饱和杂环,此“杂环”未取代或者被以下基团单取代或者多取代:氢、羟基、氨基、烷基、取代的烷基、链烯基、取代的链烯基、炔基、取代的炔基。在另一优选例中,所述片段b选自下组:片段b1-片段b20,式中,x4为ch2or12、ch2n(r13)(r14)、醛基、coor12、con(r13)(r14),r12、r13、r14相互独立,选自氢、烷基、取代的烷基、环烷基、取代的环烷基、链烯基、取代的链烯基、炔基、取代的炔基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环、取代的杂环、烷酰基、取代的烷酰基、烷氧基羰基、芳基烷氧基羰基、烷基磺酰基、烷基亚磺酰基、芳基磺酰基、芳基烷基磺酰基、氨基甲酰基、取代的氨基甲酰基;x6为or15、n(r16)(r17),r15、r16、r17相互独立,选自氢、烷基、取代的烷基、环烷基、取代的环烷基、链烯基、取代的链烯基、炔基、取代的炔基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环、取代的杂环、烷酰基、取代的烷酰基、烷氧基羰基、芳基烷氧基羰基、烷基磺酰基、烷基亚磺酰基、芳基磺酰基、芳基烷基磺酰基、氨基甲酰基、取代的氨基甲酰基,x7为ch2或者c=o。在另一优选例中,r1、r2、r3各自独立地选自氢、c3-c8环烷基、c6-c10芳基、c3-c8的饱和杂环基、c1-c4烷基,其中环烷基、芳基、饱和杂环基、烷基任选地被选自下组的基团单取代、二取代或三取代:卤素、羟基、c1-c4烷基、c6-c10芳基、-c(=o)-o-c1-c4烷基;或者r2、r3与相连的n形成含有1-3个n、0-2个o和/或0-2个s原子的3-7元饱和或不饱和杂环,所述“杂环”未取代或者被以下基团单取代或者多取代:氢、c1-c4烷基、c1-c4烷氧基、c2-c4烯基、c2-c4炔基、羟基;r4a、r4b各自独立地选自氢、羟基、取代或未取代的c1-c6烷基,所述取代是指具有选自下组的一个、两个或三个取代基:卤素、羟基、c1-c4烷基、c1-c4烷氧基;或者r4a、r4b与相连的c形成含有1-2个o和/或1-2个s原子的3-7元饱和或不饱和杂环,所述“杂环”未取代或者被以下基团单取代或者多取代:氢、c1-c4烷基、c1-c4烷氧基、c2-c4烯基、c2-c4炔基、羟基;x1为o、s、nr5,r5选自氢、烷基、羟基,r6a、r6b、r6c、r6d、r6e、r6f、r7a、r7b、r8a、r8b、r9a、r9b、r10a、r10b为无、氢、烷基、取代的烷基、羟基或巯基,或者r6a、r6b两两之间和/或r7a、r7b两两之间和/或r8a、r8b两两之间和/或r9a、r9b两两之间和/或r10a、r10b两两之间合并成羰基,表示单键或者双键。在另一优选例中,x1为o。在另一优选例中,r2、r3各自独立地选自氢、c3-c12环烷基、c6-c10芳基、c3-c8的饱和杂环基、c1-c4烷基,其中环烷基、芳基、饱和杂环基、烷基任选地被选自下组的基团单取代、二取代或三取代:卤素、羟基、羧基、c1-c4烷基、c6-c10芳基、3-8元杂芳基、-c(=o)-oc1-c4烷基、3-7元饱和或不饱和杂环、-nrf1rg1、-c(=o)nrf1rg1、-o-c(=o)(c1-c4亚烷基)nrf1rg1、-o-c(=o)(3-8元杂芳基)、-nhco(c1-c4亚烷基)nrf1rg1、-nhconrf1rg1,各rf1、各rg1相互独立选自:氢、c1-c4烷基、-c(=o)c1-c6烷基、-c(=o)(3-8元杂芳基)、-c(=o)(c1-c4亚烷基)(3-8元杂芳基),其中烷基为未取代的或被选自下组的基团取代:羟基、氨基、羧基、n(c1-c4烷基)(c1-c4烷基);或者rf1与rg1与相连的n形成3-8元的饱和杂环,任选被以下基团取代:c1-c4烷基、c1-c4烷氧基、卤素、羟基、氨基;或者r2、r3与相连的n形成含有1-3个n、0-2个o和/或0-2个s原子的3-7元饱和或不饱和杂环;所述“杂环”未取代或者被以下基团单取代或者多取代:氢、c1-c4烷基、c1-c4烷氧基、羟基、3-8元杂芳基。在另一优选例中,r3为苯基、环己基、环戊基、金刚烷基、c1-c4烷基,c3-c8的饱和杂环,上述基团任选被选自下组的基团取代:羟基、c1-c4烷基、卤素、苯基、-c(=o)-oc1-c4烷基。在另一优选例中,r2为氢或取代或未取代的c1-c4烷基,取代基选自下组:羟基、氨基、-nhco(c1-c4亚烷基)nrf1rg1,其中各rf1、各rg1相互独立选自:氢、c1-c4烷基。在另一优选例中,当“---”为无时,x2为羟基、氨基或-ococh3;r4a、r4b与连接的碳共同形成-xark,xa为ch2、choh或者c=o,rk为取代或未取代的c1-c8的烷基,取代基选自下组:羟基、羧基、氨基、c3-c6环烷基。在另一优选例中,x1为o;r1为氢;r6a、r6b、r6c、r6d、r6e、r6f、r7a、r7b、r8a、r8b、r9a、r9b、r10a、r10b均为氢;r2、r3各自独立地选自氢、c3-c8环烷基、c6-c10芳基、c3-c8的饱和杂环基、c1-c4烷基,其中环烷基、芳基、饱和杂环基、烷基任选地被选自下组的基团单取代、二取代或三取代:卤素、羟基、c1-c4烷基、c6-c10芳基、-c(=o)-oc1-c4烷基;或者r2、r3与相连的n形成含有1-3个n、0-2个o和/或0-2个s原子的3-7元饱和或不饱和杂环,所述“杂环”未取代或者被以下基团单取代或者多取代:氢、c1-c4烷基、c1-c4烷氧基、羟基。在另一优选例中,片段b为片段b1-片段b8中的任一片段。在另一优选例中,r1为h、r2为h、r3为环己基。在另一优选例中,片段b为片段b1、片段b3、片段b5或片段b7。在另一优选例中,x1为o;r1为氢;r6a、r6b、r6c、r6d、r6e、r6f、r7a、r7b、r8a、r8b、r9a、r9b、r10a、r10b均为氢;r2为环己基、环戊基、金刚烷基;片段b为r3为-mx3px5q,其中,m选自c1-c4亚烷基,x3选自o、nra或者无,ra选自氢、烷基,p为c=o或者无,x5选自o、(ch2)m、nre或者无,re选自氢、烷基、取代的烷基,m=0,1,2,3,q为氢、羟基、烷氧基、氨基、烷基、取代的烷基、nrfrg,rf、rg相互独立,为氢、烷基、取代的烷基,或者rf、rg两两之间形成含有0-3个n、0-2个o和/或0-2个s原子的3-7元饱和或不饱和杂环,此“杂环”未取代或者被以下基团单取代或者多取代:氢、羟基、氨基、烷基、取代的烷基、链烯基、取代的链烯基、炔基、取代的炔基。在另一优选例中,所述化合物为实施例中制备的任一化合物。在另一优选例中,所述化合物为:在另一优选例中,所述化合物为实施例中制备的任一化合物。在另一优选例中,片段a为其中,r3a选自环己烷基、环戊烷基、环丁烷基、苯基;r3b选自氢、(c1-c6)烷氧基羰基、羧基;r2a选自氢以及r2b选自氢、羟基、氨基、-oc(=o)r2c、-nhc(=o)r2c、-nhc(=o)nhr2c,r2c选自q=0,1,2或3;片段b选自下组:在另一优选例中,所述化合物为:在另一优选例中,片段a为其中r3c选自环己烷基、环戊烷基、环丁烷基、氢、甲基、苯基或者取代的苯基,取代基选自氟、氯、溴、碘、氰基、羟基、甲氧基、三氟甲基、三氟甲氧基;d选自或者d与r3c相连形成含有1个n的3-7元饱和杂环,r3d选自片段b选自下组:在另一优选例中,片段a为其中r3e选自环己烷基、环戊烷基、环丁烷基、氢、甲基、苯基或者取代的苯基,取代基选自氟、氯、溴、碘、氰基、羟基、甲氧基、三氟甲基、三氟甲氧基,rdd为o或nh;d选自或者与r3e相连形成含有1个n的3-7元饱和杂环,r3f选自下组:氢、氨基、c1-c6烷基氨基、取代的c1-c6烷基氨基、c3-c6环烷基氨基、取代的c3-c6环烷基氨基、c1-c6烷基、取代的c1-c6烷基、c3-c6环烷基、取代的c3-c6环烷基、片段b选自下组:在另一优选例中,所述化合物选自下组:本发明的第二方面,提供第一方面所述的化合物,或其药学上可接受的盐、溶剂化物、光学纯异构体或立体异构体的制备方法,所述制备方法包括以下步骤:(a)3-氨基甾体配基与异氰酸酯反应得到第一方面所述的化合物,其中r1和r2为氢,其他取代基的定义如第一方面所述。上述3-氨基甾体配基可以为光学纯手性化合物或者各种比例混合的光学纯手性化合物。当为各种比例混合的光学纯手性化合物时,所述制备方法还包括对步骤a)得到的第一方面所述的化合物进行拆分得到光学纯手性化合物的步骤。本发明的第三方面,提供第一方面所述的化合物,或其药学上可接受的盐、溶剂化物、光学纯异构体或立体异构体的制备方法,所述制备方法包括以下步骤:(i)由3-氨基甾体配基制备3-异氰酸酯甾体化合物;(ii)3-异氰酸酯甾体化合物与nhr2r3反应生成权利要求1所述的化合物,其中r1为氢,其他取代基的定义如第一方面所述。在另一优选例中,所述制备方法还包括以下步骤:(iii)所得到的产物可以经过进一步的化学反应得到新化合物,-nhboc取代基脱除boc反应得到-nh2,-cooch3取代基水解得到-cooh。上述3-氨基甾体配基可以为光学纯手性化合物或者各种比例混合的光学纯手性化合物。当为各种比例混合的光学纯手性化合物时,所述制备方法还包括对步骤ii)得到的第一方面所述的化合物进行拆分得到光学纯手性化合物的步骤。在另一优选例中,本发明化合物采用以下路线合成:本发明的第四方面,提供一种药物混合物,所述药物混合物包含选自下组的两种或三种以上的化合物:第一方面所述的化合物,或其药学上可接受的盐、溶剂化物、光学纯异构体、立体异构体。在另一优选例中,所述药物混合物是化合物c-1至化合物c-32中任意两种或三种以上化合物的混合物。本发明中药物混合物中的组分可以以任意质量比例进行混合。例如,当药物混合物是化合物c-1至化合物c-32中任意两种化合物的混合物时,质量比例为0.01:0.99-0.99:0.01,较佳为1:9-9:1、2:8-8:2、3:7-7:3或4:6-6:4。本发明的第五方面,提供一种药物组合物,所述药物组合物包含第一方面所述的化合物,或其药学上可接受的盐、溶剂化物、光学纯异构体或立体异构体,或第四方面所述的药物混合物;以及药学上可接受的载体。在另一优选例,药物组合物可以更进一步地包含附加治疗剂,这些附加治疗剂选自:抗抑郁药、抗躁狂药、帕金森病治疗药、阿尔兹海默病治疗药或它们的组合。在另一优选例,药物组合物可以更进一步地包含附加治疗剂,所述的附加治疗剂是吗氯贝胺、托洛沙酮、氟西汀、帕罗西汀、西酞普兰、舍曲林、文拉法辛、曲米帕明、曲唑酮、丙咪嗪、地昔帕明、氯米帕明、阿米替林、去甲替林、多塞平、马普替林、洛沙平、阿莫沙平、米氮平、丁螺环酮、氯美扎酮、坦度螺酮、碳酸锂、他克林、石杉碱甲、加兰他敏、多奈哌齐、力帆斯的明、美金刚、普拉克索、他利克索、罗匹罗尼,或它们的组合。本发明的化合物可以单独使用,或者与其他治疗剂联合使用。联合治疗可以提供协同作用,即当活性成分一起使用时达到的效果,大于分别使用所述化合物所产生效果的加和。所述联合治疗可以以同时或连续的方案施用。当连续施用时,所述组合可以以两种或多种用法来施用。化合物可以再单一的药物组合中一起施用,或分开施用,且当分开施用时,可以同时地或以任意次序先后地进行。本发明化合物可以通过适宜所治疗病况的任何途径施用。适宜的途径包括但是不局限于口腔、胃肠外(包括皮下、肌内、静脉内、动脉内、皮内)、阴道、腹膜内、肺内和鼻内。应当理解,优选的途径可以因例如病人的病况变化。当所述化合物经口施用时,可以将其与药学上可接受的载体或赋形剂配制成丸剂、胶囊剂、片剂等。当所述化合物配制成胃肠外时,其可以与药学上可接受的胃肠外载体配制。本发明可以以任意方便的制剂形式施用化合物,本发明所称的“制剂”是指含有本发明通式i化合物的有利于给药(drugdelivery)的剂型,如:但不仅限于,水溶液注射剂、粉针剂、丸剂、散剂、片剂、贴剂、栓剂、乳剂、霜剂、凝胶剂、颗粒剂、胶囊剂、气雾剂、喷雾剂、粉雾剂、缓释剂和控释剂等。这些药用辅料既可以是各种制剂中常规使用的,如:但不仅限于,等渗剂、缓冲液、矫味剂、赋形剂、填充剂、粘合剂、崩解剂和润滑剂等;也可以是为了与所述物质相适应而选择使用的,如:乳化剂、增溶剂、抑菌剂、止痛剂和抗氧剂等,这类辅料能有效提高组合物所含化合物的稳定性和溶解性或改变化合物的释放速率和吸收速率等,从而改善本发明化合物在生物体内的代谢,进而增强给药效果。此外,还可以为实现特定的给药目的或方式,如:缓释给药、控释给药和脉冲给药等,而使用的辅料,如:但不仅限于,明胶、白蛋白、壳聚糖、聚醚和聚酯类高分子材料,如:但不仅限于,聚乙二醇、聚氨酯、聚碳酸酯及其共聚物等。所称的“有利于给药”的主要表现有:但不仅限于提高治疗效果、提高生物利用度、降低毒副作用和提高患者顺应性等。本发明的第六方面,提供第一方面所述的化合物,或其药学上可接受的盐、溶剂化物、光学纯异构体或立体异构体,第四方面所述的药物混合物物或第五方面所述的药物组合物的用途,用于制备防护、处理、治疗或减轻患者疾病、病症或病状的药物的用途,所述的疾病、病症或病状选自抑郁症、焦虑症、帕金森病、阿尔兹海默病、亨廷顿病、精神分裂症、躁狂症、癌症、瘤转移、高血糖、高血脂、病毒性病症、细菌感染病症、血管生成性病症、自体免疫疾病、炎症性病症、与器官移植相关联的病状。在另一优选例中,所述的疾病、病症或病状选自抑郁症、焦虑症、帕金森病、阿尔兹海默病、亨廷顿病、精神分裂症、躁狂症。在另一优选例中,所述的疾病、病症或病状选自抑郁症、焦虑症、帕金森病、阿尔兹海默病、躁狂症。在另一优选例中,所述的疾病、病症或病状选自抑郁症。本发明的第七方面,提供一种预防和/或治疗抑郁症的方法,包括将第一方面所述的化合物,或其药学上可接受的盐、溶剂化物、光学纯异构体或立体异构体,第四方面所述的药物混合物物或第五方面所述的药物组合物给予有需要的患者。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1为实施例29灌胃给药对icr小鼠强迫游泳不动时间的影响结果图(“*”表示p<0.05;“**”表示p<0.01)。图2为实施例29灌胃给药对icr小鼠悬尾不动时间的影响结果图(“*”表示p<0.05;“**”表示p<0.01)。图3为实施例30灌胃给药对大鼠强迫游泳不动时间的影响结果图(“*”表示p<0.05;“**”表示p<0.01)图4为实施例30灌胃给药对大鼠悬尾不动时间的影响结果图(“*”表示p<0.05;“**”表示p<0.01)图5为实施例31灌胃给药化合物c-11对社交失败抑郁动物模型的影响结果图(“*”表示p<0.05;“**”表示p<0.01)。图6为大鼠分别口服和尾静脉注射c-49后药时曲线图。图7为体重增长图。具体实施方式本申请的发明人经过广泛而深入地研究,首次研发出一种结构新颖的化合物,由脲基和甾体配基连接而成,结构如式i所示。本发明的化合物,可以用于防护、处理、治疗或减轻抑郁症等多种疾病、病症。在此基础上,完成了本发明。术语下面是本说明书中所用术语的定义。除非另外指出,本文所提供的基团或术语的初始定义适用于本书明说中单独地或作为其他基团的一部分的基团或者术语。术语“取代的”是指本发明说明书中提到的任一取代基,包括但不限于,卤素、硝基、氰基、羧基、氧代基、烷基、取代的烷基、环烷基、取代的环烷基、链烯基、取代的链烯基、炔基、取代的炔基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环、取代的杂环、羟基、烷氧基、芳氧基、烷酰氧基、芳酰氧基、氨基、烷酰基氨基、芳酰基氨基、芳基烷基酰基氨基、杂芳基烷基酰基氨基、氨基烷基酰基氨基、烷基氨基烷基酰基氨基、二烷基氨基烷基酰基氨基、烷基氨基、芳基氨基、芳基烷基氨基、二取代的胺(其中所述的两个氨基取代基选自烷基、芳基或芳基烷基)、烷酰基、取代的烷酰基、芳酰基、杂芳酰基、羧基、烷氧基羰基、芳氧基羰基、烷氨基羰基、芳氨基羰基、芳基烷氧基羰基、烷基磺酰基、芳基磺酰基、芳基烷基磺酰基、氨基甲酰基、取代的氨基甲酰基、取代烷基氨基甲酰基、酰胺、取代的酰胺、磺酰胺基、取代的磺酰胺基。术语“卤素”或“卤”是指氟、氯、溴、碘。术语“烷基”是指直链或者支链未取代的具有1-20个碳原子、优选1-7个碳原子的烃基团。“烷基”的实例包括但是不要局限于甲基、乙基、1-丙基、2-丙基、1-丁基、2-丁基等等。术语“取代的烷基”是指由1-4个取代基取代的烷基,所述的取代基诸如:卤素、硝基、氰基、羧基、氧代基、烷基、取代的烷基、环烷基、取代的环烷基、链烯基、取代的链烯基、炔基、取代的炔基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环、取代的杂环、羟基、烷氧基、芳氧基、烷酰氧基、芳酰氧基、氨基、烷酰基氨基、芳酰基氨基、芳基烷基酰基氨基、杂芳基烷基酰基氨基、氨基烷基酰基氨基、烷基氨基烷基酰基氨基、二烷基氨基烷基酰基氨基、烷基氨基、芳基氨基、芳基烷基氨基、二取代的胺(其中所述的两个氨基取代基选自烷基、芳基或芳基烷基)、烷酰基、取代的烷酰基、芳酰基、杂芳酰基、羧基、烷氧基羰基、芳氧基羰基、烷氨基羰基、芳氨基羰基、芳基烷氧基羰基、烷基磺酰基、芳基磺酰基、芳基烷基磺酰基、氨基甲酰基、取代的氨基甲酰基、取代烷基氨基甲酰基、酰胺、取代的酰胺、磺酰胺基、取代的磺酰胺基。术语“亚烷基”其通过从具有1-20个碳原子、优选1-7或1-4个碳原子的烷烃结构的单个碳原子或者两个碳原子上除去两个氢原子得到。术语“链烯基”是指具有2-20个碳原子、优选2-15个碳原子、最优选2-8个碳原子,且具有1-4个双键的直链或支链烃基团。术语“取代的链烯基”是指由1-2个取代基取代的链烯基,所述取代基例如:卤素、硝基、氰基、芳基、取代的芳基、杂芳基、取代的杂芳基、烷氧基、芳氧基、烷酰氧基、芳酰氧基、氨基、烷基氨基、芳基氨基、芳基烷基氨基、二取代的胺(其中所述的两个氨基取代基选自烷基、芳基或芳基烷基)。术语“炔基”是指具有2-20个碳原子、优选2-15个碳原子、最优选2-8个碳原子,且具有1-4个三键的直链或支链烃基团。术语“取代的炔基”是指由以下取代基取代的炔基,所述取代基例如:卤素、硝基、氰基、芳基、取代的芳基、杂芳基、取代的杂芳基、羟基、烷氧基、芳氧基、烷酰氧基、芳酰氧基、氨基、烷基氨基、芳基氨基、芳基烷基氨基、二取代的胺(其中所述的两个氨基取代基选自烷基、芳基或芳基烷基)。术语“芳基”是指在环部分中具有6-12个碳原子的单环或双环芳烃基团。芳基包括二环基团,该二环将基团中包括稠合至饱和的或部分不饱和的芳族环,或者芳族碳环或杂环的环。通常芳基基团包括但是不局限于以下的基团:苯、萘、蒽、联苯基、1,2-二氢萘、1,2,3,4-四氢萘基等等。术语“取代的芳基”是指由1-4个取代基取代的芳基,所述取代基例如:卤素、卤素、硝基、氰基、脲基、羧基、三氟甲氧基、三氟甲基、烷基、取代的烷基、环烷基、取代的环烷基、链烯基、取代的链烯基、炔基、取代的炔基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环、取代的杂环、羟基、烷氧基、芳氧基、烷酰氧基、芳酰氧基、氨基、烷基氨基、芳基氨基、芳基烷基氨基、二取代的胺(其中所述的两个氨基取代基选自烷基、芳基或芳基烷基),烷酰基、取代的烷酰基、烷氧基羰基、芳基烷氧基羰基、烷基磺酰基、芳基磺酰基、芳基烷基磺酰基、氨基甲酰基、取代的氨基甲酰基、酰胺、取代的酰胺、磺酰胺基、取代的磺酰胺基。术语“环烷基”是指非芳族的、饱和的或部分不饱和的环烃基团,所述环烷基可以任意地被一个或多个本申请所述的取代基取代,其具有3-30个碳原子成为单环的环,或者7-12个碳原子成为二环、三环的环。单环环烷基的实例包括但是不局限于环丙基、环丁基、环戊基、1-环戊-1-烯基、1-环戊-2-烯基、1-环戊-3-烯基、环己基、1-环己-1-烯基、环庚基、环辛基。示例性的成桥二环环烷基包括但是不局限于二环[2.2.1]庚烷、二环[2.2.2]辛烷、二环[3.2.2]壬烷、金刚烷基。术语“亚环烷基”其通过从环烃结构的单个碳原子或者两个碳原子上除去两个氢原子得到。环烃具有3-30个碳原子,优选3-10个碳原子包括但不限于环丙基、环丁基、环戊基、1-环戊-1-烯基、1-环戊-2-烯基、1-环戊-3-烯基、环己基、1-环己-1-烯基、环庚基、环辛基、二环[2.2.1]庚烷、二环[2.2.2]辛烷、二环[3.2.2]壬烷、金刚烷基。术语“杂环”、“杂环的”和“杂环基”是指任选取代的、完全饱和的或不饱和的、芳族或非芳族环基团,例如它可以是4-7元单环、7-11元双环或10-15元三环体系,其在至少一个含碳原子的环中具有至少一个杂原子。含杂原子的杂环基的每个环可以具有1、2或3个选自氮原子、氧原子和硫原子的杂原子。所述“杂环基”可以任意地被一个或多个本申请所述的取代基取代,“杂环基”的实例包括但是不局限于吡咯烷基、四氢呋喃基、四氢吡喃基、吗啉代、硫吗啉代、哌嗪基、高哌嗪基、环氧丙烷基、咪唑烷基、3-氮杂二环[3.1.0]己烷基、3-氮杂二环[4.1.0]庚烷基、氮杂二环[2.2.2]己烷基、n-吡啶基脲、嘧啶酮基和1,1-二氧代-硫吗啉基。术语“杂芳基”是指5-、6-、7-、8、9或10-元环的一价芳香基团,并且包括5-20个原子的稠合系统,含有一个或多个选自氮、氧、磷和硫的杂原子,可以任意地被一个或多个本申请所述的取代基取代。“杂芳基”的实例包括但是不局限于吡啶基、咪唑基、咪唑并吡啶基、嘧啶基、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、噻唑基、喹啉基、吲哚基等等。术语“氧代基”代表二价基=o。术语“氨基甲酰基”是指-oc(=o)nh2基团。术语“酰胺”是指-c(=o)nh2基团。术语“磺酰胺基”是指-so2nh2基团。术语“取代的氨基甲酰基”、“取代的酰胺”、“取代的磺酰胺基”是指酰胺、磺酰胺或氨基甲酸酯分别至少有一个氢被选自烷基、取代的烷基、链烯基、取代的链烯基、环烷基、取代的环烷基、芳基、取代的芳基、杂芳基、取代的杂芳基、杂环基、取代的杂环基的基团所取代。术语“可接受的盐”,是指本发明化合物的药学上可接受有机或无机盐。示例性的盐包括但是不局限于硫酸盐、枸橼酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、酸式硫酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式枸橼酸盐、琥珀酸盐、马来酸盐、延胡索酸盐、葡萄糖酸盐、甲酸盐、甲磺酸盐和巴莫酸盐。“可接受的盐”可涉及包括另一分子例如马来酸盐或其他平衡离子。平衡离子在母体化合物中稳定电荷。“可接受的盐”可以有多于一个的荷电原子,多个荷电原子可具有多个平衡离子。如果本发明化合物是碱,需要的“可接受的盐”可通过适宜的方法制备,例如,用以下的无机酸处理该游离碱:盐酸、氢溴酸、硫酸、硝酸、磷酸;或者用如下的有机酸:乙酸、马来酸、琥珀酸、扁桃酸、富马酸、丙二酸、丙酮酸、水杨酸、吡喃糖苷基酸如葡萄糖醛酸或半乳糖醛酸、α-羟基酸如枸橼酸或酒石酸、氨基酸如谷氨酸、芳香族酸如苯甲酸或肉桂酸、磺酸如甲磺酸或对甲苯磺酸。如果本发明化合物是酸,需要的“可接受的盐”可通过适宜的方法制备,例如,用如下的无机碱或者有机碱处理该游离酸:胺、碱金属氢氧化物或碱土金属氢氧化物等。适宜的盐的示例性的示例包括但是不限于由氨基酸得到的有机盐,伯、仲、叔胺盐,以及环状胺例如哌啶、吗啉和哌嗪的盐,以及由钠、钙、钾、镁、锰、铁、铜、锌、铝和锂得到的无机盐。溶剂合物是指一个或多个溶剂分子与本发明化合物的结合物或络合物。形成溶剂合物的溶剂的示例包括但是不局限于水、异丙醇、乙醇、甲醇、二甲亚砜、乙酸乙酯、乙酸和乙醇胺。本发明化合物可以以非溶剂化形式存在,也可以与药学上可接受的溶剂如水、乙醇等以溶剂化形式存在,所以本发明将包括溶剂化和非溶剂化的形式。本发明的化合物可以含有不对称中心或手性中心,并且因此存在不同的立体异构体形式。本发明化合物的所有立体异构体形式,包括但不局限于,非对映体、对映体和位阻异构体,以及它们的混合物例如外消旋混合物,将形成本发明的一部分。在本文中,当任何特定手性原子的立体化学未确定时,所有立体异构体均被考虑。此外,本发明涉及所有的几何和位置异构体。本发明化合物可以以不同的互变异构体形式存在,并且所有这些形式均包括在本发明范围内。本发明化合物的所有立体异构体预期包括混合物形式或纯的或基本上纯的形式。可以通过物理方法例如分步结晶、非对映体衍生物的分离或结晶、或者通过hplc制备柱、手性制备柱拆分制备纯的光学异构体。本发明所用的hplc制备柱拆分光学异构体的条件如下:分析色谱条件如下:柱子:watersxbridgec185μm4.6*250mm;柱温为30℃;流速为1ml/min;流动相:乙腈(a)-水(b):86%a-95%a30min;elsd检测器:雾化温度为55℃;载气流量:2.4l/min。制备用色谱条件1如下:制备色谱柱:选自美国沃特斯watersxbridgec185μm10*250mm、watersxbridgec185μmobd30*150mm、watersxbridgec185μmobd50*150mm、watersxbridgec185μmobd50*250mm;流动相为水和乙腈,线性梯度洗脱程序:0~30min,14%水→5%水;流速为3.0ml/min。流动相在使用前需经,超声脱气;进样量为800ul。或者制备用色谱条件2如下:制备色谱柱:选自大赛璐手性制备柱chiralpakad-h5μm20*250mm、chiralpakad-h5μm30*250mm、chiralpakad5μm20*250mm、chiralpakas-h5μm20*250mm、chiralcelod-h5μm20*250mm,流动相为正己烷和异丙醇,流速为3.0ml/min。流动相在使用前需经,超声脱气;进样量为600ul。本发明提到的上述特征,或实施例提到的特征可以任意组合。本案说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以被任何提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数,所有温度均以摄氏度给出,试剂从商业供应商购置或者定制,例如国药、韶远、安耐吉、tci、sigma等等。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。实施例13α-氨基菝葜皂苷元的制备称取菝葜皂苷元1.2g,加入30mldcm溶解,加入2ml吡啶,室温搅拌溶解。冰浴条件下,缓慢滴加0.5ml甲磺酰氯,滴加完毕后,继续在冰浴条件下搅拌0.5h,再慢慢回复到室温继续反应4h。向反应液加入冰水搅拌30min,用dcm萃取,合并有机相无水硫酸钠干燥,硅胶柱层析得到产物1g。将其再次溶解于40mldmf中,加入800mg的nan3,60℃下搅拌12h。冷却到室温,加入冰水搅拌30min,有白色固体析出,过滤,水洗,干燥后硅胶柱层析得到550mg的3α-叠氮基菝葜皂苷元。将其溶解于20mlthf/2ml水中,加入三苯基膦600mg,60℃下搅拌过夜。减压除去溶剂,剩余物经过硅胶柱层析纯化得到350mg的3α-氨基菝葜皂苷元。1hnmr(300mhz,cdcl3):δ4.40(1h,dd,j=6.0,12.0hz,h-16),3.95(1h,dd,j=3.0,9.0hz,h-26a),2.70(1h,m,h-3),3.30(1h,d,j=6.0hz,h-26b),1.08(3h,d,j=6.0hz,h-21),0.99(3h,d,j=6.0hz,h-27),0.93(3h,s,h-19),0.75(3h,s,h-18).13cnmr(300mhz,cdcl3):δ157.3(c=o),109.8(c-22),81.1(c-16),65.2(c-26),62.1(c-17),56.6(c-14),51.5(c-3),42.5(c-5),42.2(c-20),40.7(c-13),40.6(c-9),40.4(c-12),37.6(c-4),36.2(c-1),35.6(c-8),34.8(c-10),31.8(c-15),31.4(c-2),27.3(c-6),27.2(c-23),26.8(c-7),26.0(c-25),25.9(c-24),23.7(c-19),20.7(c-11),16.6(c-18),16.2(c-27),14.4(c-21).lc-ms,计算(c27h45no2,m)为415.3450,发现[m+h]+:416.3528.实施例23β-氨基菝葜皂苷元的制备称取3g菝葜皂苷元溶解于80mlthf中,加入三苯基膦2.6g,再加入diad4.3ml,最后加入对硝基苯乙酸1.6g,室温搅拌过夜。减压除去溶剂,残余物直接硅胶柱层析,得到产物1.2g。将其再溶解在20mlthf/5mlh2o中,加入氢氧化钠400mg,室温搅拌过夜。减压除去溶剂,加入dcm和水,分出dcm层,水层用dcm萃取,合并有机相,1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析,洗脱剂p/e=5:1,得到3α-羟基菝葜皂苷元,其数据如下所示:1hnmr(300mhz,cdcl3):δ4.40(1h,dd,j=6.0,12.0hz,h-16),3.95(1h,dd,j=3.0,9.0hz,h-26a),2.70(1h,m,h-3),3.30(1h,d,j=6.0hz,h-26b),1.08(3h,d,j=6.0hz,h-21),0.99(3h,d,j=6.0hz,h-27),0.93(3h,s,h-19),0.75(3h,s,h-18).13cnmr(300mhz,cdcl3):δ157.3(c=o),109.8(c-22),81.1(c-16),65.2(c-26),62.2(c-17),56.5(c-14),71.8(c-3),42.2(c-5),42.1(c-20),40.7(c-13),40.6(c-9),40.4(c-12),36.5(c-4),35.5(c-1),35.6(c-8),34.8(c-10),31.9(c-15),30.6(c-2),27.3(c-6),27.2(c-23),26.8(c-7),26.0(c-25),25.9(c-24),23.5(c-19),20.7(c-11),16.6(c-18),16.2(c-27),14.4(c-21).lc-ms,计算(c27h44o3,m)为416.3290,实测[m+h]+:417.3334。称取菝葜皂苷元1.2g,加入30mldcm溶解,加入2ml吡啶,室温搅拌溶解。冰浴条件下,缓慢滴加0.5ml甲磺酰氯,滴加完毕后,继续在冰浴条件下搅拌0.5h,再慢慢回复到室温继续反应4h。向反应液加入冰水搅拌30min,用dcm萃取,合并有机相无水硫酸钠干燥,硅胶柱层析得到产物900mg。将其再次溶解于40mldmf中,加入800mg的nan3,60℃下搅拌12h。冷却到室温,加入冰水搅拌30min,有白色固体析出,过滤,水洗,干燥后硅胶柱层析得到450mg的3β-叠氮基菝葜皂苷元。将其溶解于20mlthf/2ml水中,加入三苯基膦600mg,60℃下搅拌过夜。减压除去溶剂,剩余物经过硅胶柱层析纯化得到250mg的3β-氨基菝葜皂苷元。实施例33-氨基菝葜皂苷元(混合物)的制备称取菝葜皂苷元1g,加入无水dcm20ml溶解,在冰浴条件下缓慢加入pcc800mg,然后缓慢升至室温反应,tlc点板追踪反应结束。向反应体系中加入dcm和水,分出有几层,水层用dcm萃取,合并有机相,水洗,无水硫酸钠干燥,减压旋出溶剂,硅胶柱层析分离,得到产物菝葜皂苷元氧化产物790mg。称取氧化产物700mg,加入无水甲醇40ml溶解,加入乙酸铵1.3g,室温搅拌1h,加入氰基硼氢化钠120mg继续搅拌24h,点板追踪反应结束。减压旋出溶剂,向残留物中加入dcm和水,分出有机层,水层用dcm萃取,合并有机层,用naoh水溶液洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,减压旋出有机溶剂,粗产品经过硅胶柱层析分离得到350mg产物,为非对映异构体3α-氨基菝葜皂苷元和3β-氨基菝葜皂苷元的混合物。实施例4hplc制备柱拆分实施例3的3-氨基菝葜皂苷元(混合物)制备光学纯3α-氨基菝葜皂苷元和3β-氨基菝葜皂苷元取实施例3中经过硅胶柱层析分离得到的3-氨基菝葜皂苷元(混合物)350mg,经过hplc制备柱拆分制备得到纯的光学异构体,得到3α-氨基菝葜皂苷元150mg;3β-氨基菝葜皂苷元130mg。实施例5化合物c-7的制备称取三光气840mg溶解于20mldcm中,3α-氨基菝葜皂苷元1.2g溶解于20mldcm中,然后缓慢滴加入到反应体系中,三乙胺0.85ml溶解于20mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm50ml中。胺ⅱ0.28ml于30mldcm的溶液缓慢滴加入反应体系中,减压旋尽溶剂,残留物柱层析分离,得到890mg化合物c-7。lc-ms,计算(c32h53n3o4,m)为543.4036,发现[m+h]+:544.4190.化合物c-5的制备制备方法同以上化合物c-7的制备方法。lc-ms,计算(c34h56n2o4,m)为556.4240,发现[m+h]+:557.4298.实施例6化合物c-13的制备称取三光气2.8g溶解于90mldcm中,3α-氨基菝葜皂苷元3.9g溶解于60mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2eq)溶解于60mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm120ml中。苯胺(2eq)于120mlthf的溶液缓慢滴加入反应体系中,加入dcm稀释反应液,1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到2.5g化合物c-13。1hnmr(300mhz,cdcl3):δ7.30(2h,m,h-2’,h-6’),7.25(2h,m,h-3’,h-5’),7.01(1h,d,j=6.0hz,h-4’),4.40(1h,dd,j=6.0,9.0hz,h-16),3.95(1h,dd,j=3.0,9.0hz,h-26a),3.61(1h,m,h-3),3.30(1h,d,j=9.0hz,h-26b),1.08(3h,d,j=6.0hz,h-21),1.00(3h,d,j=6.0hz,h-27),0.89(3h,s,h-19),0.74(3h,s,h-18).13cnmr(300mhz,cdcl3):δ155.8(c=o),132.9(c-1’),120.4(c-2’,c-6’),129.3(c-3’,c-5’),123.3(c-4’),109.9(c-22),81.2(c-16),65.3(c-26),62.2(c-17),56.4(c-14),50.4(c-3),42.5(c-5),42.2(c-20),40.7(c-9),40.7(c-13),40.3(c-12),36.1(c-4),35.5(c-8),34.8(c-1),34.4(c-10),31.9(c-15),28.6(c-2),27.2(c-6),27.1(c-23),26.8(c-7),26.1(c-25),25.9(c-24),23.7(c-19),20.7(c-11),16.6(c-18),16.2(c-27),14.5(c-21).lc-ms,计算(c34h50n2o3,m)为534.3821,发现[m+h]+:535.3879.实施例7hplc制备柱拆分制备化合物c-13和化合物c-14称取三光气300mg溶解于10mldcm中,3-氨基菝葜皂苷元(两种构象的混合物)400mg溶解于10mldcm中,然后缓慢滴加入到反应体系中,2.2当量的三乙胺溶解于10mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm30ml中。2当量的苯胺于20mlthf的溶液缓慢滴加入反应体系中,减压旋尽溶剂,残留物dcm溶解,1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,粗产品经过硅胶柱层析分离,再经过hplc制备柱拆分制备得到纯的光学异构体,得到化合物c-13有90mg,化合物c-14有80mg。所用的3-氨基菝葜皂苷元(α和β两种构象的混合物)来自实施例3的制备。实施例8化合物c-11的制备称取三光气800mg溶解于50mldcm中,3α-氨基菝葜皂苷元1g于20mldcm的溶液缓慢滴加入到反应体系中,三乙胺1ml缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm150ml中。2当量的环己胺于20mldcm的溶液缓慢滴加入反应体系中,减压旋尽溶剂,残留物dcm溶解,1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,粗产品经过硅胶柱层析分离,洗脱剂p/e=3:1~2:1,得到产物750mg化合物c-11。1hnmr(300mhz,cdcl3):δ4.40(1h,dd,j=6.0,12.0hz,h-16),3.95(1h,dd,j=3.0,9.0hz,h-26a),3.49(1h,m,h-3),3.47(1h,m,h-1’),3.30(1h,d,j=9.0hz,h-26b),1.08(3h,d,j=6.0hz,h-21),0.99(3h,d,j=6.0hz,h-27),0.94(3h,s,h-19),0.75(3h,s,h-18).13cnmr(300mhz,cdcl3):δ157.2(c=o),109.9(c-22),81.1(c-16),65.3(c-26),62.2(c-17),56.6(c-14),50.4(c-3),49.1(c-1’),42.5(c-5),42.2(c-20),40.8(c-9),40.8(c-13),40.4(c-12),36.2(c-4),35.5(c-8),34.9(c-1),34.7(c-10),34.1(c-2’,c-6’),31.9(c-15),28.8(c-2),27.2(c-6),27.1(c-23),26.8(c-7),26.1(c-25),25.9(c-24),25.7(c-4’),25.1(c-3’,c-5’),23.7(c-19),20.7(c-11),16.6(c-18),16.2(c-27),14.4(c-21).lc-ms,计算(c34h56n2o3,m)为540.4291,发现[m+h]+:541.4353.实施例9化合物c-12的制备称取三光气800mg溶解于50mldcm中,3β-氨基菝葜皂苷元1g于20mldcm的溶液缓慢滴加入到反应体系中,三乙胺1ml缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm150ml中。2当量的环己胺于20mldcm的溶液缓慢滴加入反应体系中,减压旋尽溶剂,残留物dcm溶解,1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,粗产品经过硅胶柱层析分离,洗脱剂p/e=3:1~2:1,得到产物700mg化合物c-12。1hnmr(300mhz,cdcl3):δ4.40(1h,dd,j=6.0,9.0hz,h-16),3.95(1h,m,h-26a),3.94(1h,m,h-3),3.52(1h,m,h-1’),3.30(1h,d,j=6.0hz,h-26b),1.08(3h,d,j=6.0hz,h-21),0.99(3h,d,j=6.0hz,h-27),0.96(3h,s,h-19),0.75(3h,s,h-18).13cnmr(300mhz,cdcl3):δ157.2(c=o),109.8(c-22),81.1(c-16),65.2(c-26),62.2(c-17),56.5(c-14),45.8(c-3),49.1(c-1’),42.5(c-20),40.3(c-9),40.8(c-13),40.0(c-12),37.9(c-5),35.4(c-10),35.3(c-8),31.5(c-4),31.3(c-1),34.1(c-2’,c-6’),31.8(c-15),26.9(c-7),27.2(c-23),26.6(c-7),26.1(c-25),25.9(c-24),25.8(c-4’),25.6(c-6),25.1(c-3’,c-5’),24.2(c-19),20.9(c-11),16.6(c-18),16.2(c-27),14.4(c-21).lc-ms,计算(c34h56n2o3,m)为540.4291,发现[m+h]+:541.4331.实施例103-环己基脲基菝葜皂苷元的制备(化合物c-11和化合物c-12的混合物)称取三光气80mg溶解于5mldcm中,3-氨基菝葜皂苷元(两种构象的混合物)100mg于2mldcm的溶液缓慢滴加入到反应体系中,三乙胺85ul缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm5ml中。2当量的环己胺于2mlthf的溶液缓慢滴加入反应体系中,减压旋尽溶剂,残留物dcm溶解,1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,粗产品经过硅胶柱层析分离,得到产物3-环己基脲基菝葜皂苷元60mg,为化合物c-11以及化合物化学c-12的混合物(质量比约为6:4)。所用的3-氨基菝葜皂苷元(α和β两种构象的混合物)来自实施例3的制备。实施例11hplc制备柱拆分实施例10的3-环己基脲基菝葜皂苷元制备化合物c-11和化合物c-12实施例10中经过硅胶柱层析分离制备的3-环己基脲基菝葜皂苷元60mg,再经过hplc制备柱拆分制备得到纯的光学异构体,得到化合物c-11有30mg,得到化合物c-12有20mg。实施例12化合物c-11的制备称取2g3α-氨基菝葜皂苷元溶解于80mldcm中,加入环己基异氰酸酯2ml,室温搅拌过夜。加入dcm稀释反应液,1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析,洗脱剂p/e=3:1~2:1,得到产物1.5g化合物c-11。实施例13化合物c-12的制备称取2g3β-氨基菝葜皂苷元溶解于80mldcm中,加入环己基异氰酸酯2ml,室温搅拌过夜。加入dcm稀释反应液,1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析,洗脱剂p/e=3:1~2:1,得到产物1.5g化合物c-12。参考以上实施例的制备方法制备化合物c-23。实施例14化合物c-33的合成称取三光气(1mmol)溶解于60mldcm中,3α-氨基菝葜皂苷元(1mmol)溶解于30mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2mmol)溶解于30mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm60ml中,将环戊胺(2mmol)于30mldcm的溶液缓慢滴加入反应体系中,过夜反应。1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到化合物,产率60%。1hnmr(400mhz,chloroform-d)δ4.53(d,j=7.2hz,2h),4.47–4.36(m,2h),3.96(ddd,j=13.1,8.7,5.9hz,3h),3.55(s,1h),3.31(d,j=10.9hz,1h),1.27(s,4h),1.09(d,j=7.0hz,4h),1.00(d,j=6.8hz,3h),0.95(s,4h),0.76(s,3h).lc-ms,理论值(c33h55n2o3,[m+h]+)为527.4213,实测值:527.4185.实施例15化合物c-34的合成称取三光气(1mmol)溶解于60mldcm中,3α-氨基菝葜皂苷元(1mmol)溶解于30mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2mmol)溶解于30mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm60ml中,将金刚烷胺盐酸盐(2mmol)和三乙胺(2mmol)于30mldcm的溶液缓慢滴加入反应体系中,过夜反应。1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到化合物,产率70%。1hnmr(400mhz,chloroform-d)δ4.42(q,j=7.4hz,1h),4.15(s,2h),3.97(dd,j=11.0,2.7hz,1h),3.47(td,j=10.9,5.6hz,1h),3.32(d,j=10.9hz,1h),1.09(d,j=7.1hz,4h),1.01(d,j=6.7hz,3h),0.95(s,4h),0.76(s,3h).lc-ms,理论值(c38h61n2o3,[m+h]+)为593.4682,实测值:593.4668.实施例16取代环己胺的合成方法1:还原胺化反应环己酮(3eq)与胺(1eq)溶解在甲醇中,加入0.2eq的乙酸,氰基硼氢化钠(1.2eq)进行还原,减压除去溶剂,加入饱和氯化钠与乙酸乙酯,分出有机层,硅胶快速柱层析,得到化合物直接投入下一步反应。按此方法可以得到如下的化合物:方法2:亲核取代反应环己胺(5mmol)与2-氯甲基酰胺(5.5mmol)溶于30mldmf中,在体系加入碳酸钾(15mmol),过夜反应。乙酸乙酯每次200ml萃取三次,后用饱和氯化钠洗涤乙酸乙酯层3次,分出有机层,硅胶快速柱层析,得到化合物直接投入下一步反应。实施例17化合物c-35~c-39的合成称取三光气(1mmol)溶解于60mldcm中,3α-氨基菝葜皂苷元(1mmol)溶解于30mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2mmol)溶解于30mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm60ml中,将环己胺衍生物(2mmol)于30mldcm的溶液缓慢滴加入反应体系中,过夜反应。1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到化合物如表1所示。表1化合物c-35~c-39的化学结构及数据实施例18化合物c-40~c-41的合成1hnmr(400mhz,chloroform-d)δ5.13(d,j=23.8hz,1h),4.43(q,j=7.2hz,1h),3.97(dd,j=11.2,2.7hz,1h),3.89(s,1h),3.68(s,1h),3.32(d,j=10.9hz,1h),3.12(t,j=7.8hz,2h),2.40(t,j=6.1hz,2h),1.45(s,2h),1.10(d,j=6.9hz,4h),1.01(d,j=6.5hz,3h),0.96(s,3h),0.78(s,3h).lc-ms,理论值(c38h63n2o5,[m+h]+)为627.4737,实测值:627.4675。实施例19化合物c-42~c-43的合成将底物(1mmol)溶解于30mldcm中,称取edci·hcl(2mmol),dmap(3mmol)于反应体系中,再取rbcooh(2mmol)于反应体系中,室温搅拌过夜,加入dcm稀释反应液,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,硅胶柱层析,得到化合物如表2所示。表2化合物c-42~c-43的化学结构及数据实施例20化合物c-44的合成将底物(1mmol)、三氮唑(1.5mmol)、三苯基膦(1.5mmol)溶于30mlthf,缓慢滴入diad(2mmol)。室温搅拌过夜,旋干thf,硅胶柱层析,产率20%。1hnmr(400mhz,chloroform-d)δ10.62(d,j=7.2hz,1h),8.23(s,2h),4.89(s,1h),4.72(t,j=8.4hz,2h),4.41(d,j=7.0hz,1h),3.96(dd,j=11.2,2.8hz,1h),3.83(t,j=8.4hz,2h),3.55(d,j=32.4hz,2h),3.33(d,j=11.0hz,1h),2.30(q,j=12.6hz,1h),1.04(dd,j=38.5,6.8hz,6h),0.94(s,3h),0.73(s,3h).lc-ms,理论值(c38h62n5o3,[m+h]+)为636.4853,实测值:636.4813。实施例21化合物c-45~c-46的合成第一步的成脲反应得到中间体可以参照化合物c-34的合成,底物(1mmol)溶解于dcm中,加入hcl(8mmol)的乙酸乙酯溶液,室温搅拌过夜,减压除去溶剂,烘干得到目标化合物,产率65%。1hnmr(400mhz,chloroform-d)δ4.40(q,j=7.4,6.8hz,1h),4.00–3.89(m,1h),3.62(d,j=10.6hz,4h),3.47(s,2h),3.29(d,j=10.8hz,1h),3.24–3.08(m,3h),1.08(d,j=7.0hz,3h),0.99(d,j=6.7hz,3h),0.95(s,4h),0.75(s,3h).13cnmr(100mhz,chloroform-d)δ157.60,109.72,81.01,77.26,65.12,57.27,56.21,51.91,42.51,42.10,40.63,40.52,40.18,35.97,35.49,34.75,34.02,31.76,30.80,28.25,27.06,26.69,25.95,25.72,25.10,23.52,20.64,16.44,16.04,14.35.lc-ms,理论值(c36h62n3o3,[m+h]+)为584.4791,实测值:584.4751。实施例22化合物c-47~c-52的合成将底物(1mmol)溶解于30mldcm中,称取edci·hcl(2mmol),dmap(3mmol)于反应体系中,再取rbcooh(2mmol)于反应体系中,室温搅拌过夜,加入dcm稀释反应液,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,硅胶柱层析,得到化合物如表3所示。表3化合物c-47~c-52的化学结构及数据实施例23化合物c-55的合成酰胺化反应参照化合物c-47~c-52的合成,后脱boc反应参照化合物c-46的合成.可以得到产物,产率:50%。1hnmr(400mhz,chloroform-d)δ7.84(d,j=5.9hz,1h),4.46–4.35(m,1h),3.96(dd,j=11.0,2.7hz,1h),3.81(d,j=11.2hz,1h),3.70–3.58(m,1h),3.42(s,2h),3.35–3.27(m,3h),3.23(dd,j=7.9,5.3hz,2h),2.28–2.23(m,3h),1.44(s,3h),1.09(d,j=7.1hz,4h),1.00(d,j=6.8hz,3h),0.95(s,3h),0.76(s,3h).13cnmr(100mhz,chloroform-d)δ173.30,157.57,109.74,81.05,77.23,65.14,62.14,56.32,54.32,51.14,44.42,42.61,40.65,40.59,40.27,36.24,35.53,34.84,34.35,31.77,31.53,28.37,27.09,26.91,26.74,25.97,25.76,25.54,23.64,20.67,16.46,16.03,14.32.lc-ms,理论值(c38h65n4o4,[m+h]+)为641.5006,实测值:641.4984。实施例24化合物c-55和化合物c-56的合成称取三光气(1mmol)溶解于60mldcm中,底物(1mmol)溶解于30mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2mmol)溶解于30mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm60ml中,将rcnh(2mmol)于30mldcm的溶液缓慢滴加入反应体系中,过夜反应。1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到化合物如表4所示。表4化合物c-55~c-56的化学结构及数据实施例25化合物c-57的合成将1g化合物c-11溶于干燥dcm中,冰浴,在氮气保护下加入2.4ml三氟化硼乙醚和3.1ml乙酸酐。10分钟后加入冰水搅拌过夜。用饱和碳酸氢钠洗涤、饱和食盐水洗涤,硅胶柱层析得到0.4g化合物c-57。1hnmr(400mhz,chloroform-d)δ4.98(s,1h),4.20(d,j=55.5hz,3h),3.48(s,2h),3.43(d,j=5.3hz,1h),2.98(dd,j=10.9,6.8hz,1h),2.72(dt,j=17.9,7.1hz,1h),2.53–2.20(m,2h),1.98(s,2h),1.95–1.87(m,3h),1.71(d,j=12.3hz,2h),1.26(d,j=10.3hz,2h),1.15(d,j=7.5hz,3h),0.85(s,3h).13cnmr(101mhz,cdcl3)δ214.01,170.00,157.22,77.39,77.07,76.76,75.87,67.33,55.35,53.94,50.08,48.87,43.47,42.36,42.28,40.50,40.12,38.46,35.98,35.43,35.25,34.82,34.60,34.52,33.96,28.67,26.94,26.32,25.64,24.96,23.52,21.19,20.54,16.90,16.73,13.42,lc-ms,理论值(c36h61n2o5,[m+h]+)为601.4502,发现[m+h]+:601.4619.实施例26化合物c-58的合成将1.6g3-氨基知母皂苷元于乙醇中与36g锌粉加热回流,滴入32ml浓盐酸。30分钟后,冷却,旋干乙醇,加入200mldcm,和同体积含16gnaoh的水溶液。产生大量白色沉淀,硅藻土过滤得到dcm和水的混合液,分液得到dcm层,旋干得到产物,产物加入环己基异氰酸酯0.55ml、三乙胺0.08ml,30min后得到终产物化合物c-58,硅胶柱层析纯化得到0.22g。1hnmr(400mhz,chloroform-d)δ4.40–4.30(m,1h),4.08(t,j=8.0hz,2h),3.60–3.38(m,5h),2.24(dt,j=13.0,7.6hz,1h),1.76–1.67(m,2h),1.49–1.37(m,2h),1.13(ddd,j=14.4,10.1,5.8hz,6h),1.06(s,1h),0.87(s,3h).lc-ms,理论值(c34h61n2o3,[m+h]+)为545.4604,发现[m+h]+:545.4638.实施例27化合物c-59的合成将1.6g3-氨基知母皂苷元于乙醇中与36g锌粉加热回流,滴入32ml浓盐酸。30分钟后,冷却,旋干乙醇,加入200mldcm,和同体积含16gnaoh的水溶液。产生大量白色沉淀,硅藻土过滤得到dcm和水的混合液,分液得到dcm层,旋干得到产物,产物在dcm中加入cdi1.2eq,30min后加入2eq环己胺衍生物,过夜反应后得到终产物化合物c-59,硅胶柱层析纯化得到0.2g。1hnmr(400mhz,chloroform-d)δ4.86(s,1h),4.35(td,j=7.3,4.2hz,1h),4.06(s,1h),3.71(q,j=4.0hz,2h),3.64(d,j=8.9hz,1h),3.55(s,2h),3.56–3.40(m,2h),3.36(t,j=4.9hz,2h),2.25(dt,j=12.9,7.6hz,1h),2.05–1.95(m,1h),1.58(s,1h),1.50–1.39(m,2h),0.87(s,3h).13cnmr(101mhz,cdcl3)δ159.26,72.57,68.26,65.00,61.67,55.61,54.37,50.90,45.07,42.60,42.48,40.62,36.63,35.85,35.38,34.63,34.54,33.57,31.29,29.83,28.72,26.42,25.95,25.51,23.75,23.57,20.52,18.22,16.75,13.27.lc-ms,理论值(c36h65n2o4,[m+h]+)为589.4866,发现[m+h]+:589.4985。实施例28化合物c-65的合成将0.14g化合物c-57溶于dcm,加入催化量dmap和2eq乙酸酐,过夜反应。1m盐酸洗涤、饱和碳酸氢钠洗涤、饱和食盐水洗涤得到0.1g化合物c-65。lc-ms,理论值(c38h63n2o6,[m+h]+)为643.4608,发现[m+h]+:643.4684实施例29化合物c-66与化合物c-67的合成250mg化合物c-57溶于50mldmf,加入2gpdc,5天后,旋去部分dmf,加入饱和食盐水,用乙酸乙酯萃取,硅胶柱层析得到0.03g化合物c-66与0.06g化合物c-67。化合物c-66,lc-ms,理论值(c36h59n2o6,[m+h]+)为615.4295,发现[m+h]+:615.4403化合物c-67,lc-ms,理论值(c36h59n2o5,[m+h]+)为599.4346,发现[m+h]+:599.4450实施例30化合物c-69与化合物c-70的合成将580mg化合物c-57溶于10ml甲醇,加入46.6微升乙酸,加热至55摄氏度,投入1.2g硼氢化钠,旋去甲醇,溶于dcm,饱和氯化铵洗涤,饱和碳酸氢钠洗涤、饱和食盐水洗涤,硅胶柱层析得到0.1g化合物c-69与0.06g化合物c-70。化合物c-69数据1hnmr(400mhz,methanol-d4)4.31(t,j=6.6hz,1h),4.25(td,j=7.8,4.6hz,1h),3.84(ddd,j=9.8,4.0,1.9hz,1h),3.47(tdd,j=12.1,6.8,3.3hz,3h),3.40–3.35(m,1h),0.99(s,3h),0.98(d,j=1.9hz,3h),0.96(d,j=1.6hz,3h),0.92(s,3h).13cnmr(101mhz,meod)δ167.87,158.48,73.43,71.29,66.81,65.26,58.92,54.24,49.73,48.39,48.27,48.05,47.84,47.63,47.42,47.20,46.99,42.71,42.65,40.47,36.42,35.82,35.75,35.44,34.33,34.05,33.41,30.34,30.02,28.13,26.89,26.27,25.38,24.74,22.76,20.32,18.89,16.24,12.72,12.31,11.90.lc-ms,理论值(c36h63n2o5,[m+h]+)603.4659,发现[m+h]+:603.4738化合物c-70数据,1hnmr(400mhz,methanol-d4)4.36(td,j=7.7,4.6hz,1h),3.73(ddd,j=9.1,3.3,1.7hz,1h),3.47(ddd,j=16.5,9.4,4.8hz,3h),3.37(dd,j=10.6,6.5hz,1h),2.22(dt,j=12.8,7.6hz,1h),0.99(s,3h),0.96(d,j=2.6hz,3h),0.91(s,3h).13cnmr(101mhz,meod)δ167.87,158.47,74.38,71.28,67.08,65.26,57.37,54.35,49.73,48.39,48.28,48.07,47.92,47.86,47.64,47.43,47.22,47.00,42.65,42.36,40.49,40.40,36.00,35.83,35.52,35.46,35.11,34.34,34.06,33.42,30.75,30.35,30.02,29.41,28.15,26.92,26.28,25.40,24.74,22.79,20.32,18.90,15.81,13.10,12.74,12.37.lc-ms,理论值(c36h63n2o5,[m+h]+)603.4659,发现[m+h]+:603.4742实施例31化合物c-71合成将540mg化合物c-11在氮气保护下加入10ml乙酸酐和0.29g无水氯化锌。5小时后加入冰水搅拌过夜。用饱和碳酸氢钠洗涤、饱和食盐水洗涤,硅胶柱层析得到0.3g化合物c-71。lc-ms,理论值(c38h61n2o5,[m+h]+)为625.4502,发现[m+h]+:625.4584。实施例32化合物c-72合成将1g化合物c-11溶于干燥dcm中,在氮气保护下加入2.4ml三氟化硼乙醚和3.1ml乙酸酐。60分钟后加入冰水搅拌过夜。用饱和碳酸氢钠洗涤、饱和食盐水洗涤,硅胶柱层析得到0.1g化合物c-72。1hnmr(400mhz,chloroform-d)δ5.14(td,j=7.6,3.7hz,1h),4.13(dt,j=11.4,6.4hz,3h),4.05(d,j=9.6hz,1h),3.49(s,3h),3.38(t,j=10.5hz,1h),2.23(s,3h),2.08(s,2h),0.96–0.88(m,3h),0.74(s,2h).lc-ms,理论值(c38h61n2o5,[m+h]+)为625.4502,发现[m+h]+:625.4834实施例33化合物c-83~c-88的合成化合物c-83~c-88的合成的合成可以参展下面的合成路径进行合成得到。将底物(1mmol)溶解于30mldcm中,称取edci·hcl(2mmol),dmap(3mmol)于反应体系中,再取羧酸rcooh(2mmol)于反应体系中,室温搅拌过夜,加入dcm稀释反应液,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,硅胶柱层析,浓缩洗脱液得到中间体。中间体加入dcm溶解后,加入三氟乙酸(5eq)搅拌过夜,加入dcm和饱和碳酸钠溶液,分出有机层,饱和氯化钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到目标化合物。羧酸rcooh选自:实施例34化合物c-75、化合物c-91、化合物c-93-c-101、化合物c-105、化合物c-106的合成称取三光气(1mmol)溶解于60mldcm中,3α-氨基菝葜皂苷元(1mmol)溶解于30mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2mmol)溶解于30mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm60ml中,将有机胺衍生物(2mmol,ii)于30mldcm的溶液缓慢滴加入反应体系中,过夜反应。1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,浓缩洗脱液得到中间体1;中间体1加入dcm溶解后,加入三氟乙酸(5eq)搅拌过夜,加入dcm和饱和碳酸钠溶液,分出有机层,饱和氯化钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到中间体2;将中间体2(1mmol)溶解于30mldcm中,称取edci·hcl(2mmol),dmap(3mmol)于反应体系中,再取羧酸n,n-二甲基甘氨酸(2mmol)于反应体系中,室温搅拌过夜,加入dcm稀释反应液,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,硅胶柱层析,浓缩洗脱液得到目标化合物。有机胺选自实施例35化合物c-104、化合物c-107、化合物c-108的合成化合物c-104、c-107、c-108的合成的合成可以参展下面的合成路径进行合成得到。将底物(1mmol)溶解于30mldcm中,称取edci·hcl(2mmol),dmap(3mmol)于反应体系中,再取羧酸rcooh(2mmol)于反应体系中,室温搅拌过夜,加入dcm稀释反应液,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥,硅胶柱层析,浓缩洗脱液得到中间体。中间体加入dcm溶解后,加入三氟乙酸(5eq)搅拌过夜,加入dcm和饱和碳酸钠溶液,分出有机层,饱和氯化钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到目标化合物。羧酸rcooh选自:实施例36化合物c-113~c-114、c-130~c-132的合成称取三光气(1mmol)溶解于60mldcm中,底物(1mmol)溶解于30mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2mmol)溶解于30mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm60ml中,将有机胺rnh2(2mmol)于30mldcm的溶液缓慢滴加入反应体系中,过夜反应。1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥硅胶柱层析,浓缩洗脱液得到中间体。中间体加入dcm溶解后,加入三氟乙酸(5eq)搅拌过夜,加入dcm和饱和碳酸钠溶液,分出有机层,饱和氯化钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到目标化合物。rnh2选自实施例37化合物c-133~c-143的合成称取三光气(1mmol)溶解于60mldcm中,3α-氨基菝葜皂苷元(1mmol)溶解于30mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2mmol)溶解于30mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm60ml中,将有机胺衍生物(2mmol,ii)于30mldcm的溶液缓慢滴加入反应体系中,过夜反应。1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,浓缩洗脱液得到中间体1;中间体1加入dcm溶解后,加入三氟乙酸(5eq)搅拌过夜,加入dcm和饱和碳酸钠溶液,分出有机层,饱和氯化钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到中间体2;称取中间体2(1eq),dcm溶解,加入n,n'-羰基二咪唑(cdi,1eq)以及三乙胺(2eq),室温搅拌0.5h,加入n,n-二甲基乙二胺(2eq),室温搅拌过夜。饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,浓缩洗脱液得到目标化合物。有机胺选自实施例38化合物c-144~c-154的合成称取三光气(1mmol)溶解于60mldcm中,3α-氨基菝葜皂苷元(1mmol)溶解于30mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2mmol)溶解于30mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm60ml中,将有机胺衍生物(2mmol,ii)于30mldcm的溶液缓慢滴加入反应体系中,过夜反应。1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,浓缩洗脱液得到中间体1;中间体1加入dcm溶解后,加入三氟乙酸(5eq)搅拌过夜,加入dcm和饱和碳酸钠溶液,分出有机层,饱和氯化钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到中间体2;称取中间体2(1eq),dcm溶解,加入n,n'-羰基二咪唑(cdi,1eq)以及三乙胺(2eq),室温搅拌0.5h,加入n-boc-1,2-乙二胺(2eq),室温搅拌过夜。饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,浓缩洗脱液得到中间体3;中间体3加入dcm溶解后,加入三氟乙酸(5eq)搅拌过夜,加入dcm和饱和碳酸钠溶液,分出有机层,饱和氯化钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,得到目标化合物。有机胺选自实施例39化合物c-73~c-75、化合物c-91、化合物c-93-c-101、化合物c-105、化合物c-106、化合物c-133~c-143的合成称取三光气(1mmol)溶解于60mldcm中,3α-氨基菝葜皂苷元(1mmol)溶解于30mldcm中,然后缓慢滴加入到反应体系中,三乙胺(2.2mmol)溶解于30mldcm,然后缓慢滴加入反应体系中,减压旋尽溶剂,将残留物溶于dcm60ml中,将有机胺衍生物(2mmol,ii)于30mldcm的溶液缓慢滴加入反应体系中,过夜反应。1m盐酸洗涤,饱和碳酸氢钠洗涤,饱和氯化钠洗涤,无水硫酸钠干燥。硅胶柱层析分离,浓缩洗脱液得到目标化合物。nhr2r3选自下列的胺:本发明其他化合物可以参照以上合成路径进行合成。药理实施例知母药材中含有大量的皂苷类化合物,与本发明化合物结构相关的主要是螺甾烷型皂苷及知母皂苷元(即菝葜皂苷元),如知母皂苷a1、知母皂苷a3等。这些皂苷类化合物的结构特征是3位取代基为糖基,比如知母皂苷a1是3位单糖取代皂苷;知母皂苷a3是3位双糖取代皂苷。而本发明的化合物,其结构特征在于,在3位上采用化学合成手段,连接其他类型取代基。动物强迫游泳试验(fst)和悬尾试验(tst)为两种经典的抗抑郁药效筛选模型。本发明的化合物主要采用这两种模型来进行抗抑郁活性的筛选。下文表中或者图中出现的一些代号的解释如下所示:flx表示氟西汀,fluoxetine表示氟西汀,化合物知母皂苷a1、知母皂苷a3、菝葜皂苷元的化学结构如下所示:实施例40强迫游泳试验(fst)考察本发明部分化合物及部分天然产物的抗抑郁活性实验选用雄性icr小鼠,体重(20±2)g,购自中科院上海药物所实验动物中心,自由摄食饮水,室温(23±2)℃,自然光照。所有小鼠随机分组分为空白对照组和试验组,每组10只,5只/笼,于饲养环境中适应3天后开始实验,实验前禁食12小时,饮水自由。具体给药方法为灌胃给药,给药组的给药剂量都是10mg/kg,空白对照组给予等体积的0.5%cmc-na。具体操作:连续给药6天,末次给药后1小时进行测试。首先利用开野法测定小鼠的自主活动,即将小鼠单独置于圆柱型玻璃缸内,计时4分钟,记录后2分钟内的抬臂次数。然后将小鼠单独放入高20厘米、直径14厘米的圆柱型玻璃缸中,缸内水深10厘米,水温23℃-25℃。从小鼠入水后计时6分钟,记录后4分钟内的累计不动时间(判定不动标准:小鼠在水中停止挣扎,或呈漂浮状态,仅有细小的肢体运动以保持头部浮在水面)。各组小鼠平行操作。实验数据处理:实验结果以均值±标准误差(x±sd)表示。采用t检验进行统计分析,判断是否具有显著性意义。首先对其自主活动指标进行t检验,其p﹥0.05说明小鼠的自主后动没有影响,以避免中枢兴奋药的干扰。然后对强迫游泳实验指标进行t检验,判断是否具有抗抑郁作用。实验相关结果如表5、表6、表7、表8和表9所示。表5本发明部分化合物及部分天然产物对icr小鼠强迫游泳不动时间的影响“*”表示p<0.05;“**”表示p<0.01。3-环己基脲基菝葜皂苷元(即实施例20的产物)、化合物c-11、化合物c-12的实验结果如表5所示,并且与天然产物知母皂苷a1、知母皂苷a3、菝葜皂苷元进行了比较。结果表明,与空白组比较,自然界存在的化合物知母皂苷a1、知母皂苷a3、菝葜皂苷元,在小鼠强迫游泳模型上,不能显著降低小鼠强迫游泳不动时间,统计学无显著性差异。3-环己基脲基菝葜皂苷元(实施例20)、化合物c-11、化合物c-12均可显著减少小鼠强迫游泳实验不动时间。其中,3-环己基脲基菝葜皂苷元(实施例20)和化合物c-12具有显著的抗抑郁活性(p<0.05);化合物c-11具有极显著的抗抑郁活性(p<0.01)。表6化合物c-13对icr小鼠强迫游泳不动时间的影响组别tst累计不动时间(mean±sd,s)空白对照组154.7±18.8化合物c-13131.1±28.1*化合物c-13的实验结果如表6所示,与空白组比较,化合物c-13可显著减少小鼠强迫游泳实验不动时间,具有显著的抗抑郁活性(p<0.05)。表7化合物c-23对icr小鼠强迫游泳不动时间的影响组别tst累计不动时间(mean±sd,s)空白对照组118.4±37.3化合物c-2394.7±29.8(p=0.062)化合物c-23的实验结果如表7所示,与空白组比较,化合物c-23可减少小鼠强迫游泳实验不动时间,具有一定的抗抑郁活性。表8化合物c-49对icr小鼠强迫游泳不动时间的影响组别tst累计不动时间(mean±sd,s)空白对照组134.3±25.3氟西汀阳性对照100.7±24.1*菝葜皂苷元127.0±44.4化合物c-49110.8±20.5*“*”表示p<0.05;“**”表示p<0.01。化合物c-49的实验结果如表8所示,结果表明,与空白组比较,菝葜皂苷元,在小鼠强迫游泳模型上,不能显著降低小鼠强迫游泳不动时间,统计学无显著性差异;而化合物c-49可显著减少小鼠强迫游泳实验不动时间(p<0.05),统计学有显著性差异。表9化合物c-58、c-72对icr小鼠强迫游泳不动时间的影响与空白组比较,化合物c-58可显著减少小鼠累计不动时间(p<0.05),显示出显著的抗抑郁活性;化合物c-72可明显减少小鼠累计不动时间(p=0.06),显示出一定的抗抑郁活性。实施例41悬尾试验(tst)考察本发明部分化合物及部分天然产物的抗抑郁活性实验选用雄性icr小鼠,体重(20±2)g,购自中科院上海药物所实验动物中心,自由摄食饮水,室温(23±2)℃,自然光照。所有小鼠随机分组分为空白对照组和试验组,每组10只,5只/笼,于饲养环境中适应3天后开始实验,实验前禁食12小时,饮水自由。具体给药方法为灌胃给药,空白对照组一组给予等体积的0.5%cmc-na,给药剂量都是10mg/kg。具体操作:连续给药6天,末次给药后1小时进行测试。首先利用开野法测定小鼠的自主活动,即将小鼠单独置于圆柱型玻璃缸内,计时4分钟,记录后2分钟内的抬臂次数。然后用胶带将小鼠尾在距尾尖2厘米处粘在横杠上,四周以板隔离动物视线,横杠距地面约25厘米,使小鼠距地面约10厘米,计时6min,记录后4分钟内累计不动时间,各组小鼠平行操作。实验数据处理:实验结果以均值±标准误差(x±sd)表示。采用t检验进行统计分析,判断是否具有显著性意义。首先对其自主活动指标进行t检验,其p﹥0.05说明小鼠的自主后动没有影响,以避免中枢兴奋药的干扰。然后对悬尾实验指标进行t检验,判断是否具有抗抑郁作用。实验相关结果如表10-15所示。3-环己基脲基菝葜皂苷元(实施例20)、化合物c-11、化合物c-12的实验结果如表10所示,并且与天然产物知母皂苷a1、知母皂苷a3、菝葜皂苷元进行了比较:表10本发明部分化合物及部分天然产物对icr小鼠悬尾不动时间的影响“*”表示p<0.05;“**”表示p<0.01。结果表明,与空白组比较,自然界存在的化合物知母皂苷a1、菝葜皂苷元,在小鼠悬尾模型上,不能显著降低小鼠悬尾不动时间,统计学上无显著性差异。知母皂苷a3、3-环己基脲基菝葜皂苷元(实施例20)、化合物c-11、化合物c-12均可显著减少小鼠悬尾实验不动时间。其中,知母皂苷a3、3-环己基脲基菝葜皂苷元(实施例20)和化合物c-12具有显著的抗抑郁活性(p<0.05);化合物c-11具有极显著的抗抑郁活性(p<0.01)。表11化合物c-7对icr小鼠悬尾不动时间的影响组别tst累计不动时间(mean±sd,s)空白对照组91.2±38.5化合物c-754.7±44.9(p=0.067)化合物c-7的实验结果如表11所示,与空白组比较,化合物c-7可减少小鼠悬尾实验不动时间,具有一定的抗抑郁活性。表12化合物c-5、化合物c-20对icr小鼠悬尾不动时间的影响组别tst累计不动时间(mean±sd,s)空白对照组104.7±24.3化合物c-581.1±26.2(p=0.051)化合物c-2079.6±29.5(p=0.053)化合物c-5、化合物c-20的实验结果如表11所示,与空白组比较,化合物c-5、化合物c-20可减少小鼠悬尾实验不动时间,具有一定的抗抑郁活性。表13化合物c-19对icr小鼠悬尾不动时间的影响组别tst累计不动时间(mean±sd,s)空白对照组105.3±34.8化合物c-1974.1±30.6(p=0.079)化合物c-19的实验结果如表13所示,与空白组比较,化合物c-19可减少小鼠悬尾实验不动时间,具有一定的抗抑郁活性。表14本发明部分化合物对icr小鼠悬尾不动时间的影响组别tst累计不动时间(mean±sd,s)空白对照组126.2±21.8氟西汀89.5±28.9*菝葜皂苷元116.6±29.4化合物c-3581.3±47.7*化合物c-42116.9±43.3化合物c-46118.0±28.4化合物c-4982.4±43.6*“*”表示p<0.05;“**”表示p<0.01。化合物c-49等的实验结果如表14所示。结果表明,与空白组比较,菝葜皂苷元,在小鼠悬尾模型上,不能显著降低小鼠强迫游泳不动时间,统计学无显著性差异;而化合物c-35以及化合物c-49在小鼠悬尾模型上可显著减少小鼠悬尾实验不动时间(p<0.05),统计学有显著性差异。表15本发明化合物c-58、c-72小鼠悬尾不动时间的影响“*”表示p<0.05;“**”表示p<0.01。与空白组比较,化合物c-72可显著减少小鼠累计不动时间(p<0.05),显示出显著的抗抑郁活性;化合物c-58可明显减少小鼠累计不动时间(p=0.07),显示出一定的抗抑郁活性。本发明部分化合物与部分天然产物的抗抑郁比较试验结果表明,自然界中存在的螺甾烷型知母皂苷类化合物知母皂苷a1、菝葜皂苷元在两种动物模型上都没有抗抑郁效果;知母皂苷a3仅在悬尾模型有效,但是在强迫游泳模型上没有效果,可见天然产物知母皂苷a3的抗抑郁药效不强,而且知母皂苷a3具有明显毒性(actapharmacologicasinica2014;35(9):1188-1198.)。在与上述天然产物比较的同批动物药效筛选中,本发明化合物在两种动物模型上都显示了显著的抗抑郁活性。在强迫游泳模型中,本发明中的化合物c-12、3-环己基脲基菝葜皂苷元(实施例20)都显示出显著的抗抑郁活性(p<0.05),化合物c-11具有极显著的抗抑郁活性(p<0.01)。在悬尾模型中,本发明中化合物c-12、3-环己基脲基菝葜皂苷元(实施例20)都显示出显著的抗抑郁活性(p<0.05),化合物c-11具有极显著的抗抑郁活性(p<0.01)。本发明化合物c-11、12以及3-环己基脲基菝葜皂苷元(实施例20)未发现明显毒性。在其他批次动物抗抑郁药效筛选中,本发明化合物c-13、化合物c-23、化合物c-5、化合物c-7、化合物c-19、化合物c-20也都具有显著或者一定的抗抑郁活性。与空白组对比,在强迫游泳模型中,本发明中的化合物c-49显示出显著的抗抑郁活性(p<0.05)。在悬尾模型中,本发明中化合物c-35与化合物c-49都显示出显著的抗抑郁活性(p<0.05)。而且化合物c-49在两种动物模型上都显示出显著的抗抑郁活性。实施例42化合物c-11与氟西汀在小鼠模型抗抑郁活性比较强迫游泳试验在给药前24小时,小鼠放入圆柱型缸内适应水中环境15min。行为测试当天,动物给药两次,分别在行为测试前4h和1h口服给药。将小鼠单独置于圆柱型玻璃缸内,计时6分钟,记录后2分钟内的抬臂次数。然后将小鼠单独放入高30厘米、直径20厘米的圆柱型玻璃缸中,缸内水深为15厘米(大鼠水深20厘米),使动物既不能逃出玻璃缸,其脚和尾部又不接触到缸底,水温23℃-25℃。拍摄小鼠入水后的6分钟视频,由于大多数动物在开始两分钟十分活跃,因此计算后4分钟不动时间(判定不动标准:小鼠在水中停止挣扎,不动和为保持平衡或呈漂浮状态的细小的肢体运动)。各组小鼠平行操作。悬尾实验行为测试当天,动物给药两次,分别在行为测试前4h和1h口服给药。实验时将小鼠尾部距末端约1cm处用胶带或夹子,倒吊于距地面15cm左右的悬尾试验架上,小鼠为克服不正常体位而挣扎活动,但活动一段时间后,出现间断性不动,显示失望状态,各组实验时间为6分钟。由于前两分钟小鼠大多因兴奋而挣扎频繁,统计其后4分钟不动时间。实验结果表明,小鼠游泳实验以及小鼠悬尾实验,化合物c-11可显著减少小鼠强迫游泳试验累计不动时间(p<0.05),以及可显著减少小鼠悬尾不动时间(p<0.05),显示出抗抑郁活性。而且化合物c-11的起效剂量明显低于阳性药氟西汀,化合物c-11的起效剂量仅为氟西汀的一半。小鼠游泳试验结果如图1所示。与空白组比较,化合物c-11可显著减少小鼠强迫游泳试验累计不动时间(p<0.05),显示出抗抑郁活性。而且,化合物c-11起效剂量明显低于阳性药氟西汀,起效剂量仅为氟西汀的一半。小鼠悬尾试验结果如图2所示:与空白组比较,化合物c-11可显著减少小鼠悬尾试验累计不动时间(p<0.05),显示出抗抑郁活性。而且,化合物c-11起效剂量明显低于阳性药氟西汀,起效剂量仅为氟西汀的一半。实施例43化合物c-11与氟西汀在大鼠模型抗抑郁活性比较强迫游泳试验实验操作:在给药前24小时,大鼠放入圆柱型缸内适应水中环境15min。行为测试当天,动物给药两次,分别在行为测试前4h和1h口服给药。将大鼠单独置于圆柱型玻璃缸内,计时6分钟,记录后2分钟内的抬臂次数。然后将大鼠单独放入高30厘米、直径20厘米的圆柱型玻璃缸中,缸内水深为20厘米,使动物既不能逃出玻璃缸,其脚和尾部又不接触到缸底,水温23℃-25℃。拍摄大鼠入水后的6分钟视频,由于大多数动物在开始两分钟十分活跃,因此计算后4分钟不动时间(判定不动标准:把大鼠在水中的状态分为静止(immobility)、游泳(swimming)和爬壁(climbing)三种状态,统计这三种状态的等分数,每隔5秒计一次,一共5分钟,合计60次)。悬尾实验实验操作:行为测试当天,动物给药两次,分别在行为测试前4h和1h口服给药。实验时将大鼠尾部距末端约1cm处用胶带或夹子,倒吊于距地面15cm左右的悬尾试验架上,大鼠为克服不正常体位而挣扎活动,但活动一段时间后,出现间断性不动,显示失望状态,各组实验时间为6分钟。由于前两分钟大鼠大多因兴奋而挣扎频繁,统计其后4分钟不动时间。实验结果表明,大鼠游泳实验以及大鼠悬尾实验,化合物c-11可显著减少大鼠强迫游泳试验累计不动时间(p<0.05),以及显著减少大鼠悬尾不动时间(p<0.05),显示出抗抑郁活性。而且,在大鼠模型上,化合物c-11的起效剂量明显低于阳性药氟西汀。大鼠游泳试验结果如图3所示。在大鼠的强迫游泳实验中,化合物c-11的抗抑郁活性得到进一步的验证,而且化合物c-11的起效剂量明显低于阳性药氟西汀:氟西汀在给药剂量为6.92mg/kg才可以显著影响大鼠的不动时间和爬壁行为,而1.73mg/kg和3.46mg/kg剂量对这两种抑郁样行为均无影响;与之相比,c-11剂量明显减小,1.73mg/kg和3.46mg/kg剂量均可以显著减少大鼠强迫游泳的不动时间,3.46mg/kg的口服剂量显著增加爬壁时间(*p<0.05,**p<0.01与vehicle组比较)。大鼠悬试验结果如图4所示。在大鼠的悬尾实验中,化合物c-11的抗抑郁活性也得到了进一步的验证,而且,化合物c-11的起效剂量明显低于阳性药氟西汀:氟西汀在给药剂量为6.92mg/kg才可以显著影响大鼠悬尾试验累计不动时间,而1.73mg/kg和3.46mg/kg剂量对这两种抑郁样行为均无影响;与之相比,c-11剂量减小,3.46mg/kg剂量可以显著减少大鼠悬尾试验累计不动时间(*p<0.05,**p<0.01与vehicle组比较)。实施例44社交失败抑郁动物模型(socialdefeatedstress,sds)考察本发明化合物的抗抑郁活性试验结果表明,化合物c-11在这个模型上,皆显示优于氟西汀的抗抑郁活性。具体实验操作如下:采用4-6个月已过育龄的雄性cd-1单独饲养,让其自由饮食并适应环境一周左右。8-20周不同周龄雄性c57用来筛选具有攻击性的cd-1小鼠,将c57筛选小鼠直接放在cd-1的笼子内,与其接触3分钟,并记录cd-1开始表现出进攻性的潜伏期,随后移出c57筛选小鼠。对每一只cd-1小鼠,一天中用同一只c57筛选小鼠重复三次实验,每天选取不同的c57筛选小鼠,共进行三天的筛选。根据每只cd-1表现出进攻性的潜伏期来选择具有进攻性的小鼠:在一天中每次3分钟的三次接触环节内,cd-1小鼠必须至少在两个连续环节内表现出攻击行为,并且在每一次的3分钟接触时间内,其表现出进攻性的潜伏期必须小于1分钟。在筛选出用于造模的cd-1侵略性小鼠后,每只c57测试小鼠每天暴露于不同的cd-1侵略性小鼠10分钟,连续进行10天。在短暂的暴露中,所有的测试小鼠都表现出具有压力和依顺性的特征,包括发声、逃避反应以及顺从性姿势。在10分钟的接触后,测试小鼠与侵略者分离。测试小鼠与侵略性小鼠被安排在同一个鼠笼内的相邻部分,中间用一个多孔的透明塑料挡板隔开,使得测试小鼠在接下来的24小时暴露于威胁性的慢性压力刺激。对照组小鼠则被安排在同样结构的鼠笼内,但挡板另一边放置每天更换的同种系的其它小鼠。在最后一天实验结束后的24小时之后,根据之前相关报道,我们评估csds诱导的社交行为学改变并挑选出所有的易感型小鼠。社交互动比例(socialinteractionratio,siratio)按照以下公式计算:siratio=侵略者存在时在互动区域的时间/侵略者缺席时在互动区域的时间。如果siratio小于1,说明测试小鼠在侵略者存在时在互动区域的时间比侵略者缺席时少,被用作鉴别易感型小鼠的判断标准和阈值。随后所有被挑选出的测试小鼠以及对照组小鼠单独饲养3周,在此期间,易感型小鼠被随机分成三组:defeat抑郁模型组每天灌胃给予0.5%cmc-na,c-11给药组每天灌胃给予10mg/kgc-11,flx给药组每天腹腔注射给予10mg/kgfluoxetine。vehicle组小鼠每天灌胃给予0.5%cmc-na。siratio每周评估一次。所有数据分析采用spss22(formac)数据处理软件完成。使用双因素方差分析(two-wayanova),采用lsd法多重比较校验结果。数据用mean±sem表示。p<0.05时标记一个星号;p<0.01时标记两个星号。试验结果如图5所示。a图示社交失败抑郁小鼠模型的药效评估,计算小鼠社交时间。结果显示c-11在给药的第二周就可以显著提高小鼠的社交时间,而氟西汀在给药的第三周仍未起效。b图示小鼠的社交比例,该值越大表示动物的社交行为越好。结果进一步提示c-11在给药的第一周就可有效的提高小鼠的社交活动,而氟西汀给药三周仍未起效。c图示旷场实验结果,各组间动物的移动距离均无明显变化,提示各组动物的运动能力无差异,不会对社交行为造成影响。这些结果提示口服化合物c-11的1-2周可有效缓解抑郁症状,且药物起效时间明显比氟西汀快。实施例45化合物c-49生物利用度考察具体实验步骤如下:健康雄性sd大鼠,体重270g左右,给药前禁食10h,自由饮水。灌胃c-49(cmc-na溶剂混悬),剂量为100mg/kg大鼠体重,眼眶取血的时间点为给药后眼眶取血的时间点为30min,1h,2h,4h,6h,8h,10h,24h,48h(n=5)。尾静脉注射c-49(10%乙醇/15%吐温80/75%生理盐水配制成溶液),剂量为1mg/kg大鼠体重,眼眶取血的时间点为5min,10min,30min,1h,2h,4h,8h(n=4)。将血浆置于涂有肝素的离心试管中,离心10min(8000r)后取上清液。置于-80℃冰箱中保存。经过乙腈沉淀处理后,进hplc-qqq进行检测。药动学参数通过winnonlin(pharsight6.2,nc,usa)的非房室模型进行计算每只老鼠的pk参数。所有的参数用mean±s.d.表示。生物利用度(f)=(auc口服/dose口服)/(auc尾静脉/dose尾静脉)药时曲线如图6所示,药动参数如下表16所示。表16大鼠口服、尾静脉注射c-49的药代动力学参数由实验可知,大鼠口服c-49(100mg/kg),血药浓度较高,cmax和auc分别为250.8ng/ml和3115.3h*ng/ml,t1/2和mrt分别为9.7和13.6h。大鼠尾静脉注射c-49(1mg/kg)后,血药浓度比较低,cmax和auc分别为284.7ng/ml和293.0h*ng/ml,t1/2和mrt分别为9.7和13.6h。通过比较大鼠口服和尾静脉注射的c-49的auc/does,计算出c-49的生物利用度为11.1%。自然界中,螺甾烷型知母皂苷及其苷元的抗抑郁活性较弱,而且生物利用度也比较低。经过对菝葜皂苷元进行结构修饰,本申请得到的化合物c-11、c-49等,相对于先导化合物菝葜皂苷元,具有更好的抗抑郁活性。而且,化合物c-49的生物利用度为11.1%,也有了较大幅度的提高。实施例46化合物c-49对小鼠学习记忆促进作用的药效学筛选研究学习记忆是人类和动物大脑的高级功能。在本次筛选试验中,通过比较给药小鼠及记忆障碍小鼠的被动回避行为则可初步评估候选药物是否具有促学习记忆作用。在本次实验中,选用乙醇诱导小鼠的记忆再现障碍,对候选药物c-49的促进学习记忆作用进行了初步探索。其实验原理为:乙醇具有中枢抑制作用,可抑制大脑皮层的神经功能活动,明显干扰记忆的再现。训练后重测前,给予小鼠乙醇溶液,可阻断动物的记忆再现过程,造成记忆再现障碍。实验选用雄性icr小鼠,16-18g,购自上海西普尔-毕凯实验动物有限公司。动物喂养:动物均喂以标准灭菌鼠饲料,动物饮用水采用饮水瓶供应,动物自由饮水。动物饲养:每笼饲养动物10只。动物设定室温20℃~22℃,湿度40%~70%,光照12小时明暗交替。垫料每周至少更换2次,同时更换饲养盒,遇有异常情况时随时更换饲养盒。每天更换消毒饮水瓶和瓶塞,每两周消毒1次笼架。所有换洗的笼具清洗后均采用高压灭菌。40只雄性小鼠由excel完全随机分组法分为4组,每组10只动物。第1组小鼠(空白组)、第2组小鼠(模型组)每天经口灌胃(i.g.)给予饮用水,第3组小鼠(阳性药组)i.g.给予多奈哌齐1.6mg/kg,第4组小鼠分别按相应c-49药液灌胃给药,给药剂量15mg/kg。每日1次,0.2ml/10g体重/次,连续给药3周。给药满3周后,末次给药后1h,以避暗法训练一次。将小鼠放入避暗箱内,背朝洞口放入明室,同时启动视频分析装置,动物穿过洞口进入暗室受到电击,计时自动停止。取出小鼠,视屏分析将记录每鼠从放入明室至进入暗室遇到电击所需的时间,此即潜伏期。24h后进行测试,测试前30min经口灌胃给予45%的乙醇溶液(0.1ml/10g),视频分析系统将摄制并自动记录动物所有相关数据。数据以平均值±标准差表示,数据差异统计采用单因素方差分(anova)或x2检验,组间差异以p<0.05判断。实验结果表明,经口灌胃给予15mg/kg的c-49,给药后未观察到小鼠有异常状态出现。期间每周称体重并记录。给药期21d内,所有动物体重增长未见异常。动物体重的增长情况见(图7)。候选药物c-49灌胃连续三周对乙醇造成的记忆再现障碍小鼠的实验结果如表17所示。表17.c-49连续i.g.给药3周对乙醇所致小鼠记忆再现障碍的影响(n=10)**p<0.01;*p<0.05,与模型组相比表17实验结果表明,训练后24h,给予小鼠45%乙醇可致明显记忆再现障碍(与空白组比较,均出现统计学显著差异),证明造模成功。与模型组小鼠比较,1.6mg/kg多奈哌齐和15mg/kg剂量c-49连续给药三周,可显著延长小鼠进入暗室的潜伏期,并降低5min内小鼠受电击总次数,同时显著减少受电击的动物数(p<0.01或0.05)。实验表明c-49(15mg/kg)对乙醇诱导的记忆再现障碍小鼠有显著促学习记忆作用。同时,在该剂量下连续三周给药对小鼠未出现明显的毒性作用。针对乙醇诱导的动物记忆障碍模型,c-49在实验中表现良好的安全性及显著的药效作用。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1