一种苯氧羧酸类除草剂的制备方法与流程
本发明涉及有机合成技术领域,尤其是涉及一种苯氧羧酸类除草剂的制备方法。
背景技术
苯氧羧酸类除草剂是一类重要除草剂,由于其除草速度较快、除草谱较宽等优点,在农业上应用广泛。
目前,苯氧羧酸类除草剂的制备方法主要有以下两个步骤:(1)以酚为主要原料,经氯化制得氯代酚;(2)氯代酚在碱性条件下与氯代羧酸进行缩合反应,所得反应液经过酸化、过滤,得到苯氧羧酸类除草剂湿料,烘干后得苯氧羧酸类除草剂。
上述方法中,第(1)步产出的氯代酚具有极难闻的刺激性气味,导致生产现场环境极差,而且氯化选择性较差。而第(2)步中,氯代酚中的二氯酚或多氯酚会发生两分子间的缩合,从而产生极难降解的剧毒性物质-二噁英,不仅会产生大量含有氯代酚、氯代苯氧羧酸的废水和危废,而且产出的苯氧羧酸类除草剂产品中也含有二噁英,这给环境和生产人员的健康带来了极大的风险,产品品质差。此外,二噁英还会随着苯氧羧酸类除草剂及其衍生产品的使用进入植物体、空气、土壤和水源,并随着食物链富集,进而造成更加严重的环境和健康危害。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种苯氧羧酸类除草剂的制备方法,该方法能改善产品品质和生产现场的操作环境。
本发明提供了一种苯氧羧酸类除草剂的制备方法,包括以下步骤:
s1、酚类化合物和羟基羧酸酯,在催化剂的作用下进行缩合反应,得到苯氧羧酸酯;
所述催化剂为质子酸、固体酸和负载型催化剂中的一种或多种;
s2、将所述苯氧羧酸酯在第一催化剂和第二催化剂存在的条件下,与氯化剂进行2位和/或4位的选择性氯化反应,得到氯代苯氧羧酸酯;所述第一催化剂选自路易斯酸,所述第二催化剂选自碳原子数为5~22的硫醚类化合物、碳原子数为5~22的噻唑类化合物、碳原子数为5~22的异噻唑类化合物或碳原子数为5~22的噻吩类化合物;
s3、将所述氯代苯氧羧酸酯进行酸解反应,得到苯氧羧酸类除草剂。
优选的,所述酚类化合物为苯酚,卤代苯酚,或烷基取代苯酚。
优选的,所述酚类化合物为苯酚、2-氯苯酚或2-甲基苯酚。
优选的,所述羟基羧酸酯分子式为hor1coor,其中,r为c1~c10的烷基或碳原子数为3~10的环烷基;r1为c1~c5的亚烷基或次烷基。
优选的,所述质子酸为盐酸、硫酸、磷酸,次磷酸和对甲苯磺酸中的一种或多种;
所述固体酸为y型分子筛和mcm型分子筛中的一种或多种。
所述负载型催化剂的载体包括al2o3、硅胶、活性炭、天然陶土、分子筛和硅藻土中的一种或多种;所述负载型催化剂的有效成分包括v、p、si、mo、zr和ti中的一种或多种。
优选的,所述负载型催化剂的载体为分子筛,有效成分为monpm,其中,n为1~5的整数,m为1~5的整数。
优选的,所述催化剂为monpm-mcm-48、monpm--hzsm-5;所述monpm-mcm-48中,monpm和mcm-48的质量比为(10~30):100;所述monpm--hzsm-5中,monpm和hzsm-5的质量比为(10~30):100。
优选的,所述步骤s1中,所述催化剂的用量为酚类化合物和羟基羧酸酯总量的10wt%~50wt%。
优选的,所述步骤s1中,所述反应的温度为80~150℃,所述反应的时间为1~5h。
优选的,所述步骤s2中,所述氯化剂为氯气、亚硫酰氯或硫酰氯。
优选的,所述步骤s2中,所述第一催化剂的用量为苯氧羧酸酯重量的0.05%~1.0%,所述第二催化剂的用量为苯氧羧酸酯重量的0.05%~1.0%。
优选的,所述步骤s2中,所述选择性氯化反应的温度为-20~100℃。
本发明使用酚与羟基羧酸酯合成苯氧羧酸酯,然后选择性氯化合成氯代苯氧羧酸酯,最后酸解合成苯氧羧酸类除草剂。与现有合成技术相比,本发明有效的避免了具有难闻气味的氯代酚的生产和使用,从根本上杜绝了剧毒的二噁英的产生,极大的改善了产品品质和生产现场的操作环境,同时杜绝了氯化钠的产出,极大幅度地降低的废水的产出量。实验结果表明,所得苯氧羧酸类除草剂产品含量≥98.5%,总收率≥96%。本发明以酚和羟基羧酸酯为原料,经缩合、选择性氯化和酸解,得到了高品质的苯氧羧酸类除草剂,本发明的方法有效地避免了有效成分的损失,提高了产品的收率。
此外,本发明通过对工艺路线的创新,有效杜绝了高cod、高盐废水的产生,同时不再产出废盐(金属氯化物),三废产出有了极大幅度的降低,三废处理成本大幅下降。
附图说明
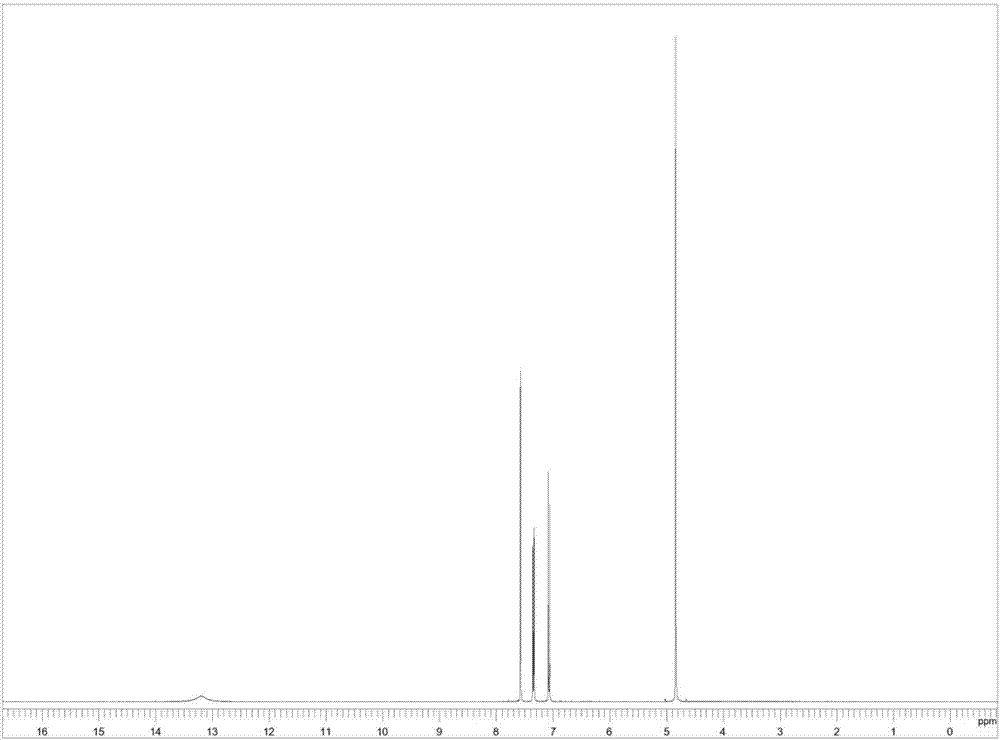
图1为本发明实施例1所得2,4-二氯苯氧乙酸的核磁共振氢谱图。
具体实施方式
本发明提供了一种苯氧羧酸类除草剂的制备方法,包括以下步骤:
s1、酚类化合物和羟基羧酸酯,在催化剂的作用下进行缩合反应,得到苯氧羧酸酯;
所述催化剂为质子酸、固体酸和负载型催化剂中的一种或多种;
s2、将所述苯氧羧酸酯在第一催化剂和第二催化剂存在的条件下,与氯化剂进行2位和/或4位的选择性氯化反应,得到氯代苯氧羧酸酯;所述第一催化剂选自路易斯酸,所述第二催化剂选自碳原子数为5~22的硫醚类化合物、碳原子数为5~22的噻唑类化合物、碳原子数为5~22的异噻唑类化合物或碳原子数为5~22的噻吩类化合物;
s3、将所述氯代苯氧羧酸酯进行酸解反应,得到苯氧羧酸类除草剂。
本发明提供的苯氧羧酸类除草剂的制备方法能改善生产现场的操作环境,并且具有产品品质好、收率高、三废少等优点。
本发明以酚类化合物和羟基羧酸酯为原料,在特定催化剂的作用下,酚类化合物的酚羟基和羟基羧酸酯的羟基基团进行缩合反应,制备得到苯氧羧酸酯。
在本发明一些具体实施例中,所述酚类化合物为苯酚,卤代苯酚,或烷基取代苯酚。
在本发明的某些具体实施例中,所述酚类化合物为苯酚,邻氯苯酚、间氯苯酚、对氯苯酚、邻甲苯酚、对甲苯酚或间甲苯酚。
所述羟基羧酸酯分子式为hor1coor,其中,r为c1~c10的烷基或碳原子数为3~10的环烷基;优选为c1~c5的烷基或c3~c6的环烷基;在本发明的某些具体实施例中,r具体为甲基、乙基、丙基、异丙基或正丁基。
r1为c1~c5的亚烷基或次烷基,优选为c1~c3的亚烷基或次烷基。在本发明的一些具体实施例中,r1为亚甲基、亚乙基或亚丙基。
以苯酚和羟基乙酸甲酯为例,上述反应的方程式如下:
本发明对所述酚类化合物和羟基羧酸酯的比例并无特殊限定,一般计量比即可。
优选的,所述酚类化合物与羟基羧酸酯的摩尔比为1:1,为了提高酚的转化率可以适当提高羟基羧酸酯的摩尔比例,若为了提高羟基羧酸酯的转化率也可以适当提高酚类化合物的摩尔比例,本领域技术人员可以根据需要适当调整二者的比例,本发明对此并无特殊限定。
上述缩合反应的催化剂为质子酸、固体酸和负载型催化剂中的一种或多种。
其中,所述质子酸优选为盐酸、硫酸、磷酸,次磷酸和对甲苯磺酸中的一种或多种。
所述固体酸优选为y型分子筛和mcm型分子筛中的一种或多种。所述y型分子筛的型号优选包括-zsm-5、5a、3a、10x和13x中的一种或多种;所述mcm型分子筛的型号优选包括mcm-22、mcm-48和mcm-41中的一种或多种。
所述负载型催化剂的载体优选包括al2o3、硅胶、活性炭、天然陶土、分子筛和硅藻土中的一种或多种,更优选为分子筛;所述负载型催化剂的有效成分优选包括v、p、si、mo、zr和ti中的一种或多种;更优选为monpm,其中,n为1~5的任意整数;m为1~5的任意整数。
在本发明的某些具体实施例中,所述催化剂优选为monpm-mcm-48、monpm--hzsm-5;m、n的范围同上。上述催化剂中,活性组分:载体的质量比优选为(10~30):100,在本发明的某些具体实施例中,更优选的质量比为25:100。
上述筛选出的催化剂组合物,催化活性更强,能使反应收率更高,产物纯度更高。
所述催化剂用量优选为酚类化合物和羟基羧酸酯总量的10wt%~50wt%,更优选为20wt%~30wt%。
所述反应的温度优选为80~150℃,更优选100~120℃,在本发明的某些具体实施例中,所述反应的温度为80-100℃,100~120℃,120-150℃或130-140℃;所述反应的时间优选为1~5h,更优选2~4h。
优选的,所述制备方法具体为:
在催化剂作用下,酚类化合物和羟基羧酸酯反应,经精馏脱水,油相蒸馏回收催化剂后得到产品苯氧羧酸酯。
若催化剂为固体,过滤除去催化剂即可。
所述苯氧羧酸酯具有式i所示结构:
其中,r和r1的范围同上,在此不再赘述。
r3优选为h、卤素或烷基;更优选为h、cl或c1~c5烷基,进一步优选为h、cl或甲基。
得到苯氧羧酸酯后,向其中加入一定比例的第一催化剂和第二催化剂,然后于一定温度下加入一定量的氯化剂进行2位和/或4位的选择性氯化反应,得到氯代苯氧羧酸酯。优选的,加入氯化剂完毕保温反应0.5~1h。
在本发明中,所述第一催化剂为路易斯酸。通常可接受一个电子对的物质就是路易斯酸;本发明所述路易斯酸催化剂一般采用:(1)含mg、fe、al、zn、ti或sn的氯化物;(2)含mg、fe、al、zn、ti或sn的氧化物;(3)氟化物,如bf3、sbf5等;(4)乙酸类化合物,如pb(oac)2、zn(oac)2等。具体的,所述第一催化剂包括但不仅限于sncl4、mgcl2、fecl3、alcl3、zncl2、ticl4、bf3、sbf5、al2o3、fe2o3、tio2、pb(oac)2、zn(oac)2或al2o(oac)4,优选为mgcl2、fecl3、zncl2、sbf5、tio2、pb(oac)2,更优选为fecl3、tio2、pb(oac)2。
在本发明中,所述第二催化剂为碳原子数为5~22的硫醚类化合物、碳原子数为5~22的噻唑类化合物、碳原子数为5~22的异噻唑类化合物或碳原子数为5~22的噻吩类化合物,优选为碳原子数为5~22的硫醚、噻唑、异噻唑、噻吩或它们的卤代衍生物,包括但不仅限于叔丁基甲基硫醚、叔丁基硫醚、苯硫醚、4,4'-二氯苯硫醚、2-甲基苯硫醚、2,4,6-三甲基苯硫醚、4,4'-硫代双(6-叔丁基-3-甲基苯酚)、噻唑、2-乙基噻唑、2,5-二氯噻唑、4-甲基噻唑、2-叔丁基噻唑、异噻唑、4,5-二甲基异噻唑、5-氯异噻唑、2,4,5-三叔丁基异噻唑、噻吩、2-甲基噻吩、2,5-二甲基噻吩、3-氯噻吩、3,4-二氯噻吩、2,3,4-三氯噻吩,其中优选叔丁基硫醚、2,4,6-三甲基苯硫醚、4,4'-硫代双(6-叔丁基-3-甲基苯酚)、2-乙基噻唑、2,5-二氯噻唑、2,4,5-三叔丁基异噻唑、4,5-二甲基异噻唑、3,4-二氯噻吩、2,3,4-三氯噻吩,更优选叔丁基硫醚、4,4'-硫代双(6-叔丁基-3-甲基苯酚)、2,4,5-三叔丁基异噻唑、2,3,4-三氯噻吩。
在本发明的实施例中,所述第一催化剂和/或第二催化剂也可以以负载的形式存在,即为负载型催化剂;优选的催化剂载体是硅胶(主要成分为二氧化硅),催化剂通过浸渍法负载至催化剂载体上。所述第一催化剂的负载率优选为10%~20%;所述第二催化剂的负载率优选为5%~15%。
在本发明中,部分使用非负载型催化剂的实施例中通过蒸馏分离催化剂和产品从而得到氯代苯氧羧酸酯;而在部分第一催化剂和第二催化剂均为负载型的实施例中,可以不需蒸馏而直接通过过滤实现催化剂与氯代苯氧羧酸酯的分离,特别的,当将第一催化剂和第二催化剂固定于反应器内时,甚至不需要过滤即可分离得到氯代苯氧羧酸酯,这使得催化剂和产物的分离变得简单易行,同时提高了催化剂的使用效率,节省了大量能耗,而且特别适合进行连续化操作。
在本发明的实施例中,所述第一催化剂的用量可为苯氧羧酸酯重量的0.05%~1.0%,优选为0.25%~1.0%,更优选为0.5%~1.0%。所述第二催化剂的用量可为苯氧羧酸酯重量的0.05%~1.0%,优选为0.2%~0.8%,更优选为0.3%~0.5%。当第一催化剂以负载型催化剂的形式存在时,负载型催化剂中有效成分的用量为苯氧羧酸酯重量的0.05%~1.0%,优选为0.25%~1.0%,更优选为0.5%~1.0%,此处负载型催化剂中的有效成分是指负载于载体上的第一催化剂,第一催化剂的有效成分用量=负载型第一催化剂的使用量×负载率。当第二催化剂以负载型催化剂的形式存在时,负载型催化剂中有效成分的用量为苯氧羧酸酯重量的0.05%~1.0%,优选为0.2%~0.8%,更优选为0.3%~0.5%,此处负载型催化剂中的有效成分是指负载于载体上的第二催化剂,第二催化剂的有效成分用量=负载型第二催化剂的使用量×负载率。
本发明所述氯化剂优选为氯气、亚硫酰氯或硫酰氯,更优选为氯气或硫酰氯。本发明在所合成的苯氧羧酸酯的苯环上选择性氯化,得到氯代苯氧羧酸酯。所述选择性氯化可以为2位取代或2,4位二取代。本发明所述选择性氯化反应温度可为-20~100℃,优选-20~60℃,更优选-20~20℃。
在本发明的一些具体实施例中,所述氯代苯氧羧酸酯具有以下结构:
本发明所述苯氧羧酸酯与氯化剂的摩尔比可按以下选取:当使用氯化剂对苯氧羧酸酯进行二取代时,其与氯化剂的摩尔比为1:(1.98~2.4),优选1:(2~2.2),更优选1:(2.02~2.06);当使用氯化剂对苯氧羧酸酯进行一取代时,其与氯化剂的摩尔比为1:(0.99~1.2),优选1:(1~1.1),更优选1:(1.01~1.03)。
本发明实施例中苯氧羧酸酯选择性氯化,得到氯代苯氧羧酸酯。然后,将所述氯代苯氧羧酸酯进行酸解反应,得到式i所示的苯氧羧酸类除草剂。并且,所产生的氯化氢可回收用于苯氧羧酸酯酸解反应,直接得到苯氧羧酸和醇。酸解所得苯氧羧酸类除草剂还可以根据需要制成具有各种形式的固体颗粒,从而减少使用时的粉尘伤害。
本发明实施例在s3步骤中向所述氯代羧酸酯中加入一定量的酸,于一定温度下酸解反应2h~4h,同时蒸出反应生成的醇,反应完毕后降温至室温,过滤,并加入少量水洗涤滤饼,滤饼烘干得苯氧羧酸类除草剂。
本发明s3步骤中所述的酸可以是盐酸、磷酸、硫酸或磺酸xso3h等磺酸类物质,其中x为碳原子数为1~18的烷基、芳基、被卤素取代的烷基或芳基。另外,本发明s3步骤中酸解优选采用无氧化性、高沸点的易溶于水的磷酸、磺酸作为催化剂,保证了产品品质和催化剂的循环使用;相较于使用固体酸作为催化剂的工艺,不仅能加快反应速度,还可降低产品和催化剂的分离难度。
在本发明s3步骤的实施例中,所述氯代苯氧羧酸酯酸解所用酸的质量浓度可为5%~35%;酸的折百用量为氯代苯氧羧酸酯重量的0.4~1倍。在本发明中,所述酸解反应温度可为60~120℃,优选80~100℃。
本发明酸解所得苯氧羧酸类除草剂具有式ⅲ所示结构:
其中,r1、r3结构同上,在此不再赘述。
在本发明的一些具体实施例中,所述苯氧羧酸类除草剂具有以下结构:
实验结果表明,本发明实施例所得苯氧羧酸类除草剂产品含量≥98.5%,总收率≥96%,水洗水和滤液合并回用。与现有技术相比,本发明提供的方法有效地避免了有效成分的损失,提高了产品的收率。以下表1是本发明一些实施例中各目标产物和杂质情况(质量含量):
表1本发明一些实施例中各目标产物和杂质情况
综上所述,本发明提供的苯氧羧酸类除草剂的制备方法避免了氯代酚的生产和使用,可从根本上杜绝剧毒的二噁英的生成,极大地改善产品品质和生产场所的环境,同时提高收率。此外,本发明通过对工艺路线的创新,有效杜绝了高cod、高盐废水的产生,杜绝了废盐(金属氯化物)产出,三废产出有了极大幅度的降低,三废处理成本大幅下降,利于工业化推广。
为了进一步说明本发明,以下结合实施例对本发明提供的苯氧羧酸类除草剂的制备方法进行详细描述。
以下实施例中,所涉及的原料均为市售。
实施例1
将苯酚144.89g(99%)、羟基乙酸甲酯138.70g(99%),以及催化剂mo1p3-mcm-48(mo1p3和mcm-48质量比为25:100)1.70g,投入反应精馏装置,混合搅拌,升温至100-120℃,反应3小时。待塔顶基本无水份时反应结束,降温至室温,滤去催化剂,滤液蒸馏回收含苯酚48.20g、羟基乙酸甲酯29.97g的混合物81.42g,得产物苯氧乙酸甲酯168.53g,纯度98.1%,收率以苯酚计98.3%。
向蒸馏所得苯氧乙酸甲酯中,加入1.72g纯度99%的四氯化锡和0.60g纯度99%的2,5-二氯噻唑,于60℃下加入279.41g纯度99%的硫酰氯使之反应,加入完毕于此温度下保温反应0.5h,于1kpa压力下蒸馏并收集115~125℃的馏分,得2,4-二氯苯氧乙酸甲酯234.12g,含量99.18%。
向所得2,4-二氯苯氧乙酸甲酯中加入780.40g浓度30%的盐酸,于110℃下酸解反应4h,同时蒸出反应生成的醇,反应完毕后降温至室温,过滤,并加少量水洗涤滤饼,滤饼烘干,得2,4-二氯苯氧乙酸217.52g,其结构检测谱图参见图1,图1为1hnmr(dmso-d6)谱图;含量98.8%,总收率以苯酚计97.2%。
实施例2
将邻甲酚175.16g(99%)、羟基乙酸正丁酯214.10g(99%),以及催化剂mo2p5-mcm-48(mo2p5和mcm-48质量比为25:100)1.32g投入反应精馏装置,混合搅拌,升温至120℃,反应3小时。待塔顶基本无水份时反应结束,降温至室温,滤去催化剂,滤液蒸馏回收含邻甲酚64.85g、羟基乙酸正丁酯48.94g的混合物118.54g,得产物邻甲苯氧乙酸正丁酯223.82g,纯度98.9%,收率以苯酚计99.2%。
向蒸馏所得邻甲苯氧乙酸正丁酯中,加入1.15g负载率为10%的氯化铁/硅胶负载型催化剂和15.4g负载率为15%的叔丁基甲基硫醚/硅胶负载型催化剂,于40℃下滴加入118.46g纯度99%的亚硫酰氯使之反应,加入完毕于此温度下保温反应0.5h,过滤,得4-氯-2-甲基苯氧乙酸正丁酯256.98g,含量99.01%。
向所得4-氯-2-甲基苯氧乙酸正丁酯中加入1370.55g浓度15%的盐酸,于70℃下酸解反应4h,同时蒸出反应生成的醇,反应完毕后降温至室温,过滤,并加少量水洗涤滤饼,滤饼烘干,得4-氯-2-甲基苯氧乙酸200.19g,含量98.5%,总收率以邻甲酚计98.33%。
实施例3
将苯酚158.14g(99%)、2-羟基丙酸正丁酯245.68g(99%),以及催化剂mo2p5--hzsm-5(mo2p5和hzsm-5质量比为25:100)2.02g,投入反应精馏装置,混合搅拌,升温至150℃,反应3小时。待塔顶基本无水份时反应结束,降温至室温,滤去催化剂,滤液蒸馏回收含苯酚62.15g、2-羟基丙酸正丁酯57.46g的混合物124.60g,得产物2-苯氧基丙酸正丁酯223.67g,纯度98.8%,收率以苯酚计99.1%。
向蒸馏所得2-苯氧基丙酸正丁酯中,加入1.73g纯度99%的氧化铝和0.12g纯度99%的叔丁基硫醚,于100℃下通入76.89g纯度99%的氯气使之反应,加入完毕于此温度下保温反应0.5h,于1kpa压力下蒸馏并收集130~140℃的馏分,得2-(4-氯苯氧基)丙酸正丁酯257.60g,含量98.77%。
向所得2-(4-氯苯氧基)丙酸正丁酯中加入721.28g浓度25%的磷酸,于80℃下酸解反应3h,同时蒸出反应生成的醇,反应完毕降温至室温,过滤,并加少量水洗涤滤饼,滤饼烘干,得2-(4-氯苯氧基)丙酸200.13g,含量98.6%,总收率以苯酚计98.40%。
实施例4
将2-氯苯酚292.43g(99%)、2-羟基丙酸正癸酯524.09g(99%),以及催化剂mo1p4--hzsm-5(mo1p4和hzsm-5质量比为25:100)2.84g,投入反应精馏装置,混合搅拌,升温至100℃,反应1小时。待塔顶基本无水份时反应结束,降温至室温,滤去催化剂,滤液蒸馏回收含2-氯苯酚161.25g、2-羟基丙酸正癸酯127.04g的混合物300.31g,得产物2-(2-氯苯氧基)丙酸正癸酯341.15g,纯度99.1%,收率以2-氯苯酚计99.4%。
向蒸馏所得2-(2-氯苯氧基)丙酸正癸酯中,加入2.06g纯度99%的氯化镁和0.47g纯度99%的2,4,5-三叔丁基异噻唑,于-20℃下通入85.22g纯度99%的氯气使之反应,加入完毕于此温度下保温反应0.5h,于1kpa压力下蒸馏并收集165~175℃的馏分,得2-(2,4-二氯苯氧基)丙酸正癸酯374.49g,含量98.89%。
向所得2-(2,4-二氯苯氧基)丙酸正癸酯中加入1497.97g浓度10%的三氟甲磺酸,于100℃下酸解反应2h,同时蒸出反应生成的醇,反应完毕降温至室温,过滤,并加少量水洗涤滤饼,滤饼烘干,得2-(2,4-二氯苯氧基)丙酸235.07g,含量98.8%,总收率以苯酚计98.50%。
实施例5
将苯酚182.34g(99%)、羟基乙酸异辛酯364.83g(99%),硫酸催化剂3.41g,投入反应精馏装置,混合搅拌,升温至80℃,反应2小时。待塔顶基本无水份时反应结束,降温至室温,除去催化剂,滤液蒸馏回收含苯酚84.48g、羟基乙酸异辛酯87.24g的混合物178.88g,得产物苯氧乙酸异辛酯269.24g,纯度97.5%,收率以苯酚计97.3%。
在三级串联连续反应器(每个容积为200ml)内分别加入45.5g负载率为20%的氯化锌/硅胶负载型催化剂和9.1g负载率为5%的4,4’-二氯苯硫醚/硅胶负载型催化剂,向第一级反应器内加入54.57g蒸馏所得苯氧乙酸异辛酯,搅拌,然后于-20℃下匀速加入27.34g99%的硫酰氯,待硫酰氯加完后接着按比例匀速加入2674.0g蒸馏所得苯氧乙酸异辛酯和1339.9g99%的硫酰氯,随着物料从第一级反应器的加入,物料不断溢流进入第二级反应器和第三级反应器,在第二、第三级反应器也有物料时保持其温度为-20℃,反应物料最后由第三级反应器溢流出系统,得到4-氯苯氧乙酸异辛酯,而负载型催化剂由于密度较大,不会随物料流出系统。待所有物料加入完毕保温30min,将第一、二、三级反应器中的物料过滤与由第三级反应器溢流出的4-氯苯氧乙酸异辛酯合并,得4-氯苯氧乙酸异辛酯2980.8g,含量99.12%。
向所得4-氯苯氧乙酸异辛酯中加入8942.5g浓度20%的磷酸,于120℃下酸解反应3h,同时蒸出反应生成的醇,反应完毕降温至室温,过滤,并加少量水洗涤滤饼,滤饼烘干,得4-氯苯氧乙酸1821.1g,含量98.9%,总收率以苯酚计96.50%。
实施例6
将邻甲酚181.81g(99%)、4-羟基丁酸乙酯222.22g(99%),以及si-al负载型催化剂(活性组分:载体的质量比优选为10:100)0.70g,投入反应精馏装置,混合搅拌,升温至90℃,反应1小时。待塔顶基本无水份时反应结束,降温至室温,滤去催化剂,滤液蒸馏回收含邻甲酚69.83g、4-羟基丁酸乙酯50.77g的混合物126.53g,得产物邻甲苯氧丁酸乙酯226.67g,纯度97.6%,收率以邻甲酚计97.7%。
向蒸馏所得邻甲苯氧丁酸乙酯中,加入0.35g纯度99%的氧化铁和1.96g纯度99%的2,4,6-三甲基苯硫醚,于0℃下通入78.40g纯度99%的氯气使之反应,加入完毕于此温度下保温反应0.5h,于1kpa压力下蒸馏并收集130~140℃的馏分,得4-氯-2-甲基苯氧丁酸乙酯255.82g,含量99.29%。
向所得4-氯-2-甲基苯氧丁酸乙酯中加入2046.53g浓度5%的十八烷基磺酸,于85℃下酸解反应2h,同时蒸出反应生成的醇,反应完毕降温至室温,过滤,并加少量水洗涤滤饼,滤饼烘干,得4-氯-2-甲基苯氧丁酸224.10g,含量98.7%,总收率以邻甲酚计96.73%。
实施例7
将邻甲酚233.66g(99%)、4-羟基丁酸异辛酯467.49g(99%),以及ti-活性炭负载型催化剂(活性组分:载体的质量比优选为30:100)2.68g,投入反应精馏装置,混合搅拌,升温至110℃,反应4小时。待塔顶基本无水份时反应结束,降温至室温,滤去催化剂,滤液蒸馏回收含邻甲酚120.98g、4-羟基丁酸异辛酯112.02g的混合物242.71g,得产物邻甲苯氧丁酸异辛酯312.40g,纯度97.8%,收率以邻甲酚计97.7%。
向蒸馏所得邻甲苯氧丁酸异辛酯中,加入1.75g纯度99%的二氧化钛和0.80g纯度99%的2-乙基噻唑,于50℃下通入85.67g纯度99%的氯气使之反应,加入完毕于此温度下保温反应0.5h,于1kpa压力下蒸馏并收集160~170℃的馏分,得4-氯-2-甲基苯氧丁酸异辛酯340.17g,含量99.08%。
向所得4-氯-2-甲基苯氧丁酸异辛酯中加入680.33g浓度35%的磷酸,于95℃下酸解反应3h,同时蒸出反应生成的醇,反应完毕降温至室温,过滤,并加少量水洗涤滤饼,滤饼烘干,得4-氯-2-甲基苯氧丁酸224.11g,含量98.5%,总收率以邻甲酚计96.50%。
实施例8
将苯酚144.77g(99%)、羟基乙酸甲酯138.59g(99%),以及陶瓷和ti负载型催化剂(活性组分:载体的质量比优选为20:100)22.02g,投入反应精馏装置,混合搅拌,升温至130℃,反应5小时。待塔顶基本无水份时反应结束,降温至室温,滤去催化剂,滤液蒸馏回收含苯酚47.01g、羟基乙酸甲酯29.25g的混合物79.44g,得产物苯氧乙酸甲酯169.38g,纯度97.6%,收率以苯酚计97.2%。
向蒸馏所得苯氧乙酸甲酯中,加入0.09g纯度99%的醋酸铅和1.29g纯度99%的2,3,4-三氯噻吩,于20℃下滴加入118.34g纯度99%的亚硫酰氯使之反应,加入完毕于此温度下保温反应0.5h,于1kpa压力下蒸馏并收集110~120℃的馏分,得4-氯苯氧乙酸甲酯200.87g,含量98.84%。
向所得4-氯苯氧乙酸甲酯中加入401.74g浓度25%的硫酸,于80℃下酸解反应2h,同时蒸出反应生成的醇,反应完毕降温至室温,过滤,并加少量水洗涤滤饼,滤饼烘干,得4-氯苯氧乙酸182.27g,含量98.6%,总收率以苯酚计96.31%。
由以上实施例可知,本发明实施例所得苯氧羧酸类除草剂产品含量≥98.5%,总收率≥96%,水洗水和滤液合并回用。
本发明实施例中一些目标产物和杂质情况如下:
表2本发明实施例中一些目标产物和杂质情况
本发明以酚类化合物与羟基羧酸酯为原料,进行缩合反应,合成苯氧羧酸酯,然后选择性氯化合成氯代苯氧羧酸酯,最后酸解合成苯氧羧酸类除草剂。本发明有效地避免了具有难闻气味的氯代酚的生产和使用,从根本上杜绝了剧毒的二噁英的产生,极大的改善了产品品质和生产现场的操作环境。并且,本发明有效杜绝了高cod、高盐废水的产生,同时不再产出废盐(金属氯化物),极大地降低了三废处理量、三废处理难度和处理成本。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!