一种检测幽门螺旋杆菌的人工模拟分子信标与试剂盒的制作方法
本发明涉及生物
技术领域:
中,一种检测幽门螺旋杆菌的人工模拟分子信标与试剂盒。
背景技术:
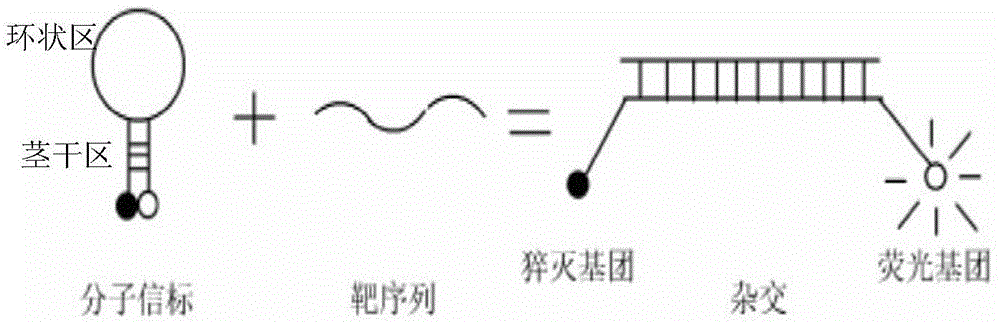
:幽门螺旋杆菌(helicobaeterpylori,hp)是一种常见的可长期定植于人类胃黏膜的革兰阴性微需氧杆菌,与许多上消化道疾病有着紧密的联系。全世界有超过半数的人感染hp,而在我国的感染率为55%。hp的感染给患者造成极大的痛苦,加重医疗负担。who把hp列为同乙型、丙型肝炎一样,都是生物致癌物。幽门螺杆菌的传播方式主要有:①粪-口传播,粪便中的hp是传染源,细菌经粪便排出体外后污染了水源、食物等,再由它们来感染人类;②口-口传播,是hp传播的另一主要方式。寄居于口腔中的hp可能通过唾液传播给他人;③经内窥镜传播,内镜是临床诊断胃病的重要工具,因暴露于胃液及唾液,常用的胃镜及活检钳易被幽门螺杆菌污染。目前,临床针对hp的检测方法很多,经典的细菌培养和形态学检查虽然特异性高,但是灵敏度低,周期较长应用较麻烦,且不适用于痕量细菌检测;快速尿素酶试验(rut检测)灵敏度较低、受环境及主观影响较大;c13、c14-ubt试验和n15-尿素排出试验,容易出现假阳性的可能;血清学hp抗体检测、粪便抗原检测作为常用的非侵入性检测手段存在以下缺陷:a、由于系统免疫反应持续存在,检测过程尚不稳定,不易区分感染分期;b、与空肠弯曲菌、胎儿弯曲菌等有血清交叉反应,不同个体菌株之间存在差异。因此,抗原制备、菌株选择均影响检测结果;c、敏感性与特异性受年龄影响较大,30岁以上患者,血清学诊断不推荐作为随访治疗结果的方法。hp的分子检测方法主要有pcr-sanger测序法、芯片杂交法、荧光定量pcr法等。这些方法虽然都可以在一定程度上检测hp,但都有不可忽视的局限性。sanger测序法步骤较多,需要pcr后处理,不仅操作繁琐,还易产生污染,并不能满足临床的需求。芯片杂交法操作繁琐,其检测还依赖于昂贵的设备仪器,导致成本较高。基于sybr染料的荧光定量pcr,成本较低,但是常会出现非特异扩增,导致检测特异性较差。基于taqman水解探针的荧光定量pcr,利用taq酶的外切酶活性,切断探针产生荧光信号,由于taqman探针荧光基团与淬灭基团并不紧密靠近,导致荧光淬灭不彻底,存在背景荧光信号,扩增曲线起峰稍晚,进而导致低拷贝样本存在漏检的可能。因此,临床上迫切需要一种简便易行、灵敏度高、准确可靠的检测hp的方法。分子信标(molecularbeacon)在空间结构上呈发夹型,由环状区和茎干区组成,环状区与靶dna序列互补,长约15-35个核苷酸,茎杆区长约5-7个核苷酸,由gc含量较高的与靶序列无关的互补序列构成,分子信标的5′端标记荧光基团(f),3′端标记淬灭基团(q)。对于分子信标来说,自由状态时,荧光基团与猝灭基团靠近(约为7-10nm)。此时发生荧光共振能量转移,使荧光基团发出的荧光被猝灭基团吸收并以热的形式散发,荧光几乎完全被猝灭,荧光本底极低。当分子信标的环状区与序列完全互补的靶dna杂交形成双链杂交体时,分子信标茎杆区被拉开,荧光基团和猝灭基团距离增大。根据foerster理论,中心荧光能量转移效率与两者距离的6次方成反比,因此,杂交后,分子信标的荧光几乎100%恢复,且所检测到的荧光强度与溶液中靶dna的量成正比(图1)。因此,理想的分子信标比taqman水解探针更为高效。然而,由于分子信标中与靶序列无关的茎杆区的引入导致分子信标与模板序列之间常会产生一些非特异性相互作用,从而导致背景信号增强,进而影响检测效率。而要消除这种背景信号,就会对分子信标的设计尤其是茎杆区的序列设计产生很高的要求。此外,研究显示分子信标在环状区序列较短时,用于检测基因突变(包括单碱基的错配、缺失或插入突变)效果较好,但实际上,很多时候,由于特定靶序列区的gc含量较低,往往会导致环状区序列过长,从而影响检测效率。因此,得到一个理想的分子信标往往比较困难。针对碱基的修饰改造也就是人工模拟的非天然核苷酸对的研究发展至今已有近40年的历史,这其中异胞嘧啶脱氧核苷酸-异鸟嘌呤脱氧核苷酸(isoc-isog)及其衍生物5-甲基异胞嘧啶脱氧核苷酸-异鸟嘌呤脱氧核苷酸(isomec-isog)中的人工核苷酸对堪称经典。有关isoc-isog中的核苷酸对的研究工作最早是由美国著名合成生物学家bennersa开展的,其团队实现了异胞嘧啶脱氧核苷酸-异鸟嘌呤脱氧核苷酸(isoc-isog)的人工扩展核酸在体外的复制、转录乃至翻译的整个中心法则。如图2所示,isoc和isog分别是天然核苷酸c和g的异构体,它们自身可以完美配对,但无法与天然核苷酸之间形成配对。除了以上人工对碱基结构的改造,还有一大类基于对碱基糖环的改造的非天然核酸,如锁核酸(lna)。lna泛指含有一个或多个lna单体(锁核苷酸)的寡核苷酸序列,是一类近年来迅速发展起来的并且已经在分子诊断、基因治疗等领域得到广泛应用的人工模拟核酸。如图3所示,lna单体的戊糖环的2’-o和4’-c之间形成了一个亚甲基桥。lna不改变天然核酸的碱基配对,但相对于天然核酸有着更强的亲和力以及更强的错配识别能力。技术实现要素:基于一种新型的基于人工模拟核酸的分子信标,本发明提供了一种新型的检测幽门螺旋杆菌(hp)和urea基因的分子信标与试剂盒。本发明提供的分子信标的序列为序列表中序列2,所述分子信标满足:序列2的第2位为5-甲基异胞嘧啶脱氧核苷酸残基(isomec),第6位为异鸟嘌呤脱氧核苷酸残基(isog),第32位为5-甲基异胞嘧啶脱氧核苷酸残基,第36位为异鸟嘌呤脱氧核苷酸残基,序列2的其余核苷酸残基均为天然核苷酸残基。所述分子信标环状区靶向hp的dna序列。所述hp的dna序列可为urea基因或其任一片段。所述hp的特异dna序列具体可为序列表中序列1。上述分子信的两端还可标记有荧光基团和淬灭基团。所述荧光基团发出的荧光可被所述猝灭基团吸收。所述荧光基团和所述淬灭基团位于所述基础分子信标的5′末端和3′末端,所述荧光基团和所述淬灭基团的位置可以交换,只要满足自由状态下的基础分子信标中的荧光基团发出的荧光可被淬灭基团淬灭即可。所述荧光基团具体可为fam、hex、tet、cy3或joe;所述淬灭基团具体可为dabcyl或tamra。为解决上述技术问题,本发明还提供了用于检测幽门螺旋菌或检测urea基因的成套试剂,所述成套试剂由所述分子信标与能从hp基因组中扩增得到含有所述分子信标茎环区识别序列的引物对组成。上述成套试剂中,所述引物对可由序列表中序列1的第1-21位所示的单链dna和与序列表中序列1的第87-106位互补的单链dna组成。上述成套试剂中,所述分子信标与所述引物对均独立包装。所述引物对中的两条单链dna的摩尔比为1:1。所述成套试剂中所述分子信标与所述引物对的两条单链dna的摩尔比可为2:5:5。为解决上述技术问题,本发明还提供了检测hp或检测urea基因的试剂盒,所述试剂盒含有所述分子信标或所述成套试剂。所述试剂盒还可包括利用分子信标检测dna所需的其他试剂。所述其他试剂具体可为含有hp基因组dna片段的重组质粒、可检测dna质量的内控探针和内控引物对、dntps、mgcl2和/或dna聚合酶。所述试剂盒具体可由所述分子信标或所述成套试剂与所述其他试剂组成。所述重组质粒具体可为含有序列表中序列1所示dna片段的质粒。所述内控引物对可由序列表中序列4和5所示的两条单链dna组成。所述内控探针的序列可为序列表中序列3。所述内控探针还标记有所述荧光基团和所述淬灭基团。所述dna聚合酶可为extaqdna聚合酶。为解决上述技术问题,本发明还提供了非诊断目的的检测hp或检测urea基因的方法,所述方法包括:利用所述分子信标或所述成套试剂检测待测样本,根据待测样本中荧光信号的变化确定所述待测样本中是否含有hp或urea基因或所述待测样本是否为hp。如所述待测样本的扩增曲线为s型曲线,则所述待测样本含有或候选含有urea基因;如所述待测样本的扩增曲线非s型曲线,则所述待测样本不含有或候选不含有urea基因。如所述待测样本的扩增曲线为s型曲线,则所述待测样本含有或候选含有hp,或为或候选为幽门螺旋菌;如所述待测样本的扩增曲线非s型曲线,则所述待测样本不含有或候选不含有hp,或不为或候选不为幽门螺旋菌。所述利用所述分子信标或所述成套试剂检测待测样本具体可利用所述分子信标或所述成套试剂检测所述待测样本的dna。在利用所述分子信标或所述成套试剂检测所述待测样本的dna时,还可先对所述待测样本dna的质量进行检测,在所述待测样本dna的质量满足要求时进一步确定所述待测样本中是否含有hp或是否为hp或是否含有urea基因。所述待测样本具体可为待测对象的胃窦部位的组织样本或胃液。本发明的检测hp或检测urea基因的分子信标与方法简单易行、具有较高的灵敏度和特异性,并可检出细菌培养、组织学、快速尿素酶法乃至基于taqman水解探针的荧光定量pcr法不能发现的少量hp(低至3个拷贝即可检出),可灵敏地发现感染程度较低或者是症状虽然减轻但并未真正根治的病人,可广泛用于hp感染的辅助诊断,指导临床用药以及进行流行病学研究等多个领域。附图说明图1为分子信标工作原理。图2为不同核苷酸对中碱基对的配对方式。其中,r均表示脱氧核苷酸的非碱基部分。图3为锁核苷酸残基的结构。其中,base表示碱基。图4为实施例2的hp-anabmb及引物对a1检测hp特异性结果。图5为实施例2的hp-anabmb及引物对a1检测brevibacteriumcasei、klebsiellapneumonia及人类胃粘膜上皮细胞的特异性结果。图6为实施例3的hp-anabmb和引物对a1的灵敏度的检测结果。1-6分别为30000、3000、300、30、3拷贝/μl以及ntc的结果。图7为实施例3的hp-mb和引物对a1的检测结果。1-6分别为30000、3000、300、30、3拷贝/μl以及ntc的结果。图8为实施例3的hp-taqman和引物对a1的检测结果。1-6分别为30000、3000、300、30、3拷贝/μl以及ntc的结果。图9为本发明检测临床样本典型扩增曲线。图10为对照试剂盒检测临床样本典型扩增曲线。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的试验,均设置三次重复实验,结果取平均值。实施例1、利用anab-mb检测hp方法的建立一、引物对及分子信标的合成设计并合成能扩增hpurea基因dna片段的特异性引物对,将该引物对命名为引物对a1,引物对a1由a1-f和a1-r组成,其序列如下:a1-f:5'-acctgatgatgtgatggatgg-3';a1-r:5'-ctcaataggggtatgcacgg-3'。引物对a1扩增到的urea基因dna片段的序列为:acctgatgatgtgatggatggcgtggcaagcatgatccatgaagtgggtattgaagcgatgtttcctgatgggaccaaactcgtaaccgtgcatacccctattgag(序列1)。根据该序列设计并合成含有非天然核苷酸对isomec-isog的anab-mb,将其命名为hp-anabmb,具体如下:未经非天然核苷酸isomec-isog修饰的对照分子信标为:其中,fam为荧光基团,dabcyl为淬灭基团;方框部分为茎杆区序列;下划线部分为环状区,可以识别靶序列;*g表示非天然核苷酸异鸟嘌呤核苷酸残基(isog),*c表示非天然核苷酸5-甲基异胞嘧啶脱氧核苷酸残基(isomec)。二、方法的建立检测hp的具体步骤如下:以待测样本的基因组dna为模板,采用引物对a1及hp-anabmb进行实时荧光定量pcr。定量pcr检测试剂extaqdna聚合酶、dntps与反应缓冲液均为takara公司产品。1、反应体系与反应条件的优化反应体系与反应条件优化的基础体系与条件如下:20μl反应体系:qpcr混合反应液(表1)10μl、a1-f1μl(在反应体系中的浓度为0.5μm)、a1-r1μl(在反应体系中的浓度为0.5μm)、hp-anabmb0.5μl(在反应体系中的浓度为0.2μm)、模板5μl(在反应体系中的浓度为1-300ng/μl)和无核酸酶水2.5μl。表1、qpcr混合反应液各组分在反应体系中的浓度组分浓度mgcl22mmextaqdna聚合酶5u/μldntps2.5mm反应缓冲液1×反应体系配好后上机,使用定量pcr仪appliedbiosystemsabi7500。基础反应条件:95℃预变性10分钟,95℃15秒,62℃40秒,扩增反应44循环,在62℃40秒阶段收集荧光。(1)引物浓度的优化:在反应体系其它条件相同的情况下,调整引物a1-f和a1-r的浓度,引物在反应体系中的浓度分别为0.1μm、0.2μm、0.4μm、0.5μm、0.6μm、0.8μm和1.0μm。反应条件同上基础反应条件。结果显示,引物浓度为0.5μm时的反应体系的扩增效果最好,确定反应体系中最佳引物浓度是0.5μm。(2)探针浓度的优化:在反应体系其他条件相同的情况下,调整hp-anabmb的浓度,hp-anabmb在反应体系中的浓度分别为0.05μm、0.1μm、0.2μm、0.3μm、0.4μm和0.5μm。反应条件同上基础反应条件。结果显示,hp-anabmb浓度为0.2μm时的反应体系的扩增效果最好,确定反应体系中hp-anabmb最佳浓度是0.2μm。(3)酶的优化:在反应体系其他条件相同的情况下,使用不同的dna聚合酶,所用的dna聚合酶分别为extaqdna聚合酶、pfudna聚合酶、rtaqdna聚合酶,每个反应体系一种dna聚合酶,各dna聚合酶在反应体系中的浓度均相同。反应条件同上基础反应条件。结果显示,extaqdna聚合酶的反应体系的扩增效果最好,确定最佳dna聚合酶为extaqdna聚合酶。(4)镁离子浓度的优化:在反应体系其它条件相同的情况下,调整镁离子在反应体系中的浓度,镁离子在反应体系中的浓度分别为0.5mm、1.0mm、2.0mm、3.0mm和4.0mm。反应条件同上基础反应条件。结果显示,镁离子浓度是2mm时的反应体系的扩增效果最好,确定反应体系中最佳镁离子浓度是2mm。(5)退火温度的优化:反应体系为基础反应体系,在反应的其他条件相同的情况下,调整退火温度进行梯度pcr(退火温度分别为58℃、60℃、62℃和64℃)。结果显示,退火温度是62℃时的反应体系的扩增效果最好,确定最佳退火温度是62℃。由此得到上述基础反应体系即为最佳反应体系,基础反应条件即为最佳反应条件。2、试剂盒的制备利用上述引物对a1、hp-anabmb以及内控探针、内控引物对、反应缓冲液;dntps;mgcl2溶液;extaqdna聚合酶以及无核酸酶水作为试剂盒的组分,制备检测幽门螺杆菌的试剂盒。其中,内控探针为:actb-p:fam-tgtctttcctgcctgagctgacc-bhq1(序列3);内控引物对为:actb-f:5'-cagcacaatgaagatcaagg-3'(序列4);actb-r:5'-caggaggagcaatgatctga-3'(序列5)。内控探针和内控引物对的作用是对提取的dna质量进行监控。该试剂盒还可以包括阳性质控和阴性质控。阳性质控为人工合成的含有urea基因dna片段的重组质粒,该质粒为将大肠杆菌克隆载体puc57(赛默飞世尔科技(中国)有限公司)中的ecorv和smai识别序列间的dna片段替换为序列1所示的dna片段得到的重组质粒。阴性质控为无核酸酶水。实施例2、实施例1的hp-anabmb及引物对a1的特异性待测样本:hp和brevibacteriumcasei、klebsiellapneumonia及人类胃粘膜上皮细胞。其中,hp为bncc细胞库产品(bncc105772);brevibacteriumcasei为bncc细胞库产品(bncc198452)、klebsiellapneumonia为bncc细胞库产品(bncc194471)及人胃粘膜上皮细胞为bncc细胞库产品(bncc337969)。提取各菌株的基因组dna,照一定的比例(1:100)稀释到正常人类细胞的全基因组dna去,成功建立了标准检测样本可以模拟临床检测样本。以各标准检测样本作为模板,按照实施例1的最佳反应体系和反应条件分别利用实施例1的hp-anabmb及引物对a1检测各菌株(检测管)。利用实施例1的阳性质控和阴性质控分别替换各菌株的基因组dna分别作为阳性和阴性对照(ntc),并利用实施例1的内控探针和内控引物对分别替换hp-anabmb和引物对a1检测扩增质量(内控管)。对于hp,内控管扩增s型曲线且ct≤32,检测管有扩增s型曲线且与内控引物管的扩增曲线δct≤7(图4),表明待测菌株为hp,与实际情况一致;对于brevibacteriumcasei、klebsiellapneumonia及人胃粘膜上皮细胞,内控管扩增s型曲线且ct≤32,检测管、ntc均无扩增曲线(图5),表明brevibacteriumcasei、klebsiellapneumonia及人类胃粘膜上皮细胞均不为hp。说明,实施例1的hp-anabmb和引物对a1在检测待测样本是否含有hp或是否为hp时具有很好的特异性。根据上述结果得到的确定待测样本是否含有或是否为hp的方法如下:若内控管扩增曲线为非s型曲线或ct>32,表明该实验失败,需重新提取dna或更换模板;若内控管的扩增曲线为s型曲线且ct≤32,则可根据检测管中的扩增曲线确定待测样本是否含有或是否为hp:如检测管中的扩增曲线为s型曲线且与内控引物管的扩增曲线δct≤7,则待测样本含有或为hp;如检测管中的扩增曲线非s型曲线或与内控引物管的扩增曲线δct>7,则待测样本不含有或不为hp。实施例3、实施例1的hp-anabmb和引物对a1的灵敏度将实施例1的作为阳性质控的重组质粒进行倍比稀释,分别得到浓度分别为30000、3000、300、30、3拷贝/μl的重组质粒溶液。将上述各重组质粒溶液中的重组质粒作为模板,按照实施例1的最佳反应体系和反应条件利用实施例1的hp-anabmb和引物对a1进行检测,并与相同序列的不含非天然核苷酸的分子信标hp-mb和引物对a1进行对比。每个反应体系一种浓度的重组质粒溶液,每种反应体系设置三个重复,以无核酸酶水替换重组质粒溶液作为阴性对照(ntc)。同时设计合成对照taqman探针,hp-taqman:fam-attgaagcgatgtttcctgatggga-bhq1。结果(图6)显示,hp-anabmb扩增曲线基线平稳,且可以检出低至3拷贝的模板;对照hp-mb扩增曲线基线倾斜,导致定量检测结果不可靠(图7);对照hp-taqman扩增曲线相比hp-anabmb扩增曲线起峰晚1~2循环,导致低至3拷贝的样本定量检测结果不精确(图8)。上述结果表明,实施例1的hp-anabmb和引物对a1的灵敏度为3拷贝/μl,明显优于普通的hp-mb分子信标和hp-taqman探针;与此同时,hp-anabmb可以降低基线背景干扰,有利于对结果进行准确判读。实施例4、利用实施例1的hp-anabmb和引物对a1检测临床样本1、待测临床样本取41例胃炎患者(均知情同意)胃窦部位的石蜡包埋组织切片样本,然后提取基因组dna(测定基因组dna的浓度和纯度,要求浓度大于10ng/μl;od260nm/od280nm在1.8-2.0之间)。2、基于非天然碱基对分子信标探针的荧光pcr检测将各样本的基因组dna作为模板,按照实施例1的最佳反应体系和反应条件分别利用实施例1的hp-anabmb和引物对a1进行检测,每个反应体系一种样本的基因组dna,每种反应体系设置三个重复,以无核酸酶水替换基因组dna作为阴性对照。同时利用对照试剂盒(hp核酸检测试剂盒(pcr-荧光探针法),中山大学达安基因股份有限公司,国食药监械(准)字2014第3401651号)检测上述各样本。结果如表2所示。表2、临床样本的检测结果检测结果显示,临床病理诊断为慢性胃炎的41例患者中应用本发明检测出33例阳性样本,其余8例为阴性样本,发明检测结果典型扩增曲线见图9;对照试剂盒检出33例阳性样本,其余8例为阴性样本,对照试剂盒检测结果典型扩增曲线见图10。本发明检测出的阳性样本与对照试剂盒检出的阳性样本完全相符。尽管本发明检测出的阳性样本与对照试剂盒检出的阳性样本完全相符,但是对照试剂盒检出的阳性样本扩增曲线整体起峰比本发明扩增曲线起峰晚,这也与实施例3中相关本方法与taqman探针法的灵敏度比较结果相一致,总的说来,本发明检测结果可信度更高。上述结果表明应用实施例1的hp-anabmb和引物对a1检测hp的灵敏度高,可检测胃粘膜样本中的微量的hp存在。与对照试剂盒相比阳性符合率为100%,阴性符合率为100%,总体符合率为100%。此外该方法检测速度快,操作简单,结果判读客观,闭管反应污染少,非常适合于在临床中大规模开展。<110>北京福安华生物科技有限公司<120>一种检测幽门螺旋杆菌的人工模拟分子信标与试剂盒<160>5<170>patentinversion3.5<210>1<211>106<212>dna<213>人工序列<220><223><400>1acctgatgatgtgatggatggcgtggcaagcatgatccatgaagtgggtattgaagcgat60gtttcctgatgggaccaaactcgtaaccgtgcatacccctattgag106<210>2<211>37<212>dna<213>人工序列<220><223><400>2ccatcgattgaagcgatgtttcctgatgggacgatgg37<210>3<211>23<212>dna<213>人工序列<220><223><400>3tgtctttcctgcctgagctgacc23<210>4<211>20<212>dna<213>人工序列<220><223><400>4cagcacaatgaagatcaagg20<210>5<211>20<212>dna<213>人工序列<220><223><400>5caggaggagcaatgatctga20当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1