一种CD34+造血干细胞的培养方法与流程
本发明属于生物技术领域,尤其涉及一种cd34+造血干细胞的培养方法。
背景技术:
造血干细胞(hematopoieticstemcell,hsc)为血液系统中的成体干细胞,具有不断自我更新的能力,并可多向分化发育成血液系统中各种细胞类型,能长期重建各系造血和免疫功能。临床治疗中,造血干细胞移植广泛应用于血液系统疾病以及自身免疫疾病,在其它实体瘤的治疗中,比如淋巴瘤、生殖细胞瘤、乳腺癌、小细胞肺癌,主要应用于常规治疗失败或复发难治以及具有不良预后因素的患者。造血干细胞移植的主要来源有脐带血,骨髓和动员外周血,但是其中造血干细胞的比例最多1%-5%,因此需通过体外扩增获得足够数量的造血干细胞。
目前体外培养扩增的造血干细胞的方法有:(1)添加细胞因子培养;(2)添加化学分子培养;(3)使用饲养层细胞培养;(4)基因修饰造血干细胞培养。上述体外培养的方法能使造血干细胞的数量增加,但存在几个问题:一是使用细胞因子和化学分子培养,造血干细胞在体外扩增过程中易发生分化,扩增后的造血干细胞降低了自我更新和重建造血的能力;二是使用饲养层培养,培养体系成分复杂,饲养层细胞是异体来源,应用于临床存在排斥和传染疾病的风险;三是用基因修饰造血干细胞培养,存在基因异常插入突变等风险;四是造血干细胞的培养需要先进行造血干细胞的分选再培养扩增,而分选成本过高且耗时费力。
技术实现要素:
本发明的目的在于提供一种脐带血来源的cd34+造血干细胞的培养方法,旨在解决现有的造血干细胞的培养方法存在体外扩增过程中易发生分化、异体来源存在排斥和传染疾病的风险、以及成本高的问题。
为实现上述发明目的,本发明采用的技术方案如下:
本发明提供一种cd34+造血干细胞的培养方法,包括以下步骤:
配置cd34+造血干细胞完全培养基,所述cd34+造血干细胞完全培养基包括细胞因子和化学分子,其中,所述细胞因子包括scf、flt-3l、tpo、il-6、ldl,所述化学分子包括sr1和um171;
提供脐带血,从所述脐带血分离pbmc;
采用所述cd34+造血干细胞完全培养基重悬所述pbmc,摇床培养;培养期间,每天添加新鲜的所述cd34+造血干细胞完全培养基,培养9-12天。
本发明提供的cd34+造血干细胞的培养方法,具有以下优点:
首先,使用新的细胞因子和化学分子组合(scf、flt-3l、tpo、il-6、ldl、sr-1和um171)作为cd34+造血干细胞的培养基成分,不仅能使cd34+造血干细胞在体外进行大量扩增,提高扩增效率;而且进一步的,该特定组成的细胞因子和化学分子,能够在cd34+造血干细胞的培养过程中,维持cd34+造血干细胞的培养的干性,保持其自我更新和重建造血的能力。
其次,直接利用脐带血分离出的外周血单个核细胞(pbmc)扩增培养cd34+造血干细胞,无需cd34+造血干细胞分选富集过程,极大地降低了成本。
此外,使用摇床培养,可以避免cd34+造血干细胞簇集于底部而无适合的营养和氧分布情况,减少cd34+造血干细胞体外培养过程中的分化。
附图说明
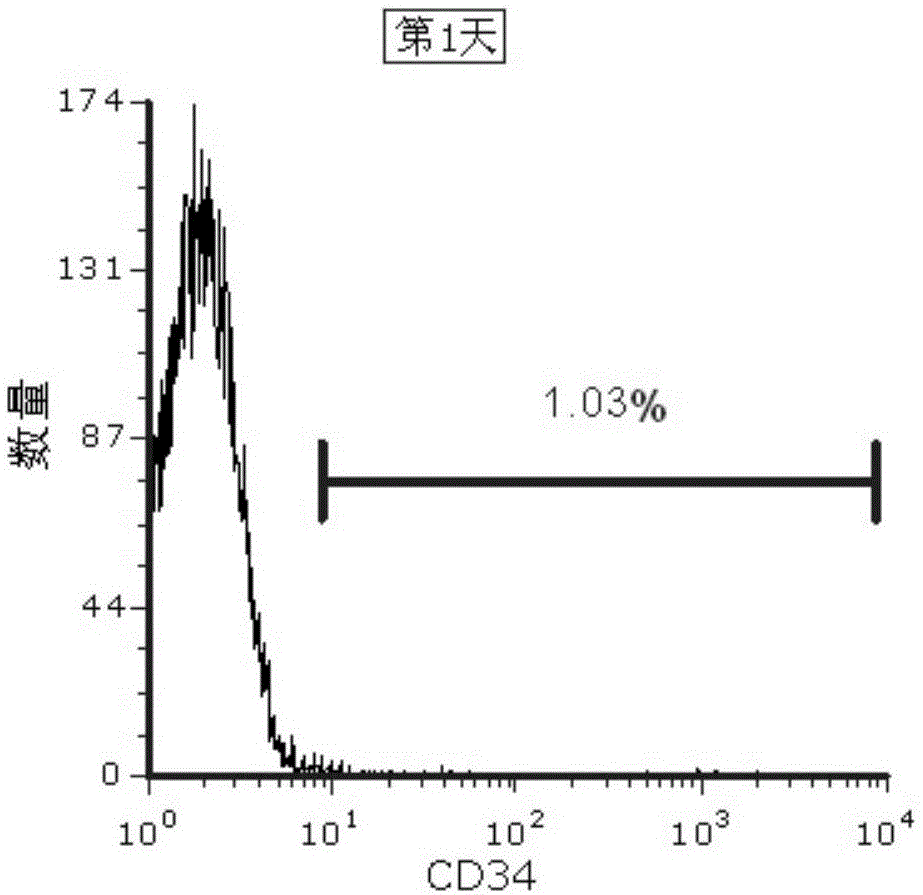
图1是实施例1与对比例1的cd34+造血干细胞培养第1天,cd34+造血干细胞培养计数和流式表型图;
图2是实施例1培养第9天,cd34+造血干细胞培养计数和流式表型图;
图3是对比例1培养第9天,cd34+造血干细胞培养计数和流式表型图;
图4是实施例1提供的cd34+造血干细胞培养的第2天的图片;
图5是实施例1提供的cd34+造血干细胞培养的第3天的图片;
图6是实施例1提供的cd34+造血干细胞培养的第5天的图片;
图7是实施例1提供的cd34+造血干细胞培养的第7天的图片;
图8是实施例1提供的cd34+造血干细胞培养的第9天的图片;
图9是对比例1提供的cd34+造血干细胞培养的第2天的图片;
图10是对比例1提供的cd34+造血干细胞培养的第3天的图片;
图11是对比例1提供的cd34+造血干细胞培养的第5天的图片;
图12是对比例1提供的cd34+造血干细胞培养的第7天的图片;
图13是对比例1提供的cd34+造血干细胞培养的第9天的图片;
图14是实施例1诱导分化的t细胞图片;
图15是对比例1诱导分化的t细胞图片;
图16是实施例1诱导分化的nk细胞图片;
图17是对比例1诱导分化的nk细胞图片;
图18是实施例1诱导分化的t细胞流式图;
图19是对比例1诱导分化的t细胞流式图;
图20是实施例1诱导分化的nk细胞流式图;
图21是对比例1诱导分化的nk细胞流式图。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
在本发明的描述中,需要理解的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
本发明实施例提供了一种cd34+造血干细胞的培养方法,包括以下步骤:
s01.配置cd34+造血干细胞完全培养基,所述cd34+造血干细胞完全培养基包括细胞因子和化学分子,其中,所述细胞因子包括scf、flt-3l、tpo、il-6、ldl,所述化学分子包括sr1和um171;
s02.提供脐带血,从所述脐带血分离pbmc;
s03.采用所述cd34+造血干细胞完全培养基重悬所述pbmc,摇床培养;培养期间,每天添加新鲜的所述cd34+造血干细胞完全培养基,培养9-12天。
本发明实施例提供的cd34+造血干细胞的培养方法,具有以下优点:
首先,使用新的细胞因子和化学分子组合(scf、flt-3l、tpo、il-6、ldl、sr-1和um171)作为cd34+造血干细胞的培养基成分,不仅能使cd34+造血干细胞在体外进行大量扩增,提高扩增效率;而且进一步的,该特定组成的细胞因子和化学分子,能够在cd34+造血干细胞的培养过程中,维持cd34+造血干细胞的培养的干性,保持其自我更新和重建造血的能力。
其次,直接利用脐带血分离出的外周血单个核细胞(pbmc)扩增培养cd34+造血干细胞,无需cd34+造血干细胞分选富集过程,极大地降低了成本。
此外,使用摇床培养,可以避免cd34+造血干细胞簇集于底部而无适合的营养和氧分布情况,减少cd34+造血干细胞体外培养过程中的分化。
具体的,上述步骤s01中,所述cd34+造血干细胞完全培养基中含有特定的细胞因子和化学分子组成,具体的,所述细胞因子包括scf、flt-3l、tpo、il-6、ldl,所述化学分子包括sr1和um171。上述特定的cd34+造血干细胞完全培养基,使得形成的cd34+造血干细胞完全培养基在cd34+造血干细胞培养过程中具有较高的扩增效率;更重要的是,扩增过程中,特定的cd34+造血干细胞完全培养基能够维持cd34+造血干细胞的培养的干性,保持其自我更新和重建造血的能力。特别的,选择sr1和um171组合,进一步与上述细胞因子组合,形成的培养环境,有利于培养过程中维持cd34+造血干细胞的干性。
所述cd34+造血干细胞完全培养基中,各细胞因子和化学分子的终浓度为,scf:50-500ng/ml,flt-3l:50-500ng/ml,tpo:30-300ng/ml,il-6:30-300ng/ml,ldl:5-50ug/ml,sr1:200-2000nm,um171:20-200nm。优选的,各细胞因子和化学分子的终浓度为:scf:50-500ng/ml,flt-3l:50-500ng/ml,tpo:30-300ng/ml,il-6:30-300ng/ml,ldl:5-50ug/ml,sr1:200-2000nm,um171:20-200nm。浓度在上述范围内,不仅能够提高扩增效率,维持cd34+造血干细胞的干性;而且,控制浓度在上述合理的范围内,可以避免培养基产生细胞毒性,影响cd34+造血干细胞的的培养。进一步优选的,scf80-200ng/ml,flt-3l80-200ng/ml,tpo40-150ng/ml,il-640-150ng/ml,ldl5-20ug/ml,sr1500-1000nm,um17120-100nm,浓度在上述范围内,在维持cd34+造血干细胞的干性的基础上,细胞快速稳定扩增的效果更佳。
本发明实施例中,所述cd34+造血干细胞完全培养基,通过下述方法配置:细胞因子scf、flt-3l、tpo、il-6、ldl使用无血清培养基溶解,化学分子sr1和um171用dmso溶解,将溶解后的细胞因子和化学分子添加到无血清培养基中,配置成cd34+造血干细胞完全培养基。该培养方法得到的cd34+造血干细胞完全培养基,具有较好的均匀性。
上述步骤s02中,直接利用脐带血分离出的外周血单个核细胞(pbmc)扩增培养cd34+造血干细胞,无需cd34+造血干细胞分选富集过程,极大地降低了成本。所述脐带血为抗凝脐带血,取所述脐带血之前,还包括将生物安全柜紫外照射处理,时间不低于30分钟。
优选的,从所述脐带血分离pbmc的方法,包括以下步骤:
s021.取脐带血置于离心管中,离心后去除上层富含血小板的血浆,加入pbs溶液稀释,得到稀释血样。
步骤s021中,将脐带血离心处理去除富含血小板的血浆,离心条件优选为3000rpm离心10min。离心结束后,加入pbs溶液稀释收集的血样,得到稀释血样。优选的,取脐带血置于离心管中,离心后去除上层富含血小板的血浆,加入pbs溶液稀释的步骤中,按照离心后的血样与pbs溶液的体积比为1:(1-2)的比例加入pbs溶液。若所述pbs溶液添加量过多,则所述稀释血样的浓度过低,在下述步骤中,收集到的pbmc减少。若所述pbs溶液添加量过少,则所述稀释血样的浓度过高,同样不利于pbmc的收集,更重要的是,由于稀释不够,在采用淋巴分离液分离红细胞和pbmc的过程中,难以将红细胞和pbmc有效分离,从而导致收集的pbmc中含有红细胞,进而影响pbmc的纯度,不利于pbmc中cd34+造血干细胞的培养。
s022.提供淋巴分离液置于离心管底部,沿壁加入所述稀释血样,且不破坏淋巴分离液液面,离心处理后,收集乳白色的pbmc层。
步骤s022中,采用淋巴分离液分离血样中的红细胞和pbmc。具体的,提供淋巴分离液并置于离心管底部,将所述沿壁加入所述稀释血样,所述稀释血样处于淋巴分离液液面之上。由于红细胞密度较淋巴分离液高,因此,血样中的红细胞在在淋巴分离液中,经过离心后会在离心管底部。经密度梯度离心后,样品分为四层:最底下为红色的红细胞层,最上面为淡黄色的血浆和pbs溶液混合层,中间的淋巴分离液中,上层为乳白色的pbmc层。去掉上层血浆和pbs溶液后,通过吸取可以收集乳白色的pbmc层。离心处理的条件为2000rpm离心20min。
值得注意的是,在加入所述稀释血样时,不能破坏淋巴分离液液面,否则,由于淋巴分离液与血样混合后,密度改变,使得其无法与红细胞形成有利于分离的密度差,从而不能实现红细胞和pbmc的分离。
优选的,提供淋巴分离液置于离心管底部,沿壁加入所述稀释血样的步骤中,按照脐带血与淋巴分离液的体积比为5:(3-4)的比例,添加淋巴分离液。若所述淋巴分离液添加量过低,不利于红细胞和pbmc的分离。具体的,淋巴分离液添加量过低,分层界面不明显,难以通过分层实现红细胞和pbmc的有效分离。
s023.用pbs溶液稀释收集的pbmc层样品后离心处理,去除上清液,用pbs溶液重悬细胞,离心后,去掉上清液,收集pbmc。
步骤s023中,由于吸取的pbmc层中,不可避免的含有淋巴分离液,因此,通过pbs溶液稀释收集的pbmc层样品,然后离心处理去除残留的淋巴分离液(上清液),以避免淋巴分离液的引入,对cd34+造血干细胞的培养造成不利影响。其中,离心条件可为1500rpm离心10min。
上述步骤s03中,采用所述cd34+造血干细胞完全培养基重悬所述pbmc,优选的,重悬后的pbmc密度为(1-10)×106个/ml。合适的pbmc密度,能够促进pbmc的生长。若所述pbmc密度过小,则细胞产生的促进相邻细胞生长的分泌物之间的交流变少,不能有效促进pbmc的生长,造成pbmc生长缓慢。若所述pbmc密度过大,则细胞生产空间变小,细胞之间产生接触抑制,从而会影响pbmc生长,降低pbmc扩增效率。
采用所述cd34+造血干细胞完全培养基重悬所述pbmc的步骤中,所述摇床培养的条件为:在二氧化碳培养箱,于37℃、5%co2的条件下培养。该条件有利于pbmc中cd34+造血干细胞的生长。
进一步的,所述摇床培养的条件还包括:培养体积不能超过培养瓶的50%,且在培养体积小于培养瓶体积30%时,摇床转速为100rpm/min,有利于细胞在稳定环境下生长;在培养体积大于等于培养瓶体积30%时,摇床转速为110-120rpm/min。培养体积大于等于培养瓶体积30%时,若摇床转速过低,细胞沉积底部不动就会贴壁而分化;若摇床转速过高,细胞无法成克隆生长。
更进一步的,为了保证合适的pbmc细胞密度,每天添加新鲜的所述cd34+造血干细胞完全培养基,添加的所述cd34+造血干细胞完全培养基满足:使得pbmc细胞密度为(1-10)×106个/ml。
本发明实施例采用所述cd34+造血干细胞完全培养基培养所述cd34+造血干细胞9-12天,培养时间过短,cd34+造血干细胞扩增数量不够;培养时间过长,则会有部分cd34+造血干细胞分化,无法维持cd34+造血干细胞的干性,降低了自我更新和重建造血的能力。
实施例1
一种cd34+造血干细胞的培养方法,包括以下步骤:
配置cd34+造血干细胞完全培养基,所述cd34+造血干细胞完全培养基包括细胞因子和化学分子,其中,所述细胞因子包括scf、flt-3l、tpo、il-6、ldl,所述化学分子包括sr1和um171,且各细胞因子和化学分子的最终浓度:scf:50-500ng/ml,flt-3l:50-500ng/ml,tpo:30-300ng/ml,il-6:30-300ng/ml,ldl:5-50ug/ml,sr1:200-2000nm,um171:20-200nm。
范围参考上面
提供脐带血,将25ml脐带血放到50ml的离心管中,3000rpm10min离心后,去除上层富含血小板的血浆,按照离心后的血样与pbs溶液的体积比为1:1的比例,向每支离心管加入pbs溶液稀处理。按照脐带血与淋巴分离液的体积比为5:3的比例,吸取淋巴分离液加入到离心管底部,然后将稀释血样沿离心管壁缓慢的加入至淋巴分离液的液面,不破坏淋巴分离液液面,2000rpm离心20min。离心结束后,离心管中可看到四层,最底下的红色一层为红细胞层,最上面淡黄色的一层为血浆和pbs溶液混合层,中间淋巴分离液上乳白色一层为pbmc层。先去掉上层血浆和pbs溶液,然后吸取乳白色层的pbmc到离心管中,用pbs溶液稀释混匀,1500rpm离心10min。离心结束后,去掉上清液,用pbs溶液重悬细胞到离心管中,取样计数,1200rpm离心10min后,去掉上清液,收集pbmc。同时取细胞1×106个进行流式检测cd34+造血干细胞比例。
采用所述cd34+造血干细胞完全培养基重悬所述pbmc,重悬后的pbmc细胞密度为5×106个/ml,将培养瓶竖直放到摇床上,摇床转速100rpm/min,置于二氧化碳培养箱,37℃,5%co2中培养;每天添加新鲜的cd34+造血干细胞完全培养基使得pbmc细胞密度为(1-10)×106个/ml,培养9-12天。
对比例1
与实施例1的不同之处在于,配置cd34+造血干细胞完全培养基中,不含化学分子。
实施例1与对比例1的cd34+造血干细胞培养第1天,cd34+造血干细胞培养计数和流式表型图如图1所示,由图1可见,实施例1和对比例1的细胞计数均为5.2×107个,实施例1和对比例1的cd34+造血干细胞的比例均为1.03%。培养第9天,实施例1的cd34+造血干细胞培养计数和流式表型图如图2所示,对比例1的cd34+造血干细胞培养计数和流式表型图如图3所示,由图2、图3可见,对比例1的细胞计数为1.0×108个,实施例1的细胞计数为1.55×108个;对比例1的cd34+造血干细胞的比例为16.03%,实验组的cd34+造血干的比例为33.69%。可见,本发明实施例提供的cd34+造血干细胞的培养方法。具有很高的扩增效率。
实施例1提供的cd34+造血干细胞培养的第2、3、5、7、9天的图片如图4-8所示,对比例1提供的cd34+造血干细胞培养的第2、3、5、7、9天的图片如图9-13所示。cd34+造血干细胞成克隆团生长,细胞状态越好,细胞形成的克隆团越多,克隆团越大。从细胞生长图片就可以看出,实验组的细胞克隆团比对照组的,不仅数目多,而且体积大,说明实验组的培养效果比对照组效果好。
分别在相同的条件下,将实施例1和对比例1得到的cd34+造血干细胞诱导分化成t细胞和nk细胞。实施例1诱导分化的t细胞如图14所示,对比例1诱导分化的t细胞如图15所示;实施例1诱导分化的nk细胞如图16所示,对比例1诱导分化的nk细胞如图17所示。
实施例1诱导分化的t细胞流式图如图18所示,对比例1诱导分化的t细胞流式图如图19所示;实施例1诱导分化的nk细胞流式图如图20所示,对比例1诱导分化的nk细胞流式图如图21所示。由图18-21可见,本发明实施例提供的方法得到的cd34+造血干细胞诱导分化成t细胞和nk细胞的流式图。
造血干细胞的干性越强,我们诱导分化的目的细胞就越多。由图14-21显示,将造血干细胞诱导分化成t细胞,同一个诱导条件,实施例造血干细胞的干性较对比例强,分化得到的目的细胞t细胞、nk细胞更多。图1-3、18-21中,横坐标cd3,图20-21中,纵坐标cd56。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!