白色脂肪棕色化关键早期调控因子FGF9的应用的制作方法
本发明涉及基因的功能与应用
技术领域:
,具体涉及一种白色脂肪棕色化关键早期调控因子fgf9的应用。
背景技术:
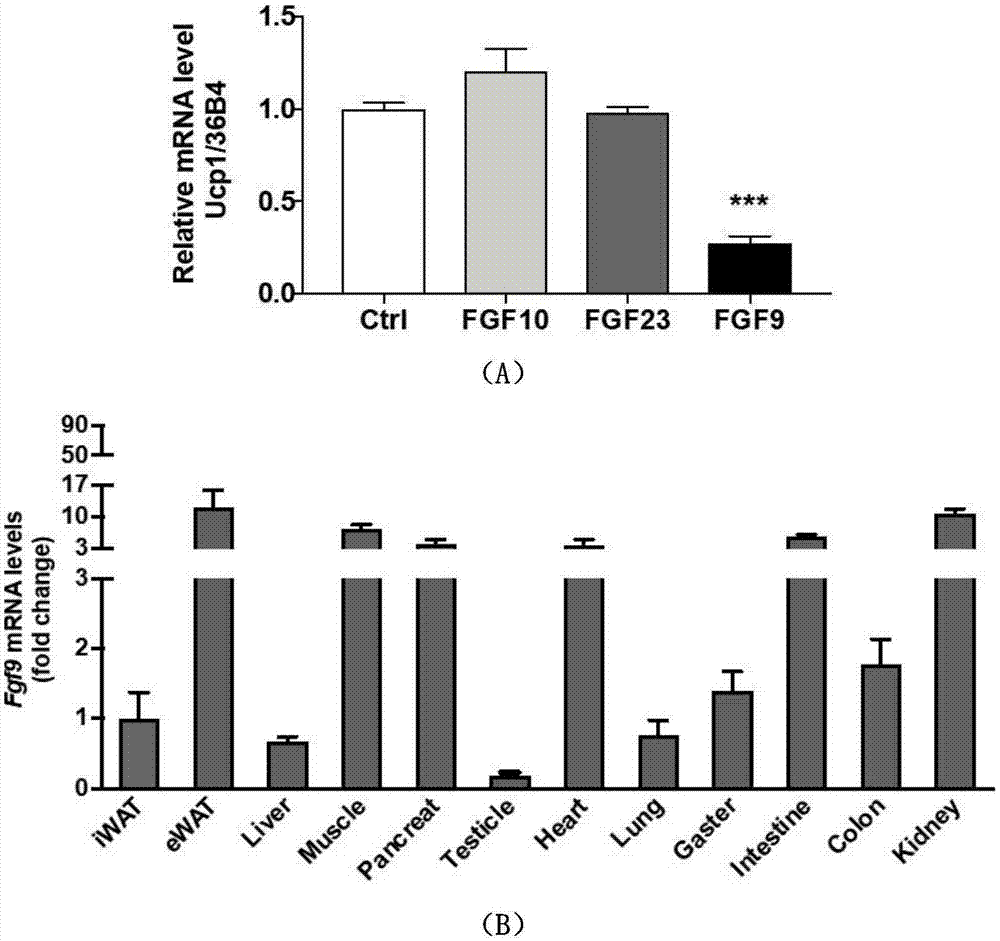
能量过剩所导致的脂肪细胞大量累积并异位沉积是肥胖症发生的主要原因。随着对脂肪细胞研究的深入,人们逐渐认识到脂肪细胞的多样性,其不仅包含有储存能量的白色脂肪细胞,还有可以消耗能量的棕色脂肪细胞,更重要的是,人们还发现了可以由储能向耗能转换的米色(beige)脂肪细胞,并由此引出了白色脂肪棕色化的概念。由于在白色脂肪棕色化的过程中,脂肪细胞中所储能量可以直接且有效的被消耗,因此可以带来包括体重减轻在内的多种代谢获益,成为近年来肥胖症研究中的热点。找到合适的作用靶点,促进分布于白色脂肪组织中的米色脂肪细胞产热耗能增加,是目前白色脂肪棕色化研究中的关键目标。脂肪细胞耗能产热的过程主要依赖于其上解偶联蛋白(uncouplingprotein1,ucp1)的表达上调。ucp1通过使脂肪细胞内线粒体氧化呼吸链解耦联,从而导致其摄取的能量无法转化为atp而储存,转而以热能形式释放。ucp1的表达依赖于一系列转录因子的共同参与,如pgc1a、prdm16、ebf2和ehmt1等,这些分子共同组成了一个复杂的脂肪细胞产热调控网络,共同参与调控白色脂肪棕色化的过程。随着研究的深入,近年来不断有可以调控该网络的分子被报道,如bmp7、irisin等。fgf9作为经典型fgf家族成员之一,其分布遍布于人体的脑、肾、运动神经元和发育中的骨等组织中,主要通过旁分泌方式调控神经元和胶质细胞的多项生理功能,此外该分子还被报道可以调控小鼠肺细胞的发育、损伤修复和再生过程,抑制长骨生长,但目前还暂无fgf9在脂肪细胞能量代谢方面的报道。技术实现要素:本发明的目的在于提供一种白色脂肪棕色化关键早期调控因子fgf9的应用;该fgf9基因可作为靶点基因用于制备治疗或预防肥胖症药物。本发明的目的是通过以下技术方案来实现的:第一方面,本发明涉及一种fgf9基因在作为白色脂肪棕色化关键早期调控因子中的用途。所述fgf9对白色脂肪棕色具有负性调控关系。fgf9可抑制白色脂肪棕色化。下调或抑制fgf9可促进白色脂肪棕色化。优选的,所述fgf9基因通过激活脂肪细胞分化早期的hifla通路来抑制白色脂肪棕色化。第二方面,本发明涉及一种fgf9基因在制备治疗或预防肥胖症药物中的用途。优选的,所述药物中fgf9基因作为靶点基因。所述药物是通过下调或抑制fgf9来促进白色脂肪棕色化,进而治疗或预防肥胖症。第三方面,本发明涉及一种药物组合物,所述药物组合物是以fgf9基因为靶点,还包括至少一种可药用的载体、稀释剂和赋形剂。优选的,所述药物用于治疗2型糖尿病、肥胖、异常血脂症或代谢综合征。所述药物组合物通过下调或抑制fgf9来促进白色脂肪棕色化,进而治疗2型糖尿病、肥胖、异常血脂症或代谢综合征。因此,所述药物组合物中包括fgf9抑制剂。与现有技术相比,本发明为肥胖症提供了新的治疗靶点。本发明发现fgf9可以抑制白色脂肪棕色化,且成剂量依赖性,敲除脂肪细胞内源性fgf9可以促进脂肪细胞产热能力上升;rna测序结果显示fgf9可以引起脂肪细胞早期分化阶段的hifla信号通路增强;进而实现为肥胖症提供了新的治疗靶点。附图说明通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:图1为fgf9的表达情况;其中,a为fgf9、fgf10、fgf23对ucp1表达的影响;b为fgf9在多个器官中的表达情况;图2为fgf9抑制白色脂肪棕色化示意图;其中,a、冷冻前、冷冻4小时和冷冻24小时后,小鼠白色脂肪上fgf9的表达情况;b、分别向白色脂肪原代细胞(svf)加入pbs和fgf9100ng/ml后开始棕色化诱导,诱导完成后通过油红染色观察细胞脂滴数量的变化;图3为分别向白色脂肪原代细胞(svf)加入pbs、0.1ng/ml、1ng/ml、10ng/ml、25ng/ml和100ng/mlfgf9后开始棕色化诱导,诱导完成后产热相关基因ucp1(a)、pgcla(b)、prdm16(c)、cidea(d)的表达情况;图4为分别向白色脂肪原代细胞(svf)加入pbs、0.1ng/ml、1ng/ml、10ng/ml、25ng/ml和100ng/mlfgf9后开始棕色化诱导,诱导完成后脂肪生成相关基因pparg(a)、fabp4(b)、cebpa(c)、cebpb(d)的表达情况;图5为分别向白色脂肪原代细胞(svf)加入pbs和fgf9100ng/ml后开始棕色化诱导,诱导完成后通过通过westernblot观察ucp1蛋白的表达(a),通过seahorse检测细胞氧耗的变化(b);图6为分别向未分化的白色脂肪原代细胞(svf)中转入空载质粒(ad-gfp)和fgf9过表达质粒(ad-fgf9)后进行棕色化诱导分化,在诱导完成后检测细胞fgf9、产热相关基因及脂肪生成相关基因的mrna表达情况(a),以及其ucp1、pgc1a蛋白水平表达情况(b)和细胞氧耗的变化(c);图7为fgf9下调促进白色脂肪棕色化示意图;a、分别向未分化的白色脂肪原代细胞(svf)中转入空载病毒(lv)和两条fgf9干扰慢病毒(fgf-shrna-1、fgf9-shrna-2)后进行棕色化诱导分化,脂肪细胞内源性fgf9的表达情况;b、油红染色检测脂滴数目的变化;图8中,a为fgf9下调促进白色脂肪棕色化实验中rt-pcr检测脂肪产热基因及脂肪生成相关基因mrna的表达情况;b为westernblot检测ucp1、pgc1a蛋白表达情况;图9a、b为fgf9下调促进白色脂肪棕色化实验中seahorse检测细胞氧耗量的变化;图10为在fgf9的作用下,脂肪棕色化诱导过程中产热相关基因ucpl(a)、pgcla(b)、cidea(c)、prdm16(d)的动态变化情况;图11为在有无fgf9的情况下,对小鼠白色脂肪原代细胞棕色化过程进行rna测序的实验流程图;图12为依据各组细胞所表达的基因对各组进行聚类,以观察样本的可比性和差异性;图13通过火山图展示在开始诱导后的fgf9所引起的差异基因分布;其中,a为第0天,b为第1天,c为第2天;图14为由fgf9在棕色化开始后第一天和第二天内发生变化的基因所生成的热图;图15为对图8中第一天和第二天持续上调或下调的基因进行kegg通路分析的结果;其中,a为针对持续上调的基因,b为针对持续下调的基因;图16为rt-pcr验证hifla通路相关基因改变示意图。具体实施方式下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。以下各实施例涉及的试验方法如下:a)小鼠冷冻实验先将小鼠放置常温适应数天,然后置入4℃冷库;每天保持观察小鼠状态,避免小鼠断水断食,持续十天;待冷冻十天后,低温下处死小鼠,并立即眼眶取血,然后取下皮下脂肪组织、内脏脂肪组织和棕色脂肪组织,并冻存备用。b)小鼠组织取材小鼠禁食12小时后,腹腔注射10%水合氯醛并处死,取材内容包括:皮下脂肪组织、内脏脂肪组织及棕色脂肪组织。c)脂肪原代细胞诱导分化相关实验1)分离脂肪原代细胞(stromalvascularfraction,svf)将准备好的dmem/f12培液倒入6cm皿中备用;将小鼠颈椎脱臼处死,并浸入75%乙醇中15分钟;按照上述组织取材方式,将小鼠腹股沟的皮下脂肪组织和附睾旁内脏脂肪组织分离出并置入所备培液中备用;待所需脂肪组织均被分离后,将培养基中的组织取出,在无菌容器中用无菌剪刀剪碎后转移至已备好的hepes溶液(含有胶原酶ii)中,用50ml离心管装好并封口;立即放入已备好的37℃水浴锅,最大振速,振荡30-35分钟后,待无明显组织块时立即停止消化;将消化好的细胞液,4℃离心,2400rpm,10分钟;弃去顶层漂浮物(即成熟脂肪细胞),下层沉淀即为所需svf;加入约5mldmem/f12培养基,重悬后,过40μm筛网至一新50ml离心管;再次离心:4℃*2400rpm*10min;弃上清,加入5ml10%fbsdmem/f12培养基,重悬后,铺6cm细胞培养皿。轻晃培养皿,使细胞均匀;放入二氧化碳细胞孵箱;3h待细胞贴壁后,用pbs洗3遍后,用力摇晃使其中杂质细胞漂浮,洗掉杂质细胞后,加入5ml10%fbsdmem/f12培养基;放入二氧化碳细胞孵箱,待细胞增殖至细胞皿的90-100%后,开始按照实验设计铺板。2)脂肪原代细胞铺板1.待上述分离后的svf增殖至90-100%后,将其从孵箱中取出,吸干培养基并用pbs清洗,然后加入含edta的胰酶消化液1-2ml,放回孵箱约30秒后,取出显微镜下观察细胞是否漂浮,若消化效果不佳,继续消化至1分钟2.待消化结束后,迅速加入与胰酶等体积的培养基终止消化,并将细胞轻柔吹落,转移至新的50ml离心管中,然后以900rmp离心2min;3.弃掉上清,再加入2ml新的培养基,吹匀后,计数;4.计数后按照4x104/孔铺入细胞板(此数目适用于48孔板,若其他孔数板,在此基础上按比例调整细胞数目),具体铺的孔数按照实验设计有所不同5.铺板后,平缓晃动细胞板,从而使细胞均匀分布;6.轻柔的放入二氧化碳孵,备用7.第二天待细胞贴壁后,可按照实验设计向细胞中加入不同处理。3)白色脂肪棕色化诱导诱导分化液配制,配置方案如下表1:表1诱导方案:待铺板后的细胞增殖至90-100%后,加入a液4天+b液4天,每隔两天换一次液。d)fgf9加药诱导实验分别在开始诱导的-3、0、2、4、6天重组fgf9(购于r&d公司),浓度分别为0.1ng/ml、1ng/ml、10ng/ml、25ng/ml、100ng/ml;第8天停止诱导,收细胞,以备下一步实验。e)fgf9-knockdown实验构建fgf9干扰慢病毒(由上海吉玛生物有限公司完成),相关信息如下:表2名称序列lv(空载)ttctccgaacgtgtcacgtfgf9-shrna-1gtcacggacttggatcatttafgf9-shrna-2cttccaacctctataaacatg将增殖满后的svf细胞,按照4x104个/孔,铺至48孔板。铺板后过夜,然后换液,并加入按照5ug/ml浓度加入polybrene,然后按照实验计划加入lv,fgf9-shrna-1,fgf9-shrna-2,moi值=100。加入shrna后8-12小时后,换出含有polybrene的培养基,加入新培养基,待2天后待细胞长满至后,开始正常诱导正常诱导。f)细胞氧耗及代谢率测定(seahorse)1)seahorse铺板取v28型号seahorse细胞培养板,用poly-l-lycin50μl包被其孔底,然后置于细胞孵箱里30-60分钟,以增强其对细胞的亲和力。包被完成后吸去poly-l-lycin,并每孔用pbs清洗3遍;除了1a、2d、3c、4f孔,其余孔铺入细胞,细胞数量为4000个/孔,培液体积为100μl,铺入细胞后,将细胞培养板置于细胞孵箱中待细胞贴壁后(大约3-6小时),补入150μl/孔的培液2)seahorse上机检测用bca法检测每孔蛋白浓度,再用该浓度其校正seahorse及其所检测出的氧耗量,最终得到单位细胞的氧耗量进行比较。g)分子生物学实验步骤1)rna抽提/逆转录/rt-pcr检测所用引物如下表3:表3引物序列mfgf9-facagtggactctacctcggcatmfgf9-rggttggaagagtaggtgttgtacchfgf9-fatggctcccttaggtgaagtthfgf9-rcccaggtggtcacttaacaaaacmcebpa-fcaagaacagcaacgagtaccgmcebpa-rgtcactggtcaactccagcacmcebpb-facgacttcctctccgacctctmcebpb-rcgaggctcacgtaaccgtagtmfabp4-facaccgagatttccttcaaactgmfabp4-rccatctagggttatgatgctcttcah)rna-seq检测(测序部分由上海伯豪生物有限公司完成)其中,1)一链cdna合成(synthesizefirststrandcdna):配制mix:1μlsuperscriptii加9μlfirststrandsynthesisactdmix;加入8μl的mix到第一章片断化后的样品中,混合均匀;将样品放置在pcr仪上,运行如下表4的程序:表42)二链cdna合成(synthesizesecondstrandcdna)一链合成结束后,在样品中加入5μl的resuspensionbuffer;再加入20μl的secondstrandmarkingmastermix,混合均匀;将样品放置在pcr仪上,运行如下程序:16℃forlhourholdat4℃。3)pcr扩增(amplification):加入5μl的pcrprimercocktail到每个样品中;加入25μl的pcrmastermix到每个样品中,混合均匀。将样品放置在pcr仪上,运行程序,程序设定如下表5:表54)文库质检(qcthelibrary)取1μl文库dna,用qubit2.0fluorometer定量。用agilent2100进行大小分布的检测,条带分布在350bp左右。-20℃保存文库样本。5)cluster生成按照cbotuserguide所示相应流程,在illumina测序仪配套的cbot上完成cluster生成和第一向测序引物杂交。6)上机测序按照illumminauserguide准备测序试剂,将携有cluster的flowcell上机。选用paired-end程序,进行双端测序。测序过程由illumina提供的datacollectionsoftware进行控制,并进行实时数据分析。实施例1、fgf9高表达于脂肪组织且可抑制ucp1表达的验证选择具有旁分泌功能的fgf9、fgf10以及和fgf21同样具有内分泌功能的fgf23,检测其对白色脂肪棕色化的作用。具体为向体外分化的脂肪原代细胞中加入上述三种重组蛋白,观察它们在小鼠棕色脂肪组织、小鼠皮下白色脂肪组织、小鼠内脏白色脂肪组织等等中的表达。通过本实施例的实验可以观察到,加入fgf9后,分化完成后的脂肪细胞中所表达的ucp1显著下降(图1a),而其他fgf蛋白并未对ucp1表达产生影响,提示fgf9可以抑制白色脂肪棕色化。因此将注意力转移至fgf9,并在全身多个器官检测了fgf9的表达,发现fgf9广泛表达于全身各器官,并且在内脏脂肪组织中具有很高的表达(图1b),进一步提示该蛋白在脂肪细胞功能中的重要作用。实施例2、fgf9抑制白色脂肪棕色化的验证为了进一步验证fgf9在白色脂肪棕色化中的抑制作用。本实施例首先比较了寒冷刺激下和常温状态下,小鼠皮下白色脂肪中的fgf9的表达变化。进一步分离小鼠白色脂肪原代细胞(svf),并在体外向棕色脂肪方向诱导,以模拟白色脂肪棕色化过程,并在诱导过程中加入不同剂量的fgf9;观察fgf9干预组的细胞脂滴、脂肪细胞产热基因ucp1、pgc1α、cidea、prdm16的表达水平、ucp1蛋白水平、细胞氧耗量等。最后,构建了fgf9过表达质粒,并通过转染将其转入未分化的白色脂肪svf中,然后将其向棕色脂肪方向诱导;观察fgf9过表达组的上述产热基因和成脂相关基因的表达水平、细胞氧耗量等等。通过本实施例的实验可以发现,随着寒冷刺激的时间增长,白色脂肪组织中的fgf9表达显著下降(图2a),进一步支持fgf9对白色脂肪棕色化的抑制作用。诱导实验中,fgf9干预组的细胞脂滴明显减少(图2b),脂肪细胞产热基因ucp1、pgc1α、cidea、prdm16的表达水平随着fgf9浓度增高而呈剂量依赖性降低(图3a-d),与此同时脂肪生成相关基因cebpa、cebpb、pparg、fabp4也呈现同样的下降趋势(图4a-d)。fgf9干预组的ucp1蛋白水平也明显下降(图5a),seahorse细胞代谢测定仪(图5b)显示fgf9干预组的细胞氧耗量显著下降,这些结果均说明fgf9可以抑制白色脂肪棕色化。real-timepcr结果显示在fgf9成功过表达的情况下,fgf9过表达组的上述产热基因和成脂相关基因明显降低(图6a、b),氧耗减弱(图6c),进一步证实了fgf9抑制白色脂肪棕色化的作用。实施例3、敲低脂肪细胞内源性fgf9促进白色脂肪棕色化的验证本实施例为了进一步验证生理状态下脂肪内源性fgf9是否参与调控脂肪细胞产热能力,构建了两株针对fgf9的shrna干扰慢病毒,并在未分化的白色脂肪原代细胞svf中敲低内源性fgf9,然后进行体外棕色化诱导。通过本实施例的实验可以观察到,在成功干扰脂肪内源性fgf9表达水平的情况下(图7a),诱导完成后的细胞脂滴明显增多(图7b),产热基因细胞表达明显上调,但成脂相关基因并未出现明显变化(图8a)。westernblot显示,抑制fgf9表达后ucp1和pgcla的表达明显升高(图8b)。seahorse细胞代谢测定显示,细胞基础和解耦联的氧耗均显著升高(图9a、b)。以上结果说明抑制脂肪细胞内源性fgf9显著促进白色脂肪棕色化,进一步明确了内源性fgf9对白色脂肪棕色化的负性调控关系。实施例4、fgf9激活脂肪细胞分化早期阶段hifla信号通路并抑制早期分化阶段产热基因表达的验证为了探索fgf9抑制白色脂肪棕色化的分子机制,本实施例首先检测了在fgf9的影响下,脂肪细胞产热基因在命运决定阶段和细胞分化阶段的动态表达情况。观察到,fgf9对产热基因所产生的抑制效果最早在细胞分化阶段的第二天开始出现(图10a-d),说明fgf9抑制棕色化的分子机制主要发生在分化早期。进一步的,本实施例在fgf9干预的情况下,针对细胞分化早期阶段(分化开始后第0天、第1天和第二天)的脂肪细胞进行rna测序(如图11);并对测序结果进行聚类分析。通过上述rna测序可以发现,不同干预组的样本非常清晰的被分为6组(图12a),进一步pca聚类分析发现,在细胞分化第0天以及第1天fgf9刺激并未引起基因聚类发生明显改变,而在细胞分化开始后的第2天,基因聚类发生了明显的差异(图12b),进一步支持产热基因发生差异的时间点。深入分析三个时间点的差异基因发现,在分化刚开始的第0天,fgf9仅引起22个基因上调,33个基因下调(图13a);说明fgf9并未引起命运决定阶段的明显分子变化,而在随后的两个时间点中(细胞分化后的第1天和第2天),相继观察到差异基因的数量逐渐增多(图13b、c)。在排除了生理性细胞分化所引起的差异基因后,观察到fgf9在脂肪分化的第1天,可以逆转146个下调基因和130个上调基因的变化趋势,在第2天可以逆转338个下调基因和293个上调基因(图14)。接下来对这些差异基因进行了kegg通路分析,发现这些差异基因可以富集于多条通路,其中hif1信号通路持续在第1天和第2天上调,而癌症相关通路持续下调。进一步分别对两天内持续上调(112个)和下调(71个)的基因做kegg通路分析,发现了相同的通路变化结果(图15a、b)。通过rt-pcr对hifla通路的相关基因进行了验证,观察到hifla的表达于棕色化诱导后第一天和第二天显著升高,其下游信号基因也在这两个时间点发生了相一致的变化(图16),这提示,fgf9刺激可能促进脂肪细胞早期缺氧,而与此同时,细胞棕色化、产热相关基因表达显著降低。以上结果说明fgf9可能通过引起脂肪细胞缺氧而抑制白色脂肪棕色化的过程。综上所述,本发明发现fgf9可以抑制白色脂肪棕色化,且成剂量依赖性,敲除脂肪细胞内源性fgf9可以促进脂肪细胞产热能力上升;rna测序结果显示fgf9可以引起脂肪细胞早期分化阶段的hifla信号通路增强;进而实现为肥胖症提供了新的治疗靶点。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1