一种治疗阿尔茨海默症的血浆蛋白分离物及其制备方法和应用与流程
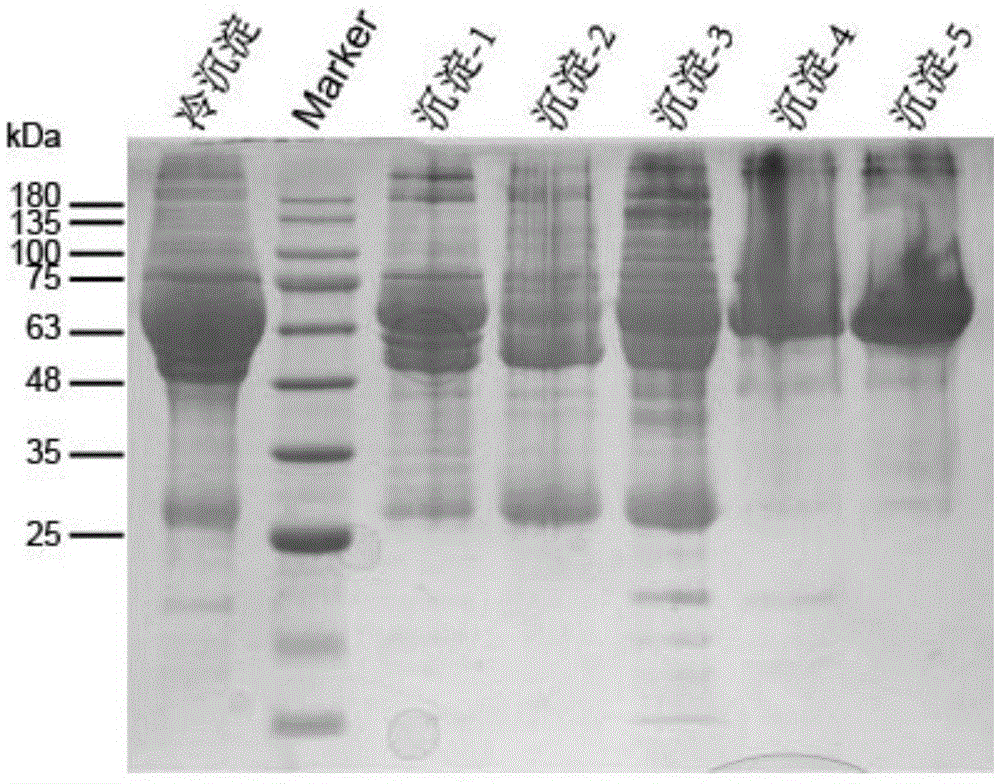
本发明属于分子生物学领域,涉及一种血浆蛋白分离物,具体地,涉及一种治疗阿尔茨海默症的血浆蛋白分离物及其制备方法和应用。
背景技术:
:阿尔茨海默症(alzheimer’sdisease,ad)又称早老性痴呆,是一种由神经元丢失导致的脑中枢神经系统退行性疾病,在老年人群中该病的发病率约为4%-8%。1906年,德国神经病理学家阿尔茨海默首次报告了一例具有进行性记忆力下降表现的51岁女性患者。1910年,以命名和分类大脑疾病著称的精神病学家emilkraepelin提议将此病命名为阿尔茨海默症。该病常见的临床表现为进行性记忆力和认知力减退、语言障碍、精神运动异常等,对患者的正常生活造成严重影响,同时也给家庭和社会带来沉重的负担。随着人口老龄化时代的到来,阿尔茨海默症成为危害公共健康的主要疾病之一,全球几乎3.5亿人口受到其影响。ad是一种最为常见的神经退行性病变,其主要病理特征是淀粉样斑块(即老年斑,senileplaque,sp)沉积、神经原纤维缠结(neurofibrillarytangles,nfts)和神经元丢失。由于ad的病因和发病机制尚不明确,目前临床上尚没有药物能够逆转或阻止病情发展。在衰老研究领域,有很多科学家通过异体共生方式将年轻小鼠与年迈小鼠的循环系统连接在一起。在心脏、大脑、肌肉、肝脏与骨骼组织中,年轻血液似乎能逆转衰老带来的影响,使年迈小鼠变得更加强壮、聪明和健康,因此认为在年轻人血液中存在能够逆转衰老的因子。随之而来,多种抗衰老因子被鉴定出来,如催产素;生长分化因子-11;timp-2等。血浆是血液的液体成分,其组成及其复杂,包括蛋白质、脂类、无机盐、糖、氨基酸、代谢废物以及大量的水。血液制品是从人血浆中分离制备的有明确临床应用意义的血浆蛋白制品的总称。美国哈佛大学e.j.cohn教授及其同事们于1946年创建了低温乙醇法人血浆蛋白分离技术(被称为cohn6法),并用该工艺分离制备出第一种血浆制品,即人血浆白蛋白。随后于1949年cohn又发表了用于分离制备丙种球蛋白的cohn9法。cohn6+9法,即低温乙醇分离法,形成了工业化人血浆蛋白分离的完整系统。但是,目前专门针对于阿尔茨海默症的血浆蛋白提取物的低温乙醇分离方法、和得到的血浆蛋白分离物还尚未报道。技术实现要素:本发明的目的在于提供一种治疗阿尔茨海默症的血浆蛋白分离物及其制备方法和应用。本发明的目的是通过以下技术方案实现的:一种治疗阿尔茨海默症的血浆蛋白分离物,所述血浆蛋白分离物包括:α、β球蛋白,铜蓝蛋白,运铁蛋白,结合珠蛋白以及白蛋白,所述血浆蛋白分离物的制备方法依次包括:从血液中分离血浆步骤,对血浆进行冷沉淀去除步骤,对所述冷沉淀去除步骤得到的上清液进行第一次低温乙醇沉淀的步骤,对所述第一次低温乙醇沉淀步骤得到的上清液进行第二次低温乙醇沉淀的步骤,对所述第二次低温乙醇沉淀步骤得到的上清液进行第三次低温乙醇沉淀的步骤,对所述第三次低温乙醇沉淀步骤得到的上清液进行第四次低温乙醇沉淀的步骤,取所述第四次低温乙醇沉淀后得到的沉淀物作为所述血浆蛋白分离物。作为优选的实施方式,所述制备方法还包括:亲和层析法去除所述血浆蛋白分离物中igm的步骤和除菌步骤;优选地,所述亲和层析法去除所述血浆蛋白分离物中igm步骤中,亲和层析处理采用的亲和层析预装柱的填料优选为2-巯基吡啶连接琼脂糖;更优选地,所述亲和层析处理的步骤包括:利用1-10倍,优选为5倍柱体积的结合液平衡层析柱;再将所述血浆蛋白分离物上样;再利用10-20倍,优选为15倍柱体积的结合液洗出蛋白组分并检测,得到去除igm的所述血浆蛋白分离物;优选地,所述除菌步骤中,将所述去除igm的所述血浆蛋白分离物过滤除菌,得到无菌的所述血浆蛋白分离物;更优选地,所述过滤除菌的滤膜为0.22μm低蛋白吸附的pvdf膜,压力为不超过10bar,更优选为5bar;优选地,所述血浆蛋白分离物的sds-page变性胶电泳至少包括8条条带,所述条带的分子量为:9kd,16kd,40kd,25kd,50kd,57kd,70kd,132kd。作为优选的实施方式,所述分离血浆步骤中,收集血液,再通过离心收集上清液,得到血浆;再将所述血浆冷冻为新鲜冷冻血浆;优选地,所述离心中,离心力为500-1200g,时间为10-30分钟,离心温度为0-8℃;更优选地,所述离心力为900g,时间为20分钟,离心温度为4℃;优选地,所述冷冻温度为小于等于零下30℃,更优选为零下40℃。作为优选的实施方式,所述冷沉淀去除步骤中,将所述新鲜冷冻血浆在2-6℃下融化后进行离心,其中上清液为抗凝血浆,沉淀物为冷沉淀;优选地,所述离心中,离心力为1000-5000g,时间为5-20分钟,离心温度为0-8℃;更优选地,所述离心力为3000g,时间为10分钟,离心温度为4℃。作为优选的实施方式,所述第一次低温乙醇沉淀步骤中,向所述冷沉淀去除步骤得到的上清液中加入乙醇溶液、ph调节剂,形成第一次低温乙醇沉淀体系,在所述第一次低温乙醇沉淀体系中,乙醇体积百分含量为5-10%,温度为0至-5℃,蛋白浓度为3-10g/dl,离子强度为0.10-0.20mol/kg,ph值为7.1-7.3;然后将该体系于0至-5℃条件下搅拌0.5-2h,随后进行分离处理,得到第一分离组分沉淀物和第一分离组分上清液;优选地,在所述第一次低温乙醇沉淀体系中,所述乙醇体积百分含量为8%,温度为-3℃,蛋白浓度为5.1g/dl,离子强度为0.14mol/kg,ph值为7.2;优选地,所述搅拌的温度为-3℃,时间为1h;第二次低温乙醇沉淀理步骤中,向所述第一分离组分上清液中加入乙醇溶液、ph调节剂,形成第二次低温乙醇沉淀体系,在所述第二次低温乙醇沉淀体系中,乙醇体积百分含量为22-28%,温度为0至-10℃,蛋白浓度为1-5g/dl,离子强度为0.05-0.20mol/kg,ph值为6.7-7.0;再将该体系于0至-10℃条件下搅拌3-8h,随后进行分离处理,得到第二分离组分沉淀物和第二分离组分上清液;优选地,在所述第二次低温乙醇沉淀体系中,所述乙醇体积百分含量为25%,温度为-5℃,离子强度为0.09mol/kg,蛋白浓度为3.0g/dl,ph值为6.9;优选地,所述搅拌的温度为-5℃,时间为5h;第三次低温乙醇沉淀步骤中,向所述第二分离组分上清液中加入乙醇溶液、ph调节剂,形成第三次低温乙醇沉淀体系,在所述第三次低温乙醇沉淀体系中,乙醇体积百分含量为15-20%,温度为0至-10℃,蛋白浓度为1.0-2.0g/dl,离子强度为0.05-0.20mol/kg,ph值为5.0-5.4;再将该体系于0至-10条件下搅拌0.5-2.0h,静置大于等于6h,随后进行分离处理,得到第三分离组分沉淀物和第三分离组分上清液;优选地,在所述第三次低温乙醇沉淀体系中,所述乙醇体积百分含量为18%,温度为-5℃,蛋白浓度为1.6g/dl,离子强度为0.09mol/kg,ph值为5.2;优选地,所述搅拌的温度为-5℃,时间为1h,所述静置的时间为12h;第四次低温乙醇沉淀步骤中,向所述第三分离组分上清液中加入乙醇溶液、ph调节剂,形成第四次低温乙醇沉淀体系,在所述第四次低温乙醇沉淀体系中,体系的乙醇体积百分含量为35-45%,温度为0至-10℃,蛋白浓度为0.05-2.0g/dl,离子强度为0.05-0.20mol/kg,ph值为5.7-6.0;再将该体系于0至-10℃搅拌0.3-1h,随后进行分离处理,得到第四分离组分沉淀物和第四分离组分上清液;优选地,在所述第四次低温乙醇沉淀体系中,所述乙醇体积百分含量为40%,温度为-5℃,蛋白浓度为1.0g/dl,离子强度为0.09mol/kg,ph值为5.8;优选地,上述搅拌的温度为-5℃,时间为0.5h。作为优选的实施方式,所述血浆蛋白分离物的供血者为人类;优选地,所述供血者的年龄为小于等于40岁;更优选小于等于35岁,进一步优选为小于等于30岁,更进一步优选为小于等于25岁,再进一步优选为小于等于20岁。一种药物组合物,包含上述血浆蛋白分离物和药学上可接受的载体;优选地,所述药学上可接受的载体为:药学上可接受的缓冲液、蛋白质、明胶、单糖、多糖、氨基酸、螯合剂、糖醇、聚乙二醇、以及表面活性剂中的一种或多种。作为优选的实施方式,所述药物组合物包括如下组分:1倍体积的权利要求1-6任一所述的血浆蛋白分离物,9倍体积的8.5wt%nacl或1.5m、ph7.0的pbs;优选地,所述药物组合物中还包括白蛋白、葡萄糖以及谷氨酰胺;更优选地,所述白蛋白在所述药物组合物中的质量体积百分比为2%,所述葡萄糖在所述药物组合物中的质量体积百分比为1%,所述谷氨酰胺在所述药物组合物中的质量体积百分比为3%。一种试剂盒,包含上述血浆蛋白分离物或者上述药物组合物。上述血浆蛋白分离物、上述药物组合物、上述试剂盒,在制备预防、改善或/和治疗阿尔茨海默症的药物中的应用。相比于现有技术,本发明具有如下有益效果:1、本发明制备的血浆蛋白分离物可以用于预防、改善和治疗阿尔茨海默症,此外其还可以起到增强记忆力的作用。2、本发明提供的从血浆蛋白分离物可以比血浆和目前药物更有效地提升阿尔茨海默症患者的认知水平;与此同时,长期服用这种血浆蛋白分离物可以大大降低长期服用西药带来的副作用和药物依赖。3、本发明制备的血浆分离物源自人血浆,经过一系列合理的操作步骤,各个步骤中选用合理的试剂和参数,各种因素相互协调作用,进一步提高了该血浆蛋白分离物对于阿尔茨海默症的疗效和增强记忆力的功效。4、本发明的制备方法较为简单,而且可以直接工业化放大生产,大规模地应用于制药工业。附图说明图1:检测例1中sds-page检测低温乙醇法沉淀得到的不同血浆沉淀物的电泳图。图2:检测例1中光镜检测不同血浆沉淀物处理原代培养海马神经元。其中,a部分为海马神经元显微照片,b部分为海马神经元数量柱状图,c部分为海马神经元突起长度柱状图。图3:检测例1中光镜检测不同浓度的p4(除菌的组分iv-4)处理原代培养海马神经元的效果图,a部分均为海马神经元数量柱状图,b部分为海马神经元突起长度柱状图。图4:检测例1中synapsin免疫荧光染色检测不同血浆沉淀物处理原代培养海马神经元的荧光染色照片。图5:检测例1中水迷宫行为学实验检测p4(除菌的组分iv-4)处理小鼠的记忆改善情况。其中,a部分为迷宫行为学实验检测p4(除菌的组分iv-4)处理小鼠水迷宫示意图,b部分为小鼠在可视平台阶段上台前游泳距离,c部分为小鼠在隐藏平台阶段上台时间,d部分为小鼠在隐藏平台阶段上台前游泳距离。具体实施方式为了更好地对本发明的技术特征和效果进行说明,下面采用具体实施方式对本发明进行详细说明,但本发明并不限于此。第一方面,本发明提供一种治疗阿尔茨海默症的血浆蛋白分离物,其中包括:α、β球蛋白,铜蓝蛋白,运铁蛋白,结合珠蛋白。上述血浆蛋白分离物的sds-page变性胶电泳至少包括8条条带,所述条带的分子量为:9kd,16kd,40kd,25kd,50kd,57kd,70kd,132kd。其中,结合珠蛋白的条带的分子量包括:9kd,16kd,40kd;α、β球蛋白的重链和轻链的条带的分子量包括:25kd,50kd;白蛋白的条带的分子量包括:57kd;运铁蛋白的条带的分子量包括:70kd;铜蓝蛋白的条带的分子量包括132kd。上述血浆蛋白分离物的供血者为人类;优选地,其供血者的年龄为小于等于40岁;更优选小于等于35岁,进一步优选为小于等于30岁,更进一步优选为小于等于25岁,再进一步优选为小于等于20岁。例如:上述供血者的年龄可以为20、25、30、35、40岁中任意数值或任意二者之间的范围。第二方面,本发明提供上述血浆蛋白分离物的制备方法,包括以下步骤:分离血浆,冷沉淀去除,低温乙醇法沉淀血浆组分,亲和层析法去除igm,除菌以及冻干。步骤一、分离血浆:上述分离血浆步骤中,利用抗凝管收集供血者的血液,再通过离心收集上清液,得到血浆;并将该血浆于6-8小时内置于小于或等于零下30℃冰冻成块,所述离心过程的离心力为500-1200g,离心时间为10-30分钟,离心温度为0-8℃;(优选为零下40℃)冰冻成块,获得新鲜冷冻血浆。上述抗凝管中已加有抗凝剂,该抗凝剂与血液的质量体积比为1:(5-15),优选为1:9;该质量体积比的含义为,加入的抗凝剂的质量(克)与血液的体积(毫升)之间的比例。该抗凝剂优选为枸橼酸钠。上述离心中,离心力为500-1200g(可以为500、800、1000、1200g中任意值或任意二者之间的范围),时间为10-30分钟(可以为10、15、20、25、30min中任意值或任意二者之间的范围),离心温度为0-8℃(可以为0、2、4、5、6、8℃中任意值或任意二者之间的范围),优选为离心力900g,时间为20分钟,温度4℃。步骤二、冷沉淀去除步骤中:将上述新鲜冷冻血浆在2-6℃下融化后,再在0-8℃(可以为0、2、4、5、6、8℃中任意值或任意二者之间的范围)条件下以离心力1000-5000g(可以为1000、2000、3000、4000、5000g中任意值或任意二者之间的范围)离心5-20分钟(可以为5、10、15、20min中任意值或任意二者之间的范围),将上清液和沉淀物(即冷沉淀)分离;该上清液即为抗凝血浆,沉淀物即为冷沉淀。优选地,上述离心中,离心力为3000g,温度为4℃,时间为10min。本步骤的目的是去除血浆中的部分纤维蛋白原、ⅷ因子等具有凝血功能的蛋白。步骤三、低温乙醇法沉淀血浆组分:将上述抗凝血浆依次进行4次低温乙醇沉淀处理,得到第一分离组分沉淀物(组分i)、第二分离组分沉淀物(组分ii+iii)、第三分离组分沉淀物(组分iv-1)、第四分离组分沉淀物(组分iv-4)。其中,第一次低温乙醇沉淀处理:向上述抗凝血浆中加入乙醇溶液、ph值调节剂,形成第一次低温乙醇沉淀体系;该体系中,乙醇体积百分含量为5-10%(即乙醇在该体系的体积百分含量,可以为5、6、7、8、9、10%中任意值或任意二者之间的范围),温度为0至-5℃(可以为0、-1、-2、-3、-4、-5℃中任意值或任意二者之间的范围),蛋白浓度为3-10g/dl(可以为3、5、7、8、10g/dl中任意值或任意二者之间的范围),离子强度为0.10-0.20mol/kg(可以为0.10、0.12、0.15、0.18、0.20mol/kg中任意值或任意二者之间的范围),ph值为7.1-7.3(可以为7.1、7.2、7.3中任意值或任意二者之间的范围);再将该体系于0至-5℃条件下搅拌0.5-2h,得到第一分离组分;优选地,第一次低温乙醇沉淀体系中,上述乙醇体积百分含量为8%,温度为-3℃,蛋白浓度为5.1g/dl,离子强度为0.14mol/kg,ph值为7.2,上述搅拌的温度为-3℃,时间为1h。再对上述第一分离组分进行分离处理,得到第一分离组分沉淀物(组分i)和第一分离组分上清液;上述第一分离组分沉淀物含有:纤维蛋白原、第ⅷ因子、纤维黏连蛋白。上述分离处理采用离心分离:在0至零下5℃(可以为0、-1、-2、-3、-4、-5℃中任意值或任意二者之间的范围),3000-5000rpm(可以为3000、3500、4000、4500、5000rpm中任意值或任意二者之间的范围)离心5-15min(可以为5、7、10、12、15min中任意值或任意二者之间的范围),优选为在零下3℃,4000rpm离心10min。第二次低温乙醇沉淀处理:向上述第一分离组分上清液中加入乙醇溶液、ph值调节剂,形成第二次低温乙醇沉淀体系;该体系中,乙醇体积百分含量为22-28%(可以为22、23、24、25、26、27、28%中任意值或任意二者之间的范围),温度为0至-10℃(可以为0、-2、-5、-6、-8、-10℃中任意值或任意二者之间的范围),蛋白浓度为1-5g/dl(可以为1、2、3、4、5g/dl中任意值或任意二者之间的范围),离子强度为0.05-0.20mol/kg(可以为0.05、0.08、0.10、0.12、0.15、0.20mol/kg中任意值或任意二者之间的范围),ph值为6.7-7.0(可以为6.7、6.8、6.9、7.0中任意值或任意二者之间的范围);再将该体系于温度为0至-10℃搅拌3-8h,得到第二分离组分;优选地,上述乙醇体积百分含量为25%,温度为-5℃,离子强度为0.09mol/kg,蛋白浓度为3.0g/dl,ph值为6.9,上述搅拌的温度为-5℃,时间为5h。再对上述第二分离组分进行分离处理,得到第二分离组分沉淀物(组分ii+iii)和第二分离组分上清液;上述第二分离组分沉淀物含有:igg,igm,iga,β球蛋白,凝血因子ⅱ、ⅴ、ⅶ、ⅸ、ⅹ。上述分离处理采用离心分离:在0至零下5℃(可以为0、-1、-2、-3、-4、-5℃中任意值或任意二者之间的范围),3000-5000rpm(可以为3000、3500、4000、4500、5000rpm中任意值或任意二者之间的范围)离心5-15min(可以为5、7、10、12、15min中任意值或任意二者之间的范围),优选为在零下5℃,4000rpm离心10min。第三次低温乙醇沉淀处理:向上述第二分离组分上清液中加入乙醇溶液、ph值调节剂,形成第三次低温乙醇沉淀体系;该体系中,乙醇体积百分含量为15-20%(可以为15、16、17、18、19、20%中任意值或任意二者之间的范围),温度为0至-10℃(可以为0、-2、-5、-6、-8、-10℃中任意值或任意二者之间的范围),蛋白浓度为1.0-2.0g/dl(可以为1.0、1.2、1.5、1.8、2.0g/dl中任意值或任意二者之间的范围),离子强度为0.05-0.20mol/kg(可以为0.05、0.08、0.10、0.12、0.15、0.20mol/kg中任意值或任意二者之间的范围),ph值为5.0-5.4(可以为5.0、5.1、5.2、5.3、5.4中任意值或任意二者之间的范围);再将该体系于温度为0至-10℃搅拌0.5-2.0h,静置大于等于6h,得到第三分离组分;优选地,在第三次低温乙醇沉淀体系中,上述乙醇体积百分含量为18%,温度为-5℃,蛋白浓度为1.6g/dl,离子强度为0.09mol/kg,ph值为5.2;上述搅拌的温度为-5℃,时间为1h,上述静置时间优选为12h。再对上述第三分离组分进行分离处理,得到第三分离组分沉淀物(组分iv-1)和第三分离组分上清液;上述第三分离组分沉淀物主要含有:α1脂蛋白、铜蓝蛋白、αβ球蛋白。上述分离处理采用离心分离:在0至零下5℃(可以为0、-1、-2、-3、-4、-5中任意值或任意二者之间的范围),3000-5000rpm(可以为3000、3500、4000、4500、5000rpm中任意值或任意二者之间的范围)离心5-15min(可以为5、7、10、12、15min中任意值或任意二者之间的范围),优选为在零下5℃,4000rpm离心10min。第四次低温乙醇沉淀处理:向上述第三分离组分上清液中加入乙醇溶液、ph值调节剂,形成第四次低温乙醇沉淀体系;该体系中,乙醇体积百分含量为35-45%(可以为30%、35%、40%、45%、50%中任意值或任意二者之间的范围),温度为0至-10℃(可以为0、-2、-5、-6、-8、-10℃中任意值或任意二者之间的范围),蛋白浓度为0.05-2.0g/dl(可以为0.05、0.08、0.10、0.12、0.15、0.20g/dl中任意值或任意二者之间的范围),离子强度为0.05-0.20mol/kg(可以为0.05、0.08、0.10、0.12、0.15、0.20mol/kg中任意值或任意二者之间的范围),ph值为5.7-6.0(可以为5.7、5.8、5.9、6.0中任意值或任意二者之间的范围);再将该体系于0至-10℃搅拌0.3-1h得到第四分离组分;优选地,上述乙醇体积百分含量为40%,温度为-5℃,蛋白浓度为1.0g/dl,离子强度为0.09mol/kg,ph值为5.0,上述搅拌温度为-5℃,时间为0.5h;再对上述第四分离组分进行分离处理,得到第四分离组分沉淀物(组分iv-4)和第四分离组分上清液,将上述第四分离组分沉淀物(组分iv-4)作为本发明的血浆蛋白分离物;优选地,上述第四分离组分沉淀物主要含有:运铁蛋白、α1脂蛋白、白蛋白。上述分离处理采用离心分离:在0至零下5℃(可以为0、-1、-2、-3、-4、-5中任意值或任意二者之间的范围),3000-5000rpm(可以为3000、3500、4000、4500、5000rpm中任意值或任意二者之间的范围)离心5-15min(可以为5、7、10、12、15min中任意值或任意二者之间的范围),优选为在零下5℃,4000rpm离心10min。本步骤中每次低温乙醇沉淀处理使用的ph值调节剂均优选为ph值为4.0的naac溶液。本步骤中,低温乙醇法分离血浆蛋白是通过向抗凝血浆中加入乙醇改变蛋白质水溶液的介电常数,从而使蛋白质分子聚集并沉淀。在低温乙醇法中,影响蛋白质沉淀反应的因素主要有5个,统称为五变因素,即ph值(使蛋白质在等电点时易于沉淀),温度(避免乙醇对蛋白质的变性作用),蛋白浓度(浓度越低沉淀作用越小),离子强度(影响蛋白质溶解度)与乙醇浓度(使蛋白质脱水)。在低温乙醇工艺中,可通过改变以上五变因素条件从而影响不同类蛋白质的溶解度,进而得到含有不同蛋白质成分的血浆组分。上述5个因素均需要选择合适的数值范围或数值点,之间需要密切配合、协同作用,才能将具有功效的物质进一步提纯。本步骤中,沉淀体系在搅拌后需要一段时间静置,以使体系中的目的蛋白充分析出,在之后的操作中被分离出来。步骤四、亲和层析法去除igm:将上述第四分离组分沉淀物(组分iv-4)进行亲和层析处理,得到去除igm的第四分离物。上述亲和层析处理采用的亲和层析预装柱的填料优选为2-巯基吡啶连接琼脂糖,层析柱优选为hitrapigmpurificationhp,具体包括以下分步骤:分步骤一、平衡:利用1-10倍(可以为1、2、4、6、8、10倍中任意值或任意二者之间的范围),优选为5倍柱体积的结合液平衡层析柱;该结合液优选为包括20mm磷酸钠,0.8m硫酸铵,ph7.5。分步骤二、上样:将上述第四分离组分沉淀物(组分iv-4)上样至层析柱。分步骤三、结合:利用10-20倍(可以为10、12、16、18、20倍中任意值或任意二者之间的范围),优选为15倍柱体积的结合液洗出蛋白组分;并将柱中穿流出的溶液于a280检测,收集流穿液,即为去除igm的第四分离物。之后再对层析柱的进行维护工作,用于下一次亲和层析处理,包括以下分步骤。分步骤四、洗脱:利用10-15倍(可以为10、12、16、18、20倍中任意值或任意二者之间的范围),优选为12倍柱体积的洗脱液上柱洗脱,收集洗脱产物;该洗脱液优选为包括:20mm磷酸钠,ph7.5。分步骤五、清洗:利用5-10倍(可以为5、6、8、9、10倍中任意值或任意二者之间的范围),优选为7倍柱体积的清洗液(优选为:20mm磷酸钠,ph7.5,30%异丙醇)清洗柱。分步骤六、再平衡:利用1-10倍(可以为1、2、4、6、8、10倍中任意值或任意二者之间的范围),优选为5倍柱体积的结合液再平衡层析柱,以备下一次亲和层析处理。本步骤的目的为:血浆中含有天然抗体igm,如血型不符输入血液,易激活补体,使输入的红细胞大多数迅速在血管内破坏产生血管内溶血。因此,用于治疗的血浆蛋白组分需要去除igm,以消除输血反应。步骤五、除菌:将上述去除igm的第四分离物进行除菌处理,得到无菌的第四分离组分。上述除菌处理优选采用0.22μm低蛋白吸附的pvdf膜,压力优选为不超过10bar(可以为2、4、6、8、10bar中任意值或任意二者之间的范围),更优选为5bar。为了使上述无菌的第四分离组分便于保存,优选将其制备为冻干粉剂,包括以下步骤:冷冻处理:将上述无菌的第四分离组分置于零下75℃至零下85℃(可以为-75、-77、-80、-83、-85℃中任意值或任意二者之间的范围,优选为零下80℃),维持12h以上(可以为12.5、14、15、20、24h中任意值或任意二者之间的范围),优选为16h,得到冷冻的第四分离组分。冰冻干燥处理:将上述冷冻的第四分离组分采用冻干机于零下20℃至零下40℃(可以为-20、-22、-25、-27、-30、-33、-35、-38、-40℃中任意值或任意二者之间的范围,优选为零下35℃)冰冻干燥30-40h(可以为30、32、35、37、40h中任意值或任意二者之间的范围,优选为35h),得到冻干粉剂。本操作使上述血浆蛋白分离物在真空条件下升华干燥,除去冰晶,待升华结束后再解析干燥,除去部分结合水,得到有效成分含量高、易保存的冻干粉。上述冻干粉剂在冰箱于零下20℃冻存。第三方面,本发明提供一种药物组合物,包含上述血浆蛋白分离物和药学上可接受的载体。上述药学上可接受的载体包括:药学上可接受的缓冲液、蛋白质、明胶、单糖、多糖、氨基酸、螯合剂、糖醇、聚乙二醇、以及表面活性剂中的一种或多种。上述药物组合物优选包括如下组分:1倍体积的上述血浆蛋白分离物,9倍体积的8.5wt%nacl或1.5m、ph7.0的pbs;优选地,上述药物组合物中还包括白蛋白、葡萄糖以及谷氨酰胺,其中,上述白蛋白在上述药物组合物中的质量体积百分比为2%,上述葡萄糖在上述药物组合物中的质量体积百分比为1%,上述谷氨酰胺在上述药物组合物中的质量体积百分比为3%。第四方面,本发明提供一种试剂盒,包含有:上述血浆蛋白分离物、或/和包含上述血浆蛋白分离物上述药物组合物、或/和包含上述血浆蛋白分离物的上述缓释剂。第五方面,本发明提供所述血浆蛋白分离物、或/和包含所述血浆蛋白分离物的上述药物组合物、或/和包含所述血浆蛋白分离物的上述试剂盒,在预防、改善或/和治疗阿尔茨海默症的药物中的应用。下面通过实施例对本发明血浆蛋白分离物的制备、鉴定和应用进行说明。以下实施例中涉及的分子生物学操作如未注明具体试验条件和方法,请参照sambrookj等主编,科学出版社,2002,分子克隆实验指南(第三版)或相应产品的说明书。以下实施例中使用的原代海马细胞是按照如下参考文献培养的:guo,w.,y.ji,etal.(2014)."neuronalactivityaltersbdnf-trkbsignalingkineticsanddownstreamfunctions."jcellsci127(pt10):2249-2260。实施例1本实施例为血浆蛋白分离物的制备方法,该方法包括以下步骤:(1)收集血浆:供血者为20-30岁的健康人,血液由医院献血所得,采血管为抗凝管(其中加入枸橼酸钠作为抗凝剂,抗凝剂与血液的质量体积比为1:9),采血过程中边放血边摇晃采血管,防止血液凝固;将含有血液的采血管放入离心机,设定离心力为1200g,离心15分钟,离心温度为4℃;然后用移液器小心吸取上清,即为收集到的人血浆;并将该血浆于6-8小时内置于零下40℃(优选为零下40℃)冰冻成块,获得新鲜冷冻血浆。(2)冷沉淀去除:将上述新鲜冷冻血浆在4℃下融化后,于3000g,4℃离心10分钟,得到的上清液为枸橼酸钠抗凝血浆,沉淀物为冷沉淀。(3)低温乙醇法沉淀血浆组分:(3.1)第一次沉淀:第一次低温乙醇沉淀处理:向上述枸橼酸钠抗凝血浆中加入乙醇溶液、ph值为4.0的naac溶液,形成第一次低温乙醇沉淀体系;该体系中,乙醇体积百分含量为8%,温度为-3℃,蛋白浓度为5.1g/dl,离子强度为0.14mol/kg,ph值为7.2;再将该体系于-3℃搅拌1h,得到第一分离组分;再对上述第一分离组分进行分离处理(零下3℃,4000rpm离心10min),得到第一分离组分沉淀物(组分i)和第一分离组分上清液;上述组分i含有:纤维蛋白原、第ⅷ因子、纤维黏连蛋白。(3.2)第二次沉淀:向上述第一分离组分上清液中加入乙醇溶液、ph值为4.0的naac溶液,形成第二次低温乙醇沉淀体系;该体系中,乙醇体积百分含量为25%,温度为-5℃,离子强度为0.09mol/kg,蛋白浓度为3.0g/dl,ph值为6.9;再将该体系于-5℃搅拌5h,得到第二分离组分;再对上述第二分离组分进行分离处理(零下5℃,4000rpm离心10min),得到第二分离组分沉淀物(组分ii+iii)和第二分离组分上清液;上述组分ii+iii含有:igg,igm,iga,β球蛋白,凝血因子ⅱ、ⅴ、ⅶ、ⅸ、ⅹ。(3.3)第三次沉淀:向上述第二分离组分上清液中加入乙醇溶液、p值为4.0的naac溶液,形成第三次低温乙醇沉淀体系;该体系中,乙醇体积百分含量为18%,温度为-5℃,蛋白浓度为1.6g/dl,离子强度为0.09mol/kg,ph值为5.2;再将该体系于-5℃搅拌1h,静置12h,得到第三分离组分;再对上述第三分离组分进行分离处理(零下5℃,4000rpm离心10min),得到第三分离组分沉淀物(组分iv-1)和第三分离组分上清液;上述组分iv-1含有:α1脂蛋白、铜蓝蛋白、αβ球蛋白。(3.4)第四次沉淀:向上述第三分离组分上清液中加入乙醇溶液、ph值为4.0的naac溶液,形成第四次低温乙醇沉淀体系;该体系中,乙醇体积百分含量为40%,温度为-5℃,蛋白浓度为1.0g/dl,离子强度为0.09mol/kg,ph值为5.8;再将该体系于-5℃搅拌0.5h,得到第四分离组分;再对上述第四分离组分进行分离处理(零下5℃,4000rpm离心10min),得到第四分离组分沉淀物(组分iv-4)和第四分离组分上清液;优选地,上述组分iv-4含有:运铁蛋白、α1脂蛋白、白蛋白。(3.5)第五次沉淀:向上述第四分离组分上清液中加入乙醇溶液、ph值为4.0的naac溶液,形成第五次低温乙醇沉淀体系;该体系中,乙醇体积百分含量为40%,温度为-5℃,蛋白浓度为1.8g/dl,离子强度为0.11mol/kg,ph值为4.8;再将该体系于-5℃搅拌2h,静置6h,得到第五分离组分;再对上述第五分离组分进行分离处理(零下3℃,4000rpm离心10min),得到第五分离组分沉淀物(组分v)和第五分离组分上清液;上述组分v含有:白蛋白。(4)亲和层析法去除igm:将上述第四分离组分沉淀物(组分iv-4)进行亲和层析处理,得到去除igm的第四分离物。采用的亲和层析预装柱为hitrapigmpurificationhp(购自gehealthcare公司),步骤包括:(4.1)平衡:用5倍柱体积的结合液(20mm磷酸钠,0.8m硫酸铵,ph7.5)平衡层析柱。(4.2)上样:将上述第四分离组分沉淀物(组分iv-4)上样至层析柱。(4.3)结合:用15倍柱体积的结合液洗出蛋白组分,收集柱中穿流出的溶液于a280检测,收集流穿液;该流穿液即为除igm的第四分离组分。之后再对层析柱进行清洗维护,用于下一次亲和层析处理。(4.4)洗脱:用为12倍柱体积的洗脱液(20mm磷酸钠,ph7.5)上柱洗脱,收集洗脱产物。(4.5)清洗:用7倍柱体积的清洗液(优选为:20mm磷酸钠,ph7.5,30%异丙醇)清洗柱。(4.6)再平衡:利用1-10倍,优选为5倍柱体积的结合液再平衡层析柱,以备下一次亲和层析处理。(5)除菌:利用0.22μm低蛋白吸附的pvdf膜,压力为5bar,对上述去除igm的第四分离物过滤除菌,得到无菌的第四分离物(即为本实施例的血浆蛋白分离物)。(6)冻干:将上述血浆蛋白分离物置于零下80℃维持16h,得到冷冻的血浆蛋白分离物;再将上述冷冻的血浆蛋白分离物采用冻干机于零下35℃冰冻干燥35h,得到冻干粉剂。检测例1检测1:sds-page检测低温乙醇法沉淀的血浆蛋白组分。将实施例1制备的分离物进行sds-page变性胶电泳鉴定。该鉴定方法包括以下步骤:(1)从分离物(实施例1中步骤(2)的冷沉淀、步骤(3)的组分i、组分ii+iii、组分iv-1、组分iv-4、组分v均经实施例1步骤(5)除菌后的产物)里分别取出2微升,在紫外280nm下测定其吸光度,从而计算血浆蛋白分离物的蛋白浓度。(2)取一定体积的分离物,与1微升4×蛋白上样缓冲液(购自北京索莱宝科技有限公司)混合,即为需要进行电泳的样品,该样品里面有50微克的蛋白质。(3)将电泳样品升温至100℃,加热5分钟使蛋白质变性,然后立即将样品放到冰上,等待5分钟后开始跑sds-page变性还原胶(所述sds变性还原胶的配制方法如下:30(w/v)%的丙烯酰胺acrylamide(购自sigma)取2.0ml、1.5mtris-盐酸缓冲液(ph8.8,购自sigma)取1.3ml、10(w/v)%的sds取0.05ml、10%(w/v)过硫酸铵(购自sigma)取0.05ml、temed(购自sigma)取0.002ml、以及水取1.6ml,共计5ml,混合后在室温0.5-1h凝固成分离胶,利用约1ml异丙醇封胶,压平。凝固后,将异丙醇倒掉,配制浓缩胶:30(w/v)%的丙烯酰胺acrylamide(购自sigma)取0.17ml、1.0mtris-盐酸缓冲液(ph6.8,购自sigma)取0.13ml、10(w/v)%的sds取0.01ml、10%(w/v)过硫酸铵(购自sigma)取0.01ml、temed(购自sigma)取0.001ml、以及水取0.68ml,共计1ml。灌胶后插入制胶梳,在室温0.5-1h凝固成浓缩胶。)。跑胶时,每个泳道的蛋白上样量为50微克,设定跑胶电压为100v,开始跑胶,跑胶时间为1小时。(4)跑完胶后,用考马斯亮蓝染色液(该染色液的制备方法为:将2.5g考马斯亮蓝r-250溶于500ml95%乙醇溶液,加入100ml85%的乙酸溶液,然后,用蒸馏水补充至1000ml,此染液放4℃至少6个月保持稳定)对胶进行染色。检测结果参见图1:其中:泳道2:蛋白分子量标准;泳道1:除菌后的冷沉淀,泳道3-7:沉淀1(组分i除菌后)、沉淀2(组分ii+iii除菌后)、沉淀3(组分iv-1除菌后)、沉淀4(组分iv-4除菌后)、沉淀5(组分v除菌后);泳道1、3-7的主要条带中均包括:9kd,16kd,40kd,25kd,50kd,57kd,70kd,132kd。检测2:原代海马神经元培养及血浆蛋白组分处理。(1)利用0.1%的poly-l-lysine包被培养板,放入37℃培养箱中包被2小时以上。(2)在冰的hbss-buffer中解剖0天初生小鼠,取出海马体。用1×pbs清洗3次。加0.25%trypsin,37℃消化15分钟。(3)用完全dmem终止消化,并用1ml枪轻吹吸海马细胞16-20次,没有明显组织块即可,再用40mm滤网过滤,1000rpm,离心3min。(4)离心后弃上清,加完全dmem重悬细胞。并将神经元种植在细胞培养板中,种植密度为3×104cells/cm2。(5)第二天无血清neurobasal培养基全换液;第三天血浆蛋白组分处理:将过滤后的分离物(该分离物分别为:实施例1中步骤(3)的组分i经实施例1步骤(5)除菌后的产物即p1、实施例1中步骤(3)的组分ii+iii经实施例1步骤(5)除菌后的产物即p2、实施例1中步骤(3)的组分iv-1经实施例1步骤(5)除菌后的产物即p3、实施例1中步骤(3)的组分iv-4经实施例1步骤(5)除菌后的产物即p4、实施例1中步骤(3)的组分v经实施例1步骤(5)除菌后的产物即p5)加入到不同的培养板孔内,终浓度为1mg/ml,并采用1×pbs作为对照;第五天利用cell-iq相差显微镜进行拍照。检测结果参见图2:其中,a部分为海马神经元显微照片,b部分为海马神经元数量柱状图,c部分为海马神经元突起长度柱状图。b部分中,经p3处理的海马神经元的数量为1.04±0.08au(arbitraryunit),经p4处理的海马神经元的数量为1.17±0.10au,远大于p1的为0.26±0.11au、p2的为0.23±0.0au9、p5的0.50±0.07au。c部分中,经p3处理的海马神经突触的长度为1.32±0.11au,p4处理的海马神经突触的长度为1.93±0.12au,p5的为1.02±0.13au,远大于p1的为0.44±0.15au,p2的为0.32±0.11au。以上说明,p3(组分iv-1)促进海马神经元的增殖,而p4(组分iv-4)可以明显促进海马突触长度的增长,增加神经突起的复杂度。检测3:在检测2的基础上,原代海马神经元培养及不同浓度的p4(组分iv-4)处理。检测的操作方法参见检测2,区别在于:采用检测例2中方法制备的新一批的海马细胞,步骤(5)中,第三天加入培养板孔的分离物分别是终浓度为0.25mg/ml、0.5mg/ml、1mg/ml、2mg/ml、4mg/ml的p4。检测结果参见图3:其中,a部分均为海马神经元数量柱状图,b部分为海马神经元突起长度柱状图。a部分中,pbs处理:1.00±0.09au,0.25mg/ml处理:1.24±0.10au,0.5mg/ml,处理:1.36±0.12au,1mg/ml处理:1.23±0.15au,2mg/ml处理:1.21±0.12au,4mg/ml处理:0.74±0.11au。b部分中,pbs处理:1.00±0.07au,0.25mg/ml处理:1.93±0.22au,0.5mg/ml处理:1.76±0.11au,1mg/ml处理:1.99±0.20au,2mg/ml处理:1.68±0.11au,4mg/ml处理:1.29±0.14au。以上说明在0.25-2mg/ml的浓度范围内,组分iv-4对促进海马神经元增殖作用明显,在0.25-4mg/ml的浓度范围内,组分iv-4促进海马突触长度增长的作用明显。检测4:synapsin免疫荧光染色检测。(1)将检测2步骤(5)后,24孔板中培养基吸弃后,加入1×pbs浸洗3次,每次5min。(2)洗片结束后,吸弃最后一次浸洗的1×pbs,加入4%多聚甲醛,室温固定15min。(3)1×pbs浸洗3次,每次5min。洗片结束后,加入0.2%tritonx-100穿孔,室温放置5min。加入1×pbs浸洗3次,每次5min。(3)洗片结束后,加入0.5ml封闭液,室温封闭30min。吸弃封闭液,加入synapsin一抗(1:500稀释),4℃摇床过夜。(4)一抗孵育结束后,加入0.5ml1×pbs浸洗3次,每次5min。洗片结束后,加入二抗(羊抗鼠,1:500稀释),室温避光放置30min。30min后,吸弃二抗液体。(5)洗片结束后,加入1×pbs浸洗6次,每次5min,注意避光。最后一次吸出1×pbs后,加入ddh2o。(6)在载玻片上标记好相应位置所要封的玻片;在载玻片上两个适当位置滴上3μl抗荧光淬灭封片剂;将24孔板中的盖玻片用掰弯的针头挑起,用镊子夹起,在吸水纸上略微吸取玻片上的水,将盖玻片细胞一面从一侧小心的盖到抗荧光淬灭封片剂上,尽量不要留有气泡;用中性树胶封片,放片盒,4℃避光保存。检测结果参见图4。其中,组分-4(即p4)处理的海马神经元突触长度数量较pbs处理的更多,而组分-2(即p2)和组分-3(即p3)处理的海马神经元突触长度数量则比对照少,说明组分-4可以促进突触形成。检测5:morris水迷宫测试(水迷宫行为学实验检测)。(1)5×fad转基因(app)小鼠和野生型(wt)对照小鼠尾静脉注射血浆p4(组分iv-4)(250μg/100μl,每天注射一次,每次注射100μl,连续注射7天;以pbs作为对照组),之后进行morris水迷宫训练。(2)水迷宫实验记录潜伏期的长短测定小鼠的空间辨别能力。水迷宫装置由直径120cm、高50cm的圆形水池和可移动的直径10cm的平台组成,水池的上方装有摄像头并与电脑自动记录仪连接,水温保持(22±3)℃。(3)第1天训练为可视平台训练,平台放置于固定位置并高于水面2cm,将小鼠头朝池壁轻轻随机放入水池中4个象限之一,每次试验每只小鼠游泳60s,让其找到水中平台,让其停留5s;若小鼠入水后未能找到平台,则将时间记录为60s,并且将其人为放置在平台上20s,每只小鼠重复4次试验。(4)第2-6天训练为隐藏平台训练,平台放置于固定位置并低于水面1cm,加入钛白粉使平台不可见,将小鼠头朝池壁轻轻随机放入水池中4个象限之一,每次试验每只小鼠游泳60s,让其找到水中平台,让其停留5s;若小鼠入水后未能找到平台,则将时间记录为60s,并且将其人为放置在平台上20s,每只小鼠每天重复4次试验。(5)最后一次定位航行实验结束后24h,撤出平台,将小鼠放入水中追踪器运动轨迹60s,测试小鼠60s内的运动轨迹、潜伏期及穿过原先放置平台位置象限次数及时间作为空间记忆形成指标,并进行组间对比。注意:整个测试过程中保持实验室内灯光、物品摆放等室内环境一致,以排除环境的干扰。测试结果见图5。其中,a部分为迷宫行为学实验检测p4(组分iv-4)处理小鼠水迷宫示意图,b部分为小鼠在可视平台阶段上台前游泳距离,c部分为小鼠在隐藏平台阶段上台时间,d部分为小鼠在隐藏平台阶段上台前游泳距离。b部分中,各组的逃离潜伏期(s)依次为:wt_pbs:24.81±5.36,wt_p4:24.98±5.67,app_pbs:46.24±5.03,app_p4:39.84±5.11,可见对于阿尔茨海默症的小鼠来说,注射p4能够明显缩短上台时间。c、d部分中,在隐藏平台训练阶段,app_pbs组和app_p4组学习曲线(逃离潜伏期和游泳距离)前3天差异显著。由此可见,注射p4可以明显改善阿尔茨海默症的小鼠的认知水平。对比例1本对比例的血浆蛋白分离物的制备方法的步骤(1)、(2)、(4)、(5)、(6)的操作与实施例1相同。步骤(3)的操作与实施例1基本相同,区别为:(3.1)第一次沉淀:体系中,乙醇体积百分含量为15%;(3.2)第二次沉淀:体系中,乙醇体积百分含量为10%;(3.3)第三次沉淀:体系中,乙醇体积百分含量为50%;(3.4)第四次沉淀:体系中,乙醇体积百分含量为20%;不进行第五次沉淀。对比例2本对比例的血浆蛋白分离物的制备方法的步骤(1)、(2)、(4)、(5)、(6)的操作与实施例1相同。步骤(3)的操作与实施例1基本相同,区别为:(3.1)第一次沉淀:体系中,离子强度为0.04mol/kg;(3.2)第二次沉淀:体系中,离子强度为0.25mol/kg;(3.3)第三次沉淀:体系中,离子强度为0.30mol/kg;(3.4)第四次沉淀:体系中,离子强度为0.03mol/kg;不进行第五次沉淀。对比例3本对比例的血浆蛋白分离物的制备方法的步骤(1)、(2)、(4)、(5)、(6)的操作与实施例1相同。步骤(3)的操作与实施例1基本相同,区别为:(3.1)第一次沉淀:体系中,ph值为5.5;(3.2)第二次沉淀:体系中,ph值为9.0;(3.3)第三次沉淀:体系中,ph值为4.0;(3.4)第四次沉淀:体系中,ph值为8.0;不进行第五次沉淀。对比例4本对比例的血浆蛋白分离物的制备方法的步骤(1)、(2)、(4)、(5)、(6)的操作与实施例1相同。步骤(3)的操作与实施例1基本相同,区别为:(3.1)第一次沉淀:采用实施例1的第二次沉淀的体系,搅拌的温度和时间;离心分离的温度、转速时间与实施例1的第二次沉淀相同。(3.2)第二次沉淀:采用实施例1的第一次沉淀的体系,搅拌的温度和时间;离心分离的温度、转速时间与实施例1的第一次沉淀相同。(3.3)第三次沉淀:采用实施例1的第四次沉淀的体系,搅拌的温度和时间;静置时间为12h;离心分离的温度、转速时间与实施例1的第四次沉淀相同。(3.4)第四次沉淀:采用实施例1的第三次沉淀的体系,搅拌的温度和时间,离心分离的温度、转速时间与实施例1的第三次沉淀相同。不进行第五次沉淀。检测例2测试1:参照检测例1中测试1的操作,将对比例1-4中除菌后的第四分离组分沉淀物(除菌后的组分iv-4)进行page-sds电泳,结果为无法观测到与实施例1相同的电泳图谱。测试2:参照检测例1中测试2的操作,将对比例1-4中第四分离组分沉淀物除菌后(p4)进行原代海马神经元培养及血浆蛋白组分处理,海马神经元的数量分别为0.65±0.15au、0.57±0.14au、0.63±0.13au、0.55±0.18au,海马神经突触的长度分别为0.67±0.12au、0.72±0.19au、0.56±0.14au、0.66±0.16au。测试5:参照检测例1中测试2的操作,将对比例1-4中第四分离组分沉淀物除菌后(p4)进行水迷宫行为学实验:逃离潜伏期(s):各个对比例的wt_pbs、wt_p4、app_pbs的数值均与检测例1相同,对比例1-4的app_p4数值分别为45.24±5.02、47.46±5.01、46.11±5.04、42.42±4.68。以上说明:在低温乙醇沉淀步骤中采用不适当的“五变”参数,和每次低温乙醇沉淀的“五变”参数及搅拌参数的顺序改变,均会严重影响血浆蛋白分离物的质量和效果。实施例2-实施例8实施例2-实施例6的血浆蛋白分离物的制备方法的步骤(1)、(2)、(4)、(5)、(6)的操作均与实施例1相同。步骤(3)的操作与实施例1基本相同,区别为:1):第一至第四次低温乙醇沉淀体系中,实施例2-6分别采用与实施例1不同的乙醇体积百分含量、温度、蛋白浓度、离子强度、ph值,详见下表;不进行第五次低温乙醇沉淀。2):实施例2-6中,分别采用与实施例1不同的、对于第一至第四次低温乙醇沉淀体系的搅拌时间,第三次沉淀采用与实施例1不同的静置时间,详见下表;第一次第二次第三次第四次实施例2-3℃,0.5h-5℃,8h-5℃,2h,5h-5℃,1h实施例3-3℃,2h-5℃,3h-5℃,0.5h,6h-5℃,0.3h实施例4-3℃,1.5h-5℃,4h-5℃,2h,8h-5℃,0.8h实施例5-3℃,1h-5℃,7h-5℃,1h,10h-5℃,0.5h实施例6-3℃,2h-5℃,6h-5℃,1.5h,9h-5℃,0.4h实施例7和实施例8的血浆蛋白分离物的制备方法的步骤(2)-(6)的操作均与实施例1基本相同,区别在于:实施例7中,步骤(1)的供血者为年龄35-40岁的健康人。实施例8中,步骤(1)的供血者为年龄18-25岁的健康人。检测例3测试1:参照检测例1中测试1的操作,将实施例2-8中除菌后的第四分离组分沉淀物(除菌后的组分iv-4)进行page-sds电泳,结果均为:主要条带中均包括上述血浆蛋白分离物的sds-page变性胶电泳至少包括8条条带,其分子量分别为:9kd,16kd,40kd,25kd,50kd,57kd,70kd,132kd。测试2:参照检测例1中测试2的操作,将实施例2-8中第四分离组分沉淀物经除菌后(p4,除菌后的组分iv-4)进行原代海马神经元培养及血浆蛋白组分处理,海马神经元的数量分别为1.16±0.13au、1.15±0.19au、1.16±0.18au、1.14±0.15au、1.15±0.13au、1.13±0.14au、1.47±0.18au,海马神经突触的长度分别为1.91±0.14au、1.92±0.13au、1.91±0.18au、1.92±0.11au、1.93±0.14au、2.35±0.11au。以上说明,实施例2-8的p4(除菌的组分iv-4)明显促进海马神经元的增殖,并能明显促进海马突触长度的增长;而且,供血者越年轻,对于上述促进作用越明显。测试5:参照检测例1中测试2的操作,将实施例2-8中第四分离组分沉淀物经除菌后(p4,除菌的组分iv-4)进行水迷宫行为学实验:(1)逃离潜伏期(s):实施例2-8的wt_pbs、wt_p4、app_pbs的数值均与检测例1相同,实施例2-8的app_p4数值分别为40.21±5.04、40.05±5.16、39.80±5.47、41.61±5.21、40.58±5.24、42.25±4.45、33.58±5.75。(2)在隐藏平台训练阶段,app_pbs组和app_p4组学习曲线(逃离潜伏期和游泳距离)前3天差异显著。由此可见,注射p4可以明显改善阿尔茨海默症的小鼠的认知水平;而且,供血者越年轻,p4对于小鼠的认知水平的改善效果越佳。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1