肠激酶轻链突变体及其应用的制作方法
本发明属于生物工程领域,更具体地,本发明涉及一种肠激酶轻链突变体及其应用。
背景技术:
肠激酶(enterokinase,ek)属于丝氨酸类的蛋白酶,主要出现在哺乳动物的十二指肠当中。肠激酶的轻链和重链两个亚单位构成了其主要结构,轻链作为酶的催化活性的中心,拥有全酶的催化活性,并且可以识别然后酶解专一性的氨基酸序列(asp)4-lys位点(ddddk),然后水解赖氨酸之后羧基末端的肽键来切割胰蛋白酶原,从而激活胰蛋白酶原,使胰蛋白酶具有活性。其还被广泛的被使用在了融合蛋白的技术当中。
天然肠激酶是一个通过二硫键连接的异源二聚体,包括一条82-140kda大小的重链和一条35-62kda大小的轻链,肠激酶的两条链都包含30%-50%的碳水化合物。重链能将肠激酶锚定在肠膜上。在重链中还包含一个氨基末端的跨膜结构域,在识别小分子肽方面的影响很小,但是对识别特异性小分子物质和抑制剂方面有很大影响。轻链则是肠激酶的催化活性中心,包含一个糜蛋白酶样的丝氨酸蛋白酶结构域,氨基酸(asp)4-lys序列的专一性识别和酶解都是依靠轻链来实现的。
使用基因工程技术来生产重组蛋白的过程中,为了能提高目的蛋白生产和纯化的效率,经常会使用融合表达这一方法。融合表达是指将目的基因与外源基因相连,表达后产物的稳定性有所提高,而且融合表达后融合蛋白中的融合片段常常带有不同的标签,大大简便了蛋白在生产之后的纯化。但是由于目的蛋白上增加了融合片段之后,目的蛋白的生物功能经常会受到影响,所以目的蛋白无法以融合蛋白的形式被使用,融合片段必须被去除之后目的蛋白才能发挥自身的生物功能。最早使用的去除融合蛋白中融合片段的方法是化学裂解法,但因为裂解位点的特异性低,裂解可能会发生在其它的位点,从而使目的蛋白产生不必要的修饰。随着酶学的日益发展,化学裂解法逐渐的被酶解法所取代。使用酶解法去除融合片段需要设计有特异性的识别位点,蛋白酶通过识别位于目的蛋白和标签蛋白之间的特异性位点之后进行特异性切割,切割后得到的目的蛋白具有生物活性。凝血酶、凝血因子xa和肠激酶是最常被用来切割融合蛋白的蛋白酶,其中肠激酶因为其特异性最高所以被使用的最为广泛。
肠激酶作为一种理想的工具酶,可以通过识别特异性的序列来切割融合蛋白从而达到生产目的蛋白的目的,并且在目的蛋白的氨基末端不会留下任何不必要的氨基酸残基。当然,作为一种位点特异性的切割酶,肠激酶在切割融合蛋白时发挥的效果会受到偶然发生在其它位点的切割的阻碍,这些位点由酸性残基和碱性残基组成。
作为催化亚基的肠激酶的轻链不仅拥有全酶的全部的活性,而且还可以在几个不同的细胞系中表达,包括cho细胞、毕赤酵母、酿酒酵母、黑曲霉菌和大肠杆菌等都已经可以成功的表达肠激酶轻链。由于肠激酶的酶解的反应条件相对比较温和,所以造成被切割的蛋白质在其它非切割部位发生断裂的概率非常低。此外肠激酶切割融合蛋白的位点十分特殊,是在全部的识别序列之后,不会破坏目的蛋白首位氨基酸的序列,使首位氨基酸能够完全符合天然蛋白。
综合肠激酶所有的特点,越来越多的基因工程制药会选择肠激酶作为在下游纯化融合表达的蛋白时的工具酶。然而,天然的肠激酶具有不稳定的特性,不易于纯化及保存,使得其应用受到一定的限制。同时,重组生产肠激酶的生产效率以及酶活性也亟待进一步的提高。
技术实现要素:
本发明的目的在于提供一种肠激酶轻链突变体及其应用。
在本发明的第一方面,提供一种肠激酶轻链突变体,其氨基酸序列在对应于seqidno:1氨基酸序列的第62位氨基酸突变为苏氨酸,第177位氨基酸突变为谷氨酸,以及第112位氨基酸突变为苏氨酸或丙氨酸。
在一个优选例中,所述的第112位氨基酸突变为苏氨酸。
在另一优选例中,所述的肠激酶轻链突变体还包括:由seqidno:1所示的氨基酸序列经过取代、缺失或添加一个或几个(如1-10个,较佳地1-5个,更佳地1-3个)氨基酸且具有前述限定的肠激酶轻链突变体相同的功能的衍生的蛋白,且其氨基酸序列的第62位氨基酸为苏氨酸,第177位氨基酸为谷氨酸,以及第112位氨基酸为苏氨酸或丙氨酸。
在另一优选例中,所述的肠激酶轻链突变体还包括:与seqidno:1所示的氨基酸序列具有85%以上(如具有90%以上,95%以上,98%以上或99%以上)氨基酸序列相同性的、且具有前述限定的肠激酶轻链突变体相同的功能的衍生的蛋白,且其氨基酸序列的第62位氨基酸为苏氨酸,第177位氨基酸为谷氨酸,以及第112位氨基酸为苏氨酸或丙氨酸。
在本发明的另一方面,提供一种分离的多核苷酸,该多核苷酸选自下组:
(i)编码所述的肠激酶轻链突变体的多核苷酸;或
(ii)与(i)中的多核苷酸互补的多核苷酸。
在本发明的另一方面,提供一种载体,它含有所述的多核苷酸。
在本发明的另一方面,提供一种遗传工程化的宿主细胞,它含有所述的载体,或基因组中整合有所述的多核苷酸。
在本发明的另一方面,提供一种生产所述的肠激酶轻链突变体的方法,包括步骤:
(1)培养所述的宿主细胞,获得培养物;和
(2)从培养物中分离所述的肠激酶轻链突变体。
在本发明的另一方面,提供一种提高肠激酶轻链生产效率、酶活性或稳定性的方法,所述方法包括:针对野生型的肠激酶轻链,将相应于seqidno:1氨基酸序列的第62位氨基酸突变为苏氨酸,第177位氨基酸突变为谷氨酸,以及第112位氨基酸突变为苏氨酸或丙氨酸。
在本发明的另一方面,提供一种组合物,其包含所述的肠激酶轻链突变体,以及与所述肠激酶轻链突变体相容的载体。
在本发明的另一方面,提供所述的肠激酶轻链突变体,或所述的组合物的用途,用于切割肽链;较佳地,用于识别肽链中(asp)4-lys位点、水解赖氨酸之后羧基末端的肽键。
在本发明的另一方面,提供一种用于切割肽链的试剂盒,其中包括:所述的肠激酶轻链突变体。
在本发明的另一方面,提供一种用于切割肽链的试剂盒,其中包括:所述的组合物。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
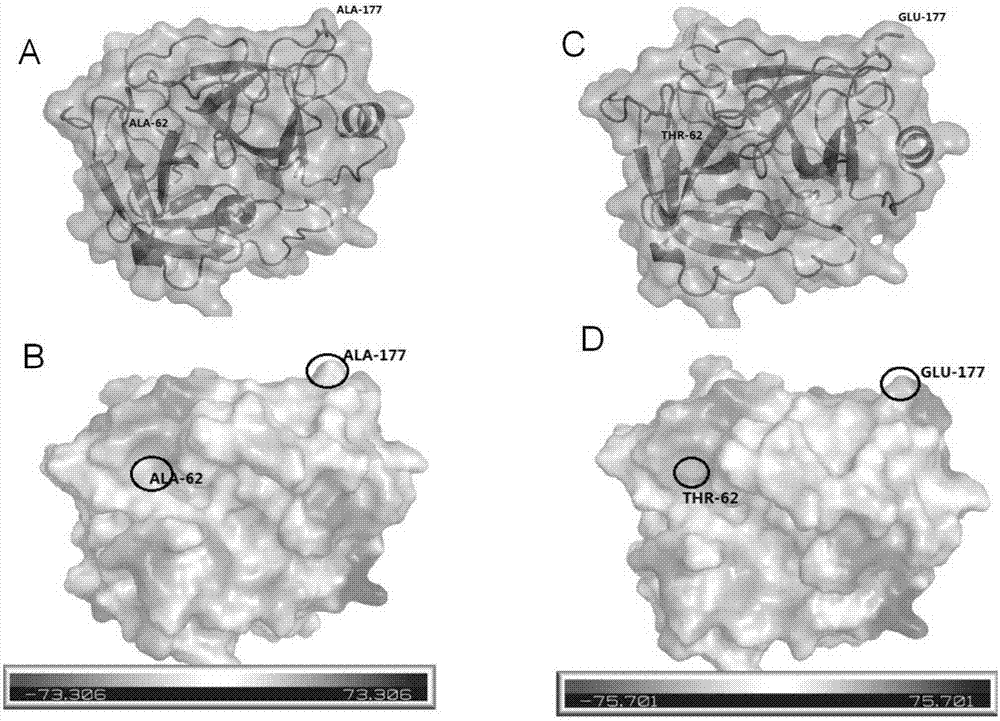
图1、ek表面突变位点分析。
a和b,野生型ek的a62和a177的表面位点及电荷示意图;
c和d,突变体a62t-a177e的表面位点及电荷示意图。
图2、菌落pcr鉴定结果;各个泳道上样量为10μl。
m,dna分子量标准(bp);
泳道1,bl21(de3)转化菌1;
泳道2,bl21(de3)转化菌2;
泳道3,bl21(de3)转化菌3;
泳道4,bl21(de3)转化菌4;
泳道5,bl21(de3)转化菌5。
图3、ek突变体菌种的诱导表达;各个泳道上样量均为10μl。
m,蛋白marker(kda);
泳道1,bl21(de3)诱导表达前;
泳道2,ek突变体菌种经诱导表达后;
泳道3,ek突变体菌种超声破碎后上清液;
泳道4,ek突变体菌种超声破碎后沉淀。
图4、deae柱纯化蛋白;各个泳道上样量均为10μl。
m,蛋白分子量标准(kda);
泳道1,上样前;
泳道2,上样穿出液;
泳道3,平衡穿出液;
泳道4~14,第1~11管洗脱液。
具体实施方式
本发明人致力于提高肠激酶的稳定性和活性,经过长期的研究和筛选,获得了一种经过序列改造的肠激酶轻链突变体,与野生型相比,该突变体具有更强的酶活性,表达效率(包括复性率和回收率)和稳定性大幅提高。在此基础上完成了本发明。
如本文所用,除非另外说明,所述的“肠激酶轻链突变体”、“突变蛋白ek轻链”、“突变体ek轻链”等可互换使用,均是指氨基酸序列对应于seqidno:1氨基酸序列的第62位氨基酸突变为苏氨酸、第177位氨基酸突变为谷氨酸、以及第112位氨基酸突变为苏氨酸或丙氨酸的蛋白。
若需要表示野生型的蛋白,其将被标示为“野生型肠激酶轻链”、“肠激酶轻链”或“野生型蛋白”,其氨基酸序列为seqidno:1。
如本文所用,所述的“肠激酶轻链(或突变体)活性”是以酶的活力单位来定义的。酶的一个活力单位(1u)定义为25℃,ph7.4)条件下,反应体系3.0ml(1cm光路),每分钟酶解n-苯甲酰-l-精氨酸乙酯(n-benzoyl-l-arginineethylester,baee)使253nm下的吸收值增加0.001定义为一个baee单位。
如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多聚核苷酸和蛋白是没有分离纯化的,但同样的多聚核苷酸或蛋白如从天然状态中同存在的其他物质中分开,则为分离纯化的。
如本文所用,“分离的肠激酶轻链突变体”是指肠激酶轻链突变体基本上不含天然与其相关的其它蛋白、脂类、糖类或其它物质。本领域的技术人员能用标准的蛋白质纯化技术纯化肠激酶轻链突变体。基本上纯的蛋白在非还原聚丙烯酰胺凝胶上能产生单一的主带。
如本文所用,“重组的”是指借助基因工程手段来获得(或大量制备)的蛋白、基因工程载体或细胞等。
本发明的蛋白可以是重组蛋白、天然蛋白、合成蛋白,优选重组蛋白。本发明的蛋白可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生。根据重组生产方案所用的宿主,本发明的蛋白可以是糖基化的,或可以是非糖基化的。本发明的蛋白还可包括或不包括起始的甲硫氨酸残基。
本发明还包括所述肠激酶轻链突变体的片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明的天然肠激酶轻链突变体相同的生物学功能或活性的蛋白。本发明的蛋白片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的蛋白,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的蛋白,或(iii)成熟蛋白与另一个化合物(比如延长蛋白半衰期的化合物,例如聚乙二醇)融合所形成的蛋白,或(iv)附加的氨基酸序列融合到此蛋白序列而形成的蛋白(如前导序列或分泌序列或用来纯化此蛋白的序列或蛋白原序列,或融合蛋白)。根据本文的定义这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。然而,所述的肠激酶轻链突变体及其片段、衍生物和类似物的氨基酸序列中,对应于seqidno:1氨基酸序列的第62位氨基酸为苏氨酸,第177位氨基酸为谷氨酸,以及第112位氨基酸为苏氨酸或丙氨酸。
在本发明中,术语“肠激酶轻链突变体”还包括具有与实施例中所验证的肠激酶轻链突变体相同功能的其它序列变异形式。这些变异形式包括(但并不限于):若干个(通常为1-20个,更佳地1-10个,还更佳如1-8个、1-5个、1-3个、或1-2个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加或缺失一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加或确实一个或数个氨基酸通常也不会改变蛋白质的功能。该术语还包括肠激酶轻链突变体的活性片段和活性衍生物。最好的,在这些变异形式中,对应于seqidno:1氨基酸序列的第62位氨基酸为苏氨酸,第177位氨基酸为谷氨酸,以及第112位氨基酸为苏氨酸或丙氨酸。
发明还提供肠激酶轻链突变体或蛋白的类似物。这些类似物与天然肠激酶轻链突变体的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。这些蛋白包括天然或诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可通过定点诱变法或其他已知分子生物学的技术。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的蛋白并不限于上述例举的代表性的蛋白。
修饰(通常不改变一级结构)形式包括:体内或体外的蛋白的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的蛋白。
本发明还提供了编码本发明肠激酶轻链突变体或其保守性变异蛋白的多核苷酸序列。
本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。
编码本发明的突变体成熟蛋白的多核苷酸包括:只编码成熟蛋白的编码序列;成熟蛋白的编码序列和各种附加编码序列;成熟蛋白的编码序列(和任选的附加编码序列)以及非编码序列。
术语“编码蛋白的多核苷酸”可以是包括编码此蛋白的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的蛋白或蛋白的片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的蛋白的功能。
本发明的肠激酶轻链突变体核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或肠激酶轻链突变体编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述蛋白的方法。
通过常规的重组dna技术(science,1984;224:1431),可利用本发明的多聚核苷酸序列来表达或生产重组的肠激酶轻链突变体。一般来说有以下步骤:
(1).用本发明的编码肠激酶轻链突变体的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
(2).在合适的培养基中培养的宿主细胞;
(3).从培养基或细胞中分离、纯化蛋白质。
本发明中,肠激酶轻链突变体多核苷酸序列可插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体。总之,只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
本领域的技术人员熟知的方法能用于构建含肠激酶轻链突变体编码dna序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(gfp),或用于大肠杆菌的卡那霉素或氨苄青霉素抗性。
包含上述的适当dna序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如植物细胞。代表性例子有:大肠杆菌,链霉菌属、农杆菌;真菌细胞如酵母;植物细胞等。
本发明的多核苷酸在高等真核细胞中表达时,如果在载体中插入增强子序列时将会使转录得到增强。增强子是dna的顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。
本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
获得的转化子可以用常规方法培养,表达本发明的基因所编码的蛋白。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
作为本发明的另一个实例,通过基因工程手段生产肠激酶轻链突变体,比如利用任何适宜的基因工程菌生产所述的肠激酶轻链突变体,分离所述的肠激酶轻链突变体。
在上面的方法中的重组蛋白可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
在本发明的具体实施例中,本发明重组表达了肠激酶的轻链突变体,通过筛选突变位点,获得了活性高,稳定性高的牛肠激酶突变体。肠激酶的重链与轻链通过一对二硫键连接。首先,本发明人单独表达肠激酶的轻链,将其中的与重链连接的112位半胱氨酸突变为苏氨酸或丙氨酸,重组表达、纯化后,获得系列该位点的突变体,提高了复性率,增加了稳定性,不同氨基酸的筛选发现突变为苏氨酸最优。在此基础上,本发明人,增加了突变位点a62t和a177e双突变,得到ek的三突变体ek-c112t-a62t-a186e,ek-c112a-a62t-a177e,使得ek的稳定性进一步增加。
在本发明的具体实施例中,通过测定突变肠激酶的活性和其它性质发现肠激酶突变体与天然的肠激酶相比,其活性和稳定性都有极为显著的提高。
本发明的肠激酶轻链突变体,在重组表达后具有良好的复性率,重组表达的多肽具有良好的稳定性以及酶活性。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
实施例1、牛肠激酶突变体
野生型牛肠激酶(ek)的轻链的氨基酸序列如下(seqidno:1):
针对ek轻链的各个氨基酸位点,本发明人进行了大量的分析、比较和试验,结果发现位于蛋白质三维结构表面的两个疏水性氨基酸ala-62和ala-177,如图1,该氨基酸的r基为一氢原子在蛋白质结构中没有与其他氨基酸侧链形成相互作用。
本发明人将ala-62和ala-177这两个位点的氨基酸分别突变为苏氨酸和谷氨酸,可增加ek蛋白表面的亲水性和局部电荷,可以增加ek在溶液中的稳定性,亦可以提高其复性率。
同时,本发明人拟进行第cys-112位的突变,来提高纯化回收率、复性率或稳定性。
后续的实施例中,验证各个突变体的效果。
实施例2、克隆菌落的pcr鉴定
合成野生型基因及其突变体基因,所述的突变体基因编码在实施例1的野生型氨基酸序列的基础上,发生如下位点突变的突变体多肽:c112a,c112t,c112a-a62t-a177e,c112t-a62t-a177e。
将合成的突变体基因构建在表达质粒pet28a的多克隆位点中,合成的重组质粒转化表达菌种bl21(de3),涂板,37℃培养过夜,挑取转化板上长势较好的单菌落到3ml含卡那抗性的lb培养基中,37℃摇床培养5~6小时,当菌液浑浊肉眼可见时进行菌落pcr。按照菌落pcr体系依次加样。
pcr体系:共20μl
pcr条件
转化牛肠激酶轻链突变体的菌落pcr鉴定结果如图2(以c112t-a62t-a177e突变体为例说明)。从图上可以清晰的看到两个位置的条带,一条条带清晰明亮,另一条条带则相对较模糊。转化时重组质粒转入bl21中,图2为转入bl21的鉴定结果。清晰明亮的条带大小为800bp左右,与所需要的重组子的理论值相符,另一位置的条带的大小为100bp左右,应为引物二聚体条带。所有挑取的单菌落通过菌落pcr鉴定之后均为重组子。
实施例3、诱导表达
将牛肠激酶轻链突变体c112t-a62t-a177e进行诱导表达,以1mm的iptg进行诱导。
通过sds-page蛋白电泳检测,诱导后条带与诱导前条带相比在30kda大小处略微变浓,超声破碎后上清液条带无明显变化,沉淀条带在30kda大小处明显变浓,该表达为包涵体表达。如图3(以c112t-a62t-a177e突变体为例)。
实施例4、肠激酶包涵体复性
菌体破碎后离心收集包涵体,按照1g:10ml加入含有0.5%的曲拉通x-100的tris-hcl缓冲液ph8.0,50mm,充分悬浮1h,离心收集包涵体,加入不含曲拉通x-100的tris-hcl缓冲液的洗涤,去除残余的曲拉通x-100,得到纯化的包涵体。取包涵体按照10mg湿重每ml8m尿素溶解,1h后,加入dtt5mm,再悬浮1h,按照1:10体积比缓慢加入到复性液(tris-hcl缓冲液ph8.5,50mm,1mmgsh,1mmgssg)中。放置复性20-30h后,检测活性,纯化。
实施例5、deae离子柱纯化
在柱子中装入deae胶,先用去离子水冲洗,彻底洗去残留的乙醇,然后用0.1mnaoh处理5个柱体积,用水将柱子冲至中性,用1mnacl冲洗2个柱体积,然后用去离子水冲洗3个柱体积,最后用平衡液50mmtris-hclph8.5平衡5-10个柱体积。按10分钟1个柱体积上样。上样结束后,用50mmtris-hclph8.5缓冲液平衡5个柱体积。平衡后用0~500mmnacl线性洗脱,按照柱体积收集洗脱液。如图4(以c112t-a62t-a177e突变体为例)。
实施例6、肠激酶的酶活测定
采用baee底物法测定牛肠激酶轻链突变体的活性。配制0.067m的磷酸二氢钾13ml和0.067m的磷酸氢二钠87ml组成的缓冲液,将适量baee底物定容至50ml,取10ml加入到缓冲液中,将测活底物预先置于25℃水浴中。取3ml的底物于石英比色皿中,加入适当的待测酶混匀,在253nm下记录3分钟内分光光度计变化的示数。每分钟od变化0.001为一个baee活性单位。
实施例7、稳定性对比
ek轻链突变体系列蛋白纯化结果如表1。
表1
经比较,对于复性后的ek轻链的纯化过程中,三突变体的纯化回收率较单突变提高2倍,比活性也增加了约1.5倍。说明三突变体的复性率和稳定性得到极为显著提高,呈现出与突变前相比出乎意料的效果。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>上海雅心生物技术有限公司
<120>肠激酶轻链突变体及其应用
<130>182480
<160>1
<170>siposequencelisting1.0
<210>1
<211>235
<212>prt
<213>牛(bovine)
<400>1
ilevalglyglyseraspserarggluglyalatrpprotrpvalval
151015
alaleutyrpheaspaspglnglnvalcysglyalaserleuvalser
202530
argasptrpleuvalseralaalahiscysvaltyrglyargasnmet
354045
gluproserlystrplysalavalleuglyleuhismetalaserasn
505560
leuthrserproglnilegluthrargleuileaspglnilevalile
65707580
asnprohistyrasnlysargarglysasnasnaspilealametmet
859095
hisleuglumetlysvalasntyrthrasptyrileglnproilecys
100105110
leuproglugluasnglnvalpheproproglyargilecysserile
115120125
alaglytrpglyalaleuiletyrglnglyserthralaaspvalleu
130135140
glnglualaaspvalproleuleuserasnglulyscysglnglngln
145150155160
metproglutyrasnilethrgluasnmetvalcysalaglytyrglu
165170175
alaglyglyvalaspsercysglnglyaspserglyglyproleumet
180185190
cysglngluasnasnargtrpleuleualaglyvalthrserphegly
195200205
tyrglncysalaleuproasnargproglyvaltyralaargvalpro
210215220
argphethrglutrpileglnserpheleuhis
225230235
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新的多肽——人网格蛋白轻链17和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——网格蛋白轻链12和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人网格蛋白轻链11和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人网格蛋白轻链15和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人网格蛋白轻链11和编码这种多肽的多核苷酸的制作方法
- 人凝血因子轻链蛋白及其应用的制作方法
- 一种新的多肽——网格蛋白轻链37和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——网格蛋白轻链21和编码这种多肽的多核苷酸的制作方法
- 肠激酶轻链基因的合成及其表达产物的制备方法
- 一种多肽——人免疫球蛋白轻链蛋白-26.40和编码这种多肽的多核苷酸的制作方法