纳米金立方的特异性修饰方法与流程
本发明涉及dna纳米技术领域,具体涉及一种纳米金立方的特异性修饰方法。
背景技术:
由于可调整的光学和电子性质以及独特的化学和生物活性,自组装纳米结构在纳米电子学、纳米光子学和生物医学等领域具有潜在的应用价值。纳米粒子能够识别非平行碱基对,因此dna可以作为构建纳米结构的一部分使用,并且近来备受关注。例如,dna可以修饰多种不同类型的纳米材料,包括金属(如金和银)、半导体(如量子点)和绝缘体(如金属氧化物)等,并且能够使其功能化。
虽然可以控制纳米粒子的大小、形状和组成,但是功能化的离散纳米结构尚未实现。dna功能化的金纳米粒子是研究最多的纳米生物系统。通过控制纳米粒子上dna的密度和方向,可以在医疗诊断、药物输送、生物成像、催化和超分子材料等领域体现广泛的应用价值。
最近,国内外研究团队已经开发出新的策略,使用空间控制或纳米笼封装的方法使dna锚定在金纳米颗粒上,以制造带有固定数量dna链的金纳米颗粒。然而,尽管已经实现了近乎完美的控制,但是化学键的各向异性经常定义不明确。
此外,dna折纸技术是一种快速发展的技术,为形成精确的结构提供了前所未有的支撑。在dna折纸结构组装过程中,利用一条m13mp18噬菌体环状单链dna为骨架链,设计216条订书钉链与骨架链碱基互补配对,使之折叠成具有特定形状或图案的纳米结构。每一条订书钉链都可以作为一个识别位点,具有良好的寻址能力。许多复杂的纳米结构都利用了dna折纸的组装能力,包括用于纳米电子学的共轭聚合物和碳纳米管以及用于等离激元的纳米金颗粒等。然而,这些类型的结构依赖于静态的dna折纸,而很少涉及到动态系统。
有鉴于此,确有必要发明一种基于dna的纳米金立方特异性修饰方法,以解决上述问题。
技术实现要素:
本发明的目的在于提供一种基于dna折纸技术,将特定数量、序列和位置的dna链锚定到纳米金立方上,实现基于dna的纳米金立方的特异性修饰方法。
为了实现上述目的,本发明采用如下技术方案:
一种纳米金立方的特异性修饰方法,所述方法基于dna折纸方法,通过在dna折纸上设置特定的连接链将其与纳米金立方结合,使所述特定的连接链转移至所述纳米金立方的表面,进而形成具有特异性连接链的纳米金立方结构。
作为本发明进一步改进的技术方案,所述dna折纸采用三角形折纸,dna三角形折纸每边设置有捕获链,所述捕获链与所述连接链结合,通过加入分离链使所述分离链替换所述连接链,所述分离链与所述捕获链结合,从而将所述连接链与所述dna三角形折纸分离。
作为本发明进一步改进的技术方案,所述纳米金立方的连接链上组装有纳米金颗粒,可在透射电子显微镜下成像,实现对具有特异性连接链的纳米金立方的表征。
作为本发明进一步改进的技术方案,具体步骤:
步骤一:制备dna三角形折纸-连接链结构;
步骤二:制备纳米金立方-巯基dna1结构并与所述dna三角形折纸-连接链结构结合,形成dna三角形折纸-纳米金立方结构;
步骤三:制备纳米金立方-连接链结构;
步骤四:制备纳米金颗粒-巯基dna2结构并与纳米金立方-连接链结构结合,形成纳米金立方-纳米金颗粒结构。
作为本发明进一步改进的技术方案,在步骤一中,dna三角形折纸每边设置有捕获链,所述捕获链与所述连接链碱基互补,形成dna三角形折纸-连接链结构;在步骤二中,将所述纳米金立方与巯基dna1吸附结合,形成纳米金立方-巯基dna1结构,所述纳米金立方-巯基dna1结构与所述dna三角形折纸-连接链结构相结合;在步骤三中,所述分离链与所述捕获链碱基互补,所述dna三角形折纸-纳米金立方结构分离为所述dna三角形折纸和纳米金立方-连接链结构;在步骤四中,加入纳米金颗粒,并在所述纳米金颗粒上设置巯基dna2,形成纳米金颗粒-巯基dna2结构,所述纳米金立方-连接链结构与所述纳米金颗粒-巯基dna2结构相结合,形成纳米金立方-纳米金颗粒结构。
作为本发明进一步改进的技术方案,dna三角形折纸每边设置有2条捕获链,共6条捕获链与所述连接链结合,每2条所述连接链连接1个所述纳米金颗粒,一个所述纳米金立方连接3个所述纳米金颗粒。
作为本发明进一步改进的技术方案,步骤一中,还包括使用100kda超滤管离心/用琼脂糖凝胶电泳除去多余的dna结构,纯化所述dna三角形折纸-连接链结构。
作为本发明进一步改进的技术方案,步骤二中,还包括通过琼脂糖凝胶电泳的方法,去除多余的dna结构和所述纳米金立方,纯化所述dna三角形折纸-纳米金立方结构。
作为本发明进一步改进的技术方案,步骤三中,还包括通过多次离心的方法,去除多余的dna结构,纯化分离后的所述纳米金立方-连接链结构。
作为本发明进一步改进的技术方案,步骤一中按照水溶液种子介导的生长方法制备尺寸为42nm的所述纳米金立方;步骤二中将所述巯基dna1与所述纳米金立方加入十二烷基硫酸钠溶液和氯化钠溶液中防止纳米金立方聚集,所述巯基dna1与所述纳米金立方的吸附时间为24h。
本发明的有益效果是:本发明基于dna折纸方法,通过在dna折纸上设置特定的连接链将其与纳米金立方结合,使所述特定的连接链转移至所述纳米金立方的表面,进而形成具有特异性连接链的纳米金立方结构。特异性连接链的纳米金立方结构,一方面,特异性连接链的数量、序列及空间位置可调控,实现纳米金立方的各向异性功能化;另一方面,其可以与纳米金颗粒结合,在透射电子显微镜下成像,实现对纳米金立方特异性修饰dna的表征。
附图说明
图1为本发明纳米金立方的特异性修饰方法示意图;
图2为本发明dna三角形折纸-纳米金立方结构的示意图;
图3为本发明dna三角形折纸-纳米金立方结构的琼脂糖凝胶电泳图;
图4为本发明纳米金立方-纳米金颗粒结构的示意图;
图5为本发明纳米金立方-纳米金颗粒结构的透射电子显微镜表征图。
具体实施方式
为了使本发明的目的、技术方案和优点更加清楚,下面结合附图和具体实施方式对本发明进行详细描述。
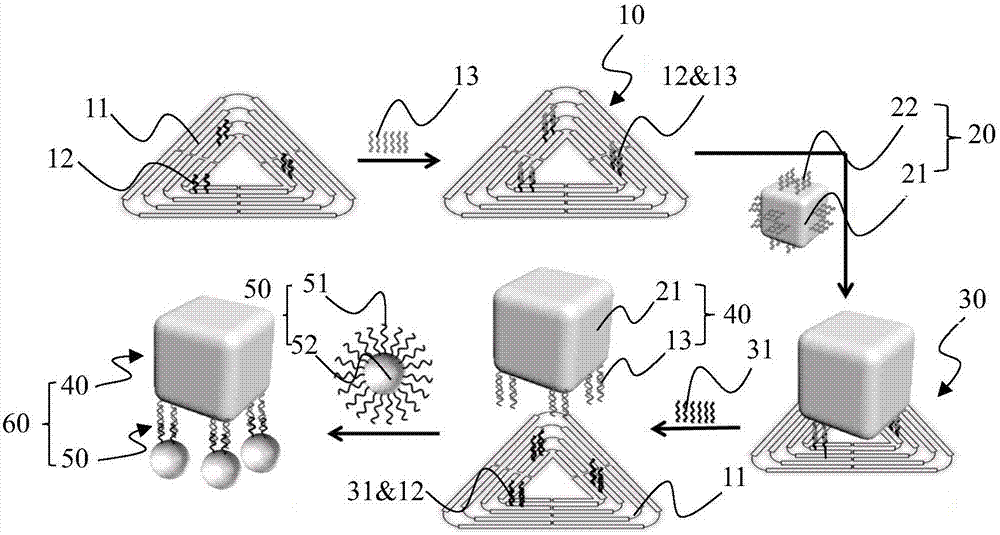
如图1所示,为本发明纳米金立方的特异性修饰方法示意图。纳米金立方的特异性修饰方法基于dna折纸方法,通过在dna折纸上设置特定的连接链13将其与纳米金立方21结合,使连接链13转移至所述纳米金立方21的表面,进而形成具有特异性连接链13的纳米金立方21结构。dna折纸采用三角形折纸,dna三角形折纸11每边设置有捕获链12,捕获链12与连接链13结合,再通过加入分离链31替换连接链13,分离链31与捕获链12结合,从而将连接链13与dna三角形折纸11分离;纳米金立方21的连接链13上组装有纳米金颗粒52,可在透射电子显微镜下成像,实现对具有特异性连接链13的纳米金立方21的表征。具体方法包括以下步骤:
步骤一:制备dna三角形折纸-连接链结构10;
步骤二:制备纳米金立方-巯基dna1结构20并与dna三角形折纸-连接链结构10结合,形成dna三角形折纸-纳米金立方结构30;
步骤三:制备纳米金立方-连接链结构40;
步骤四:制备纳米金颗粒-巯基dna2结构50并与纳米金立方-连接链结构40结合,形成纳米金立方-纳米金颗粒结构60。
如图2所示,为本发明dna三角形折纸-纳米金立方结构30的示意图。
步骤一:图2中左侧为按照rothemund和seeman的方法制备的dna三角形折纸11,在dna三角形折纸11的每条边的42号位和50号位置,分别伸出一条捕获链12,捕获链12的长度均为62nt。dna三角形折纸11的骨架链、订书钉链以及捕获链12和连接链13(即特异性连接链)一起放置于pcr仪中退火,从95℃经过2h退火到室温,并使用100kda超滤管离心除去多余的dna结构或用琼脂糖凝胶电泳纯化,纯化dna三角形折纸-连接链结构10。其中,连接链13的长度为34nt,连接链13和dna三角形折纸11上的捕获链12部分碱基互补配对。退火结束后连接链13通过碱基互补配对组装到dna三角形折纸11的六条捕获链12上,得到dna三角形折纸-连接链结构10,完成步骤一的制备。
步骤二:图2中的纳米金立方-巯基dna1结构20(即修饰了巯基dna1的纳米金立方21),其中巯基dna122长度为15nt。按照catherinej.murphy的水溶液种子介导的生长方法制备尺寸约为42nm的纳米金立方21,再将其修饰巯基dna122,具体修饰步骤包括:首先,将200μl纳米金立方21在5000rpm下离心10min,去除上清溶液,将沉淀分散在95μl超纯水中,加入5μl浓度为100nm的巯基dna122,再加入1.5μl的浓度为1m的十二烷基硫酸钠溶液,在37℃、300rpm下孵育12h;其次每隔30min分别加入1、2、3、4μl的浓度为3m的氯化钠溶液调节纳米金立方溶液的盐浓度,在37℃、300rpm下孵育12h;最后将纳米金立方溶液在5000rpm下离心10min,去除上清溶液,将沉淀中分散在0.5×tbe溶液中,再离心,去除上清溶液,得到修饰了巯基dna122的纳米金立方21(即纳米金立方-巯基dna1结构20)。优选地,巯基dna122与纳米金立方21的吸附时间为24h。
最后,将步骤一中的dna三角形折纸-连接链结构10和步骤二中的纳米金立方-巯基dna1结构20在pcr仪中退火,从45℃经过11.5h退火到23℃,得到dna三角形折纸-纳米金立方结构30,完成步骤二的制备。
如图3所示,为本发明dna三角形折纸-纳米金立方结构30的琼脂糖凝胶电泳图。进一步,针对得到的dna三角形折纸-纳米金立方结构30进行纯化,通过琼脂糖凝胶电泳的方法纯化,去除多余的dna结构和纳米金立方21。其具体操作为:
(1)将上述步骤中得到的dna三角形折纸-纳米金立方结构30进行0.8%的琼脂糖凝胶电泳纯化,电压为100v,缓冲溶液为0.5×tae(mg2+)。
(2)在图3的琼脂糖凝胶电泳图中,泳道1为dna三角形折纸结构11,泳道2为纳米金立方-巯基dna1结构20,泳道3-8为未纯化的dna三角形折纸-纳米金立方结构30。其中,泳道1和泳道2起到对比的作用,帮助找到目标条带。
(3)电泳结束后,在凝胶成像仪(紫外光下)和白光板(白光下)上进行观察。观察结构如图3所示。将形成的目标条带(即纯化的dna三角形折纸-纳米金立方结构30)割下,在透析袋中进行透析回收,得到较为纯净的dna三角形折纸-纳米金立方结构30。
(4)在图3的琼脂糖凝胶电泳图中,最上方的条带为聚集物,中间条带为目标产物(即dna三角形折纸-纳米金立方结构30),最下方的条带为离散的纳米金立方-巯基dna1结构20。
如图4所示,为本发明纳米金立方-纳米金颗粒结构60的示意图。
步骤三如图4所示,在上述步骤中得到的dna三角形折纸-纳米金立方结构30中加入过量分离链31,于pcr仪中退火,从50℃经过5.5h退火到30℃。退火结束后,纳米金立方21和dna三角形折纸11分离。其中通过dna链的置换反应,分离链31和dna三角形折纸11上的捕获链12完全互补配对,原本和捕获链12部分互补配对的连接链13被置换下来,连接链13的另一端仍然和纳米金立方21上的巯基dna122相连。因此,从整体来看,纳米金立方21带着六条特异性连接链13从dna三角形折纸11上脱离,即达到了基于dna的纳米金立方21的特异性修饰(即纳米金立方-连接链结构40)的效果,完成步骤三的制备。
此外,在步骤三中退火后的溶液有许多其他结构,包括分离下来的dna折纸11、分离链31等,需要经过如下步骤进行纯化:首先将溶液在5000rpm下离心10min,除去上清溶液;其次将得到的沉淀中分散在0.5×tbe(na+)溶液中;最后重复上述步骤。经过多次离心即可去除大部分多余的dna结构,进一步纯化纳米金立方-连接链结构40。
步骤四:将过量的修饰了巯基dna251的20nm的纳米金颗粒52(即纳米金颗粒-巯基dna2结构50)加入到步骤三中纯化的纳米金立方-连接链结构40中。
首先,巯基dna251的长度为20nt。纳米金颗粒52修饰巯基dna251的具体修饰步骤为:先在200μl纳米金颗粒52中加入5×tbe溶液20μl,再加入2μl的浓度为100nm的巯基dna251,在37℃下孵育4h;孵育结束后,每隔30min在纳米金颗粒溶液中加入5μl的浓度为3mol/l的氯化钠溶液,加四次之后在37℃、300rpm下反应12h;最后将纳米金颗粒溶液在9000rpm下离心10min,去除上清溶液后,将沉淀分散在100μl的0.5×tbe溶液中,重复上述步骤三次,即得到纳米金颗粒-巯基dna2结构50。
然后,将纳米金颗粒-巯基dna2结构50过量加入到步骤三中获得的纳米金立方-连接链结构40中,在25℃下孵育12h,每2条相近的连接链13连接1个纳米金颗粒-巯基dna2结构50,1个纳米金立方-连接链结构40连接3个纳米金颗粒-巯基dna2结构50,即得到纳米金立方-纳米金颗粒结构60,完成步骤四的制备。
此步骤是为了证明纳米金立方21上特异性修饰的dna链(即特异性连接链13)的存在,纳米金颗粒-巯基dna2结构50与纳米金立方-连接链结构40连接,即可对其进行可视化表征,通过纳米金颗粒-巯基dna2结构50与纳米金立方-连接链结构40的连接情况,可推测特异性连接链的数量和位置。
如图5所示,为本发明纳米金立方-纳米金颗粒结构60的透射电子显微镜表征图。
将实施例步骤四中得到的纳米金立方-纳米金颗粒结构60的等离子体纳米金结构在透射电子显微镜下进行表征,可以观察到到纳米金立方-纳米金颗粒结构60的等离子体纳米金结构,即证明了纳米金立方21上特异性修饰dna链(即连接链13)的存在,说明基于dna的纳米金立方的特异性修饰的成功。
综上所述,本发明公开了一种纳米金立方的特异性修饰方法,所述方法基于dna折纸方法,通过在dna折纸上设置特定的连接链将其与纳米金立方结合,使所述特定的连接链转移至所述纳米金立方的表面,进而形成具有特异性连接链的纳米金立方结构。本发明通过实现纳米金立方21的特异性修饰的方法,实现纳米金立方21的各向异性功能化和对纳米金立方21特异性修饰dna的可视化表征。
以上实施例仅用于说明本发明而并非限制本发明所描述的技术方案,对本说明书的理解应该以所属技术领域的技术人员为基础,尽管本说明书参照上述的实施例对本发明已进行了详细的说明,但是,本领域的普通技术人员应当理解,所属技术领域的技术人员仍然可以对本发明进行修改或者等同替换,而一切不脱离本发明的精神和范围的技术方案及其改进,均应涵盖在本发明的权利要求范围内。
- 还没有人留言评论。精彩留言会获得点赞!