一种体外诱导扩增高杀伤活性γδT细胞的方法与流程
本发明涉及一种体外诱导扩增高杀伤活性γδt细胞的方法,属于生物技术领域。
背景技术
γδt细胞是执行固有免疫功能的t细胞,是天然免疫的一种细胞类型,其tcr由γ和δ链组成。其tcr缺乏多样性,可直接识别某些完整的多肽抗原。γδt细胞所识别的抗原种类有限:①hsp;②感染细胞表面cd1分子提成的脂类抗原;③某些病毒蛋白或表达于感染细胞表面的病毒蛋白;④细菌裂解产物中的磷酸化抗原。此类t细胞主要分布于肠道呼吸道以及泌尿生殖道等黏膜和皮下组织,在外周血中只占cd3+t细胞的0.5%-1%,虽然在外周血t淋巴细胞的比较低,但是却是人体免疫防御第一道防线的重要组成部分。激活的γδt细胞能够分泌细胞因子和趋化因子,可以直接杀伤感染细胞或肿瘤细胞。
随着对肿瘤逃避免疫监视机理研究的不断深入,人们发现γδt细胞在抗感染和抗肿瘤方面发挥着重要的作用。肿瘤的过继免疫细胞治疗临床试验研究也表明:过继γδt细胞输注治疗肿瘤是安全的、也是有效的;γδt细胞的数量和抗肿瘤活性是过继γδt细胞输注治疗临床取得疗效的关键。因此,为了使过继γδt细胞治疗取得理想的临床治疗效果,需要获得大量具有高抗肿瘤活性的γδt细胞,以满足临床治疗的需要。
技术实现要素:
本发明的目的是解决现有技术中如何才能扩增出大量具有高杀伤活力的γδt细胞的问题,提供一种体外诱导扩增高杀伤活力γδt细胞的方法。
技术方案
一种体外诱导扩增高杀伤活力γδt细胞的方法,包括如下步骤:
(1)制备pbmcs:取外周血,肝素抗凝,采用淋巴细胞分离液分离制备外周血单个核细胞(pbmcs),用pbs缓冲液重悬洗涤细胞两次;
(2)γδt细胞的刺激培养:向无血清培养基加入5-10v%的自体血浆,同时按照每毫升无血清培养基加1μlγδt细胞刺激因子的计量加入γδt细胞刺激因子,得到γδt细胞刺激培养基,使用γδt细胞刺激培养基悬起pbmcs,并调整密度至1-3×106个细胞/ml,接种于培养瓶中,并置于37℃、5%co2的条件下培养;
(3)制备γδt细胞扩增培养基:按照每毫升培养基加1μlγδt细胞扩增因子的计量,向无血清培养基中加入γδt细胞扩增因子,得到γδt细胞扩增培养基;
(4)扩增培养:待步骤(2)中培养至第3d时,离心去除刺激培养基,使用γδt细胞扩增培养基将细胞密度调整到2-3×106个细胞/ml,以后每2-3d根据细胞密度补液,直至培养至第7-9d,然后加入尼克酰胺(nicotinamide),使其在培养基中的终浓度为2.5-7.5mm,以后每2-3d补加γδt细胞扩增培养基使细胞密度保持在2-3×106个细胞/ml,并补加尼克酰胺,使其在培养基中的终浓度为2.5-7.5mm;在37℃、5%co2的条件下培养10-14d,获得γδt细胞。
步骤(2)中,所述无血清培养基为本领域常规的无血清培养基,市售即可,比如x-vivo15tm,optimizer的无血清t细胞培养基。
进一步,步骤(2)中,所述γδt细胞刺激因子包含如下组分:含有1~10mm的唑来膦酸,2×105~1×106iu/ml的il-2,5~50μg/ml的il-7,5~50μg/ml的il-15;优选为5mm的唑来膦酸,6×105iu/ml的il-2,10μg/ml的il-7,10μg/ml的il-15,对γδt细胞的扩增和抗肿瘤活性更有利。
进一步,步骤(3)中,所述无血清培养基中加有5-10v%的自体血浆,有利于细胞的扩增、生长。
进一步,步骤(3)中,所述γδt细胞扩增因子包含如下组分:2×105~1×106iu/ml的il-2,5~50μg/ml的il-7,5~50μg/ml的il-15,优选为6×105iu/ml的il-2,10μg/ml的il-7,10μg/ml的il-15,对γδt细胞的扩增和抗肿瘤活性更有利。
进一步,步骤(4)中,尼克酰胺在培养基中的终浓度为2.5-7.5mm,优选为5mm,对γδt细胞的扩增和抗肿瘤活性更有利。
本发明的有益效果是:本发明无需对pbmcs进行纯化,在培养14天即可获得高纯度的γδ可获细胞,扩增的γδ,扩细胞具有更强的抗肿瘤活性,扩增细胞数量多,可以满足临床应用需求。本发明操作步骤简单,可操作性强,具有很好的推广价值。
附图说明
图1是采用实施例1方法诱导扩增前外周血中γδt细胞比例的流式结果;
图2是采用实施例1方法诱导扩增后的γδt细胞比例的流式结果;
图3是采用实施例2方法诱导扩增前外周血中γδt细胞比例的流式结果;
图4是采用实施例2方法诱导扩增后的γδt细胞比例的流式结果;
图5是采用实施例1和对比例1方法获得的γδt细胞的抗肿瘤活性的检测结果;
图6是采用实施例2和对比例2方法获得的γδt细胞的抗肿瘤活性的检测结果。
具体实施方式
下面结合附图和具体实施方式对本发明进行详细说明。
下述实施例中,所采用的无血清培养基为vivo-15tm无血清培养基购自lonza,唑来膦酸购自吉林省西点药业,il-2、il-7和il-15购自美天旎,尼克酰胺购自sigma。
实施例1
一种体外诱导扩增γδt细胞的方法,包括如下步骤:
(1)制备pbmcs:
a.采用肝素抗凝的真空采血管抽取一名健康志愿者的50ml外周血,并以3000rpm室温离心10min,将血浆放入新的50ml离心管里,并置于56℃的恒温培养箱中30min以灭活补体。
b.取30ml淋巴细胞分离液,平均加到淋巴细胞分离管中,每管15ml。
c.在离心后的细胞沉淀中加入40ml的pbs,混合均匀,将稀释好的血细胞慢慢加入到含有15ml淋巴细胞分离液的淋巴细胞分离管中,1800rpm室温离心20min。
d.离心后,轻轻取出淋巴细胞分离管中间的白膜层细胞至两个新的50ml离心管中,再加入10倍体积的pbs,充分混匀,以1500rpm室温离心5min,离心结束后,再加入pbs,重复洗涤1次,最终获得52.4×106个pbmcs(外周血单个核细胞)。
(2)γδt细胞的刺激培养:向无血清培养基加入5v%自体血浆,同时按照每毫升培养基加1μlγδt细胞刺激因子的计量加入γδt细胞刺激因子(每毫升γδt细胞刺激因子包含:5mm的唑来膦酸,6×105iu/ml的il-2,10μg/ml的il-7,10μg/ml的il-15),得到γδt细胞刺激培养基,使用γδt细胞刺激培养基悬起pbmcs,并调整密度至2×106个细胞/ml,接种于培养瓶中,并置于37℃、5%co2的条件下进行培养;
(3)制备γδt细胞扩增培养基:向无血清培养基加入5v%自体血浆,同时按照每毫升无血清培养基加1μlγδt细胞扩增因子的计量加入γδt细胞扩增因子(每毫升γδt细胞扩增因子包含:6×105iu/ml的il-2,10μg/ml的il-7,10μg/ml的il-15),得到γδt细胞扩增培养基;
(4)扩增培养:待步骤(2)中培养至第3d时,1500rpm室温离心5min去除刺激培养基,使用γδt细胞扩增培养基将细胞密度调整到2-3×106个细胞/ml;以后每2d根据细胞密度(2-3×106个细胞/ml)补液,直至培养至第7d,然后加入尼克酰胺,使其在培养基中的终浓度为5mm;每2d补加γδt细胞扩增培养基使细胞密度保持在2-3×106个细胞/ml,并补加尼克酰胺,使其在培养基中的终浓度为5mm,在37℃、5%co2的条件下培养14d,获得γδt细胞。
实验测试:
1.细胞计数
取实施例1步骤(4)培养的细胞,pbs稀释10倍,台盼蓝再1:1稀释2倍,取10μl加入到血细胞计数板中,在显微镜下计数,并以“细胞总数÷4×104×稀释倍数×液体总量”公式计算细胞数。经计算,细胞数为2.19×106个细胞/ml。
2.流式细胞术检测外周血γδt细胞
取100μl步骤(1)中留取的外周血,加入流式管中,加入不同荧光标记的鼠抗人cd3,vγ9抗体各5μl,室温孵育15min,加入2ml红细胞裂解液,室温孵育5min,1500rpm室温离心5min,去上清,加入2mlpbs洗涤细胞,500rpm室温离心5min,弃上清,加入200μlpbs悬起细胞,流式细胞仪检测。
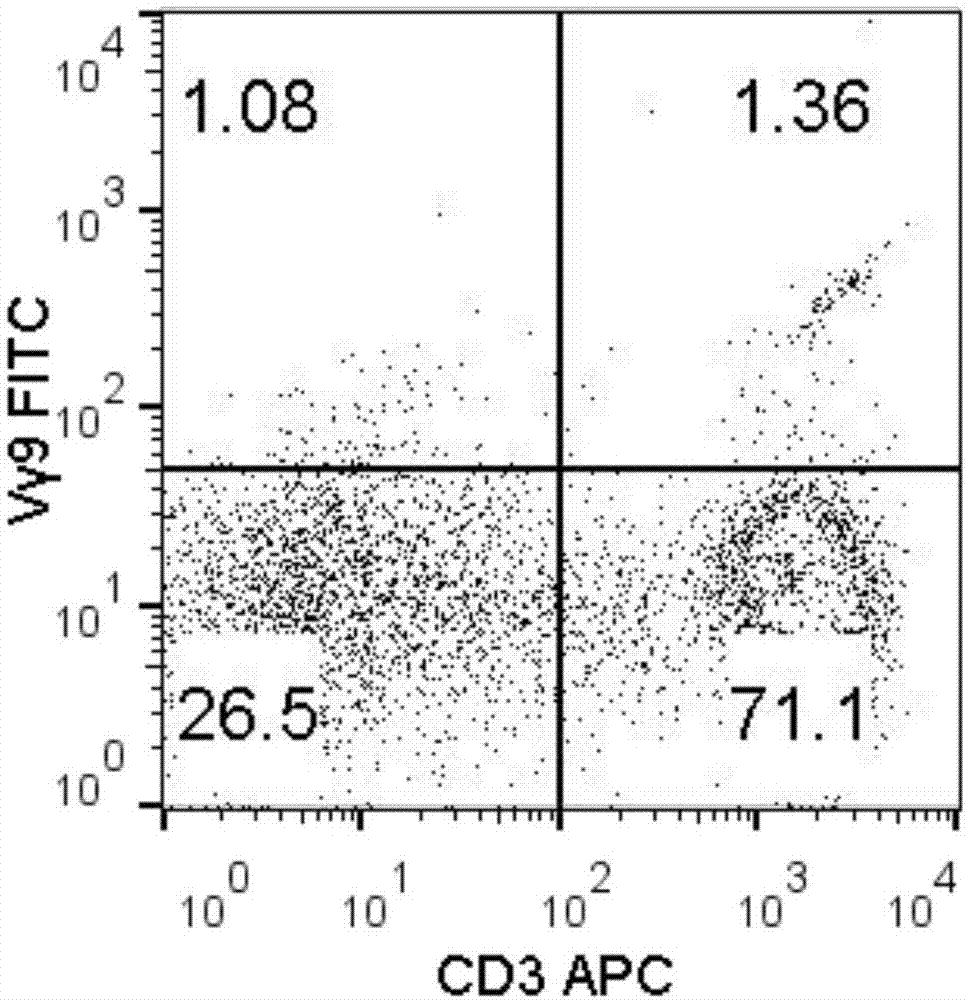
图1是采用实施例1方法诱导扩增前外周血淋巴细胞中γδt细胞比例的流式结果,图2是采用实施例1方法诱导扩增后的γδt细胞比例的流式结果;由图1和图2可以看出,经本方法诱导之前人外周血中γδt细胞的比例比较低,仅为1.36%,经本方法诱导培养后,能够获得高纯度的γδt细胞,比例高达92.4%。
3.计算γδt细胞扩增倍数
根据扩增后细胞培养基体积(600ml),细胞密度(2.19×106个细胞/ml)以及扩增后γδt细胞的比例(92.4%),计算出实际获得的γδt细胞数目为1.21×109个细胞。扩增前的γδt细胞数目为1.36%×52.4×106个细胞=0.71264×106个细胞。因此γδt细胞扩增倍数为1699倍。
实施例2
一种体外诱导扩增γδt细胞的方法,包括如下步骤:
(1)制备pbmcs:
a.采用肝素抗凝的真空采血管抽取另一名健康志愿者的50ml外周血,并以3000rpm室温离心10min,将血浆放入新的50ml离心管里,并置于56℃的恒温培养箱中30min以灭活补体。
b.取30ml淋巴细胞分离液,平均加到淋巴细胞分离管中,每管15ml。
c.在离心后的细胞沉淀中加入40ml的pbs,混合均匀,将稀释好的血细胞慢慢加入到含有15ml淋巴细胞分离液的淋巴细胞分离管中,1800rpm室温离心20min。
d.离心后,轻轻取出淋巴细胞分离管中间的白膜层细胞至两个新的50ml离心管中,再加入10倍体积的pbs,充分混匀,以1500rpm室温离心5min,离心结束后,再加入pbs,重复洗涤1次,最终获得45.4×106个pbmcs(外周血单个核细胞)。
(2)γδt细胞的刺激培养:向无血清培养基加入5v%自体血浆,同时按照每毫升培养基加1μlγδt细胞刺激因子的计量加入γδt细胞刺激因子(每毫升γδt细胞刺激因子包含:5mm的唑来膦酸,6×105iu/ml的il-2,10μg/ml的il-7,10μg/ml的il-15),得到γδt细胞刺激培养基,使用γδt细胞刺激培养基悬起pbmcs,并调整密度至2×106个细胞/ml,接种于培养瓶中,并置于37℃、5%co2的条件下进行培养;
(3)制备γδt细胞扩增培养基:向无血清培养基加入5v%自体血浆,同时按照每毫升培养基加1μlγδt细胞扩增因子的计量加入γδt细胞扩增因子(每毫升γδt细胞扩增因子包含:6×105iu/ml的il-2,10μg/ml的il-7,10μg/ml的il-15),得到γδt细胞扩增培养基;
(4)扩增培养:待步骤(2)中培养至第3d时,1500rpm室温离心5min去除刺激培养基,使用γδt细胞扩增培养基将细胞密度调整到2-3×106个细胞/ml;以后每2d根据细胞密度(2-3×106个细胞/ml)补液,直至培养至第7d,然后加入尼克酰胺,使其在培养基中的终浓度为5mm;每2d补加γδt细胞扩增培养基使细胞密度保持在2-3×106个细胞/ml,并补加尼克酰胺,使其在培养基中的终浓度为5mm,在37℃、5%co2的条件下培养14d,获得γδt细胞。
实验测试:
1.细胞计数
取步骤(4)培养的细胞,pbs稀释10倍,台盼蓝再1:1稀释2倍,取10μl加入到血细胞计数板中,在显微镜下计数,并以“细胞总数÷4×104×稀释倍数×液体总量”公式计算细胞数。经计算,细胞数为2.71×106个细胞/ml。
2.流式细胞术检测外周血γδt细胞
取100μl步骤(1)中留取的外周血,加入流式管中,加入不同荧光标记的鼠抗人cd3,vγ9抗体各5μl,室温孵育15min,加入2ml红细胞裂解液,室温孵育5min,1500rpm室温离心5min,去上清,加入2mlpbs洗涤细胞,500rpm室温离心5min,弃上清,加入200μlpbs悬起细胞,流式细胞仪检测。
图3是采用实施例2方法诱导扩增前外周血淋巴细胞中γδt细胞比例的流式结果,图4是采用实施例2方法诱导扩增后的γδt细胞比例的流式结果;由图4和图5可以看出,经本方法诱导之前人外周血中γδt细胞的比例比较低,仅为2.42%,经本方法诱导培养后,能够获得高纯度的γδt细胞,比例高达94.9%。
3.计算γδt细胞扩增倍数
根据扩增后细胞培养基体积(850ml),细胞密度(2.71×106个细胞/ml)以及扩增后γδt细胞的比例(94.9%),计算出实际获得的γδt细胞数目为2.186×109个细胞。扩增前的γδt细胞数目为2.42%×45.4×106个细胞=1.099×106个细胞。因此γδt细胞扩增倍数为1989倍。
对比例1
γδt细胞的体外诱导扩增过程中,不加入尼克酰胺,其余过程与实施例1相同。
对比例2
γδt细胞的体外诱导扩增过程中,不加入尼克酰胺,其余过程与实施例2相同。
γδt细胞对肿瘤的杀伤活性检测:
(1)靶细胞的处理
1)分别收集培养的k562细胞和raji细胞作为靶细胞,1000rpm离心5min,pbs洗1次;
2)用pbs重悬靶细胞,调整浓度为1×106个细胞/ml;
3)取1ml靶细胞(1×106个细胞/ml),加入calceinam(终浓度为1μm),37℃,5%co2避光孵育30min。
4)孵育好的靶细胞用pbs洗2次,1000rpm离心5min,用含有5%fbs的rpmi-1640培养基重悬细胞,调整浓度为5×104个细胞/ml,备用。
(2)效应细胞的处理
取实施例1、实施例2、对比例1和对比例2中诱导后的γδt细胞,1000rpm离心5min,收集细胞,并用含有5%fbs的rpmi-1640培养基将细胞密度调整至5×105个细胞/ml(10:1)。
(3)铺板(各设三个复孔,取平均值)
自发释放孔:100μl靶细胞+100μl5%fbs培养基+10μlpbs;
最大释放孔:100μl靶细胞+100μl5%fbs培养基+10μl4.2%triton100;
实验孔:100μl靶细胞+100μl效应细胞+10μlpbs
(4)检测
37℃,5%co2避光孵育4h后,1800rpm离心5min,每孔吸取上清100μl于新96孔平板中,酶标仪检测上清荧光值(激发光波长485nm,发射光波长528nm),根据下面公式计算细胞毒性,结果见表3和表4:
表3
表4
图5是采用实施例1和对比例1方法获得的γδt细胞的抗肿瘤活性的检测结果,由图5可以看出,加入尼克酰胺后γδt细胞对raji细胞的杀伤作用明显增强。
图6是采用实施例2和对比例2方法获得的γδt细胞的抗肿瘤活性的检测结果,由图6可以看出,加入尼克酰胺后γδt细胞对raji细胞的杀伤作用明显增强。
综上:本发明加入的尼克酰胺,能够明显提高γδt细胞对肿瘤细胞raji细胞的杀伤作用,说明本发明诱导扩增的γδt细胞具有更强的抗肿瘤活性。
- 还没有人留言评论。精彩留言会获得点赞!