一种CsTTG1基因与茶叶茸毛生长发育线性关系的鉴定方法与流程
本发明属于生物技术领域,具体涉及一种csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法。
背景技术
茶树的嫩叶是制茶的主要原料,特别是早春时期采摘的茶叶品质极佳,茶树嫩芽茸毛中含有更高的氨基酸和较少的多酚类物质,赋予茶汤更多鲜味和更少涩味。茶叶茸毛的数量和质量是评定茶树品种经济性的主要性状之一,茶树芽叶的茸毛越多,表明茶树芽叶越嫩,同时其质量也越好。
茶叶中的茸毛可以提高茶叶外形品质。许多名茶包括红茶、白茶等在制作过程中,都要求茶毫能显露出来,以便提高干茶外形品质和茶汤口感品质,如高级祁红、滇红、黄山毛峰、白毫银针、信阳毛尖等。高品味的名优茶中富含茸毛,茸毛能增加茶叶的鲜甜并减少苦涩,而茶叶的鲜甜主要来源于游离的氨基酸如天冬氨酸和丝氨酸。茶叶茸毛很大程度上积极影响口感品质的形成,在加工过程中,由于杀青及揉捻的外力作用,鲜叶中的部分茸毛会发生脱落,沾附在茶叶表面。冲泡之后,附在茶叶中的茶毫会完全溶在茶汤中,其中的氨基酸和其它成分会融进茶汤中,增加了茶汤的香气和滋味,提高了茶汤的口感品质。
现有研究采用smart-race技术克隆了茶树dof(dnabindingwithonefinger)基因cscdf1的全长cdna序列,并利用在线生物信息学软件对其进行了分析。采用实时荧光定量pcr分析该dof基因在茶树不同组织间的表达差异和昼夜表达规律,及其在氮饥饿处理2周后对不同浓度氮素诱导的响应。该cdna序列全长1606bp,包含1个编码464个氨基酸的完整开放阅读框,含有高度保守的dof结构域,推导的蛋白分子量为50.8kda,理论等电点(pi)为5.52;其编码的蛋白序列与茸毛烟草、马铃薯和美花烟草的cdf蛋白(cyclingdoffactor)相似性分别为69%、67%、68%。系统发育分析结果表明,该基因编码的氨基酸序列与拟南芥cdf蛋白聚为一类,因此将其命名为cscdf1;cscdf1在3个不同茶树品种根系中的表达量均高于一芽二叶和成熟叶;在一天中,该基因的表达呈现出昼夜节律变化;在氮饥饿后重新供氮,不同组织中该基因对不同浓度氮素的响应均为上调。已有研究发现,发现茶树中和调控拟南芥表皮毛生长发育相关的同源基因atttg1表达模式相关,并命名为csttg1。
但是关于影响茶叶茸毛生产发育的基因以及其与茶叶茸毛生长发育线性关系尚未有研究。因此,鉴定csttg1基因与茶叶茸毛生长发育线性关系,可以为csttg1基因的表达模式与茸毛发育的关系,通过对不同品种间茸毛密度分布特征的研究,划分品种茸毛等级;研究csttg1在品种间的表达差异,分析csttg1基因表达模式与茸毛分布特征的关系;并以模式植物的遗传转化来验证csttg1基因功能。不仅深化对茸毛形成分子机理的认识,同时也为指导茶树的遗传育种提供重要的理论依据。
技术实现要素:
有鉴于此,本发明提供一种csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法。本发明可为深化对茸毛形成分子机理的认识,同时也为指导茶树的遗传育种提供重要的理论依据。
本发明的技术方案为:一种csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,其特征在于,包括以下步骤:
s1.选取待测茶树品系,取茶树品系茶叶的顶芽、第二叶、第三叶、老叶;
s2.分别提取茶叶的顶芽、第二叶、第三叶、老叶的rna序列;
s3.将提取的rna序列分别反转录成cdna;
s4.以cdna为模板,通过特异性引物对进行pcr扩增;
s5.对pcr扩增的产物进行测序,检测分析csttg1在茶叶茸毛生长发育线性关系中是否具有特异性表达。
进一步的,步骤s2中,所述茶叶的rna序列提取方法包含以下步骤:
(1)往预冷的2.0ml的离心管中加入700uml的bufferprc1液;
(2)称取50-100mg样品材料置于加有液氮的研钵中,迅速磨成粉末状并转到第1步的离心管中,高速涡旋60秒打散样品,冰上放置5min,55℃短暂水浴1分钟;
(3)冷却到室温,14000rpm离心5min;
(4)把gdna过滤柱装在2ml收集管中,把第3步的上清液转移在gdna过滤柱中。14000rpm离心2min。弃掉gdna过滤柱;
(5)加入0.5倍体积的无水乙醇至滤纸中,移液枪吸打3-5次,按第6步进行操作;
(6)把hipurernaminicolumn装在2ml收集中。转移700ul混合液至柱子中。10000rpm离心60s;
(7)倒弃滤液,把柱子装回收集中,加入500ulbufferrw1至柱子上,10000rpm离心60s;
(8)倒弃滤液,把柱子装回收集中,加入600ulbufferrw2至柱子上,10000rpm离心60s;
(9)重复步骤(8);
(10)弃掉滤液,把柱子重新装回收集管中,10000rpm离心2min;
(11)将柱子转移至1.5ml离心管中。加入50ul的rnasefreewater至柱子膜中央,室温静置2min,10000rpm离心1min;
(12)弃掉柱子,采用2%浓度的琼脂糖凝胶电泳检测rna的完整性,以此判断rna产量和质量。
进一步的,所述hipurernaminicolumn的柱容量为1.5ml,洗脱体积为50-100ul。
进一步的,所述hipurernaminicolumn的柱容量为15ml,洗脱体积为0.3-0.6ml。
进一步的,步骤s3中,所述rna序列分别反转录成cdna的方法,包含以下步骤:
(1)基因组dna去除,在rnasefree的离心管中配置如下混合液4xgdnawipemix1-4ul;模板rna1-4ul;rnasefreeddh2o2-7ul;用移液枪轻轻吹打混匀,放于水浴锅中水浴38-50℃1-4min;
(2)配置逆反转录反应体系,在以上体系中加入5xhiscript║qrtsupermix║1-4ul,用移液枪轻轻吹打混匀;
(3)进行逆转录反应,15-30℃7-15min,40-60℃22-42min,72-90℃3-8min。
进一步的,步骤s4中,所述pcr扩增的方法包括将反转录产物为模板、通过pcr扩增引物进行qrt-pcr反应,每一个反应分别设3次重复,反应体系如下:
(1)2×sybrgreenmix:3-9µl;
(2)cdna模板:0.2-1.6µl;
(3)引物各0.025-0.205µl;
(4)加水至总体积达到8-12µl;
(5)pcr反应程序:88-96℃8-13min;88-96℃6-15s,48-68℃12-20s,62-83℃20-50s,40个循环。
进一步的,所述pcr扩增引物其上游引物和下游引物的序列分别如seqidno:1和seqidno:2所示。进一步的,所述步骤s5中,采用的分析鉴定方法为:将pcr扩增产物用融解曲线分析,采用roche公司的lightcylcer480软件收集数据,在茶树不同的样品间相对表达量的计算,用ct值的2-△ct法处理获得其茶叶茸毛生长发育线性关系。
本发明中,所述的csttg1基因核苷酸序列为:
agcttgcatgcctgcaggtcgacgatcctactctctcgctctctctctctctctctctctctctctctgttcaattcacaaaccaaaaccctaatctcataccctaatttactctcaacctctccaccccacaactcgtggaatcaacaatggagaattcgagccaagattcccacctcagatccgaaaactccgtgacctacgactccccgtaccctctctacgccatggccttctcttcctccgcccgatcgccgccccatcaccaccgcatcgccgtcggcagcttcatagaggaatacaacaaccgtgtcgacatcgtttctttcgatgaagaaaccctaaccatgaaaaccaaccccaatctctccttcgaacacccttaccctcccaccaagctcatgttccaccccaacccctctgcctccctccgcaaatcctccgacctcctcgcctcctctggcgactatcttcgcctctgggaagtccgcgacaactccatcgaatccatctctatcctcaacaacagcaagaccagcgagttctgtgcccccctcacttcatttgattggaacgaggtcgatactcgcagaattgggacttctagcatcgacactacttgtaccatttgggatgttgagagaggggttgttgaaacccagttgattgcccacgataaagaggtttacgacatcgcttggggcgaagctggggtgtttgcttcggtttccgctgatgggtctgtcaggattttcgatttgagagataaggaacactctaccattatatacgagagtcctcaaccggacactcctttgcttagattggcttggaacaagcaggatttgaggtacatggccacaattttgatggactgtaataaagttgtgatcttggatattcgatcgccaacaatgccggttgcagagctggagagacaccgggcgagtgtgaatgccatcgcttgggctccccagagtcatcgccatatttgctctgctggggacgattcacaagcgcttatttgggagttgccgactgttgctggacccaatggaattgacccaatgtctatgtactctgctggggctgagattaaccagcttcagtggtcagcggcgctgcctgattggattgcagttgccttttcaaacaaaatgcagcttctgaaagtttgagatccccagatgatggctcatgcaggcaacgtttaccgaagcccccagttaatgttgtattgttaatttacttagacaaacacgaactaatcctatctctagaggatccccgggtaccgagctcg
本发明中,所述csttg1基因编码的氨基酸序列为:
menssqdshlrsensvtydspyplyamafsssarspphhhriavgsfieeynnrvdivsfdeetltmktnpnlsfehpypptklmfhpnpsaslrkssdllassgdylrlwevrdnsiesisilnnsktsefcapltsfdwnevdtrrigtssidttctiwdvergvvetqliahdkevydiawgeagvfasvsadgsvrifdlrdkehstiiyespqpdtpllrlawnkqdlrymatilmdcnkvvildirsptmpvaelerhrasvnaiawapqshrhicsagddsqaliwelptvagpngidpmsmysagaeinqlqwsaalpdwiavafsnkmqllkv
本发明通过鉴定csttg1基因与茶叶茸毛生长发育线性关系,可以根据确定的线性关系测定基因表达量,对不同品种茶叶茸毛的多少进行有效调控,进而在茶叶品质的改进(茶的外观和口感)、提高对生物和非生物胁迫的抗性具有重要作用。本发明可以为csttg1基因的表达模式与茸毛发育的关系,通过对不同品种间茸毛密度分布特征的研究,划分品种茸毛等级;研究csttg1在品种间的表达差异,分析csttg1基因表达模式与茸毛分布特征的关系;并以模式植物的遗传转化来验证csttg1基因功能。不仅深化对茸毛形成分子机理的认识,同时也为指导茶树的遗传育种提供重要的理论依据。
附图说明
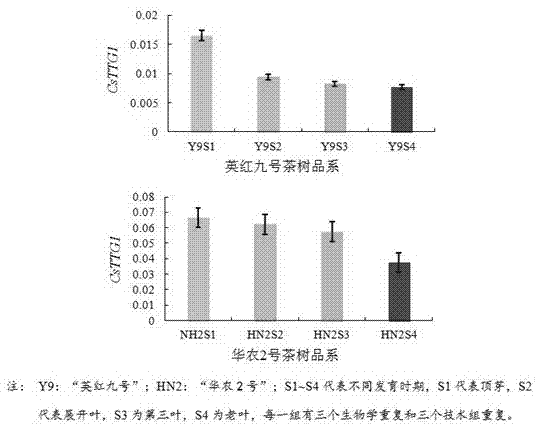
图1为csttg1在不同茶系品种中的特异性表达结果;
图2为csttg1在不同茶系品种中的特异性表达结果;
图3为csttg1在不同茶系品种中的特异性表达结果。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
实施例1
一种csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,其特征在于,包括以下步骤:s1.选取待测茶树品系,取茶树品系茶叶的顶芽、第二叶、第三叶、老叶;
s2.分别提取茶叶的顶芽、第二叶、第三叶、老叶的rna序列;
s3.将提取的rna序列分别反转录成cdna;
s4.以cdna为模板,通过特异性引物对进行pcr扩增;
s5.对pcr扩增的产物进行测序,检测分析csttg1在茶叶茸毛生长发育线性关系中是否具有特异性表达。
进一步的,步骤s2中,所述茶叶的rna序列提取方法包含以下步骤:
(1)往预冷的2.0ml的离心管中加入700uml的bufferprc1液;
(2)称取75mg样品材料置于加有液氮的研钵中,迅速磨成粉末状并转到第1步的离心管中,高速涡旋60秒打散样品,冰上放置5min,55℃短暂水浴1分钟;
(3)冷却到室温,14000rpm离心5min;
(4)把gdna过滤柱装在2ml收集管中,把第3步的上清液转移在gdna过滤柱中。14000rpm离心2min。弃掉gdna过滤柱;
(5)加入0.5倍体积的无水乙醇至滤纸中,移液枪吸打3-5次,按第6步进行操作;
(6)把hipurernaminicolumn装在2ml收集中。转移700ul混合液至柱子中。10000rpm离心60s;
(7)倒弃滤液,把柱子装回收集中,加入500ulbufferrw1至柱子上,10000rpm离心60s;
(8)倒弃滤液,把柱子装回收集中,加入600ulbufferrw2至柱子上,10000rpm离心60s;
(9)重复步骤(8);
(10)弃掉滤液,把柱子重新装回收集管中,10000rpm离心2min;
(11)将柱子转移至1.5ml离心管中。加入50ul的rnasefreewater至柱子膜中央,室温静置2min,10000rpm离心1min;
(12)弃掉柱子,采用2%浓度的琼脂糖凝胶电泳检测rna的完整性,以此判断rna产量和质量。
进一步的,步骤s3中,所述rna序列分别反转录成cdna的方法,包含以下步骤:
(1)基因组dna去除,在rnasefree的离心管中配置如下混合液4xgdnawipemix2ul;模板rna2ul;rnasefreeddh2o4ul;用移液枪轻轻吹打混匀,放于水浴锅中水浴42℃2min;
(2)配置逆反转录反应体系,在以上体系中加入5xhiscript║qrtsupermix║2ul,用移液枪轻轻吹打混匀;
(3)进行逆转录反应,25℃10min,50℃30min,85℃5min。
进一步的,步骤s4中,所述pcr扩增的方法包括将反转录产物为模板、通过pcr扩增引物进行qrt-pcr反应,每一个反应分别设3次重复,反应体系如下:
(1)2×sybrgreenmix:5µl;
(2)cdna模板:1µl;
(3)引物各0.125µl;
(4)加水至总体积达到10µl;
(5)pcr反应程序:94℃10min;94℃10s,56℃15s,72℃30s,40个循环。
进一步的,所述pcr扩增引物其上游引物和下游引物的序列分别如seqidno:1和seqidno:2所示。进一步的,所述步骤s5中,采用的分析鉴定方法为:将pcr扩增产物用融解曲线分析,采用roche公司的lightcylcer480软件收集数据,在茶树不同的样品间相对表达量的计算,用ct值的2-△ct法处理获得其茶叶茸毛生长发育线性关系。
实施例2
一种csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,其特征在于,包括以下步骤:s1.选取待测茶树品系,取茶树品系茶叶的顶芽、第二叶、第三叶、老叶;
s2.分别提取茶叶的顶芽、第二叶、第三叶、老叶的rna序列;
s3.将提取的rna序列分别反转录成cdna;
s4.以cdna为模板,通过特异性引物对进行pcr扩增;s5.对pcr扩增的产物进行测序,检测分析csttg1在茶叶茸毛生长发育线性关系中是否具有特异性表达。
进一步的,步骤s2中,所述茶叶的rna序列提取方法包含以下步骤:
(1)往预冷的2.0ml的离心管中加入700uml的bufferprc1液;
(2)称取50mg样品材料置于加有液氮的研钵中,迅速磨成粉末状并转到第1步的离心管中,高速涡旋60秒打散样品,冰上放置5min,55℃短暂水浴1分钟;
(3)冷却到室温,14000rpm离心5min;
(4)把gdna过滤柱装在2ml收集管中,把第3步的上清液转移在gdna过滤柱中。14000rpm离心2min。弃掉gdna过滤柱;
(5)加入0.5倍体积的无水乙醇至滤纸中,移液枪吸打3-5次,按第6步进行操作;
(6)把hipurernaminicolumn装在2ml收集中。转移700ul混合液至柱子中。10000rpm离心60s;
(7)倒弃滤液,把柱子装回收集中,加入500ulbufferrw1至柱子上,10000rpm离心60s;
(8)倒弃滤液,把柱子装回收集中,加入600ulbufferrw2至柱子上,10000rpm离心60s;
(9)重复步骤(8);
(10)弃掉滤液,把柱子重新装回收集管中,10000rpm离心2min;
(11)将柱子转移至1.5ml离心管中。加入50ul的rnasefreewater至柱子膜中央,室温静置2min,10000rpm离心1min;
(12)弃掉柱子,采用2%浓度的琼脂糖凝胶电泳检测rna的完整性,以此判断rna产量和质量。
进一步的,步骤s3中,所述rna序列分别反转录成cdna的方法,包含以下步骤:
(1)基因组dna去除,在rnasefree的离心管中配置如下混合液4xgdnawipemix1ul;模板rna1ul;rnasefreeddh2o2ul;用移液枪轻轻吹打混匀,放于水浴锅中水浴38℃1min;
(2)配置逆反转录反应体系,在以上体系中加入5xhiscript║qrtsupermix║1ul,用移液枪轻轻吹打混匀;
(3)进行逆转录反应,15℃7min,40℃22min,72℃3min。
进一步的,步骤s4中,所述pcr扩增的方法包括将反转录产物为模板、通过pcr扩增引物进行qrt-pcr反应,每一个反应分别设3次重复,反应体系如下:
(1)2×sybrgreenmix:3µl;
(2)cdna模板:0.2µl;
(3)引物各0.025µl;
(4)加水至总体积达到8µl;
(5)pcr反应程序:88℃8min;88℃6s,48℃12s,62℃20s,40个循环。
进一步的,所述pcr扩增引物其上游引物和下游引物的序列分别如seqidno:1和seqidno:2所示。进一步的,所述步骤s5中,采用的分析鉴定方法为:将pcr扩增产物用融解曲线分析,采用roche公司的lightcylcer480软件收集数据,在茶树不同的样品间相对表达量的计算,用ct值的2-△ct法处理获得其茶叶茸毛生长发育线性关系。
实施例3
一种csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,其特征在于,包括以下步骤:s1.选取待测茶树品系,取茶树品系茶叶的顶芽、第二叶、第三叶、老叶;
s2.分别提取茶叶的顶芽、第二叶、第三叶、老叶的rna序列;
s3.将提取的rna序列分别反转录成cdna;
s4.以cdna为模板,通过特异性引物对进行pcr扩增;s5.对pcr扩增的产物进行测序,检测分析csttg1在茶叶茸毛生长发育线性关系中是否具有特异性表达。
进一步的,步骤s2中,所述茶叶的rna序列提取方法包含以下步骤:
(1)往预冷的2.0ml的离心管中加入700uml的bufferprc1液;
(2)称取100mg样品材料置于加有液氮的研钵中,迅速磨成粉末状并转到第1步的离心管中,高速涡旋60秒打散样品,冰上放置5min,55℃短暂水浴1分钟;
(3)冷却到室温,14000rpm离心5min;
(4)把gdna过滤柱装在2ml收集管中,把第3步的上清液转移在gdna过滤柱中。14000rpm离心2min。弃掉gdna过滤柱;
(5)加入0.5倍体积的无水乙醇至滤纸中,移液枪吸打3-5次,按第6步进行操作;
(6)把hipurernaminicolumn装在2ml收集中。转移700ul混合液至柱子中。10000rpm离心60s;
(7)倒弃滤液,把柱子装回收集中,加入500ulbufferrw1至柱子上,10000rpm离心60s;
(8)倒弃滤液,把柱子装回收集中,加入600ulbufferrw2至柱子上,10000rpm离心60s;
(9)重复步骤(8);
(10)弃掉滤液,把柱子重新装回收集管中,10000rpm离心2min;
(11)将柱子转移至1.5ml离心管中。加入50ul的rnasefreewater至柱子膜中央,室温静置2min,10000rpm离心1min;
(12)弃掉柱子,采用2%浓度的琼脂糖凝胶电泳检测rna的完整性,以此判断rna产量和质量。
进一步的,步骤s3中,所述rna序列分别反转录成cdna的方法,包含以下步骤:
(1)基因组dna去除,在rnasefree的离心管中配置如下混合液4xgdnawipemix1-4ul;模板rna4ul;rnasefreeddh2o7ul;用移液枪轻轻吹打混匀,放于水浴锅中水浴50℃4min;
(2)配置逆反转录反应体系,在以上体系中加入5xhiscript║qrtsupermix║4ul,用移液枪轻轻吹打混匀;
(3)进行逆转录反应,30℃15min,60℃42min,90℃8min。
进一步的,步骤s4中,所述pcr扩增的方法包括将反转录产物为模板、通过pcr扩增引物进行qrt-pcr反应,每一个反应分别设3次重复,反应体系如下:
(1)2×sybrgreenmix:9µl;
(2)cdna模板:1.6µl;
(3)引物各0.205µl;
(4)加水至总体积达到12µl;
(5)pcr反应程序:96℃13min;96℃15s,68℃20s,83℃50s,40个循环。
进一步的,所述pcr扩增引物其上游引物和下游引物的序列分别如seqidno:1和seqidno:2所示。进一步的,所述步骤s5中,采用的分析鉴定方法为:将pcr扩增产物用融解曲线分析,采用roche公司的lightcylcer480软件收集数据,在茶树不同的样品间相对表达量的计算,用ct值的2-△ct法处理获得其茶叶茸毛生长发育线性关系。
实施例4
一种csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,其特征在于,包括以下步骤:s1.选取待测茶树品系,取茶树品系茶叶的顶芽、第二叶、第三叶、老叶;
s2.分别提取茶叶的顶芽、第二叶、第三叶、老叶的rna序列;
s3.将提取的rna序列分别反转录成cdna;
s4.以cdna为模板,通过特异性引物对进行pcr扩增;s5.对pcr扩增的产物进行测序,检测分析csttg1在茶叶茸毛生长发育线性关系中是否具有特异性表达。
进一步的,步骤s2中,所述茶叶的rna序列提取方法包含以下步骤:
(1)往预冷的2.0ml的离心管中加入700uml的bufferprc1液;
(2)称取60mg样品材料置于加有液氮的研钵中,迅速磨成粉末状并转到第1步的离心管中,高速涡旋60秒打散样品,冰上放置5min,55℃短暂水浴1分钟;
(3)冷却到室温,14000rpm离心5min;
(4)把gdna过滤柱装在2ml收集管中,把第3步的上清液转移在gdna过滤柱中。14000rpm离心2min。弃掉gdna过滤柱;
(5)加入0.5倍体积的无水乙醇至滤纸中,移液枪吸打3-5次,按第6步进行操作;
(6)把hipurernaminicolumn装在2ml收集中。转移700ul混合液至柱子中。10000rpm离心60s;
(7)倒弃滤液,把柱子装回收集中,加入500ulbufferrw1至柱子上,10000rpm离心60s;
(8)倒弃滤液,把柱子装回收集中,加入600ulbufferrw2至柱子上,10000rpm离心60s;
(9)重复步骤(8);
(10)弃掉滤液,把柱子重新装回收集管中,10000rpm离心2min;
(11)将柱子转移至1.5ml离心管中。加入50ul的rnasefreewater至柱子膜中央,室温静置2min,10000rpm离心1min;
(12)弃掉柱子,采用2%浓度的琼脂糖凝胶电泳检测rna的完整性,以此判断rna产量和质量。
进一步的,步骤s3中,所述rna序列分别反转录成cdna的方法,包含以下步骤:
(1)基因组dna去除,在rnasefree的离心管中配置如下混合液4xgdnawipemix2.5ul;模板rna2.5ul;rnasefreeddh2o5ul;用移液枪轻轻吹打混匀,放于水浴锅中水浴45℃2.8min;
(2)配置逆反转录反应体系,在以上体系中加入5xhiscript║qrtsupermix║3ul,用移液枪轻轻吹打混匀;
(3)进行逆转录反应,27℃11min,52℃36min,84℃5min。
进一步的,步骤s4中,所述pcr扩增的方法包括将反转录产物为模板、通过pcr扩增引物进行qrt-pcr反应,每一个反应分别设3次重复,反应体系如下:
(1)2×sybrgreenmix:5µl;
(2)cdna模板:1.3µl;
(3)引物各0.125µl;
(4)加水至总体积达到10µl;
(5)pcr反应程序:92℃11min;92℃13s,60℃18s,78℃45s,40个循环。
进一步的,所述pcr扩增引物其上游引物和下游引物的序列分别如seqidno:1和seqidno:2所示。进一步的,所述步骤s5中,采用的分析鉴定方法为:将pcr扩增产物用融解曲线分析,采用roche公司的lightcylcer480软件收集数据,在茶树不同的样品间相对表达量的计算,用ct值的2-△ct法处理获得其茶叶茸毛生长发育线性关系。
实施例5
本实施例提供一种与实施例1一致的csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,所不同的是,所述hipurernaminicolumn的柱容量为1.5ml,洗脱体积为75ul。
实施例6
本实施例提供一种与实施例1一致的csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,所不同的是,所述hipurernaminicolumn的柱容量为15ml,洗脱体积为0.5ml。
实施例7
本实施例提供一种与实施例1一致的csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,所不同的是,所述hipurernaminicolumn的柱容量为1.5ml,洗脱体积为50ul。
实施例8
本实施例提供一种与实施例1一致的csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,所不同的是,所述hipurernaminicolumn的柱容量为1.5ml,洗脱体积为100ul。
实施例9
本实施例提供一种与实施例1一致的csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,所不同的是,所述hipurernaminicolumn的柱容量为15ml,洗脱体积为0.3ml。
实施例10
本实施例提供一种与实施例1一致的csttg1基因与茶叶茸毛生长发育线性关系的鉴定方法,所不同的是,所述hipurernaminicolumn的柱容量为15ml,洗脱体积为0.6ml。
测试实验例
选取华南农业大学茶园中“凤凰单丛”、“华农1号”、“华农2号”、“金萱”、“长叶龙井”、“英红九号”6个茶树品系,分别提取茶叶的顶芽、第二叶、第三叶、老叶的rna序列。采用实施例1的方法,检测分析csttg1在茶叶茸毛生长发育线性关系中是否具有特异性表达。
结果发现csttg1在六个茶树品系的顶芽、第二叶、第三叶和老叶中均有表达,其中在顶芽中表现最高,在老叶中表达最低。csttg1在茸毛等级较多的“华农2号”茶树品系中表达量最高,如图1所示;在茸毛等级中等的“金萱”和“长叶龙井”茶树品系中表达量中等,如图2所示;在茸毛等级少的“凤凰单丛”表达量极少,如图3所示,这与体式显微镜观察茸毛分布的长度和密度表达一致。csttg1在“英红九号”茶树品系特异性表达比其他品种低,可能是提取rna时浓度较低存在的差异,但其茸毛分布特征与csttg1特异性表达呈显著性正相关。因此可以得出csttg1在不同茶树品系间、不同发育时期的表达成线性关系。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。需注意的是,本发明中所未详细描述的技术特征,均可以通过本领域任一现有技术实现。
基因序列表
seqidno:1
5’-aactccatcgaatccatctc-3’;
seqidno:2
5’-aacctctttatcgtgggcaa-3’。
- 还没有人留言评论。精彩留言会获得点赞!