一种可自溶的高强速粘水凝胶及其制备方法和应用与流程
本发明属于生物医用材料领域,更加具体地说,涉及一种可自溶的高强速粘水凝胶创可贴的制备及其性能和应用研究。
技术背景
水凝胶是一种高含水量的三维网状聚合物。水凝胶具有良好的生物相容性和其他优异性能,例如:环境响应性、抗菌性、自修复性、超吸水性等。这些特点使水凝胶在生物医药、传感器、自修复材料和保水抗旱等方面有着广泛的应用前景。粘附水凝胶在日常的生活,工作以及医药领域都非常的重要,特别是湿态粘附对于止血,伤口愈合以及医用传导设备等是必不可少的。类似于生物软组织的软材质的医用密封剂和胶黏剂对促进伤口愈合是很有利的。但是,传统的水凝胶很难实现将粘附性能和力学性能相结合,特别是力学性能很好的水凝胶,因为其较硬的聚合物链,不能对软组织实现粘附效果。最近由贻贝引发的粘附水凝胶虽然实现了湿态粘附,但是其粘附效果与环境中的ph值以及粘附时间是非常相关的,长时间的放置也会使得其丧失粘附能力。所以发展一种高强速粘的湿态粘附水凝胶来用作伤口敷料以及止血剂等都是非常重要的。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种可自溶的高强速粘水凝胶及其制备方法和应用,以acg和纳米活性无机纳米粒子作为反应物,采用自由基聚合的方法,使用光引发剂,在紫外光照下形成以氢键交联,离子交联以及物理吸附为交联点的凝胶网络,并对制得的凝胶进行力学、粘附强度的测试,并且进行了体内、体外的生物学实验,证明具有力学性能,对多种基质都具有极好的粘附强度,体现出良好的生物相容性。
本发明的技术目的通过下述技术方案予以实现。
一种可自溶的高强速粘水凝胶及其制备方法,将单体n-丙烯酰甘氨酸、无机纳米粒子和引发剂均匀分散在水相中,通过引发剂引发单体n-丙烯酰甘氨酸在水相中进行聚合并将无机纳米粒子复合到单体n-丙烯酰甘氨酸聚合形成的网络中,形成水凝胶。
在上述技术方案中,采用去离子水为提供水相。
在上述技术方案中,无机纳米粒子为纳米羟基磷灰石(即天然矿物纳米级羟基磷灰石hap)、纳米活性玻璃或纳米黏土。
在上述技术方案中,引发剂采用光引发剂,如2-羟基-2-甲基-1-苯基-1-丙酮(1173),通过紫外光照射进行引发,根据反应加料情况进行聚合时间的选择,聚合时间为30—60min,优选40—60min。
在上述技术方案中,单体n-丙烯酰甘氨酸在水相中的质量百分数为10—30%(即单体n-丙烯酰甘氨酸质量/单体n-丙烯酰甘氨酸和水的质量之和*100%),无机纳米粒子用量为单体n-丙烯酰甘氨酸质量的0—10%且不为零,引发剂的用量是单体质量的1—5%。
在上述技术方案中,单体n-丙烯酰甘氨酸在水相中的质量百分数为20—30%,无机纳米粒子用量为单体n-丙烯酰甘氨酸质量的4—8%且不为零,引发剂的用量是单体质量的1—3%。
本发明的技术方案通过将具有良好生物相容性的甘氨酸衍生物的乙烯基单体n-丙烯酰甘氨酸(acg)与纳米活性无机纳米粒子(如羟基磷灰石hap)作为反应物,使用光引发剂在紫外光照下通过一步自由基共聚制备而成。在形成的水凝胶中pacg分子侧链之间形成的大量的氢键,分子链末端的羧基与无机离子的离子络合以及聚合物链和纳米粒子之间发生的物理吸附作用赋予了水凝胶优异的力学性能,对多种基质都具有极好的粘附强度,体现出良好的生物相容性。本发明制备方法简单,材料来源广泛,实用性强。
附图说明
图1是本发明中pacg-hap(聚n-丙烯酰甘氨酸—羟基磷灰石)水凝胶的红外测试谱图。
图2是本发明中pacg-hap水凝胶的力学测试结果示意图。
图3是本发明中pacg-hap水凝胶的室温修复的测试结果示意图。
图4是本发明中pacg-hap水凝胶粘附性能的测试结果示意图。
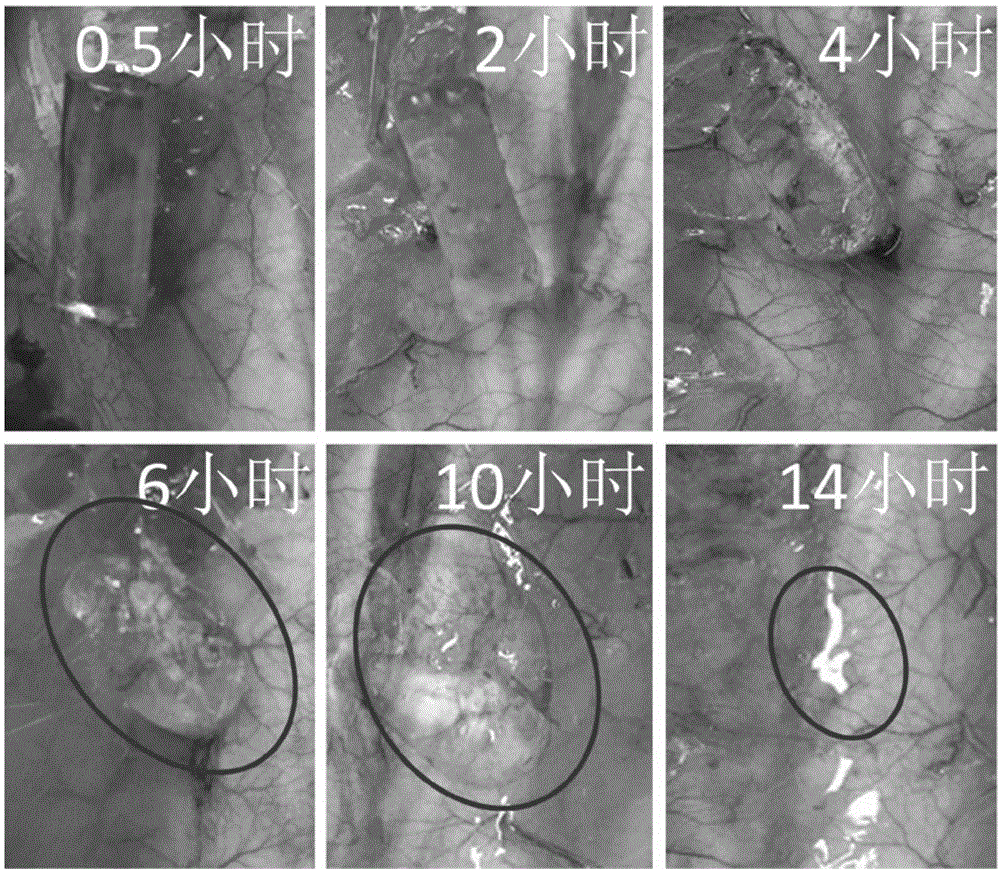
图5是本发明中pacg-hap-20-6水凝胶在大鼠体内不同时间点的自溶情况照片,红色的圈代表水凝胶的位置。
图6是本发明中pacg-hap-20-6水凝胶皮下埋植一个月内不同时间段的he和masson染色结果照片。
图7是本发明中pacg-hap-20-6水凝胶作为伤口敷料对大鼠背部伤口进行修复的结果示意照片。
图8是本发明实施例中进行粘结性测试的样品结构示意图。
具体实施方式
下面结合具体实例进一步说明本发明的技术方案,以下结合实例进一步说明本发明,但这些实例并不用来限制本发明。hap生产厂家:大连美仑生物技术有限公司,粒径为20纳米;纳米生物玻璃生产厂家:昆山华侨科技新材料有限公司,粒径为100nm;纳米黏土生产厂家:sigma,粒径200纳米。本发明中acg单体的制备参考文献f.gao,y.y.zhang,y.m.li,b.xu,z.q.cao,w.g.liu,acsappl.mater.interfaces2016,8,8956,具体来说如下:
首先将甘氨酸和碳酸钾溶于水和二氯甲烷的混合溶液中并置于三口烧瓶中,然后将丙烯酰氯和二氯甲烷的混合溶液通过恒压滴液漏斗缓慢的滴加到三口烧瓶中,并且在冰浴中持续搅拌4小时。待反应结束后进行后处理。后处理过程中首先用氢氧化钠将反应得到的混合溶液调ph至9-10,然后用乙酸乙酯进行洗涤,反复洗涤三次将混合溶液洗至澄清。然后用盐酸将所得的澄清溶液调ph值为2后,继续用乙酸乙酯进行萃取,收集萃取液,反复萃取6次,将得到的萃取液用无水硫酸镁干燥,以除去没有除尽的水分,并且静置过夜。随后将该溶液过滤除去反应生成的无机盐以及硫酸镁,最后将溶液进行旋蒸,得到干燥的白色粉末即为acg,将其置于真空干燥箱中一周,即可使用。
用托盘天平称取0.2g上述acg于10ml的离心管中,然后再分别称取0g,0.04g,0.08g,0.012g,0.016g,0.02ghap(hap的含量分别为acg含量的0%,2%,4%,6%,8%以及10%)与离心管中,用分别加入800ul去离子水将其溶解分散,最后加入4ul的1173(光引发剂2-羟基-2-甲基-1-苯基-1-丙酮,市购)于离心管中并将其混匀,将混合液注入到密闭的pet模具中,模具在紫外光照下反应40分钟以保证充分引发自由基聚合。随后打开模具取出凝胶。后续将得到的水凝胶命名为pacg-hap-x-y,其中x为acg的含量,y为hap占据acg含量的百分比。
将本发明的pacg-hap水凝胶进行红外光谱测试,如图1所示。从图中可以看出,在acg发生聚合形成pacg后,acg在1614cm-1处的双键峰消失,说明acg发生了自由基聚合形成了pacg,在pacg-hap-20-4和pacg-hap-20-8水凝胶中显示在1710cm-1处的羧基峰强度减弱,并且发生了蓝移,说明pacg分子链上的羧基与羟基磷灰石中的钙离子发生了离子相互作用,形成了有机-无机纳米复合水凝胶。
将制备的水凝胶进行力学表征,用模具将水凝胶制为长8cm,宽2cm,后0.2cm的凝胶片,使用万能拉力机对凝胶片进行力学拉伸测试;将水凝胶片利用模具剪裁成裤状(采用长8cm,宽2cm,后0.2cm的凝胶片,在宽度中央位置划个口,该破口沿长度方向为4cm),使用万能拉力机进行撕裂测试;将水凝胶制为直径为10cm高为8cm的水凝胶柱,使用万能拉力机进行力学压缩测试。如附图2所示,高强速粘水凝胶的力学测试图,图2.a:各组份水凝胶的拉伸力学测试(a:pacg;b:pacg-hap-20-2;c:pacg-hap-20-4;d:pacg-hap-20-6;e:pacg-hap-20-8;f:pacg-hap-20-10);b:pacg-hap-20-10的拉伸应变实物图;c:各组份水凝胶撕裂能;d:各组分水凝胶的压缩曲线(a:pacg;b:pacg-hap-20-2;c:pacg-hap-20-4;d:pacg-hap-20-6;e:pacg-hap-20-8;f:pacg-hap-20-10)。图2是高强速粘水凝胶的力学测试图,其中从图a中可以看出在体系内添加hap后水凝胶的力学强度会表现出先增加再降低的情况,其中pacg-hap-2水凝胶的拉伸强度最高,可达0.72mpa,而pacg水凝胶为0.5mpa,这可能是因为在凝胶体系内添加大量的羟基磷灰石后,纳米粒子会阻碍水凝胶体系内氢键的相互作用,当纳米粒子带来的离子相互作用和物理吸附作用小于被破坏的氢键作用时,则凝胶的力学强度将表现在下降,但是随着羟基磷灰石含量的增加,水凝胶的拉伸形变均表现为增加。最大形变可达1200%(图b)。相同的情况也可由水凝胶的撕裂能和压缩强度看出,当hap含量为2%时,水凝胶的撕裂能最大可达1300j/m2,是pacg水凝胶的1.6倍,但是当hap的含量继续增加,撕裂能则表现出下降的趋势当hap的含量为6%时,水凝胶的撕裂能下降为580j/m2,低于pacg水凝胶。图d为水凝胶的压缩曲线,添加hap后水凝胶的压缩强度显示出略微的增加,当hap的含量为2%,压缩强度为5mpa,而pacg水凝胶的压缩强度为4.6mpa,这可能是因为水凝胶得到压缩强度主要是与凝胶体系的交联密度有关的,而体系内加入的hap的含量较少,并没有明显的增加水凝胶体系的交联密度,因此压缩强度不会显著增加,但是当继续增加hap后,加入的纳米粒子反而会破坏pacg之间形成的氢键,进而使凝胶体系的交联密度降低,所以凝胶的压缩强度进一步减少。
将制备的水凝胶进行自修复表征,将长10cm,宽2cm,厚2cm的水凝胶片用手术刀从中间切开(沿长度方向5cm为一小段),然后将两切口对齐,在室温下放置30s,12h,24h后使用万能拉力机进行拉伸测试,计算水凝胶的室温自修复效率,即修复后的力学性能/原始样品的力学性能,采用拉伸试验中断裂点的强度进行前后对比。如附图3所示,高强粘附水凝胶的室温修复的结果,a:pacg-hap-20-6水凝胶的是室温自修复拉伸应力曲线;b:pacg-hap-20-8水凝胶的是室温自修复拉伸应力曲线;c:pacg-hap-20-10水凝胶的是室温自修复拉伸应力曲线;d:pacg-hap-20-x水凝胶在室温下不同时间后的自修复效率(星号代表不发生自修复)。其中a,b,c为pacg-hap-20-6,pacg-hap-20-8,pacg-hap-20-10水凝胶的修复的拉伸应力图,从图中可以看出随着延长在室温下的修复时间水凝胶的修复能力逐渐增强,在24小时时羟基磷灰石含量为8%和10%的水凝胶的自修复效率均可达到100%,并且其拉伸强度均大于原水凝胶,可能是因为水凝胶在室温下放置后轻微失水造成的。图d显示在水凝胶修复30秒后羟基磷灰石含量为4%,6%,8%,10%水凝胶的修复效率可达3%,10%,25%和45%,延长至12小时后,修复效率显著增加至12%,45%,76%,90%,在室温下放置时间为24小时后,其修复效率分别为33%,79%,100%,100%,说明该水凝胶具有极好的自修复效果,以及纳米hap的加入可显著的增加水凝胶的修复效果,有利于促进水凝胶的应用范围。
将制备的水凝胶进行粘附测试,使用搭接拉伸法进行测试,将长1cm,宽1cm,厚2cm的水凝胶分别粘附在粘附基质的一端,然后与另外同种粘附基质另一端粘附,使用万能拉力机进行拉伸测试粘附强度,即水凝胶上下粘贴相同东西,然后拉伸水凝胶两侧的基质,如附图8所示,以猪皮粘附为例,搭接测试的示意结构,猪皮:长4cm宽1cm;铁片、陶瓷、ps板:长均为6cm,宽均为2cm。测试结果如附图4所示,图4.a:各组分水凝胶对猪皮组织的搭接粘附测试曲线;b:各组分水凝胶对铁片的搭接粘附测试曲线;c:各组分水凝胶对陶瓷的搭接粘附测试曲线;d:各组分水凝胶对ps板的搭接粘附测试曲线(a:pacg;b:pacg-hap-20-2;c:pacg-hap-20-4;d:pacg-hap-20-6;e:pacg-hap-20-8;f:pacg-hap-20-10)。图4为水凝胶粘附性能的测试,图a,b,c,d分别为不同hap含量的水凝胶对猪皮,铁片,陶瓷和ps板的粘附测试曲线,从图中可以看出pacg-hap-20-6水凝胶的粘附强度最高,对四种粘附基质的强度分别为105,140,60,57kpa,分别为pacg水凝胶的4.8,5,1.5,5.7倍。说明加入纳米羟基磷灰石后水凝胶的粘附强度显著的提高,及纳米粒子的加入使得聚合物链大量吸附,从而使凝胶表面的羧基的含量增加,增强凝胶和基质之间的氢键作用,而且pacg链在纳米粒子上的吸附和脱吸附的过程可以耗散大量的能量也有利于水凝胶在基质表面的粘附。
在本发明方案中,用于动物体内的水凝胶单体均要经过高压灭菌才可用于成胶。在用于伤口敷料和皮下埋植前首先对伤口处进行碘伏酒精杀菌处理。将凝胶埋植在体内后对皮肤切口进行缝合,并且每隔一段时间对体内凝胶以及伤口修复进行观察,取材。对伤口敷料实验观察一周,并且在第三天和第七天拍照取材进行染色分析,对于皮下埋植实验观察一个月,并且在第一天,第三天,一周,两周,四周进行取材,染色分析。对体内自溶实验观察14小时,并且在0.5小时,2小时,4小时,6小时,10小时,14小时对凝胶状态进行记录。
将制备的pacg-hap-20-6水凝胶用于大鼠体内埋植,并且分别在埋植后的0.5h,2h,4h,6h,10h,14h对体内凝胶进行观察,记录凝胶的体内自溶情况;并且分别在水凝胶埋植后的1d(天),3d(天),1w(周),2w(周),4w(周)取大鼠皮下组织进行切片染色,观察水凝胶在大鼠体内是否会造成炎症响应。如附图5所示,pacg-hap-20-6水凝胶在大鼠体内不同时间点的自溶情况,从图中可以看出,水凝胶在14小时时基本完全自溶,说明该凝胶具有明显的自溶能力。如附图6所示,pacg-hap-20-6水凝胶皮下埋植一个月内不同时间段的he和masson染色结果,从he染色结果可以看出,在水凝胶埋植的第一天和第三天都出现了明显的炎症响应,可能是因为生物体的排异反应,但是在水凝胶埋植后的第一周炎症反应明显下降,第四周时炎症反应基本消失,在masson染色的结果中观察到了相同趋势,在第四周时和正常组织基本没有区别,说明材料具有非常好的生物相容性。
将制备的pacg-hap-20-6水凝胶用于皮肤伤口修复,用sd大鼠作为动物模型,在大鼠背部制造三个长为2cm的伤口,分别进行止血处理,缝合线缝合以及凝胶贴片修复。用acg-hap水凝胶进行修复时先将水凝胶片粘附在皮肤伤口处,待十分钟后将水凝胶取下,然后分别在第三天和第七天时对老鼠背部伤口进行观察记录,并且取材,进行切片染色。将制备的pacg-hap-20-6水凝胶用于修复断裂的肠子。将猪的盲肠用剪刀切断,然后用水凝胶对其切口处粘合,然后将修复好的肠子灌满水,进行弯曲扭转来模拟真实肠道的环境。如附图7所示,水凝胶作为伤口敷料对大鼠背部伤口修复的结果,图a显示伤口处用粘附凝胶进行修复一周后皮肤伤口已经明显修复,未处理的伤口仍没有愈合,缝合的伤口虽然愈合但是出现了明显的结痂创伤(a为仅止血处理的伤口,b为缝合的伤口,c为水凝胶敷料愈合的伤口)。在图b的伤口处的he染色结果可以看出用凝胶贴片的伤口处皮肤层已经基本愈合,而缝合的伤口和未处理的伤口的皮下修复效果远不如凝胶贴片修复(对伤口不同处理方法后的切口处皮肤在不同时间的he染色结果,黄色的圈为皮肤求口区域)。图c为使用水凝胶对断裂的大肠进行修复的照片,显示将断裂的大肠用水凝胶进行修复吻合后,对大肠灌满水,液体不会从凝胶贴片出渗漏,说明水凝胶已经完全将大肠的破洞进行了修复(pacg-hap-20-6水凝胶对肠子修复过程图,c1为将肠子剪断,c2为使用水凝胶将肠子切口处封闭,c3为将修复好的肠子灌满水,c4为灌满水的修复好的肠子,不会发生任何液体的渗漏)。
将纳米羟基磷灰石更换为生物玻璃、纳米黏土进行制备,发现使用生物玻璃的水凝胶对猪皮和铁片的最高粘附强度分别可达71和93kpa,使用纳米黏土的水凝胶对猪皮和铁片的粘附强度分别可达95和130kpa,其余性能也与使用羟基磷灰石的水凝胶基本保持一致。
根据本发明内容进行制备工艺的调整,均可实现本发明水凝胶的制备且表现出与本发明和/或实施例基本一致的性能,即本发明的水凝胶在制备自修复材料中的应用、在制备创口敷料中的应用。以上对本发明做了示例性的描述,应该说明的是,在不脱离本发明的核心的情况下,任何简单的变形、修改或者其他本领域技术人员能够不花费创造性劳动的等同替换均落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!