金属有机框架材料固定化β-葡萄糖苷酶及其制备方法和应用与流程
本发明属于材料制备技术领域,具体涉及金属有机框架材料固定化β-葡萄糖苷酶及其制备方法和应用。
背景技术
目前对可再生能源的需求已经从生物柴油转移到由木质纤维素生产的生物乙醇上,生物乙醇生产第一步就是水解纤维素产生葡萄糖,与酸催化相比,酶催化工程具有一定的优势,如消除副反应对发酵过程的阻碍,与无机催化相比,酶催化具有温和性和高效性,酶催化水解纤维素是由纤维素酶的内切和外切葡聚糖酶及β-葡萄糖苷酶协同完成,首先由内切和外切葡聚糖酶经过一系列水解产生纤维二糖,最后β-葡萄糖苷酶水解纤维二糖产生葡萄糖。其中β-葡萄糖苷酶是水解纤维素中一类重要的纤维素酶,且是纤维素完全降解所必需的,所以对其进行固定化,在提高水解效率的同时能够实现多次利用。
金属有机框架材料(mofs)是由带有连接点的金属离子和有机配体通过配位键连接组成的二维或者三维结构的多孔结构材料,在分子分离、催化和药物的缓释等方面存在着很大的应用潜力。与传统的有机和无机多孔材料相比,由于金属连接点和配体的几何结构和连接的丰富性,mofs材料拥有高比表面积、高孔体积、易调控孔径尺寸以及合成条件温和等特点,使其成为固定化酶材料的重要选择依据。目前mofs材料固定化酶主要包括共价结合、表面吸附、孔包埋和共沉淀这四种方法,共价结合法载体活化的操作复杂;共价结合可能影响酶的空间结构,从而影响酶的催化活性;表面吸附法结合力弱,易解吸附;孔包埋法反应条件要求高,制备成本也高,鉴于共沉淀法工艺简单,条件温和,故一般选用共沉淀法固定化酶。
技术实现要素:
本发明的目的在于克服游离β-葡萄糖苷酶在ph稳定性、热稳定性、贮藏稳定性以及有机溶剂耐受性等方面的不足,采用共沉淀法将β-葡萄糖苷酶引入金属铜离子和paba形成的金属有机框架材料cu(paba)的孔道结构中,实现对酶的固定化。
为达到上述技术目的,本发明采取的技术方案如下:
本发明提供一种新型的金属有机框架材料固定化β-葡萄糖苷酶,它是利用共沉淀法将β-葡萄糖苷酶引入金属铜离子和paba形成的金属有机框架材料cu(paba)的孔道结构中,实现对酶的固定化,所述固定化β-葡萄糖苷酶椭球状且表面光滑,尺寸在10-20μm左右。
本发明还提供一种金属有机框架材料固定化β-葡萄糖苷酶的制备方法,具体步骤如下:
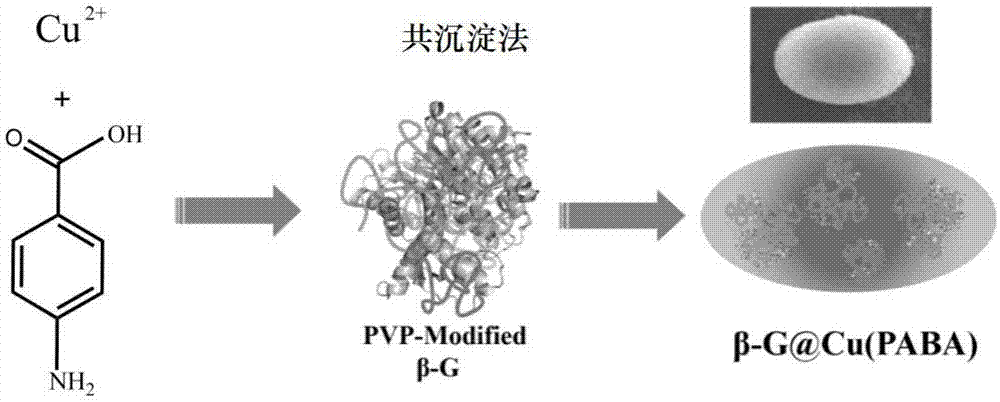
称取β-葡萄糖苷酶,用聚乙烯吡咯烷酮溶液混匀后,加入乙酸铜溶液混溶,再加入对氨基苯甲酸(paba)溶液,充分混溶;在25℃恒温振荡培养箱中静置培养,反应完毕后在4℃下离心,反复清洗后的产物在4℃冰箱中保存备用,同时得到金属有机框架材料(cu(paba))及其固定化β-葡萄糖苷酶,记为β-g@cu(paba)。
其中,所述聚乙烯吡咯烷酮溶液中加入β-葡萄糖苷酶的终浓度0.5-5mg/ml,优选为2mg/ml;
所述乙酸铜溶液中铜离子的浓度为25-62.6mm,优选为50mm;
所述对氨基苯甲酸(paba)溶液的浓度为6.25-18.75mm,优选为12.5mm;
所述乙酸铜溶液和对氨基苯甲酸(paba)溶液的溶剂均为naac-hac缓冲溶液;所述naac-hac缓冲溶液的ph为5.5-8.0,优选为7;
所述静置培养的时间为4-14h,优选为8h。
本发明还提供金属有机框架材料固定化β-葡萄糖苷酶β-g@cu(paba)催化水解纤维素的应用,具体的,固定化β-葡萄糖苷酶β-g@cu(paba)和pmaac固定化纤维素酶共同催化水解纤维素的应用。
本发明具有如下优点:
(1)目前,酶的固定化通常是先合成固定化材料,再进行酶的固定化,对酶活的损失较大;而本发明创新性地选择了有机酸(对氨基苯甲酸)和金属盐(乙酸铜),且缓冲溶液ph适宜,本发明中,金属有机框架材料是根据酶而长成的,也就是说酶的固定化与框架材料的制备是同时进行的。
本发明在mofs形成的过程中同时引入β-葡萄糖苷酶,实现了固定化;一步完成避免了金属有机框架材料孔道过小,酶无法进入材料,或者材料孔道过大,无法起固定作用的缺陷,提高了酶的稳定性、耐有机溶剂和金属离子性能,显著提高循环利用率,同时提高了纤维素酶水解纤维素的效率。
(2)本发明中将β-葡萄糖苷酶溶液与pvp混匀后,再依次与乙酸铜和paba混匀,在常温水相温和条件下成功制备出固定化酶β-g@cu(paba),与游离酶活相比,固定化酶活力提高18%左右。
(3)本发明通过调整cu2+、paba以及酶的量从而最大程度地得到固定化酶,并且优化了固定化条件,当选择ph为7.0的缓冲溶液溶解cu2+和paba,酶浓度为2mg/ml,固定化时间为8h时,酶的固载量及保留活力达到最佳值,分别为162.95mg/g和81.89%。
(4)本发明对固定化酶β-g@cu(paba)的酶学性质进行了考察,其在稳定性等方面有着明显的提高。cu(paba)材料的三维孔道结构为β-葡萄糖苷酶提供了刚性屏蔽环境从而有效地减小外界不利环境对酶活力的影响,提高了其热稳定性、贮藏稳定性、重复利用稳定性及有机溶剂耐受性等特性。
附图说明
图1为β-g@cu(paba)的合成原理图。
图2为游离β-g(a)、固定化酶β-g@cu(paba)(b)及金属-有机框架材料(cu(paba))(c)的红外光谱图。
图3为cu(paba)在明场(a)及荧光场(b)下拍摄的图和带有荧光标记的固定化酶β-g@cu(paba)在明场(c)及荧光场(d)下拍摄的图。
图4为cu(paba)(a)和β-g@cu(paba)(b)的sem图。
图5为cu(paba)(a)和β-g@cu(paba)(b)的xrd图。
图6为cu(paba)(a)和β-g@cu(paba)(b)的热重分析图。
图7为缓冲溶液的ph对酶的固定化效果的影响结果图。
图8为β-葡萄糖苷酶添加量对酶的固定化效果的影响结果图。
图9为固定化时间对酶的固定化效果的影响结果图。
图10为ph对游离β-g及其固定化酶β-g@cu(paba)催化反应活性的影响结果图。
图11为温度对游离β-g及其固定化酶β-g@cu(paba)催化反应活性的影响结果图。
图12为游离β-g及其固定化酶β-g@cu(paba)的lineweaver-burk曲线图。
图13为游离β-g及其固定化酶β-g@cu(paba)的ph稳定性验证的结果图。
图14为游离β-g及其固定化酶β-g@cu(paba)的热稳定性验证的结果图。
图15为有机溶剂对游离β-g及其固定化酶β-g@cu(paba)酶活力的影响结果图。
图16为游离β-g及其固定化酶β-g@cu(paba)的贮藏稳定性验证的结果图。
图17为固定化酶β-g@cu(paba)的重复利用稳定性验证的结果图。
图18为不同比例的β-g@cu(paba)及pmaac-纤维素酶水解cmc糖化率随时间变化关系。
图19为两种游离酶及固定化酶水解cmc的糖化率随时间变化关系。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合附图和具体实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明中的一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
对本发明得到的固定化酶通过以下的方式对其性质进行验证:
(1)酶的固载量测定:
取9个ep管进行编号,用去离子水将2000μg/ml的标准bsa溶液稀释至25-2000μg/ml的溶液,运用蛋白质试剂盒测定蛋白质含量。先用去离子水将2000μg/ml的标准bsa溶液稀释至25-2000μg/ml不等浓度的标准溶液。再将试剂盒中的溶液a和溶液b按照50:1的比例配置显色反应所需的工作液。
取20μl配置好的标准溶液加入400μl工作液,摇匀,37℃水浴反应30min后用流水迅速冷却,10min内在紫外分光光度计562nm波长处测定其吸光度值,以x轴为吸光度值,y轴为蛋白浓度,绘制蛋白标准曲线,其线性回归方程为:y=854.7x+7.447,r2=0.9989。
分别取20μl去离子水、纤维素酶溶液和离心后的一次及二次上清液加入到4个编好号的ep管中,分别加400μl工作液混合均匀后37℃下反应30min,流水冷却后测吸光度值,根据蛋白标准曲线的线性回归方程可以求出蛋白浓度,进一步可以求出纤维素酶的固载量。
蛋白固载量(mg/g)=
(2)β-葡萄糖苷酶活力的测定:
采用比色法进行酶活力测量,以对硝基苯-β-d-葡萄糖苷(p-png)为底物,催化水解所得产物为对硝基苯酚(p-np),其在410nm处有特征吸收峰,可直接进行比色测定。
200μm对硝基苯酚溶液配制:称取13.92mg标准p-np样品,用适量naac-hac缓冲溶液(50mm,ph5.0)溶解后定容到5ml,得到20mm的p-np溶液,从中取50μl加入到4.95mlnaac-hac缓冲液中,从而得到200μm的p-np溶液。
1m碳酸钠(na2co3)溶液配制:称取10.6g无水碳酸钠固体于烧杯中,用适量的去离子水充分溶解后定容至100ml。
p-np标准曲线的绘制:取8只1.5ml编好号的ep管,用配好的标准200μmp-np溶液和naac-hac缓冲溶液配制成0-100μm浓度不等的p-np溶液,向配制好的p-np溶液中分别加入500μlna2co3溶液,在410nm处测定的吸光度值为x轴,p-np浓度为y轴,绘制p-np标准曲线。得到其线性回归方程:y=80.03x-0.032,r2=0.9993。
游离酶活力:取40μl的p-png与440μl的naac-hac缓冲溶液(50mm,ph5.0)于1.5mlep管中充分混合后,50℃水浴预热10min,加入20μl一定浓度的β-葡萄糖苷酶溶液,摇匀后50℃水浴反应10min,反应完毕后立即加入500μl的na2co3溶液,摇匀后测定吸光度。
固定化酶活力:测定步骤同游离酶。
(3)酶活力的计算
β-葡萄糖苷酶活力的定义:β-葡萄糖苷酶在ph5.0,50℃反应条件下,1min分解p-png生成1μmolp-np所需的酶量,定义为一个酶活力单位(u)。
(4)固定化酶β-g@cu(paba)催化水解应用
固定化酶β-g@cu(paba)和甲基丙烯酰胺丙烯酸(pmaac)固定化纤维素酶共同催化水解纤维素:
取不同当量的固定化酶β-g@cu(paba)和固定化pmaac-纤维素酶溶液于1.5ml的ep管中,并移取10mg的羧甲基纤维素(cmc)溶液,混合后,置于50℃振荡培养箱中振荡反应一段时间,2h测一次葡萄糖的量,从而求得相对应的糖化率。糖化率计算公式如下:
固定化酶β-g@cu(paba)的回收利用:
固定化酶β-g@cu(paba)和固定化pmaac-纤维素酶共同催化水解反应结束后,对其进行回收利用。将反应后的混合液取出,常温下离心,取出上清液,得到的沉淀为固定化酶β-g@cu(paba),将上清液在5℃下离心可得沉淀pmaac-纤维素酶,用此上清液测定葡萄糖量。将得到的固定化酶β-g@cu(paba)和pmaac-纤维素酶重悬,加入cmc后进行下一次水解反应,从而得到循环次数所对应的糖化率。
实施例1:金属有机框架材料(cu(paba))及其固定化酶β-g@cu(paba)的制备
称取50µl的β-葡萄糖苷酶,用50µl的聚乙烯吡咯烷酮(polyvinylpyrrolidone,pvp)溶液混匀后,将其与50mm的乙酸铜溶液混溶,再加入12.5mm的paba溶液,充分混溶。在25℃恒温振荡培养箱中静置培养8h,反应完毕后在4℃下离心,反复清洗3次后的产物在4℃冰箱中保存备用,同时得到金属有机框架材料(cu(paba))及其固定化酶β-g@cu(paba)。
实施例2:金属有机框架材料(cu(paba))及其固定化酶β-g@cu(paba)的表征
(1)傅里叶变换红外光谱图(ftir)分析
采用傅里叶变换红外光谱仪对游离β-葡萄糖苷酶、金属有机框架材料cu(paba)及其固定化酶β-g@cu(paba)三种样品的分子结构进行检测。首先将kbr在90℃烘箱中隔夜干燥,处理好的样品和kbr以1:100当量混匀,研磨后压片。以单独的kbr薄片为空白,分别测定这三种样品的红外光谱图,测得这三种样品的红外光谱图,如图2所示。
通过考察红外光谱图中特征基团吸收峰的位置及其不同程度的位移情况来确定成功合成了金属有机框架材料(cu(paba))及固定化酶β-g@cu(paba)。如图2(b)和图2(c)所示,铜的吸收峰在433cm-1附近,其配位作用引起羧酸在1390cm-1和1606cm-1处出现强烈的振动峰,证明形成了金属有机框架材料(cu(paba))。图2(b)中,在1654cm-1处形成一个振动峰,而图2(c)在此附近没有明显吸收峰,所以该峰应该是来自于β-葡萄糖苷酶中的肽键。此外,图2(a)中,β-葡萄糖苷酶中的甲基和亚甲基在2899cm-1和2931cm-1处形成不对称伸缩振动峰,图2(b)在此附近2925cm-1处也出现较之偏移的振动峰,由此可知β-葡萄糖苷酶在共沉淀形成金属有机框架过程中被引入其孔道,成功固定化在cu(paba)中。
(2)倒置荧光显微镜分析
为了进一步验证β-葡萄糖苷酶在金属有机框架形成的过程中被固定在其孔道中,用异硫氰酸荧光素(fitc)标记β-葡萄糖苷酶,再进行共沉淀合成带有荧光标记固定化酶fitc-β-g@cu(paba)。将甲基丙烯酰胺丙烯酸(pmaac)和fitc-纤维素酶用适量的去离子水溶解,滴加少许于玻片上,用dmi4000b型号倒置荧光显微镜在明场和荧光场下分别进行拍摄,如图3所示。
图3(a)和(b)分别为cu(paba)在明场及荧光场下拍摄的图片,图3(a)中较为均匀地分布着形状统一的cu(paba)颗粒,在荧光场下隐约可见其黑色的形貌,为表面光滑的椭球体,然而并没有出现任何荧光斑点,由此可见此材料自身并不具备荧光特性。图3(c)和(d)分别为带有荧光标记的固定化酶fitc-β-g@cu(paba)在明场及荧光场下拍摄的图片,如图3(c)所示,带有荧光标记的固定化酶的形貌较cu(paba)颗粒样品的分布更分散,形貌上没有明显差别,这是由于fitc标记的β-葡萄糖苷酶进行透析处理,酶浓度出现偏差所导致。在荧光场下,通过明暗的绿色光斑可见带有荧光标记的β-g成功固定在cu(paba)孔道中。
(3)扫描电镜(sem)分析
用适当比例的无水乙醇和去离子水(无水乙醇和去离子水的体积比为2:1)将干燥好的金属有机框架材料cu(paba)及固定化酶β-g@cu(paba)重新分散,取20μl样品滴加在硅片上,25℃的真空干燥箱里干燥2h,用jsm-6010plus/la型扫描电子显微镜(日本)观察其形貌并拍照,结果如图4所示。
图4(a)和(b)分别是金属有机框架材料cu(paba)及其固定化酶β-g@cu(paba)的sem图。通过对比发现,cu(paba)和β-g@cu(paba)都呈现为椭球状且表面光滑,尺寸均在10-20μm左右,表明β-葡萄糖苷酶的引入并没有破坏cu(paba)的形貌。
(4)射线衍射(xrd)分析
为了进一步验证在cu(paba)骨架形成的过程中引入β-葡萄糖苷酶并没有破坏其结构。使用x射线衍射仪对cu(paba)及其固定化酶β-g@cu(paba)的真空干燥样品进行研究分析。在10-80°范围内进行扫描,速度为7°/min,如图5所示。
图5分别为cu(paba)(a),固定化酶β-g@cu(paba)(b)的xrd图。通过对比两者图可发现,其2θ峰的位置一致,分别为15.2°,16°,19.4°,24.4°,25.8°,28.6°,29.5°,30.6°,34.2°,表明常温下,β-葡萄糖苷酶的引入并没有影响cu(paba)的生成,其依然保持良好的晶型。
(5)热重分析(tga)
为了进一步确定酶分子在cu(paba)材料中,分别对cu(paba)和其固定化酶β-g@cu(paba)进行热重分析。将真空干燥好的样品放入坩埚中,放入综合热分析仪中,抽真空,以25ml/min速率通氮气,从20℃开始以每分钟升高10℃对样品进行加热,直到600℃,从而得到样品重量随温度变化趋势,如图6所示。
图6(a)和(b)分别为mofscu(paba)和固定化酶β-g@cu(paba)的热重分析图。如图6所示,样品失重可分为四个阶段,第一阶段从20℃到200℃,出现明显的失重情况,cu(paba)和β-g@cu(paba)均失重约5%,这主要由于孔道中残留了一部分水分造成。第二阶段为200-350℃,两条曲线失重出现明显的差别,cu(paba)在此阶段基本上没有失重,表明mofs结构在此温度区间内没有出现明显坍塌,而固定化酶β-g@cu(paba)失重较为严重,达到了约13%,这归因于固定化于其中的β-葡萄糖苷酶开始分解。350℃到420℃为失重第三阶段,此阶段cu(paba)材料及固定化酶皆剧烈失重,可知cu(paba)坍塌分解。第四阶段为420-600℃,cu(paba)和β-g@cu(paba)失重趋于缓和,主要是mofs材料部分继续坍塌分解所致。通过cu(paba)和固定化酶β-g@cu(paba)的两条失重图分析可知cu(paba)材料中存在β-葡萄糖苷酶。
实施例3:β-葡萄糖苷酶的固定化条件优化
(1)金属离子及有机酸浓度对固定化的影响
固定化酶β-g@cu(paba)的合成前提是能够形成金属有机框架材料cu(paba),通过正交实验法,得出β-g@cu(paba)保留酶活力和酶的固载量所对应的乙酸铜和对氨基苯甲酸(paba)的浓度,如表1和表2所示,paba的浓度为6.25mm时,随着乙酸铜浓度的增加,β-g@cu(paba)的固载量和保留酶活力略有升高,这是因为酸的浓度偏低时,产生的β-g@cu(paba)的量较少,游离酶被引入到骨架孔道中较少。当paba浓度为12.5mm时,固载量和保留酶活力均出现大幅度提高,当cu2+浓度达到50mm时,β-g@cu(paba)出现最大固载量为162.95mg/g,相对酶活力为81.89%,这是由于cu2+增多,促进了骨架的形成,然而当乙酸铜浓度过大时(大于62.5mm),β-葡萄糖苷酶活力因cu2+离子抑制作用而出现一定程度的损失。继续增加paba浓度,cu(paba)的量明显增加,但增加的固定化酶却有限,这可能是体系的酸度增加,不利于固定化酶骨架的生成且强酸使酶活力有所降低。因此,本发明选择的cu2+和paba的浓度分别为25-62.6mm和6.25-18.75mm,优先选择的cu2+和paba的浓度分别为50mm和12.5mm。
表1.不同浓度cu2+和paba对固定化酶保留酶活力影响
表2.不同浓度cu2+和paba对酶的固载量影响
(2)缓冲溶液ph对固定化的影响
cu(paba)骨架的形成受溶液ph影响相当严重,paba和乙酸铜水溶液在一定ph下能直接互溶,立马出现氢氧化铜沉淀,不利于金属有机框架的形成。因此选择一定ph的naac-hac缓冲溶液溶解乙酸铜和paba,这样反应体系的ph较为稳定,有利于cu(paba)的形成,并且β-葡萄糖苷酶不易失活。如图7所示,当溶液ph为5.5时,β-g@cu(paba)的固载量仅有41mg/g,相对应的保留酶活力为33%,这是因为在此缓冲液所形成的反应液下,骨架的形成较为缓慢,且固定化酶的产量较少。骨架形成所需的反应体系随着缓冲溶液的ph升高而更适宜。使用ph7.0的缓冲溶液溶解的原料进行固定化反应,产物β-g@cu(paba)的固载量和相对酶活力皆达到最佳,分别为162.95mg/g和81.89%。所以本发明采用ph为5.5-8.0,优选ph为7.0的naac-hac缓冲溶液溶解乙酸铜和paba进行酶的固定化。
(3)酶的添加量对固定化的影响
本实施例考察了β-葡萄糖苷酶的添加量对cu(paba)骨架生长的影响,得到的固定化酶的固载效率和相对酶活力如图8所示。当加入0.5mg/ml酶时,由于酶的添加量过低导致包埋酶的cu(paba)生长较为缓慢,且产物量较少,β-g@cu(paba)的固载率为46%,相对酶活力为35%。产物随着酶浓度的升高而增多,当β-g浓度为2mg/ml时,固载率最高达到85%,保留酶活力为82%。由于cu(paba)孔道引入酶的能力有限,增加酶量,虽然固载量有些许提高,固载率却下降明显,所以本发明优选0.5-5mg/ml的加酶量进行酶的固定化,优选的,采用2mg/ml的加酶量进行酶的固定化。
(4)固定化时间的影响
由于cu(paba)骨架生长较为缓慢,所以本发明对β-g@cu(paba)的固载量和相对酶活力随固定化时间变化进行研究,如图9所示。实验中,约30min后可见固定化酶复合材料,约4h后,固定化酶的量聚集较多,易于分离,测定其固载量为58mg/g,相对酶活力为48%。随着固定化进行,越来越多的晶体材料形成,在8h后,其相对酶活力达到最佳为82%,固载量为163mg/g。延长反应时间,虽然材料有一定量的增加,引入的酶量几乎达到饱和,没有明显的增加,且部分酶活力会有一定的损失,导致固载量和相对酶活力出现下降。因此,本发明选取的固定化时间为4-14h,优先的,固定化时间为8h。
实施例4:固定化酶β-g@cu(paba)的酶学性质
(1)游离β-g及固定化酶β-g@cu(paba)的最适催化反应ph值
ph是影响酶活力的一个重要因素,酶的构象易受ph变化而产生重大改变,从而引起酶活力损失;同时一些底物的溶解状态和ph变化也紧密相关。如图10所示,游离酶和固定化酶的最佳反应ph都为5.0。然而游离酶在ph过低或者过高时,酶活力损失迅速,当ph为3.5时,游离酶接近失活;中性条件下,仅剩20%左右。而固定化酶的酶活力随ph变化较为平缓,中性条件下仍然保留了55%的酶活力,固定化后的β-g催化作用ph范围变宽,这是由于cu(paba)孔道骨架使得酶的肽链不易展开,使得构象较为稳定。
(2)游离β-g及固定化酶β-g@cu(paba)的最适催化反应温度
温度是影响酶催化反应活性的另一个重要因素。因此,本发明探究了游离β-g及固定化酶β-g@cu(paba)在不同温度体系下的催化反应活性。如图11,游离酶的最佳反应温度为50℃,而β-g@cu(paba)的最佳反应温度比游离酶升高了10℃,达到60℃。当低于最佳催化温度50℃时,游离酶的相对酶活力比固定化酶的要高很多,这是因为cu(paba)孔道结构使固定化酶刚性增强,需要提高温度来增加其柔性,使其更好地与底物相结合,因此最适反应温度有所增强。同时,刚性结构使得固定化酶在高温下的催化活性较游离酶高出很多。
(3)游离β-g及固定化酶β-g@cu(paba)的动力学常数
本实施例配制1-8mm浓度不等的底物p-png,短时间内进行催化反应,测定游离β-g及固定化酶β-g@cu(paba)的酶活力,利用lineweaver-burk法得到图12,进一步可以求出其两者的km值及vmax。
表3.游离β-g及固定化酶β-g@cu(paba)的动力学常数表
如表3所示,游离酶的km值为3.86mm,固定化酶的km值稍小,为2.46mm。可见,β-葡萄糖苷酶经cu(paba)固定化后,其与底物活性催化中心接触更加容易,即亲和力增强,所以km值变小。
(4)游离β-g及固定化酶β-g@cu(paba)的ph稳定性
本实施例考察游离β-g及其固定化酶β-g@cu(paba)在ph3.0-8.0体系下培养2h后,其酶活力保留情况。如图13所示,游离酶和固定化酶都是在ph5.0下稳定性最强,在更强酸性条件下,游离酶的酶活力损失较大,ph=3.0,游离酶相对酶活力仅剩14%,而固定化酶比之高了近40%。游离酶和固定化酶在弱酸性条件下的稳定性略高,ph=8.0,固定化酶的相对酶活力比游离酶的仍然高出40%。因此,cu(paba)材料固定化酶后,极大地提高了酶的ph稳定性,这是由于cu(paba)孔道骨架提供了刚性屏蔽环境,从而“稀释”了ph偏离所带来的不利影响。
(5)游离β-g及固定化酶β-g@cu(paba)的热稳定性
通常酶促反应需要的时间较长,并且为了提高催化速率,反应需要在较高温度下进行,这对酶的热稳定性提出了很高的要求。虽然高温下的酶解速率较快,但是很容易引起酶的不可逆失活,从而失去获得高产率的意义。本实施例将游离β-g及其固定化酶在30-80℃下培养2h后,测其相对酶活力。如图14所示,在40-60℃范围内,固定化酶活力损失较少,而游离酶酶活力在60℃时开始大幅下降,剩余不足40%,比固定化酶低近45%。80℃下,游离酶基本失活,而固定化酶仍剩余接近一半的酶活。由此可知,固定化酶的热稳定性得到显著增强,这说明cu(paba)孔道网络可为包埋于其中的酶分子提供稳定的刚性屏蔽空间,从而减小了高温引起酶变性失活。
(6)游离β-g及固定化酶β-g@cu(paba)对有机溶剂的耐受性
通常情况下,酶分子在水溶液里进行酶促反应,然而,部分有机底物的水溶性较差,为了改善其在反应体系中的溶解性以提高产物得率,通常需要加入适量的有机溶剂。由于酶分子大多数是亲水性的,其表面的水化层容易遭受有机溶剂的破坏,导致酶活性有所损失,甚至完全失活。本实施例将游离β-g及β-g@cu(paba)在乙腈、甲醇、二甲基甲酰胺(dmf)等有机溶剂-水混溶体系中培养1h,通过测量其酶活力,分析其对有机溶剂的耐受情况。如图15所示,游离酶受dmf的影响较为严重,仅剩28%的相对酶活力,而固定化酶所保留的酶活力较游离酶高出47%;在其他有机溶剂-水混溶体系下,固定化酶的相对酶活力比游离酶高出近30%甚至更多。这可归功于cu(paba)孔道结构成功地对接近酶分子活性中心的有机溶剂形成了屏障,从而有效地减少了有机溶剂对酶分子水化层的破坏。
(7)游离β-g及固定化酶β-g@cu(paba)对金属离子的耐受性
金属离子对酶活力有一定的影响,本实施例将游离β-g及β-g@cu(paba)在一定浓度的mg2+,k+,ca2+等金属离子溶液中培养30min,测其相对酶活力,将不加金属离子的游离酶及固定化酶活力设为100%。如表4所示,k+和co2+对β-葡萄糖苷酶具有明显的刺激作用,而fe3+,cu2+和zn2+对酶有较强的抑制作用,其它的如fe2+和ni2+对酶活力没有太大影响。实验中发现固定化酶β-g@cu(paba)对酶活力的保护比游离酶强,应该是cu(paba)骨架对酶分子起到了一定的保护作用。
表4.不同金属离子对游离β-g及其固定化酶β-g@cu(paba)酶活力的影响
(8)游离β-g及固定化酶β-g@cu(paba)的贮藏稳定性
酶的贮藏条件及稳定性等问题是酶工业化应用中必须应对的问题。本实施例将游离β-g及固定化酶β-g@cu(paba)保存在4℃的冰箱中。如图16所示,游离酶活力在第五天后开始出现大幅下降,15天后相对酶活力不足50%,30天后,基本失活。而固定化酶较为稳定,酶活力下降较小且较为平缓,40天后,仍有超过80%的相对酶活力。这是由于cu(paba)提供了刚性屏蔽环境,从而很大程度地降低了酶活力的损失。
(9)固定化酶β-g@cu(paba)的重复利用稳定性
重复利用稳定性作为衡量酶的固定化是否成功的一个重要参考标准。如图17所示,排除实验中离心等一系列破坏酶活力因素,在重复使用10次后,相对酶活力仍高达88%,说明固定化酶具有很强的操作稳定性。
实施例5:游离β-g及固定化酶β-g@cu(paba)的催化水解应用测试
(1)固定化酶β-g@cu(paba)和pmaac-纤维素酶共同催化水解纤维素
以β-g为补充酶和纤维素酶共同固定化在载体pmaac上,然后进行催化水解微晶纤维素,发现糖化率比单独pmaac-纤维素酶高出近2倍。因此,本实施例探索不同比例的β-g@cu(paba)水解cmc所得的糖化率随时间变化关系。
如图18所示,水解初始阶段,平均反应速率较快,随着反应的进行,反应逐渐趋于缓和,这是由于产物抑制作用及纤维素的结构影响,8h后,糖化率基本上不再变化。由图可知,单独的固定化纤维素酶水解得到的糖化率为48%,当加入的β-g@cu(paba)与纤维素酶的质量比从1:4到0时,水解反应速率也随之有较大提升,这是由于增加的β-g@cu(paba)有效地催化了中间产物纤维二糖,从而降低了产物的抑制作用。水解cmc的糖化率随着β-g@cu(paba)的增加,由68%提高到94%,因此,用等量的两种固定化酶进行水解cmc反应所得的糖化率是单独固定化pmaac-纤维素酶的近2倍。
(2)两种固定化酶和游离酶催化水解对比
加入同样当量的两种固定化酶和游离酶进行cmc水解反应。如图19所示,固定化酶的水解反应速率比游离酶的较快,这是由于固定化酶β-g@cu(paba)与底物的亲和作用力比游离酶强,所以活性催化中心得以更容易与底物接触,进行催化反应。同时,结果证明,β-葡萄糖苷酶的加入,对水解效率的提高起着关键作用,这是由于复合纤维素酶中β-g的成分较少,而其又是水解最后一环,因此引入的β-g极大地促进了水解。最终的固定化酶糖化率较游离酶稍高,这是由于固定化酶的热稳定性及催化性能都得到了提高。
- 还没有人留言评论。精彩留言会获得点赞!