一种B族链球菌核酸检测试剂盒的制作方法
本发明涉及生物检测技术,尤其是涉及一种b族链球菌核酸检测试剂盒。
背景技术:
b族链球菌(groupbstreptococcus,gbs)是一种寄生于人类泌尿生殖道及下呼吸道的条件致病菌,健康人群带菌率可达35%。早在20世纪70年代,b族链球菌就已经被证实为围产期母婴感染的重要致病菌之一。定植于产妇生殖道的b族链球菌可在分娩时垂直传播给新生儿,而新生儿b族链球菌感染所引起的新生儿败血症、脑膜炎和肺炎等症致死率极高,并可导致神经系统后遗症。2010年美国疾病预防中心制定了《围产期gbs预防指南》,建议孕妇于妊娠35-37周进行gbs筛查。
目前,国内对gbs的诊断方法主要有培养法、免疫学诊断法和分子生物学诊断法。细菌培养法是gbs的实验室诊断常规方法,是检测gbs的金标准,即:孕35-37周取阴道及直肠标本于肉汤培养基呈阳性。传统培养法特异性和敏感性高,但临床检测时间长(至少需要24-48h),过程繁琐,且阳性率受到多种因素影响,不适用于大范围检测。血清学方法由于窗口期的存在,诊断存在滞后性,不能准确反映当前是否感染,虽然特异性可高达95%,但是敏感性不够,检测率较低。分子诊断学方法包括基因序列测序及核酸检测方法,其中基因序列测序具有成本昂贵,步骤复杂繁琐,耗时长等缺点,不适宜临床检测用。而细菌核酸荧光pcr检测法具有快速性、准确性和高灵敏性等优点,能够对细菌感染作出早期诊断,适合临床筛查及诊断,同时给疫情的快速分析和控制提供了有力的技术支撑。研究显示,实时荧光pcr检测方法与标准的细菌培养方法在gbs检测的敏感性和特异性方面均能达到90%以上,符合筛检标准,已经得到美国食品和药品管理局(fda)的批准并应用于临床。因此,在国内采用实时荧光pcr技术进行gbs筛检是最快速、可靠的方法。
但是常规pcr荧光定量检测dna扩增采用热启动taq酶扩增体系,rna扩增采用taq酶和反转录mlv酶扩增体系,二者选用的buffer也不一样,两种扩增体系不能实现统一。在检测时间方面,dna扩增需要约1.5h,rna扩增需要约2h,耗时也较长。并且热启动taq酶扩增试剂储存条件必须为-20℃保存,干冰或冰袋运输,有效期较短,在使用和运输过程中不便捷。
技术实现要素:
本发明的目的在于针对上述现有技术存在的检测耗时长、扩增体系不统一且试剂存储不便的缺陷,提供一种b族链球菌核酸检测试剂盒。
为实现上述目的,本发明可采取下述技术方案:
本发明所述的b族链球菌核酸检测试剂盒,包括pcr反应液,所述pcr反应液包括pcr反应液1和pcr反应液2,其中pcr反应液1包含用于靶多核苷酸扩增的上游引物和下游引物以及用于靶多核苷酸检测的探针,双功能dna聚合酶,尿嘧啶dna糖基化酶,dutp,pcr扩增增强剂;所述pcr反应液2包含锰离子。
所述用于靶多核苷酸扩增的上游引物、下游引物和检测探针是源于b族链球菌的保守区域的引物和探针,其序列分别为:
上游引物(seqidno.1):5’-agcaatcacacatgctgttgga-3’;
下游引物(seqidno.2):5’-taatgctgtttgaagtgctgct-3’;
探针(seqidno.3):5’-cagttgaatccaaatgttacggtacaac-3’。
所述试剂盒还包括内标,所述内标采用人β-珠蛋白基因扩增,既能监测临床取样过程又能监测样本核酸提取过程。
所述试剂盒还包括用于内标片段扩增的上、下游引物和用于检测内标的探针,所述检测内标的上下游引物和探针序列分别为:
上游引物(seqidno.4):5’-gaaggctcatggcaagaaag-3’;
下游引物(seqidno.5):5’-ctcactcagtgtggcaaagg-3’;
探针(seqidno.6):5’-cttgaggttgtccaggtgagccag-3’。
所述试剂盒还包括阳性对照和阴性对照。
所述用于靶多核苷酸扩增的上游引物和下游引物的浓度为0.2μmol/l-1.0μmol/l;所述检测探针的浓度为0.2μmol/l-1.0μmol/l。
所述用于内标片段扩增的上、下游引物的浓度为0.1μmol/l-0.5μmol/l;检测内标探针的浓度为0.1μmol/l-0.5μmol/l。
本发明的优点在于操作方便,检测灵敏度高,特异性好,可重复性强,检测结果快速,试剂无需-20℃保存,方便储存和运输。采用本发明试剂盒可以对围产期孕妇生殖道分泌物和直肠分泌物等未知样本中的b族链球菌-dna进行快速检测,为诊断b族链球菌感染提供可靠的实验依据。
附图说明
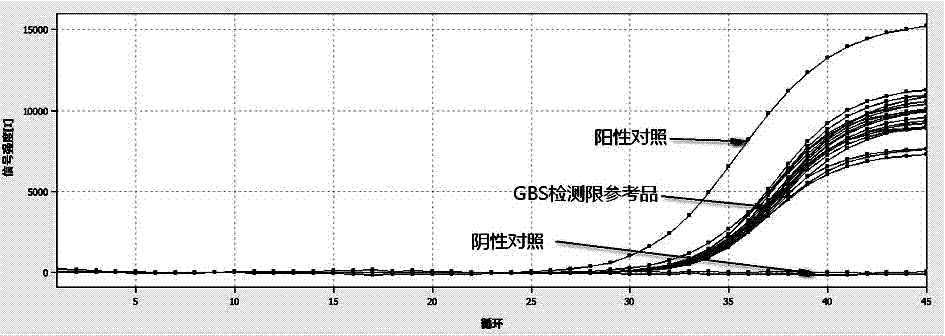
图1为本发明试剂盒检测检测限参考品的扩增曲线图。
图2为本发明试剂盒检测阴阳参考品的扩增曲线图。
图3为本发明试剂盒特异性实验扩增曲线图。
图4a、4b、4c为本发明试剂盒特异性实验扩增曲线图。
图5为本发明试剂盒第20170919批次试剂批内精密度检测扩增曲线。
图6为本发明试剂盒第20171010批次试剂批内精密度检测扩增曲线。
图7为本发明试剂盒第20171128批次试剂批内精密度检测扩增曲线。
具体实施方式
下面结合具体实施例来对本发明做进一步更加详细的描述。本领域技术人员应该理解的是,实施例仅是范例性的,并不对本发明的范围构成任何限制,在不偏离本发明的的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1制备b族链球菌核酸检测试剂盒
1、pcr反应液1
其组分包括:
0.2μmol/l-1.0μmol/l的用于靶多核苷酸检测的探针,0.2μmol/l-1.0μmol/l的用于靶多核苷酸检测的上游引物和下游引物;
0.1μmol/l-0.5μmol/l的用于人β-珠蛋白内标核苷酸检测的探针,0.1μmol/l-0.5μmol/l的用于人β-珠蛋白内标检测的上游引物和下游引物;
0.01u/μl-0.1u/μl双功能dna聚合酶、0.001u/μl-0.01u/μl尿嘧啶dna糖基化酶和0.1mmol/l-0.5mmol/ldutp;利用ung酶可以降解含du的dna链的特点,在pcr体系中添加了ung酶和dutp,可以预防前次pcr产物的污染,防止样本检测假阳性。
ph7.0-ph9.01mol/l三(羟甲基)甲基甘氨酸溶液、6.25%-12.5%pcr扩增增强剂。
2、pcr反应液2:醋酸锰盐溶液。
3、阳性对照:合成b族链球菌靶标序列质粒,其浓度为1.00-5.00e+05copies/ml。
4、阴性对照:灭菌后的生理盐水。
实施例2采用实施例1制备的试剂盒检测生殖道分泌物和直肠道分泌物等未知样本中的b族链球菌-dna的方法
一、试剂准备
根据待测样本、阴性对照和阳性对照数量,按比例(pcr反应液120μl/人份+pcr反应液210μl/人份)取相应量的pcr反应液1、pcr反应液2,充分混匀成pcr-mix混合液,瞬时离心后备用。
二、样本处理
1、将待测拭子放入1ml生理盐水中,涮洗5-10次,涮洗后液体备用;
2、取600μl涮洗后液体样本,配合郑州安图生物工程股份有限公司磁珠法核酸提取试剂提取待测样本中b族链球菌dna核酸,备用;
3、同时取600μl阴/阳性质控品,配合郑州安图生物工程股份有限公司磁珠法核酸提取试剂提取阴、阳性质控品dna核酸,备用;
4、取pcr反应管若干,加入pcr-mix混合液30μl,再分别加入提取的待测样本、阴/阳性质控品核酸产物各20μl,盖上管盖(去除气泡后),瞬时离心10秒。
三、荧光pcr反应
1、将pcr反应管放入扩增仪样品槽,按对应顺序设置待测样本名称,
2、荧光检测通道选择:选择fam通道检测gbs靶标;选择cy5通道检测内标;参比荧光设置为none,
3、荧光pcr反应条件见表1:
表1:荧光pcr反应条件:
四、结果分析
反应结束后,仪器自动保存结果,可以利用仪器自带的软件进行自动分析(也可手动调节基线的开始值、结束值以及阈值线进行分析),然后记录样本ct值结果。扩增曲线与阈值线的焦点,称为ct值(即cyclethreshold,指pcr反应管内的荧光信号达到设定的阈值时所经历的循环数值);仪器软件根据各样本ct值大小,可以判断检测结果。对于测定ct值≤38的样本,报告为gbs-dna阳性;对于测定ct值>38的样本,同时内标检测为阳性(ct值≤40),报告为gbs-dna小于检测限;对于测定无ct值的样本,同时内标检测为阳性(ct值≤40),报告为gbs-dna阴性;若内标ct值>40或无显示,则该样本的检测结果无效,应查找并排除原因,并对此样本进行重复试验。
实施例3本发明试剂盒性能测定
1、灵敏度实验
配合郑州安图生物工程股份有限公司磁珠法核酸提取试剂,采用实施例1制备的试剂盒,检测企业工作参考品,检测限参考品检出率>95%。本试剂盒检测检测限企业工作参考品各10例,图1所示为试剂盒检测检测限参考品的扩增曲线。
结论:根据检测结果显示,本发明试剂盒配合郑州安图生物工程股份有限公司磁珠法核酸提取试剂,检测企业检测限工作参考品10例,扩增曲线为标准“s”型曲线,其中10例全检出,检出率大于95%,本试剂盒灵敏度高。
2、准确性实验
配合郑州安图生物工程股份有限公司磁珠法核酸提取试剂,采用实施例1制备的试剂盒,检测企业工作参考品,阴阳性参考品符合率为100%。本试剂盒检测阴阳性企业工作参考品各10例,检测结果如下表2所示:
表2:准确性检测结果
图2所示为试剂盒检测阳性参考品的扩增曲线;图3所示为试剂盒检测阴性参考品的扩增曲线。
结论:由图2和图3可知,本发明试剂盒配合郑州安图生物工程股份有限公司磁珠法核酸提取试剂,检测企业阴、阳性工作参考品各10例,扩增曲线为标准“s”型曲线,其中阴性符合率100%,阳性符合率100%,证明本试剂盒准确性高。
3、特异性实验
配合郑州安图生物工程股份有限公司磁珠法核酸提取试剂进行特异性实验,与临床常见病原体和微生物:沙眼衣原体(ct)、淋球菌(ng)、解脲脲原体(uu)、乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)、人巨细胞病毒(hcmv)、肠炎沙门氏菌、化脓性链球菌、肺炎克雷伯菌、肺炎链球菌、解没食子酸链球菌、铜绿假单胞菌、金黄色葡萄球菌、粪肠球菌、表皮葡萄球菌、大肠杆菌、光滑念珠菌、热带念珠菌、白色念球菌、流感嗜血杆菌、弗氏柠檬酸杆菌无交叉反应,检测结果为阴性。
图4a、b4、4c为本发明试剂盒特异性实验扩增曲线图(其中,图4a为沙眼衣原体(ct)、淋球菌(ng)、解脲脲原体(uu)交叉反应检测扩增曲线图;图4b为乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)、人巨细胞病毒(hcmv)交叉反应检测扩增曲线图;图4c为肠炎沙门氏菌、化脓性链球菌、肺炎克雷伯菌、肺炎链球菌、解没食子酸链球菌、铜绿假单胞菌、金黄色葡萄球菌、粪肠球菌、表皮葡萄球菌、大肠杆菌、光滑念珠菌、热带念珠菌、白色念球菌、流感嗜血杆菌、弗氏柠檬酸杆菌交叉反应检测扩增曲线图)。
结论:检测结果显示,临床常见病原体和微生物:沙眼衣原体(ct)、淋球菌(ng)、解脲脲原体(uu)、乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)、人巨细胞病毒(hcmv)、肠炎沙门氏菌、化脓性链球菌、肺炎克雷伯菌、肺炎链球菌、解没食子酸链球菌、铜绿假单胞菌、金黄色葡萄球菌、粪肠球菌、表皮葡萄球菌、大肠杆菌、光滑念珠菌、热带念珠菌、白色念球菌、流感嗜血杆菌、弗氏柠檬酸杆菌对gbs检测无交叉反应,证明本试剂盒特异性较高。
4、精密度实验
分别用三批次试剂盒(批号1:20170919,批号2:20171010,批号3:20171128)检测高、中、低三个浓度样本,每个样本各检测8个重复。具体的检测结果如表3-6和图5-7所示,图5-7分别所示为批号1批内精密度检测扩增曲线,批号2批内精密度检测扩增曲线,批号3批内精密度检测扩增曲线。
表3:批号1试剂批内精密度检测结果统计
表4:批号2试剂批内精密度检测结果统计
表5:批号3试剂批内精密度检测结果统计
表6:批间精密度检测结果统计
实验表明:本发明试剂盒批内和批间重复性好,检测结果ct值的变异系数<10%。
5、2-8℃稳定性实验
配合郑州安图生物工程股份有限公司磁珠法核酸提取试剂,采用实施例1制备的试剂盒,将pcr反应液1和pcr反应液2同时放置37℃加速,分别在0天、3天、7天、14天4个时间点检测高、中、低三个浓度样本,每个样本每个时间点各检测2个重复,n1-n10阴性参考品、p1-p10阳性参考品、阴阳性对照各1个重复。检测结果如表7所示:
表7
根据以上实验结果,按照阿伦尼乌斯公式计算,本发明实施例1制备的试剂盒37℃加速14天,可在2-8℃储存至少18-24个月。
序列表
<110>郑州安图生物工程股份有限公司
<120>b组链球菌核酸检测试剂盒
<141>2018-08-16
<160>6
<170>siposequencelisting1.0
<210>1
<211>22
<212>dna
<213>人工合成
<400>1
agcaatcacacatgctgttgga22
<210>2
<211>22
<212>dna
<213>人工合成
<400>2
taatgctgtttgaagtgctgct22
<210>3
<211>28
<212>dna
<213>人工合成
<400>3
cagttgaatccaaatgttacggtacaac28
<210>4
<211>20
<212>dna
<213>人工合成
<400>4
gaaggctcatggcaagaaag20
<210>5
<211>20
<212>dna
<213>人工合成
<400>5
ctcactcagtgtggcaaagg20
<210>6
<211>24
<212>dna
<213>人工合成
<400>6
cttgaggttgtccaggtgagccag24
- 还没有人留言评论。精彩留言会获得点赞!