一种用于检测猪流行性腹泻病毒和猪星状病毒的引物组和试剂盒的制作方法
本发明属于分子生物学检测领域,具体涉及一种用于检测猪流行性腹泻病毒和猪星状病毒的引物组和试剂盒。
背景技术
猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)是一种小的、多形性、有囊膜、单股正链rna病毒。病毒粒子直径为95-190nm。猪流行性腹泻病毒只有一个血清型,是引起仔猪腹泻的主要病原,该病主要表现为猪呕吐、水样腹泻和脱水,给养殖业带来巨大的经济损失,是目前危害世界养猪业的重要疫病之一。我国于1986年首次成功分离到pedv,该病毒广泛存在于我国的养猪场中,严重影响了养猪业的经济效益。猪星状病毒(porcineastrovirus,pastv)是一种无囊膜,单股正链rna病毒。pastv粒子呈20面体对称结构,直径在27nm-40nm之间,基因组长度6170-7720bp之间。pastv是引起仔猪腹泻的主要病原之一,临床主要表现为呕吐和脱水,与pedv混合感染后可加强临床表现,严重威胁着养猪业的健康发展。由于pedv和pastv感染猪以后的临床表现、病理变化等非常相似,给临床诊断造成了一定困难。目前猪病多病毒混合感染相当严重。建立一种能够快速区分pedv和pastv的多重pcr诊断方法和专用试剂盒,能够方便在疫病发生早期快速、准确的诊断疫病,为疫病的防控提供有效的参考。
技术实现要素:
针对现有技术中存在的问题,本发明的目的旨在提供一种用于检测猪流行性腹泻病毒和猪星状病毒的引物组及其检测方法和试剂盒。
为实现发明目的,本发明采用的技术方案如下:
本发明首先提供了一种用于检测猪流行性腹泻病毒和猪星状病毒的引物组,所述引物组由用于检测猪流行性腹泻病毒的引物和用于检测猪星状病毒的引物组成,其中,
所述用于检测猪流行性腹泻病毒的引物的核苷酸序列为:
上游引物l1:5ˊ-caacaccttagaaactggaatttcacatg-3ˊ(seqidno.1),
下游引物l2:5ˊ-ccactacaacaattgtctacggac-3ˊ(seqidno.2);
所述用于检测猪星状病毒的引物的核苷酸序列为:
上游引物l3:5ˊ-cagctgtcaactctggcaac-3ˊ(seqidno.3),
下游引物l4:5ˊ-ctggagcaaaatggtcctggc-3ˊ(seqidno.4)。
上述用于检测猪流行性腹泻病毒和猪星状病毒的引物组能够用于制备检测猪流行性腹泻病毒和/或猪星状病毒的试剂。
本发明还提供了一种用于检测猪流行性腹泻病毒和猪星状病毒的试剂盒,所述试剂盒成分组成包括:rna提取试剂、反转录试剂、pcr扩增试剂;其中,所述pcr扩增试剂包括:pcr扩增缓冲液、dntp、上游引物l1、下游引物l2、上游引物l3、下游引物l4、taqdna聚合酶、无菌双蒸水;所述上游引物l1的核苷酸序列如seqidno.1所示,所述下游引物l2的核苷酸序列如seqidno.2所示,所述上游引物l3的核苷酸序列如seqidno.3所示,所述下游引物l4的核苷酸序列如seqidno.4所示。
根据上述的试剂盒,优选地,所述试剂盒的成分组成还包括阳性对照和阴性对照;所述阳性对照为猪流行性腹泻病毒rna和猪星状病毒的rna;所述阴性对照为无菌双蒸水。
根据上述的试剂盒,优选地,所述反转录试剂包括10×m-mlv缓冲液、dntp、m-mlv反转录酶、rnase酶抑制剂、引物l2、引物l4。
上述的试剂盒可以用于检测猪流行性腹泻病毒和/或猪星状病毒。
本发明还提供了一种猪流行性腹泻病毒和猪星状病毒的多重pcr检测方法,包括以下步骤:
(1)引物合成:合成上述的用于检测猪流行性腹泻病毒和猪星状病毒的引物组;
(2)待测样品rna提取、反转录:提取待测样品中的rna,以提取的rna为模板反转录得到其cdna;
(3)pcr扩增:以步骤(2)制得的cdna为模板,采用步骤(1)合成的引物组进行pcr扩增反应;
(4)分析pcr扩增产物:对pcr产物进行琼脂糖凝胶电泳分析(琼脂糖凝胶电泳电压为100v,电泳40min,在dna凝胶成像系统仪下观察电泳结果)。
根据上述的多重pcr检测方法,优选地,步骤(3)中所述pcr扩增反应的反应体系为:10×pcr扩增缓冲液5.0μl,2.5mmol/l的dntp8.0μl,10mmol/l的上游引物l1、下游引物l2、上游引物l3、下游引物l4各1.0μl,cdna模板3.0μl,5u/μl的taqdna聚合酶1.0μl,无菌双蒸水补至50.0μl。
根据上述的多重pcr检测方法,优选地,步骤(3)中所述pcr扩增反应反应条件为:95℃预变性5min;94℃30s,56℃30s,72℃60s,共33个循环;72℃10min。
本发明取得的积极有益效果:
(1)本发明根据genbank中收录的pedv和pastv序列,通过比对pedv和pastv之间的差异,设计了检测猪流行性腹泻病毒和猪星状病毒的特异性引物组,与现有技术相比,本发明的引物组具有很强的敏感性,对pedv和pastv的最低检测量分别为2.0×10-4ng/μl和2.5×10-4ng/μl;该引物组的特异性强,对猪圆环病毒、猪伪狂犬病病毒、猪细小病毒、猪蓝耳病病毒、猪瘟病毒、猪副流感病毒、猪轮状病毒、猪传染性胃肠炎病毒的扩增结果均为阴性;该引物组的重复性好,对同一样品进行3次检测,每次间隔一个月,都能获得同样的结果,且与其它方法相比符合率可达95%以上。
(2)本发明猪流行性腹泻病毒和猪星状病毒的多重pcr检测方法不仅具有单个pcr的特异性、敏感性、准确性,而且检测结果准确,可以在一个反应体系里能同时检测出pedv和pastv两种病毒,简便、快速、经济、高效,省时省力,使原来需要做两次pcr和两次电泳的检测,现在一次就可以完成,大大缩短了检测时间,提高检测效率,而且还大大节约了检测成本,特别适用于临床的大量检测,在临床诊断上具有很好的应用前景。
附图说明
图1为以pedv的cdna为模板进行引物浓度优化实验的电泳检测结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-4对应的引物加入量分别为0μl、0.2μl、0.5μl、1.0μl;
图2为以pastv的cdna为模板进行引物浓度优化实验的电泳检测结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-4对应的引物加入量分别为0μl、0.2μl、0.5μl、1.0μl;
图3为以pedv的cdna为模板进行退火温度优化实验的电泳检测结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-7对应的退火温度分别为53℃、54℃、55℃、56℃、57℃、58℃、59℃;
图4为以pastv的cdna为模板进行退火温度优化实验的电泳检测结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-9对应的退火温度分别为51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃;
图5为以pedv的cdna为模板进行pcr扩增循环次数优化实验的电泳检测结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-5对应的pcr循环次数分别为29、30、31、32、33;
图6为以pastv的cdna为模板进行pcr扩增循环次数优化实验的电泳检测结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-5对应的pcr循环次数分别为29、30、31、32、33;
图7为pedv扩增引物的优化;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-9对应的退火温度分别为51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃;
图8为pedv扩增引物的优化;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-10对应的退火温度分别为51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃、60℃;
图9为pastv扩增引物的优化;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-9对应的退火温度分别为51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃;
图10为pastv扩增引物的优化;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-8对应的退火温度分别为51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃;
图11为本发明多重pcr检测方法对pedv、pastv、pedv+pastv混合的电泳检测结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1为pedv,泳道2为pastv;泳道3为pedv+pastv混合;
图12为本发明多重pcr检测方法的特异性检验结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-10分别为pedv、pastv、猪圆环病毒、猪蓝耳病病毒、猪伪狂犬病病毒、猪瘟病毒、猪副流感病毒、猪细小病毒、猪轮状病毒、猪传染性胃肠炎病毒;
图13为本发明多重pcr检测方法对pedv的敏感性检验结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-6对应pedv的cdna模板浓度分别为2.0ng/μl、2.0×10-1ng/μl、2.0×10-2ng/μl、2.0×10-3ng/μl、2.0×10-4ng/μl、2.0×10-5ng/μl;
图14为本发明多重pcr检测方法对pastv的敏感性检验结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-6对应pastv的cdna模板浓度分别为2.5×10-1ng/μl、2.5×10-2ng/μl、2.5×10-3ng/μl、2.5×10-4ng/μl、2.5×10-5ng/μl、2.5×10-6ng/μl;
图15为本发明多重pcr检测方法对临床样本的检测结果;其中,m为dl2000marker(条带从上至下为2000、1000、750、500、250、100bp),泳道1-7为pedv阳性,泳道8-10为pastv阳性。
具体实施方式
以下通过具体的实施例对本发明作进一步详细说明。若未特别指明,实施例中所用的材料、化学试剂均为常规市售商品,所用的技术手段为本领域技术人员所公知的常规手段。
材料来源:
猪流行性腹泻病毒毒株由本研究室从猪传染性胃肠炎、猪流行性腹泻二联活疫苗(购自于中牧实业股份有限公司,批准文号:兽药生字220051109)分离纯化得到。猪星状病毒来自于临床获得的含有猪星状病毒的阳性病料。
实施例1:猪流行性腹泻病毒(pedv)和猪星状病毒(pastv)的多重pcr检测方法的构建
1、用于检测猪流行性腹泻病毒和猪星状病毒的引物组的设计与合成
(1)用于检测猪流行性腹泻病毒(pedv)的引物设计与合成:
根据ncbi公布的pedv基因序列(genbank登录号分别为af353511、mh107321)的差异,以及我们实验室自行测序获得的序列进行比对,发现m基因是pedv基因组中非常保守的基因之一,根据m基因采用primerpremier5.0软件进行引物设计(引物设计条件为:引物长度控制在30个碱基以内,gc含量为37%-46%,tm值为58-66;在引物设计时,将引物之间的gc含量差距控制在10%以内,以方便进行有效的扩增;另外,本引物设计避免了连续5个以上的类似的碱基出现,避免了由于引物自身的原因而出现pcr扩增失败的情况),设计了上游引物l1和下游引物l2,上游引物l1位于m基因第37-65核苷酸处,下游引物l2位于m基因第521-544核苷酸处,pcr产物大小预计为508bp。其中,上游引物l1为:5ˊ-caacaccttagaaactggaatttcacatg-3ˊ(seqidno.1),下游引物l2为:5ˊ-ccactacaacaattgtctacggac-3ˊ(seqidno.2)。引物由上海生工生物工程有限公司合成。
(2)用于检测猪星状病毒的引物设计与合成:
根据ncbi公布的pastv基因序列的差异,根据猪星状病毒(genbank登录号为jx556692.1)设计了上游引物l3和下游引物l4两条特异性引物(引物设计条件为:引物长度控制在30个碱基以内,gc含量为55%-58%,tm值为56-65;在引物设计时,将引物之间的gc含量差距控制在10%以内,以方便进行有效的扩增;另外,本引物设计避免了连续5个以上的类似的碱基出现,避免了由于引物自身的原因而出现pcr扩增失败的情况),上游引物l3位于基因组第43-62核苷酸处,下游引物l4位于基因组第436-456核苷酸处,pcr产物大小估计为414bp。其中,上游引物l3的核苷酸序列为:5ˊ-cagctgtcaactctggcaac-3ˊ(seqidno.3),下游引物l4的核苷酸序列为:5ˊ-ctggagcaaaatggtcctggc-3ˊ(seqidno.4)。引物由上海生工生物工程有限公司合成。
2、病毒rna的提取
分别提取猪流行性腹泻病毒(pedv)、猪星状病毒(pastv)的rna。
以猪流行性腹泻病毒(pedv)为例,其rna提取的具体操作方法为:
(1)取感染猪流行性腹泻病毒(pedv)的细胞培养液或感染猪流行性腹泻病毒的猪肠道组织,用剪刀剪碎,加入适量生理盐水,反复冻融3次)3000rpm/min离心5min取上清,备用。
(2)取0.2ml氯仿,加入等体积的上清,剧烈摇晃15s,室温放置3min,然后12,000g,4℃离心5min。离心后分成3层,最下面的红色为酚-氯仿相,一个中间层,上层是无色的水相,rna存在于水相中;
(3)将(1)中的上层水相转移到另一只干净的ep管中,加入0.5ml预冷的异丙醇,室温静置10min,然后12000g,4℃离心10min;
(4)倒掉上清,加入1ml体积分数75%乙醇洗涤rna沉淀,混匀后,7500g,4℃离心5min;
(5)倒掉上清,室温放置10min,然后加入适量无rnase水溶解rna,即得到总rna。
猪星状病毒(pastv)的rna提取方法与猪流行性腹泻病毒(pedv)相同,在此不再赘述。
3、反转录
分别以步骤2提取的猪流行性腹泻病毒、猪星状病毒的rna为模板,进行反转录,获得猪流行性腹泻病毒cdna和猪星状病毒的cdna。反转录的反应体系为(10μl):10×m-mlv缓冲液2.0μl,dntp(2.5mmol/l)2.0μl,m-mlv反转录酶(200u/μl)0.5μl,rnase酶抑制剂(40u/μl)0.3μl,引物l2(10mmol/l)0.3μl,引物l4(10mmol/l)0.3μl,rna模板4.9μl。反转录的反应条件为:42℃1h,70℃10min。
4、多重pcr扩增反应条件的优化
(1)引物浓度优化:
1)、以pedv的cdna为模板,对上游引物l1、下游引物l2浓度的优化:
以pedv的cdna为模板,以上游引物l1、下游引物l2为引物进行pcr扩增反应,对pcr反应体系中的引物的浓度进行优化(将浓度为10mmol/l的上游引物l1和下游引物l2的添加量分别设定为0、0.2、0.5、1.0μl);具体采用的pcr反应体系(50μl)为:10×pcr扩增缓冲液5.0μl,2.5mmol/l的dntp8.0μl,10mmol/l的上游引物l1和下游引物l2,cdna模板3.0μl,5u/μl的taqdna聚合酶1.0μl,无菌双蒸水补至50.0μl。pcr扩增的反应条件为:95℃预变性5min;95℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸60s,共35个循环;最后72℃延伸10min。对不同引物浓度的pcr扩增产物进行琼脂糖凝胶电泳(电压100v),电泳40min,在dna凝胶成像系统仪下观察电泳结果,其结果见图1。由图1可知,引物添加量为0.5μl和1.0μl时均可扩增出目的条带(508bp),而且引物添加量为1.0μl时条带更亮,因此,为了避免条带含量低而造成的假阴性,上游引物l1、下游引物l2添加量选择1.0μl。
2)、以pastv的cdna为模板,对上游引物l3、下游引物l4浓度的优化:
以pastv的cdna为模板,以上游引物l3、下游引物l4为引物进行pcr扩增反应,对pcr反应体系中的引物的浓度进行优化(将浓度为10mmol/l的上游引物l3和下游引物l4的添加量分别设定为0、0.2、0.5、1.0μl);具体采用的pcr反应体系(50μl)为:10×pcr扩增缓冲液5.0μl,2.5mmol/l的dntp8.0μl,10mmol/l的上游引物l3和下游引物l4,cdna模板3.0μl,5u/μl的taqdna聚合酶1.0μl,无菌双蒸水补至50.0μl。pcr扩增的反应条件为:95℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸60s,共35个循环;最后72℃延伸10min。对不同引物浓度的pcr扩增产物进行琼脂糖凝胶电泳(电压100v),电泳40min,在dna凝胶成像系统仪下观察电泳结果,其结果见图2。由图2可知,引物添加量为0.2μl、0.5μl和1.0μl时均可扩增出目的条带(414bp),而且引物添加量为1.0μl时条带更亮,因此,为了避免条带含量低而造成的假阴性,上游引物l3、下游引物l4添加量选择1.0μl。
由于上游引物l1、下游引物l2的添加量均为1.0μl时,以pedv的cdna为模板能够扩增出目的条带(508bp),上游引物l3、下游引物l4添加量均为1.0μl时,以pastv的cdna为模板也能够扩增出目的条带(414bp),所以,多重pcr扩增反应体系中浓度为10mmol/l的上游引物l1、下游引物l2、上游引物l3、下游引物l4的加入量均选取1.0μl。
(2)退火温度的优化:
1)、以pedv的cdna为模板,进行退火温度的优化:
以pedv的cdna为模板,进行pcr扩增,对pcr扩增反应的退火温度进行优化,具体优化的退火温度分别为53℃、54℃、55℃、56℃、57℃、58℃、59℃。具体采用的pcr反应体系(50μl)为:10×pcr扩增缓冲液5.0μl,2.5mmol/l的dntp8.0μl,10mmol/l的上游引物l1、下游引物l2各1.0μl,cdna模板3.0μl,5u/μl的taqdna聚合酶1.0μl,无菌双蒸水补至50.0μl。pcr扩增的反应条件为:95℃预变性5min;94℃变性30s,退火30s,72℃延伸60s,共35个循环;最后72℃延伸10min。对不同退火温度的pcr扩增产物进行琼脂糖凝胶电泳(电压100v),电泳40min,在dna凝胶成像系统仪下观察电泳结果,其结果见图3。由图3可知,退火温度为55℃和56℃时,能够扩增出目的条带(508bp)。
2)、以pastv的cdna为模板,进行退火温度的优化:
以pastv的cdna为模板,进行pcr扩增,对pcr扩增反应的退火温度进行优化,具体优化的退火温度分别为53℃、54℃、55℃、56℃、57℃、58℃、59℃。具体采用的pcr反应体系(50μl)为:10×pcr扩增缓冲液5.0μl,2.5mmol/l的dntp8.0μl,10mmol/l的上游引物l3、下游引物l4各1.0μl,cdna模板3.0μl,5u/μl的taqdna聚合酶1.0μl,无菌双蒸水补至50.0μl。pcr扩增的反应条件为:95℃预变性5min;94℃变性30s,退火30s,72℃延伸60s,共35个循环;最后72℃延伸10min。对不同退火温度的pcr扩增产物进行琼脂糖凝胶电泳(电压100v),电泳40min,在dna凝胶成像系统仪下观察电泳结果,其结果见图4。由图4可知,退火温度为56℃和59℃时,能够扩增出目的条带(414bp)。
由于退火温度为56℃时,以pedv的cdna为模板能够扩增出目的条带(508bp)、以pastv的cdna为模板也能够扩增出目的条带(414bp),所以,多重pcr扩增反应的退火温度选取56℃。
(3)pcr循环次数的优化:
1)、以pedv的cdna为模板,进行pcr循环次数的优化:
以pedv的cdna为模板,进行pcr扩增,对pcr循环次数进行优化,具体优化的pcr循环次数为29、30、31、32、33。具体采用的pcr反应体系(50μl)为:10×pcr扩增缓冲液5.0μl,2.5mmol/l的dntp8.0μl,10mmol/l的上游引物l1、下游引物l2各1.0μl,cdna模板3.0μl,5u/μl的taqdna聚合酶1.0μl,无菌双蒸水补至50.0μl。pcr扩增的反应条件为:95℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸60s,共29-33个循环;最后72℃延伸10min。对不同循环次数的pcr扩增产物进行琼脂糖凝胶电泳(电压100v),电泳40min,在dna凝胶成像系统仪下观察电泳结果,其结果见图5。由图5可知,在第31个循环可以发现目的条带(508bp),但是目的条带的含量较低。因此,对于临床中检测来说,为了避免目的条带含量低而造成的假阴性,循环次数选取33次。
2)、以pastv的cdna为模板,进行pcr循环次数的优化:
以pastv的cdna为模板,进行pcr扩增,对pcr循环次数进行优化,具体优化的pcr循环次数为29、30、31、32、33。具体采用的pcr反应体系(50μl)为:10×pcr扩增缓冲液5.0μl,2.5mmol/l的dntp8.0μl,10mmol/l的上游引物l3、下游引物l4各1.0μl,cdna模板3.0μl,5u/μl的taqdna聚合酶1.0μl,无菌双蒸水补至50.0μl。pcr扩增的反应条件为:95℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸60s,共29-33个循环;最后72℃延伸10min。对不同循环次数的pcr扩增产物进行琼脂糖凝胶电泳(电压100v),电泳40min,在dna凝胶成像系统仪下观察电泳结果,其结果见图6。由图6可知,在第31个循环可以发现目的条带(414bp),但是目的条带的含量较低。因此,对于临床中检测来说,为了避免目的条带含量低而造成的假阴性,循环次数选取33次。
由于pcr循环次数为33次时,以pedv的cdna为模板能够扩增出目的条带(508bp)、以pastv的cdna为模板也能够扩增出目的条带(414bp),所以,多重pcr扩增反应的循环次数选取33次。
(4)引物优化:
1)、pedv的引物优化:
根据ncbi公布的pedv基因序列的差异,本发明还设计了用于扩增pedv的特异性引物l5、l6,该引物预期扩增产物为292bp,引物l5、l6的具体序列如下:
l5:5ˊ-tgcatgggctagctttcaggtcaat-3ˊ(seqidno.5),
l6:5ˊ-gacttacctgtacgccagtagc-3ˊ(seqidno.6)。
采用引物l5、l6,分别在51-59℃的退火温度下对pedv进行pcr扩增,扩增结果见图7。由图7可以看出,采用引物l5、l6在51-59℃的退火温度下对pedv进行pcr扩增均无目的条带,表明引物l5和l6无法实现对pedv的pcr检测。
本发明还设计了用于扩增pedv的特异性引物l7、l8,该引物预期扩增产物为496bp,引物l7、l8的具体序列如下:
l7:5ˊ-cttagaaactggaatttcac-3ˊ(seqidno.7),
l8:5ˊ-agacaattgttgtagtggccttg-3ˊ(seqidno.8)。
采用引物l7、l8,分别在51-60℃的退火温度下对pedv进行pcr扩增,扩增结果见图8。由图8可以看出,退火温度为52℃时扩增出了目的条带(496bp),但与猪星状病毒的退火温度不一致,无法与pastv实现一个pcr反应扩增两条目的条带,检测两种病毒的方法。
2)、pastv的引物优化:
根据ncbi公布的pastv基因序列的差异,本发明还设计了用于扩增pastv的特异性引物l9、l10,该引物预期扩增产物为453bp,引物l9、l10的具体序列如下:
l9:5ˊ-gggatttacatccaaggttgatt-3ˊ(seqidno.9),
l10:5ˊ-agtgcaaggattgaaa-3ˊ(seqidno.10)。
采用引物l9、l10,分别在51-59℃的退火温度下对pastv进行pcr扩增,扩增结果见图9。由图9可以看出,采用引物l9、l10在51-59℃的退火温度下对pastv进行pcr扩增均无目的条带,表明引物l9和l10无法实现对pastv的pcr检测。
本发明还设计了用于扩增pastv的特异性引物l11、l12,该引物预期扩增产物为180bp,引物l11、l12的具体序列如下:
l11:5ˊ-aggctacaagccggtgaga-3ˊ(seqidno.11),
l12:5ˊ-cataagttacccattcatt-3ˊ(seqidno.12)。
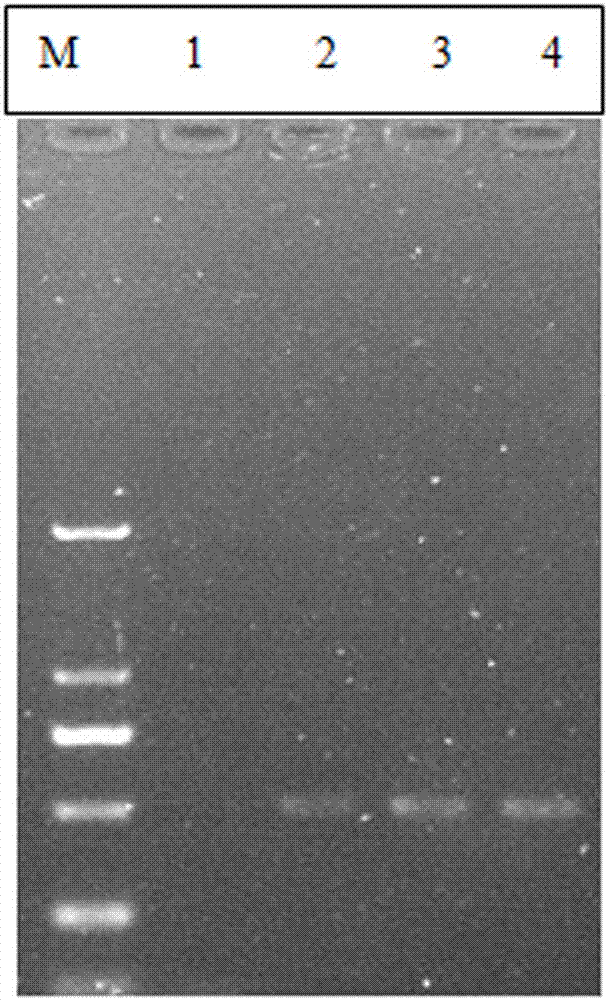
采用引物l11、l12,分别在51-59℃的退火温度下对pastv进行pcr扩增,扩增结果见图10。由图10可以看出,退火温度为51℃时扩增出了目的条带(180bp),但与pedv的退火温度不一致,无法与pedv实现一个pcr反应扩增两条目的条带,检测两种病毒的方法。
经过上述对pcr反应体系中的引物浓度、退火温度、pcr循环次数和引物的优化,得到用于检测pedv和pastv的多重pcr扩增的反应体系为(50μl):10×pcr扩增缓冲液5.0μl,2.5mmol/l的dntp8.0μl,10mmol/l的上游引物l1、下游引物l2、上游引物l3、下游引物l4各1.0μl,cdna模板3.0μl,5u/μl的taqdna聚合酶1.0μl,无菌双蒸水补至50.0μl。多重pcr扩增的反应条件为:95℃预变性5min;94℃30s,56℃30s,72℃60s,共33个循环;72℃10min。
分别以pedv的cdna、pastv的cdna、pedv+pastv的混合cdna为模板,采用优化后的pcr反应体系和反应条件进行pcr扩增反应,并对pcr产物进行琼脂糖凝胶电泳分析。结果如图11所示,其中,泳道1为pedv的cdna,泳道2为pastv的cdna,泳道3为pedv+pastv的混合cdna,泳道1扩增出了一条目的条带,泳道2扩增出了一条目的条带,泳道3扩增出了两条目的条带,分别将泳道1、2和3的目的条带进行回收、测序。经过测序发现,泳道1、2、3中的目的条带的序列与预期扩增的序列相符。由此也说明,本发明的多重pcr方法能够对猪流行性腹泻病毒和猪星状病毒进行有效检测。
本发明用于检测猪流行性腹泻病毒和猪星状病毒的试剂盒包括上述检测方法中所用的病毒rna提取试剂、反转录试剂、pcr扩增试剂。
实施例2:特异性检验
利用本发明实施例1构建的猪流行性腹泻病毒(pedv)和猪星状病毒(pastv)的多重pcr检测方法验证本发明引物组的特异性,具体方法如下:
按照实施例1中步骤2所述的方法分别提取猪蓝耳病病毒、猪瘟病毒、猪副流感病毒、猪轮状病毒、猪传染性胃肠炎病毒的rna,然后按照实施例1中步骤3所述的方法分别进行反转录,得到各个病毒的cdna,备用。分别提取猪圆环病毒、猪伪狂犬病病毒、猪细小病毒的dna,备用。
分别以猪圆环病毒的dna、猪伪狂犬病病毒的dna、猪细小病毒的dna、猪蓝耳病病毒的cdna、猪瘟病毒的cdna、猪副流感病毒的cdna、猪轮状病毒的cdna、猪传染性胃肠炎病毒的cdna为模板,按照实施例1中步骤4所述的优化后的pcr扩增反应体系和反应条件进行pcr扩增,其扩增结果如图12所示。由图12可知,只有以猪流性腹泻病毒cdna和猪星状病毒cdna为模板扩增得到了目的条带(目的条带的大小为508bp和414bp),其他均未扩增出条带。由此说明,本发明设计的用于检测猪流行性腹泻病毒和猪星状病毒的引物组具有较好的特异性,能够对猪流行性腹泻病毒和猪星状病毒进行特异性扩增。
实施例3:敏感性检验
(1)对猪流行性腹泻病毒的cdna(浓度为2.0ng/μl)进行10倍梯度稀释,分别得到浓度为2.0×10-1ng/μl、2.0×10-2ng/μl、2.0×10-3ng/μl、2.0×10-4ng/μl、2.0×10-5ng/μl的猪流行性腹泻病毒的cdna,然后分别以稀释后的各浓度梯度的cdna为模板,按照实施例1中步骤4所述的优化后的pcr扩增反应体系和反应条件进行pcr扩增,扩增结果如图13所示。由图13可知,猪流行性腹泻病毒的cdna浓度为2.0×10-4ng/μl时仍旧能够扩增出目的条带。目前现有的pedv检测引物对pedv的最低检测浓度为0.1μg/μlcdna,因此,本发明设计的引物组对猪流行性腹泻病毒的扩增灵敏度要远高于现有的检测引物。
(2)对猪星状病毒的cdna(浓度为2.5×10-1ng/μl)进行10倍梯度稀释,分别得到浓度为2.5×10-1ng/μl、2.5×10-2ng/μl、2.5×10-3ng/μl、2.5×10-4ng/μl、2.5×10-5ng/μl、2.5×10-6ng/μl的猪星状病毒的cdna,然后分别以稀释后的各浓度梯度的cdna为模板,按照实施例1中步骤4所述的优化后的pcr扩增反应体系和反应条件进行pcr扩增,扩增结果如图14所示。由图14可知,猪星状病毒的cdna浓度为2.5×10-4ng/μl时仍旧能够扩增出目的条带。
实施例4:重复性检验
利用本发明实施例1构建的猪流行性腹泻病毒(pedv)和猪星状病毒(pastv)的多重pcr检测方法对同一样品进行3次检测,每次检测间隔一个月,3次检测都能获得相同的检测结果,由此说明本发明建立的多重pcr检测方法重复性好,检测结果稳定。
实施例5:临床样本检测
收集10份来自临床的病死猪的粪便和肠道组织样品,向肠道组织(用剪刀适当剪碎)或粪便样本中加入适量生理盐水,冻融3次,取上清提取rna并反转录成cdna(rna提取及cdna合成的方法同实施例1),-20℃保存备用。
以反转录得到的10个临床样品的cdna为模板进行,以实施例1中步骤4所述的优化后的pcr扩增反应体系和反应条件进行pcr扩增,其扩增结果如图15所示。由图15可知,10份送检的临床样品中有7份为pedv阳性,有2份为pastv阳性,该检测结果与采用现有技术检测的结果的符合率为100%。
以上所述仅为本发明的较佳实施例而已,但不仅限于上述实例,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110>河南省农业科学院畜牧兽医研究所
<120>一种用于检测猪流行性腹泻病毒和猪星状病毒的引物组和试剂盒
<160>12
<170>siposequencelisting1.0
<210>1
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>1
caacaccttagaaactggaatttcacatg29
<210>2
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>2
ccactacaacaattgtctacggac24
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
cagctgtcaactctggcaac20
<210>4
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>4
ctggagcaaaatggtcctggc21
<210>5
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>5
tgcatgggctagctttcaggtcaat25
<210>6
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>6
gacttacctgtacgccagtagc22
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>7
cttagaaactggaatttcac20
<210>8
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>8
agacaattgttgtagtggccttg23
<210>9
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>9
gggatttacatccaaggttgatt23
<210>10
<211>16
<212>dna
<213>人工序列(artificialsequence)
<400>10
agtgcaaggattgaaa16
<210>11
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>11
aggctacaagccggtgaga19
<210>12
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>12
cataagttacccattcatt19
- 还没有人留言评论。精彩留言会获得点赞!