双重LAMP同时检测志贺氏菌和单核细胞增生李斯特氏菌用引物组、试剂、试剂盒及方法与流程
本发明公开涉及环介导等温扩增技术的领域,尤其涉及双重lamp同时检测志贺氏菌和单核细胞增生李斯特氏菌用引物组、试剂、试剂盒及方法。
背景技术
目前,国内外应用于检测食品中致病菌的技术主要有传统国家标准检测方法、pcr方法、荧光定量pcr和多重pcr检测方法。
随着市场经济的发展,肉制品的生产与消费一直保持持续发展的势态,进出口肉制品的需求量更是不断增加,但是某些肉制品中常见的志贺氏菌和单核细胞增生李斯特氏菌采用传统培养方法,每个致病菌均需要应用独立的检测方法,单独进行检测,不仅工作量大,检测周期长,而且受到检测人员的专业、经验等多种因素限制,容易出现误判。目前所采用的pcr方法、荧光定量pcr方法和多重pcr检测方法,虽可提高检测效率,但对仪器设备要求较高,成本高,无法在大范围内推广使用。
技术实现要素:
鉴于此,本发明公开提供了一种双重lamp同时检测志贺氏菌和单核细胞增生李斯特氏菌用引物组、试剂、试剂盒及方法,以至少解决以往的检测方法无法实现上述菌种的同时检出,检测周期长,误判率高等问题。
本发明一方面提供了一种双重lamp同时检测志贺氏菌和单核细胞增生李斯特氏菌用引物组,所述引物组包括:志贺氏菌引物序列集以及单核细胞增生李斯特氏菌引物序列集;
所述志贺氏菌引物序列集包括:外引物ipah-f3、外引物ipah-b3、内引物ipah-fip以及内引物ipah-bip;
所述外引物f3具有seqno.1序列;
所述外引物b3具有seqno.2序列;
所述内引物fip具有seqno.3序列;
所述内引物bip具有seqno.4序列;
所述单核细胞增生李斯特氏菌引物序列集包括:外引物hlya-f3、外引物hlya-b3、内引物hlya-fip以及内引物hlya-bip;
所述外引物f3具有seqno.5序列;
所述外引物b3具有seqno.6序列;
所述内引物fip具有seqno.7序列;
所述内引物bip具有seqno.8序列。
本发明还提供了一种双重lamp同时检测志贺氏菌和单核细胞增生李斯特氏菌用试剂,所述试剂含有上述的引物组。
本发明同时还提供了一种双重lamp同时检测志贺氏菌和单核细胞增生李斯特氏菌用试剂盒,所述试剂盒含有上述的引物组或上述的试剂。
优选,所述双重lamp同时检测志贺氏菌和单核细胞增生李斯特氏菌用试剂盒,还含有反应缓冲液、bstdna聚合酶、去离子水、阳性对照品以及阴性对照品。
进一步优选,所述阳性对照品为志贺氏菌dna模版以及单核细胞增生李斯特氏菌dna模版。
进一步优选,所述阴性对照品为非志贺氏菌和单核细胞增生李斯特氏菌因组dna。
本发明另一方面还提供了一种双重lamp同时检测志贺氏菌和单核细胞增生李斯特氏菌的方法,所述方法采用上述试剂盒进行检测,包括如下步骤:
1)提取待检样品基因组dna;
2)以所提取的dna作为模板,加入引物组、反应缓冲液、bstdna聚合酶以及去离子水进行lamp反应,并记录扩增结果,其中,反应温度为63℃,反应时间60min;
3)设置阳性对照和阴性对照,其中,阳性对照以志贺氏菌和单核细胞增生李斯特氏菌基因组dna为模板,按照步骤2)所述条件,进行lamp检测,记录扩增结果,阴性对照以非志贺氏菌和单核细胞增生李斯特氏菌因组dna为模板,按照步骤2)所述条件,进行lamp检测,记录扩增结果;
4)若步骤2)中的扩增结果显示为无扩增现象,且阳性对照的扩增结果显有扩增现象,而阴性对照的扩增结果显示无扩增现象,则判定待检测样品中未检出志贺氏菌和单核细胞增生李斯特氏菌;若步骤2)中的扩增结果显示为有扩增现象,且阳性对照的扩增结果显有扩增现象,而阴性对照的扩增结果显示无扩增现象,则判定待检测样品中检出志贺氏菌和单核细胞增生李斯特氏菌。
本发明通过独特的引物设计,可以实现志贺氏菌和单核细胞增生李斯特氏菌的同时检出,检测周期短,检测速度快。本发明采用的环介导等温扩增技术(loop-mediatedisothermalamplification,lamp)是一种新型的恒温核酸扩增技术,由于其独特的核酸扩增机制,产物在琼脂糖凝胶电泳上会呈现出lamp反应典型的阶梯状条带,同时,核酸大量生成时,从dntps中析出的焦磷酸根离子与反应体系中的mg2+结合,产生肉眼可见的扩增反应副产物——白色焦磷酸镁沉淀,因此lamp扩增结果不但观察方式多样,且结果鉴定简便,误判率低,非常适合高通量的快速检测。具有如下优点:1、检测周期短,作为致病菌初筛方法可以缩短时间,降低成本,加快通关速度,提高工作效率;2、检测设备体积小,方便携带;3、灵敏度较高,同时扩增。
附图说明
此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本发明的实施例,并与说明书一起用于解释本发明的原理。
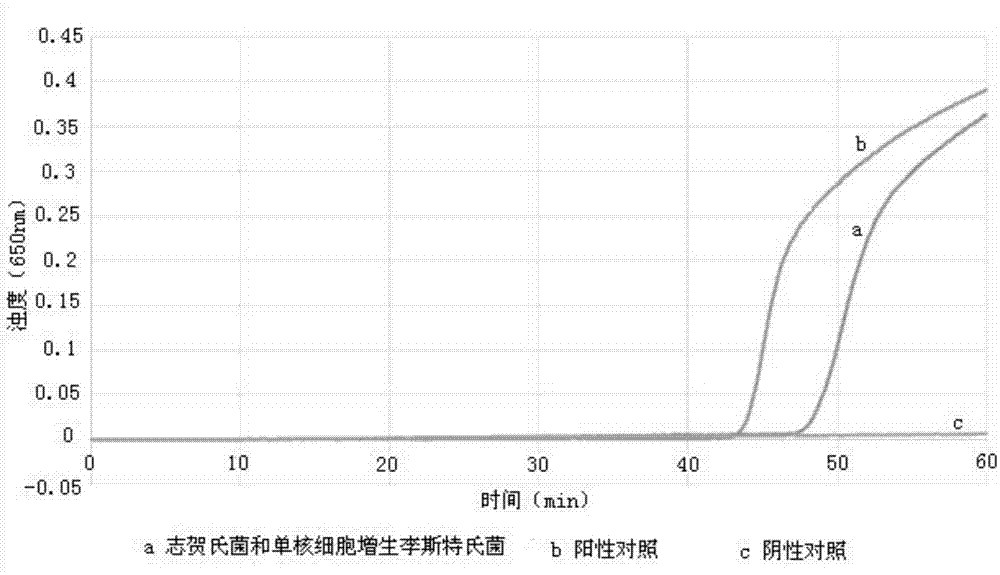
图1为本发明公开实施例在鸡肉样品中检测志贺氏菌和单核细胞增生李斯特氏菌的lamp扩增图;
图2为本发明实施例中关于灵敏性检测时的lamp扩增图;
图3为本发明实施例中关于特异性检测时的lamp扩增图;
图4为本发明实施例中关于重复性检测时的lamp扩增图。
具体实施方式
下面以具体的案例对本发明进行进一步解释,但并不用于限制本发明的保护范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用产品均为市购。
下面结合具体的实施例对本发明的检测过程进行进一步的详细说明,具体如下:
1、引物设计
选择志贺氏菌的ipah基因(genbank:m32063.1)和单核细胞增生李斯特氏菌的hlya基因(genbank:dq812517.1)作为靶序列,通过primerexplorev4在线设计软件分别设计志贺氏菌引物序列集以及单核细胞增生李斯特氏菌引物序列集,具体如下表:
2、样品dna的提取与纯化
将增菌的营养肉汤,直接取1ml加到1.5ml无菌离心管中,8000rpm离心4min,尽量吸弃上清;加入750μldna提取液,沸水浴5min,加酚:三氯甲烷(1:1,体积比)700μl,振荡混匀,13000rpm离心5min,移取上清液,加入0.6倍体积的异丙醇沉淀核酸,13000rpm离心10min,弃去上清,用1ml70%乙醇洗涤沉淀一次,13000rpm离心10min,弃去上清,沉淀溶于20μl核酸溶解液中。保存在-20℃备用。-70℃可长期保存。也可使用等效的商业化的dna提取试剂盒并按其说明提取制备模板dna。
3、建立lamp反应扩增体系
lamp反应体系为25μl:反应缓冲液12.5μl、志贺氏菌和单核细胞增生李斯特氏菌内引物fip各0.5μl(40μmol/l)、内引物bip各0.5μl(40μmol/l)、外引物f3各0.5μl(5μmol/l)、外引物b3各0.5μl(5μmol/l)、bstdna聚合酶1μl、去离子水5.5μl、志贺氏菌和单核细胞增生李斯特氏菌dna模版各1μl,阴性对照为2μl去离子水。使用脱氧核糖核酸扩增试剂盒(lamp法)在浊度仪la-320上进行lamp扩增试验,63℃反应60min,记录扩增结果,反应结束后80℃灭活5min。
4、确定质量控制指标
阳性对照以志贺氏菌和单核细胞增生李斯特氏菌基因组dna为模板,按照3所述条件,进行lamp检测,记录扩增结果;阴性对照以非志贺氏菌和单核细胞增生李斯特氏菌因组dna为模板,按照3所述条件,进行lamp检测,记录扩增结果。
5、结果判定
若待测样品的扩增结果显示为无扩增现象,且阳性对照的扩增结果显有扩增现象,而阴性对照的扩增结果显示无扩增现象,则判定待检测样品中未检出志贺氏菌和单核细胞增生李斯特氏菌;若待测样品的扩增结果显示为有扩增现象,且阳性对照的扩增结果显有扩增现象,而阴性对照的扩增结果显示无扩增现象,则判定待检测样品中检出志贺氏菌和单核细胞增生李斯特氏菌。
6、样本检测以及结果验证
将志贺氏菌(atcc12022)和单核细胞增生李斯特氏菌(cmcc54002)分别接种于营养肉汤培养液,36℃培养过夜,将培养液分别离心,弃去上清液后,加入生理盐水反复离心洗涤3次,再加入生理盐水重新悬浮,并调整菌悬液浓度,均匀混合于鸡肉加工样品,使样品中的污染量达到103/ml(g)。将模拟样品分别以两种方法检测。方法一:分别取25g鸡肉加工样品加入225ml的bpw增菌液中,36℃培养12h后,应用试剂盒提取培养液中细菌dna,并以此为模板,采用双重lamp方法进行检测;方法二:将鸡肉加工样品按照相关国家标准的方法进行定性检测,并对两组检测结果进行比对。
按照上述检测过程,将鸡肉加工品提取dna后,进行lamp检测,其中,对应的lamp扩增曲线见图1,显示有扩增现象,且阳性对照的扩增结果显有扩增现象,而阴性对照的扩增结果显示无扩增现象,具体也见图1,因此,判定该鸡肉加工品种检出志贺氏菌和单核细胞增生李斯特氏菌。
同时采用gb4789.5-2012和gb4789.30-2016国标方法分别检测鸡肉加工样品,结果检出志贺氏菌和单核细胞增生李斯特氏菌,与双重lamp检测方法结果一致。
7、灵敏性检测
将志贺氏菌和单核细胞增生李斯特氏菌的混合dna模板并进行10倍梯度稀释。为了评价双重lamp检测方法的灵敏性,对混合菌dna模版进行双重lamp扩增反应。结果显示:双重lamp检测方法灵敏度较高,能达到7.27pg/ul,具体见图2。
8、特异性检测
应用3中反应体系对提取的所有细菌基因组进行检测,检验双重lamp方法的特异性。将23株供试菌株(包括4株志贺氏菌、1株单核细胞增生李斯特氏菌,涉及斯氏李斯特氏菌等18株非目标菌株)的培养液经细菌提取制得dna模板,进行双重lamp扩增,扩增结果表明:除志贺氏菌和单核细胞增生李斯特氏菌扩增结果呈现阳性,其余菌株均为阴性,证明该双重lamp检测方法特异性良好,具体见图3。
9、重复性检测
将上述实施例中的鸡肉样品重复6次检测,结果均为阳性,具体参见图4。
上述实施例采用双重lamp检测方法可以定性分析肉制品中是否含有志贺氏菌和单核细胞增生李斯特氏菌,发挥了lamp检测技术的优点,进一步完善了肉制品中食源性致病菌的检测体系,加大对消费者利益的保护力度,但因该双重lamp检测同时扩增判定是否检出,不能同时区分两种致病菌,如有阳性需要用单一lamp或pcr方法分别扩增判定。
本领域技术人员在考虑说明书及实践这里公开的发明后,将容易想到本发明的其它实施方案。本申请旨在涵盖本发明的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本发明的一般性原理并包括本发明未公开的本技术领域中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的,本发明的真正范围和精神由下面的权利要求指出。
应当理解的是,本发明并不局限于上面已经描述的内容,可以在不脱离其范围进行各种修改和改变。本发明的范围仅由所附的权利要求来限制。
序列表
<110>沈阳出入境检验检疫局检验检疫综合技术中心
<120>双重lamp同时检测志贺氏菌和单核细胞增生李斯特氏菌用引物组、试剂、试剂盒及方法
<130>2018
<160>8
<170>siposequencelisting1.0
<210>1
<211>18
<212>dna
<213>人工序列()
<400>1
ataccgtctctgcacgca18
<210>2
<211>18
<212>dna
<213>人工序列()
<400>2
tgatggaccaggagggtt18
<210>3
<211>40
<212>dna
<213>人工序列()
<400>3
aagctccgcagaggcactgatacctccggattccgtgaac40
<210>4
<211>41
<212>dna
<213>人工序列()
<400>4
gcagtctttcgctgttgctgcccggagattgttccatgtga41
<210>5
<211>19
<212>dna
<213>人工序列()
<400>5
cgatcactctggaggatac19
<210>6
<211>19
<212>dna
<213>人工序列()
<400>6
aagctaaaccagtgcattc19
<210>7
<211>47
<212>dna
<213>人工序列()
<400>7
tgaacaatttcgttaccttcaggatgttgctcaattcaacatctctt47
<210>8
<211>49
<212>dna
<213>人工序列()
<400>8
ggagcgaaaacaataaaagtaagctgcgtaaacattaatatttcttgcg49
- 还没有人留言评论。精彩留言会获得点赞!