一种包载蛋白的外泌体的制备方法与应用与流程
本发明属于生物技术领域,特别涉及一种包载蛋白的外泌体的制备方法与应用。
背景技术:
传统药物,无论是化学药物还是中药,往往存在水溶性差、易被人体快速清除、生物相容性差、体内分布不理想和向细胞渗透能力低等缺陷,而生物药物如蛋白质药物也存在易降解,不稳定的问题。因而人们研制了不同的药物投递系统以解决以上问题,例如脂质体等纳米颗粒。然而,这些化学合成的包载颗粒存在许多问题,其中最重要的一点是,可能会引起很强的免疫反应。
1981年,trams等在透射电镜下发现了一组比多泡体还要小的、直径在40~1000nm的囊泡样物质。1987年,johnstone等命名这种膜泡为外泌体(exosomes),其产生的主要过程,可概括为:(1)细胞质膜凹陷形成细胞内小泡;(2)细胞内小泡进一步发展形成多泡小体;(3)多泡小体与细胞质膜融合释放外泌体,受体细胞对外泌体的接收可以通过配体-受体相互作用、胞饮/吞噬或膜融合来实现。从其产生过程可以看出,外泌体是细胞膜成分的囊泡,内里可以携带诸如rna,蛋白质等大量成分。这也使得人们产生了将这种细胞天然产生的外泌体作为药物包载系统的想法。
外泌体作为药物载体进行药物运输有独特的优势,主要体现在:(1)当使用自源外泌体时,外泌体引起的有害免疫反应极低;(2)外泌体在人血液中的稳定性好;(3)向细胞转运“货物”的效率高;(4)外泌体运载药物时具有一定的靶向性;(5)外泌体直径在40~100nm之间,因此可以很好地利用增强渗透滞留(epr)效应,有选择性地渗入到肿瘤或者炎症组织部位。目前已经尝试用外泌体携带sirna,化学小分子药物等进行基因治疗和肿瘤治疗等研究。然而对于大分子蛋白质药物,用现在常用的电穿孔,转染,孵育等包载药物的手段则非常困难。
因此,如何高效地获得包载蛋白的外泌体亟待研究突破。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供一种包载蛋白的外泌体的制备方法。
本发明的另一目的在于提供所述的包载蛋白的外泌体的制备方法的应用。
本发明的目的通过下述技术方案实现:
一种包载蛋白的外泌体的制备方法,包括如下步骤:
(1)构建含有外源目的蛋白基因片段的重组表达载体,
(2)将所述的重组表达载体转染细胞进行表达,培养转染后的细胞,使细胞分泌载有所述外源目标蛋白的外泌体;
①当所述的表达为瞬时表达时,具体步骤为:
a.细胞的培养:将培养至对数生长期的细胞以细胞接种后最终浓度为4×105~6×105个/ml接种到培养基中,在36~38℃,3~7%co2,转速160~200rpm下于tubespin管振荡悬浮培养60~84h,扩增到1l培养摇瓶中细胞活率维持在90%左右;
b.将所述的重组表达载体转染细胞,转染后的细胞在36~38℃,4~8%co2,转速160~200rpm下悬浮培养,当细胞活率低于30%终收样;
②当所述的表达为稳定表达时,具体步骤为:
a.将所述的重组表达载体转染细胞,培养当天细胞活率大于90%在克隆培养基中培养,在第12~14天用elisa方法测定蛋白表达情况,选出表达量高的克隆扩增至12孔板;在第12~14天再次用elisa方法测定蛋白表达情况,筛选出高表达克隆到tubespin管培养,得到表达量高的稳定表达细胞;
b.表达量高的稳定表达细胞的大规模培养:将培养至对数生长期的细胞以细胞接种后最终浓度为4×105~6×105个/ml接种到培养基中,在36~38℃,3~7%co2,转速160~200rpm下于tubespin管振荡悬浮培养60~84h,扩增到1l培养摇瓶中,培养60~84h后转移到5l发酵罐中,培养60~84h后转移到20l发酵罐中,培养60~84h后转移到200l发酵罐中;通过所述的大规模培养,培养15~18天,细胞活率可以维持在80%左右,细胞最高密度可以达到1.0~3.0×107个/ml;
(3)从细胞培养上清分离得到所述的外泌体。
所述的细胞优选为cho细胞或者hek293f细胞中的至少一种。
当所述的细胞为cho细胞,所述的培养基优选为lonza公司的procho5培养基;当所述的细胞为hek293f细胞时,所述的培养基优选为sigma公司的
所述的表达载体优选为pcdnatm3.4。
本发明的制备方法可适用于多种外源目标蛋白;所述的外源目标蛋白可以根据需要进行选择,例如her2抗体、重组融合蛋白tnfr-fc等等。
所述的分离优选为通过超速离心方法或外泌体提取试剂盒从所述的细胞培养上清中分离得到所述的外泌体。
所述的超速离心方法的具体步骤优选为:
(1)300g离心细胞培养上清10min,2000g离心细胞培养上清10~20min,弃沉淀留取第一上清液,以去除细胞;
(2)第一上清液10000g离心30min,弃沉淀留取第二上清液,以去除亚细胞成分;
(3)第二上清液100000g离心70~90min,弃掉上清液,留取第一沉淀物,所述的沉淀为外泌体和一些可溶性蛋白;
(4)用pbs溶液重新悬浮步骤(3)得到的第一沉淀物,混匀后再以100000g离心70~90min,以洗去可溶性蛋白,洗涤沉淀后得到所述的外泌体;
步骤(1)~(4)均在4℃下进行。
所述的包载蛋白的外泌体的制备方法在基因、蛋白或药物的递送系统的应用。
一种外泌体,通过所述的制备方法制备得到。
所述的外泌体的粒径为40~200nm。
本发明相对于现有技术具有如下的优点及效果:
1.本发明采用重组表达外源目的蛋白的方法,包括蛋白的瞬时表达和稳定表达,通过工程化大规模培养细胞的手段,获得大量包含该外源目的蛋白的外泌体。
本发明采用悬浮培养的cho细胞或者hek293f细胞作为表达重组蛋白最主要的表达系统,培养技术已经十分成熟,可以达到107~108个/ml的细胞密度,重组蛋白表达量可以超过10g/l,规模可达到2000l以上。但目前该种培养技术都是用于蛋白表达,还尚未见用于外泌体的生产的。本发明通过培养工艺的优化,提高外泌体的产量,培养不需要添加血清,免除了外泌体提取过程中血清囊泡的污染,可通过规模培养cho细胞或者hek细胞来获取大量装载具有生物活性抗体的外泌体,使得外泌体可以产业化。
2.通过本发明制得的外泌体包载了活性蛋白,可以更易于透过组织和细胞膜,以及血脑屏障,到达病灶部位用于肿瘤等疾病的治疗;也可以用于护肤品,更易于透过皮肤。
附图说明
图1为cho细胞培养曲线图。
图2是实施例2重组her2抗体质粒的pcr产物电泳图,其中,泳道1~2为her2抗体重链,3~4为her2抗体轻链。
图3是瞬时表达得到的重组her2抗体蛋白的还原电泳结果图。
图4是cho细胞稳定表达得到的her2抗体蛋白的还原电泳图。
图5是实施例5提取到的外泌体的透射电镜(tem)照片图。
图6是实施例5的nta检测外泌体的粒径结果分析图。
图7是纯化后的外泌体的westernblotting结果图;其中,cd9和cd63是外泌体的marker蛋白,外泌体-抗体是表达了her2抗体的cho细胞所抽取的外泌体;对照外泌体为空白cho细胞所抽取的外泌体。
图8是含有her2抗体的外泌体和her2抗体蛋白抑制肿瘤细胞活性的检测结果图。
图9是重组tnfr-fc质粒的pcr产物电泳图,其中,泳道1为蛋白marker,2~3为阳性克隆。
图10是瞬时表达得到的重组tnfr-fc蛋白的还原电泳结果图。
图11是cho细胞稳定表达得到的tnfr-fc蛋白的还原电泳图。
图12是实施例12的nta检测外泌体的粒径结果分析图。
图13是纯化后的外泌体的westernblotting结果图;其中,cd63是外泌体的marker蛋白,外泌体-tnfr-fc是表达了tnfr-fc的cho细胞所抽取的外泌体;空白外泌体为空白cho细胞所抽取的外泌体。
图14是含有tnfr-fc的外泌体和tnfr-fc纯蛋白抑制细胞活性的检测结果图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1细胞的大规模培养
采用工业生产重组蛋白所用的cho细胞(购自invitrogen公司),进行培养,规模从实验室的规模到工业生产规模。
实验方法:从液氮罐中取出细胞冻存管,于37℃温水中快速水平摇动使细胞解冻(约2min),将细胞转移至tubespin管(购自沙多利斯公司)中,加入5ml新鲜procho5培养基(购自lonza公司),混匀,1000rpm×5min离心细胞,弃上清,用10ml新鲜procho5培养基重悬细胞,台盼蓝染色后用显微镜观察,计算细胞密度和细胞活率。37℃,5%co2,180rpm,饱和湿度的条件下振荡悬浮培养。cho细胞在其对数生长期时以0.5×106个/ml的密度接种于procho5培养基中。采用一次性tubespin旋转管于37℃,5%co2,180rpm,饱和湿度的条件下振荡悬浮培养72h扩增到1l培养摇瓶中,培养72h后转移到5l发酵罐中,培养72h后转移到20l发酵罐中,培养72h后转移到200l发酵罐中。
除了将procho5培养基替换为
结果如图1所示,cho细胞在反应器中经过培养15~18天,细胞活率可以维持在80%左右,细胞最高密度可以达到1.0~3.0×107个/ml。
实施例2重组her2抗体质粒构建
以her2抗体为模式蛋白,在细胞中瞬时表达。
1.序列信息
(1)her2抗体基因信息
轻链的核苷酸序列:
gacatccagatgacgcagtcgccgtcctcattgagcgcatccgtgggagacagagtcactattacatgccgggcatcccaagacgtaaacacggccgtcgcctggtaccaacagaagcccggaaaagcgcccaaactgttgatctactccgcctcatttctgtacagcggggtaccctcgaggttcagcggctcgaggagcgggacggatttcacgttgacaatttcgtcacttcagccggaagattttgcgacatactattgccagcaacactataccacacccccgacgtttggccaggggaccaaagtcgagatcaagcggaccgtggccgctccgtcagtattcatcttcccgccgtccgatgagcaactcaagagcggaaccgcatcagtcgtatgcttgctcaataacttctatccgcgagaggcgaaggtgcagtggaaagtggacaacgccctgcagtccggtaatagccaggaatcagtcacggagcaggattcaaaggattcgacctattccctctcgtcgacattgacgctgtcgaaagcagactacgaaaaacataaagtgtacgcttgtgaagtgacacaccagggcctttcatccccggtgacaaagtcgttcaatcgcggggagtgt;
重链的核苷酸序列:
gaggtgcagcttgtcgaatccgggggagggctcgtccaacccggaggatcactgcgcctttcatgcgcagcctcgggtttcaatatcaaggacacgtatatccattgggtgcggcaggcgccaggaaaaggtttggagtgggtcgcgaggatctaccccaccaatgggtacacacgatacgccgattcggtcaaggggcggttcacaatctcggcggacacgtcgaaaaacactgcgtacttgcagatgaatagcctccgcgcagaagatactgcggtgtattactgctcccgctggggaggtgatggcttctatgcgatggactattggggacaaggaacacttgtaacggtcagctcggccagcaccaaggggccgtccgtgtttcccctcgccccctcgtcgaagtcaactagcggcggaacagccgcccttggttgcctggtcaaggactacttccccgaaccggtcacggtgtcatggaactcgggagcattgacttcgggtgtgcatacatttcccgcagtgctccagtcatcaggactgtatagcctctcgtccgtcgtaacggtcccgtcatcgtcgctcgggacccagacatacatttgcaatgtcaaccacaaaccttcgaatacaaaggtggataagaaggtcgagccgaagtcgtgtgacaagacgcacacatgtcctccatgccctgcgcctgagttgctgggagggccgagcgtgttcctctttcctcccaagccgaaggacacactgatgatttcgaggacgcctgaggtaacttgcgtggtagtagatgtgtcccatgaggaccccgaagtaaagtttaactggtatgtggacggtgtggaggtccacaatgccaaaaccaaaccgcgcgaagagcaatacaacagcacatatcgggtggtgagcgtgctcaccgtcttgcaccaggactggctgaacgggaaagagtacaaatgtaaagtatcaaacaaagcgctccccgcacccattgaaaagactatctcaaaggctaagggacagcccagagagccacaagtctacacgctcccgccctcgagagatgagttgacgaagaatcaggtcagccttacgtgcctcgtcaaagggttttacccatccgacattgcggtggaatgggaaagcaacggacagccagagaacaactacaagactacaccgcctgtgctggactcggatggttcgttcttcctctactcgaaattgactgtggacaaatcccgctggcagcagggaaatgtgttctcgtgtagcgtaatgcatgaagcgttgcacaatcactatacccagaaatcgctctccctttcgcctggc;
(2)引物信息
重链引物:
hc-forwardprimer:
gacggatccgccatggagttctggttgtcatgggtctttctggtagc
hc-reverseprimer:
gacggatcctcattagccaggcgaaagggagagcgatttctgggta
轻链引物:
lc-forwardprimer:
gacggatccgccatggatatgcgagtacccgcacaacttcttgggct
lc-reverseprimer:
gacggatcctcattaacactccccgcgattgaacgactttgtcaccg
目的基因片段的获得(primerstarhsdnapolymerase)反应体系和反应条件如下:
表1目的基因pcr扩增体系
表2目的基因pcr扩增反应条件
上述pcr产物经qiaquickpcrpurification试剂盒(购自qiagen公司)回收纯化,分别获得1450bp和750bp的两个pcr产物。使用限制性的内切酶kpni,thermoscientific(购自thermo公司)和xhoi(购自thermo公司)酶切表达载体pcdnatm3.4(购自invitrogen公司)和重链和轻链目的基因,分别用t4dna连接酶(购自fermentas公司)连接质粒和重链和轻链两个目的基因构建两个重组质粒。将连接产物转化宿主菌dh5a(购自上海生工生物工程股份有限公司)中,涂布在含有lb固体培养基(含有100mg/l氨苄青霉素)的板上,37℃过夜。
(2)挑选单个菌落接种在5mllb培养液(含有100mg/l氨苄青霉素)中,37℃摇床培养过夜。然后接种1ml过夜菌种至400mllb培养基(含有100mg/l氨苄青霉素)中,挑取阳性克隆进行pcr鉴定。
结果如图2所示,阳性克隆经pcr鉴定为两条带,分别为1450bp的重链和750bp轻链,与我们的预期相一致,说明我们已经成功构建了重组质粒。
实施例3重组her2抗体在动物细胞中的瞬时表达
重组蛋白在cho细胞或hek293f细胞中分别进行瞬时表达,具体步骤如下:
(1)细胞的培养:
a.cho细胞的培养:将培养至对数生长期的cho细胞procho5培养基(购自lonza公司)中,最终浓度为4×105~6×105个/ml,在36~38℃,3~7%co2,转速160~200rpm下于tubespin管振荡悬浮培养60~84h,扩增到1l培养摇瓶中,细胞活率可以维持在90%左右;
b.hek293f细胞的培养:将培养至对数生长期的293f细胞接种到
(2)瞬时表达:细胞培养至对数生长期,取一灭菌的1.5mlep管,按照需要的质粒dna浓度(0.5~2μg/106cells)(重链和轻链的质粒dna浓度比例为1:1,)及转染试剂linear25kdapei(聚乙烯亚胺)(polysciences公司),将两者按照一定比例(dna:pei=1:2~1:3)分别加入ep管中充分混合,静置5~10min;将dna/pei混合液加入浓度2×106~4×106个/ml细胞悬液中,使得最终dna浓度为0.5~2μg/106cells。使细胞和dna/pei复合物充分均匀;37℃,6%co2,180rpm振荡悬浮培养,每天检测活细胞密度和细胞活率,第三天开始隔天收样检测,当细胞活率低于30%终收样。
(3)蛋白质纯化:收取的细胞5000×g离心30min后取上清。使用proteina填料(ge公司)一步纯化。设置流速选择为1ml/min,开始上样,上样完毕后,使用100mm甘氨酸洗脱缓冲液对proteina柱进行洗脱,用50ml离心管对目的洗脱液进行收集,并立即加入适量的1mtris-hcl调节ph进行中和。
(4)纯化后的蛋白sds-page电泳检测:
配置蛋白胶,分离胶和浓缩胶配方如表3所示:
表3电泳胶配置
取样品100℃5min加热变性,加样80v稳压开始进行电泳。
电泳结果如图3所示,还原电泳后,蛋白解离为重链和轻链两条带,分别为50kda和25kda的位置,与抗体预期分子量相一致,说明蛋白在cho细胞或hek293f细胞均表达成功。
实施例4重组her2抗体在细胞中的稳定表达
所述的重组蛋白在cho细胞中进行稳定表达,转染方法同实施例3。
(1)单克隆筛选
配置克隆培养基1000ml(1000mlcd-forti+30ml200mm的谷氨酰胺母液)(购自gbico公司)。
培养当天细胞活率大于92%,细胞先用克隆培养基10倍倍比稀释至1000个细胞每孔备用(120ml克隆培养基),接种15块板,每块板接种60个孔。接种孔板200μl/孔。大约在克隆第13天的时候利用elisa方法测定蛋白表达结果,选出表达量高的细胞克隆扩增到12孔板,同样培养13天后采用elisa方法检测,之后再筛选出高表达克隆到tubespin管培养,最终确定表达量高的细胞克隆。
(2)elisa方法
用包被液将山羊抗人igg(fc)抗体(购自kpl)按1:1000比例稀释,100μl/孔,4℃冰箱包被过夜;pbst(购自thermo)洗1次;用样品稀释液将igg标准品(购自amgen)稀释至浓度梯度:6.25ng/ml、3.125ng/ml、1.5625ng/ml、0.78125ng/ml、0.39063ng/ml、0.19531ng/ml、0.09766ng/ml。每孔加样100μl,37℃孵育1h。
扣干样品液,pbst洗3次;用二抗稀释液将山羊抗人igg(h+l)/ap(购自abcam)抗体按1:1000比例稀释后加入每孔,100μl/孔,37℃放置1h;pbst洗5次;按照100μl/孔加入显色液(购自sigma),37℃避光显色15min。加入3mol/lnaoh(购自panera)终止显色。用酶标仪(购自thermo)进行405nm波长检测。
(3)蛋白的稳定表达:选出克隆后,采用实施例1的方法进行大规模细胞培养,培养10~15天,收集细胞培养上清,进行纯化并电泳检测(同实施例3)。
电泳结果如图4所示,还原电泳后,蛋白解离为重链和轻链两条带,分别为50kda和25kda的位置。
实施例5外泌体抽提与鉴定
1.外泌体抽提:实施例3瞬时表达和实施例4稳定表达蛋白质的培养上清中包含有外泌体,因此首先进行外泌体的抽提。将欲提取的细胞培养上清液,在4℃的环境下,300g10min,2000g20min离心,去除细胞;再用l0000g30min离心,去除亚细胞成分;接着用100000g70min离心,弃掉上清液,最后所得沉淀即为外泌体和一些可溶性蛋白;用pbs溶液重新悬浮沉淀物,混匀后再以100000g70min离心洗去可溶性蛋白,反复洗涤三次,所得沉淀即为外泌体;最后用pbs溶液悬浮沉淀物提纯的外泌体溶液置于-80℃冰箱内保存备用。
2.外泌体粒径分析:nta测定外泌体的粒径与浓度。使用nanosightns300仪器(购自malvern),开机预热机器,首先用超纯水清洗进样管及样品池。等待温度升至设定温度后,取10μl超速离心获得的外泌体,加入到990μl已过膜的pbs中,将样品稀释100倍。将上述1ml外泌体稀释样品用移液枪混匀,使用干净的注射器将待测样品缓慢注入样品池中,主机旋钮调节焦距至可见清晰的“白色亮点”,调节增益进行记录,每次记录30s,单次30s记录完成后注射器缓慢推入少量样品,使得换不同的视野进行测量。每个样品重复检测3次,3次30s视频画面记录完成后,调节亮度至最大值,分辨阈值至画面至蓝色点(假阳性)少于5个/画面,软件分析每个画面中每个外泌体的运动轨迹,根据布朗运动原理自动换算成外泌体的直径大小和浓度,根据稀释比率即可得到原始浓度。
3.透射电镜观察外泌体的形态:将铜网置于一张干净的滤纸片上,取10μl样品(如若样品浓度高,可稀释至合适的倍数以便观察)滴加在铜网上待样品自然风干,然后取5%的磷钨酸染色90s,再用滤纸将液体吸干。整个操作过程在常温下进行,待样品充分晾干后,即可在电镜下观察外泌体的大小、形貌,并拍摄具有代表性的电镜照片。
以从cho细胞稳定表达抗体所提取的外泌体的结果如图5、图6所示,nta检测结果显示其粒径主要分布在0~200nm以内,并且在120nm左右有显著的峰高(见图6),这与图5透射电镜(tem)显示的外泌体大小(scalebar=100nm)相符。实施例3得到的外泌体结果与之相似。
实施例6外泌体中携带重组her2抗体的分析
抽提纯化后的外泌体(以cho细胞稳定表达her2抗体所获得的外泌体为例)进行sds-page电泳(同实施例3),电泳结束后取下电泳胶进行westernblotting的检测,以确定其是否含有重组表达的抗体蛋白。
首先甲醇活化pvdf膜(购自merckmillipore),活化后将其放在转膜液中。按照海绵、滤纸、膜、胶、滤纸、海绵的顺序夹好,将其放在转膜槽中,并在其中放置预冷的冰袋。装配好后将转膜槽放在冰水混合液中,在250ma恒流条件下,转膜60min。将转好的膜,先用tbst(购自sigma)洗一次,去除膜上残留的转膜液。配制5%脱脂牛奶,加入10ml的tbst,震荡混匀后加入到pvdf膜上,在摇床上室温低速封闭30~60min;用tbst洗膜三次,将一抗抗体(抗cd9,cd63和her2抗体的抗体,均购自abcam)用tbst稀释适当倍数后加入膜上。在室温条件下,低速摇5h以上或者在4℃低速摇过夜;然后将pvdf膜用tbst洗3次,加入相对应的羊抗鼠二抗(购自proteintech公司),在室温条件下低速摇60min,继续用tbst洗膜3次,用bio-rad的凝胶成像系统进行显影和拍照。结果用imagej软件进行分析处理。
结果如图7所示,“外泌体-抗体”对应表达了her2抗体的cho细胞所抽取的外泌体,在抗体蛋白的相应位置可以看到明显的条带,说明在外泌体中含有我们所表达的重组抗体蛋白;“对照外泌体”为空白cho细胞所抽取的外泌体。同时使用cd9,cd63的抗体进行显影,这两个蛋白是外泌体的标志性蛋白,同样可以发现其有明显的条带,进一步确认我们所提取的是外泌体。
实施例7携带重组her2抗体外泌体的应用
我们选择重组表达的her2抗体是一个具有抑制肿瘤细胞生长功能的蛋白,我们通过细胞生长实验检测了包含该重组蛋白的外泌体同样可以具有同样的药效功能,这样可以确认携带重组蛋白的外泌体可以作为一个载药系统将药物蛋白传递给靶细胞。
用rpmi1640培养基(10%fbs)(购自gibco)于96孔细胞培养板培养乳腺癌bt-474细胞(购自广州赛库生物技术有限公司),密度1.2×105个/ml,50μl/孔。37℃,5%co2,饱和湿度的条件下培养2h使细胞贴壁。加入用rpmi1640培养基(10%fbs)稀释的纯化后的单克隆抗体(5μg/ml)和含有抗体的外泌体(10%(v/v)),按递次10倍稀释的浓度分别加入细胞培养液中,50μl/孔。继续培养168h,使细胞丰度达到80%以上。加入mtt溶液(购自sigma),20μl/孔,37℃,5%co2,饱和湿度的条件下培养4h。小心移走上清,加入dmso(购自sigma),100μl/孔,37℃避光孵育15min至结晶完全溶解。在570nm的波长测定od值,参考波长为630nm。
结果如图8所示,无论是纯化后的重组抗体还是包含有重组抗体的外泌体都具有抑制肿瘤细胞的活性,说明被包裹进外泌体的蛋白是具有活性的,这说明了外泌体可以作为药物载体携带有活性的药物蛋白进行疾病的治疗。
实施例8重组tnfr-fc质粒构建
构建tnfr-fc重组质粒,在细胞中瞬时表达。
1.序列信息
(1)tnfr-fc的核苷酸序列:
atggcccccgtggccgtgtgggctgccctggccgtgggactggaactgtgggctgctgcccacgccctgcccgcccaggtggccttcaccccctacgcccccgagccaggcagcacctgcaggctgagagagtactacgaccagaccgcccagatgtgctgcagcaagtgctctccaggccagcatgccaaggtgttctgcaccaagaccagcgacaccgtgtgcgacagctgcgaggacagcacctacacccagctgtggaactgggtgcccgagtgcctgagctgtggcagcaggtgctctagcgaccaggtcgagacccaggcctgcaccagagagcagaacaggatctgcacctgcagacccggctggtactgcgccctgagcaagcaggaaggctgcaggctctgcgccccactgaggaagtgcaggcccggcttcggcgtggccagacccggcaccgagacctccgacgtggtgtgcaagccctgcgccccaggcaccttcagcaacaccacctccagcaccgacatctgcaggccccaccagatctgcaacgtggtggctatccccggcaatgccagcatggacgccgtgtgcaccagcacctcccccaccagaagcatggccccaggcgccgtgcacctgccccagcccgtgagcaccaggtcccagcacacccagcccaccccagagcctagcaccgccccctctaccagcttcctgctgcccatgggccccagccctccagccgagggcagcaccggcgacgagcccaagagctgcgacaagacccacacctgccccccctgtcctgctccagaactcctgggcggacccagcgtgttcctgttcccccccaagcccaaggacaccctgatgatcagcaggacccccgaggtgacctgcgtggtggtggacgtgagccacgaggacccacaggtcaagttcaactggtacgtggacggcgtgcaggtgcacaacgccaagaccaagccccgggagcagcagtacaactccacctacagagtggtgtccgtgctgaccgtgctgcaccagaactggctggacggcaaagagtacaagtgcaaggtctccaacaaggccctgccagcccccatcgagaaaaccatcagcaaggccaagggccagcccagggaaccccaggtgtacaccctgccaccctctcgagaggaaatgaccaagaaccaggtgtccctgacctgcctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcaacggccagcccgagaacaactacaagaccacccccccagtgctggacagcgacggcagcttcttcctgtacagcaagctgaccgtggacaagagcagatggcagcagggcaacgtgttcagctgcagcgtgatgcacgaggccctgcacaaccactacacccagaagagcctgagcctgtcccccggcaagtgatga;
(2)引物设计:
forwardprimer:ataaaaggtaccatggcccccgtggccgt
reverseprimer:ataaaaggatcctcatcacttgccgggggac
2.目的基因片段的获得方法同实施例2
图9的电泳结果显示,获得的基因片段同理论值相同,表明已成功构建了重组tnfr-fc质粒。
实施例9重组tnfr-fc在动物细胞中的瞬时表达
重组tnfr-fc在cho细胞或hek293f细胞中分别进行瞬时表达,具体步骤参照实施例3进行。
图10的实验结果显示,还原电泳后,蛋白为一条分子量约为75kd的链,与理论预测值相符,说明蛋白在cho细胞或hek293f细胞中均表达成功。
实施例10重组tnfr-fc在细胞中的稳定表达
所述的重组tnfr-fc在cho细胞中进行稳定表达,转染方法同实施例3。单克隆筛选方法和稳定表达方法同实施例4。
电泳结果如图11所示,还原电泳后,蛋白为一条分子量约为75kd的链,与理论预测值相符。
实施例11外泌体抽提与鉴定
参照实施例5的方法进行外泌体抽提方法和分析。
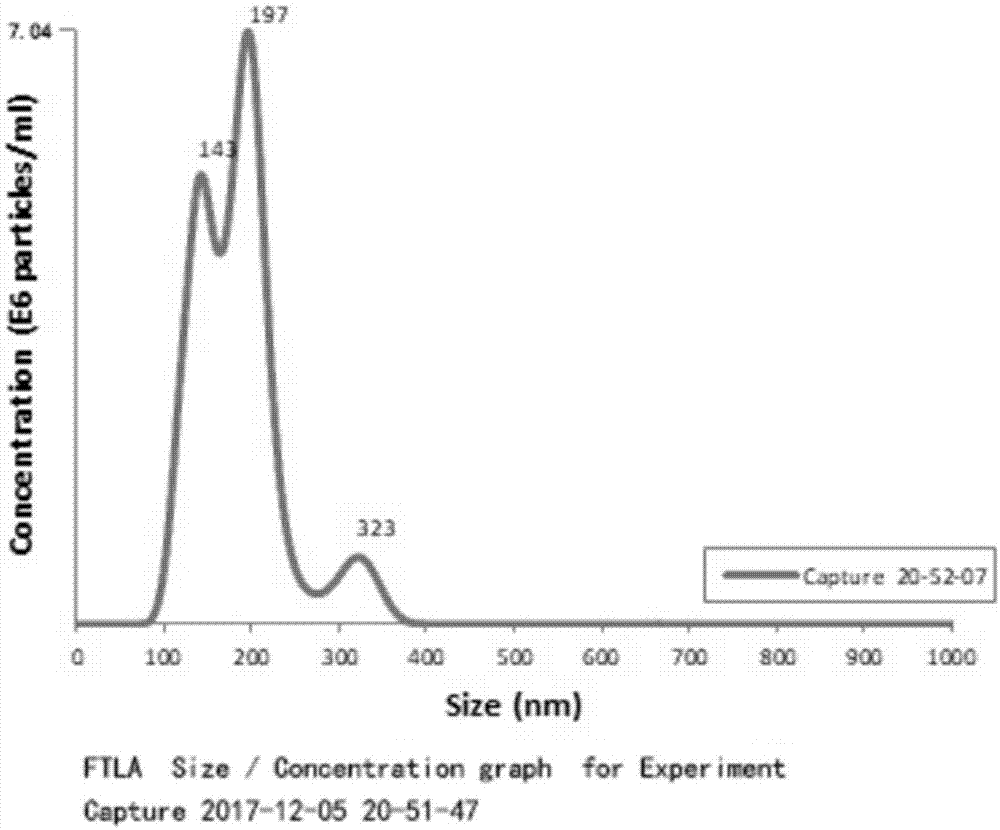
从cho细胞稳定表达抗体所提取的外泌体的结果如图12所示,nta检测结果显示与实施例3、实施例5得到的外泌体相似,本实施例得到的外泌体粒径主要分布在0~200nm以内,并且在143nm、197nm左右有两处显著的峰高,提取的囊泡属于外泌体的粒径范围。
实施例12外泌体中携带重组tnfr-fc的分析
通过实施例6的分析方法对外泌体中携带重组tnfr-fc进行分析。
结果如图13所示,“外泌体-tnfr-fc”对应表达了tnfr-fc的cho细胞所抽取的外泌体,在目的蛋白的相应位置可以看到明显的条带,说明在外泌体中含有我们所表达的重组蛋白;“空白外泌体”为空白cho细胞所抽取的外泌体。同时使用外泌体的标志性蛋白cd63的抗体进行显影,同样可以发现其有明显的条带,进一步确认我们所提取的是外泌体。
实施例13携带重组tnfr-fc外泌体的应用
tnfr-fc可以与tnf结合从而抑制tnf对细胞的杀伤活性,我们通过细胞生长实验检测了包含该重组蛋白的外泌体同样可以具有同样的药效功能,这样可以确认携带重组蛋白的外泌体可以作为一个载药系统将药物蛋白传递给靶细胞。
用rpmi1640培养基(10%fbs)(购自gibco)于96孔细胞培养板培养乳腺癌l929细胞(购自上海纪宁实业公司),细胞密度为2×105个/ml,每孔100μl,37℃、5%co2培养箱培养过夜;
取一新的96孔培养板,将提取的外泌体样品与对照的纯tnfr-fc蛋白倍比稀释(纯tnfr-fc蛋白起始浓度1.25mg/ml,外泌体起始浓度10%(v/v)),分别加入重组人tnfα(购自sigma)和放线菌素d(购自sigma)至终浓度分别为1ng/ml和2μg/ml,在37℃条件下放置30min;取样品每孔50μl加入到相应的细胞孔中,37℃培养24h;加入10μl的wst-8显色液(购自上海维晟生物科技有限公司),37℃放置2.5h后于450nm波长处测定数值。
结果如图14所示,纯化后的tnfr-fc与包装有tnfr-fc的外泌体都可与tnf-α结合,中和tnf-α对细胞的杀伤效果,说明本发明得到的外泌体中的tnfr-fc融合蛋白具有生物活性。同样证明了外泌体可以作为药物载体携带有活性的药物蛋白进行疾病的治疗。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110>暨南大学
<120>一种包载蛋白的外泌体的制备方法与应用
<160>9
<170>siposequencelisting1.0
<210>1
<211>642
<212>dna
<213>人工序列(artificialsequence)
<400>1
gacatccagatgacgcagtcgccgtcctcattgagcgcatccgtgggagacagagtcact60
attacatgccgggcatcccaagacgtaaacacggccgtcgcctggtaccaacagaagccc120
ggaaaagcgcccaaactgttgatctactccgcctcatttctgtacagcggggtaccctcg180
aggttcagcggctcgaggagcgggacggatttcacgttgacaatttcgtcacttcagccg240
gaagattttgcgacatactattgccagcaacactataccacacccccgacgtttggccag300
gggaccaaagtcgagatcaagcggaccgtggccgctccgtcagtattcatcttcccgccg360
tccgatgagcaactcaagagcggaaccgcatcagtcgtatgcttgctcaataacttctat420
ccgcgagaggcgaaggtgcagtggaaagtggacaacgccctgcagtccggtaatagccag480
gaatcagtcacggagcaggattcaaaggattcgacctattccctctcgtcgacattgacg540
ctgtcgaaagcagactacgaaaaacataaagtgtacgcttgtgaagtgacacaccagggc600
ctttcatccccggtgacaaagtcgttcaatcgcggggagtgt642
<210>2
<211>1347
<212>dna
<213>人工序列(artificialsequence)
<400>2
gaggtgcagcttgtcgaatccgggggagggctcgtccaacccggaggatcactgcgcctt60
tcatgcgcagcctcgggtttcaatatcaaggacacgtatatccattgggtgcggcaggcg120
ccaggaaaaggtttggagtgggtcgcgaggatctaccccaccaatgggtacacacgatac180
gccgattcggtcaaggggcggttcacaatctcggcggacacgtcgaaaaacactgcgtac240
ttgcagatgaatagcctccgcgcagaagatactgcggtgtattactgctcccgctgggga300
ggtgatggcttctatgcgatggactattggggacaaggaacacttgtaacggtcagctcg360
gccagcaccaaggggccgtccgtgtttcccctcgccccctcgtcgaagtcaactagcggc420
ggaacagccgcccttggttgcctggtcaaggactacttccccgaaccggtcacggtgtca480
tggaactcgggagcattgacttcgggtgtgcatacatttcccgcagtgctccagtcatca540
ggactgtatagcctctcgtccgtcgtaacggtcccgtcatcgtcgctcgggacccagaca600
tacatttgcaatgtcaaccacaaaccttcgaatacaaaggtggataagaaggtcgagccg660
aagtcgtgtgacaagacgcacacatgtcctccatgccctgcgcctgagttgctgggaggg720
ccgagcgtgttcctctttcctcccaagccgaaggacacactgatgatttcgaggacgcct780
gaggtaacttgcgtggtagtagatgtgtcccatgaggaccccgaagtaaagtttaactgg840
tatgtggacggtgtggaggtccacaatgccaaaaccaaaccgcgcgaagagcaatacaac900
agcacatatcgggtggtgagcgtgctcaccgtcttgcaccaggactggctgaacgggaaa960
gagtacaaatgtaaagtatcaaacaaagcgctccccgcacccattgaaaagactatctca1020
aaggctaagggacagcccagagagccacaagtctacacgctcccgccctcgagagatgag1080
ttgacgaagaatcaggtcagccttacgtgcctcgtcaaagggttttacccatccgacatt1140
gcggtggaatgggaaagcaacggacagccagagaacaactacaagactacaccgcctgtg1200
ctggactcggatggttcgttcttcctctactcgaaattgactgtggacaaatcccgctgg1260
cagcagggaaatgtgttctcgtgtagcgtaatgcatgaagcgttgcacaatcactatacc1320
cagaaatcgctctccctttcgcctggc1347
<210>3
<211>47
<212>dna
<213>人工序列(artificialsequence)
<400>3
gacggatccgccatggagttctggttgtcatgggtctttctggtagc47
<210>4
<211>46
<212>dna
<213>人工序列(artificialsequence)
<400>4
gacggatcctcattagccaggcgaaagggagagcgatttctgggta46
<210>5
<211>47
<212>dna
<213>人工序列(artificialsequence)
<400>5
gacggatccgccatggatatgcgagtacccgcacaacttcttgggct47
<210>6
<211>47
<212>dna
<213>人工序列(artificialsequence)
<400>6
gacggatcctcattaacactccccgcgattgaacgactttgtcaccg47
<210>7
<211>1473
<212>dna
<213>人工序列(artificialsequence)
<400>7
atggcccccgtggccgtgtgggctgccctggccgtgggactggaactgtgggctgctgcc60
cacgccctgcccgcccaggtggccttcaccccctacgcccccgagccaggcagcacctgc120
aggctgagagagtactacgaccagaccgcccagatgtgctgcagcaagtgctctccaggc180
cagcatgccaaggtgttctgcaccaagaccagcgacaccgtgtgcgacagctgcgaggac240
agcacctacacccagctgtggaactgggtgcccgagtgcctgagctgtggcagcaggtgc300
tctagcgaccaggtcgagacccaggcctgcaccagagagcagaacaggatctgcacctgc360
agacccggctggtactgcgccctgagcaagcaggaaggctgcaggctctgcgccccactg420
aggaagtgcaggcccggcttcggcgtggccagacccggcaccgagacctccgacgtggtg480
tgcaagccctgcgccccaggcaccttcagcaacaccacctccagcaccgacatctgcagg540
ccccaccagatctgcaacgtggtggctatccccggcaatgccagcatggacgccgtgtgc600
accagcacctcccccaccagaagcatggccccaggcgccgtgcacctgccccagcccgtg660
agcaccaggtcccagcacacccagcccaccccagagcctagcaccgccccctctaccagc720
ttcctgctgcccatgggccccagccctccagccgagggcagcaccggcgacgagcccaag780
agctgcgacaagacccacacctgccccccctgtcctgctccagaactcctgggcggaccc840
agcgtgttcctgttcccccccaagcccaaggacaccctgatgatcagcaggacccccgag900
gtgacctgcgtggtggtggacgtgagccacgaggacccacaggtcaagttcaactggtac960
gtggacggcgtgcaggtgcacaacgccaagaccaagccccgggagcagcagtacaactcc1020
acctacagagtggtgtccgtgctgaccgtgctgcaccagaactggctggacggcaaagag1080
tacaagtgcaaggtctccaacaaggccctgccagcccccatcgagaaaaccatcagcaag1140
gccaagggccagcccagggaaccccaggtgtacaccctgccaccctctcgagaggaaatg1200
accaagaaccaggtgtccctgacctgcctggtgaagggcttctaccccagcgacatcgcc1260
gtggagtgggagagcaacggccagcccgagaacaactacaagaccacccccccagtgctg1320
gacagcgacggcagcttcttcctgtacagcaagctgaccgtggacaagagcagatggcag1380
cagggcaacgtgttcagctgcagcgtgatgcacgaggccctgcacaaccactacacccag1440
aagagcctgagcctgtcccccggcaagtgatga1473
<210>8
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>8
ataaaaggtaccatggcccccgtggccgt29
<210>9
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>9
ataaaaggatcctcatcacttgccgggggac31
- 还没有人留言评论。精彩留言会获得点赞!