一种基于硅罗丹明的次氯酸近红外荧光探针及其制备方法和应用与流程
本发明属于分析化学技术领域,具体涉及一种基于硅罗丹明的次氯酸近红外荧光探针及其制备方法和应用。
背景技术
hclo作为重要的内源性活性氧之一,与众多生理或病理活动密切相关。在生物体内,hclo主要是在白细胞(如单核细胞、嗜酸性细胞、嗜中性粒细胞等)中的含血红素辅基的亚铁血红素蛋白酶-髓过氧化物酶(myeloperoxidase,mpo)的催化作用下,由过氧化氢和氯离子发生氧化还原反应产生的。细胞内的hclo是生物抵御细菌入侵的天然屏障,可以起到保护机体的作用,它能够通过氧化某种病毒而接触到反应中所需要的酶,从而实现抗菌杀菌的作用。在正常状态下,一定浓度的hclo对生物体受损组织的修复和疾病的防御等是有益的。然而,因hclo具有较高的反应活性和非特异性,当细胞免疫反应产生的hclo的水平过量或发生紊乱时,就会导致细胞内发生非正常氧化,会使组织损伤,进而引发一系列疾病。若人体中hclo水平过高,会引发神经元变性、骨质关节炎、心血管疾病、肾脏疾病及癌症等疾病;若人体中hclo水平过低,则会引发动脉硬化等疾病。
目前已经报道的关于hclo的检测方法有碘量法、化学滴定法、电位测定法、电解分析法、极谱法、比色法、分光光度法等,但是这些方法不是操作步骤繁杂、灵敏度低,就是可控性差、选择性差,而且在检测生物样品方面都具有一定的局限性。而荧光分子探针恰恰弥补了上述检测方法中所存在的缺陷,具有操作简单、灵敏度高、选择性强、可重复性强、对检测样品无损伤以及快速实时的原位检测等优点。近年来,次氯酸荧光探针的研制取得了显著进展,其中一些已成功地应用于活体中次氯酸的实时检测和成像。然而,由于这些探针的短波长激发和发射(一般为λex<600nm和λem<650nm)而限制了它们在体内的实际应用,这也引发了许多问题,包括体内自发荧光的干扰、成像试剂的光漂白、对生物样品的光损伤现象。近红外荧光探针(λex>600nm和λem>650nm)能较好地解决上述问题,使生物样品的光损伤最小、组织穿透深度增加及降低背景自体荧光的干扰。然而,目前报道的应用与活体中次氯酸检测的近红外荧光探针大多是基于传统的菁染料设计的,它们通常存在较差的光稳定性,不利于生命体系内长时间的荧光成像监测,难以获得准确稳定的荧光信号。而具有近红外发射的硅罗丹明却具有极好的光稳定性,在长时间的活体荧光成像中具有极大的优势。
技术实现要素:
本发明针对目前次氯酸荧光探针检测所面临的问题和现状,提供了一种基于硅罗丹明的次氯酸近红外荧光探针,该荧光探针利用hclo专一性介导的环化反应位点作为响位机理,可以用于细胞内hclo的高选择性和高灵敏性检测和成像,为探寻细胞内hclo与生理或者病理进程的关联提供理论依据与技术支持。
本发明还提供了上述基于硅罗丹明的次氯酸近红外荧光探针的制备方法及其在水环境或生物细胞体系选择性检测次氯酸中的应用。
本发明为解决上述技术问题采用如下技术方案,一种基于硅罗丹明的次氯酸近红外荧光探针,其特征在于该荧光探针的结构式如下:
本发明所述的基于硅罗丹明的次氯酸近红外荧光探针的制备方法,其特征在于具体步骤为:
步骤s1:于-78℃,在氩气保护下,将6g3-溴-n,n-二甲基苯胺与60ml无水乙醚加入至干燥的250ml圆底烧瓶中,磁力搅拌5min使其溶解,随后将13.1ml摩尔浓度为2.4mol/l的正丁基锂的正己烷溶液滴加至反应液中,滴加完毕后于0℃反应2h,再将2.2ml二氯二甲基硅烷溶于10ml无水乙醚中并滴加至反应液中,滴加完毕后反应至室温并搅拌过夜,加入50ml水猝灭反应,并将反应液用乙醚萃取,再依次用水和饱和nacl水溶液洗涤,无水硫酸钠干燥,减压旋干溶剂后得到粗产品,将粗产品用硅胶柱纯化得到化合物1,其结构式如下:
步骤s2:将500mg化合物1、1260mg2-羧基苯甲醛和37.5mg溴化铜加入到100ml玻璃厚壁耐压管中,于140℃加热搅拌反应5h后自然冷却至室温,再将反应混合物溶于50ml二氯甲烷中,用质量浓度为10%的naoh溶液洗涤三遍,回收并旋干二氯甲烷相得到粗产品,将粗产品用硅胶柱纯化得到化合物2,其结构式如下:
步骤s3:将428.6mg化合物2、50ml乙醇和2ml质量浓度为85%的水合肼加入至100ml的圆底烧瓶,于78℃反应4h后将反应液减压蒸馏除去溶剂,将残余物用50ml二氯甲烷溶解后,用饱和食盐水水洗二氯甲烷相,并用无水硫酸钠干燥,减压蒸馏除去二氯甲烷相得到粗产物,将粗产物用硅胶柱纯化得到化合物3,其结构式如下:
步骤s4:将221.3mg化合物3、加入0.1ml异硫氰酸苯酯和20mln,n-二甲基甲酰胺倒入50ml圆底烧瓶中,于50℃回流反应24h,将反应液冷却后减压除去溶剂,并进一步用硅胶柱柱层析纯化得到目标荧光探针化合物nir-hclo。
本发明所述的基于硅罗丹明的次氯酸近红外荧光探针在水环境或生物细胞体系选择性检测次氯酸中的应用,其中检测包括水溶液中荧光检测、细胞成像检测、活体成像检测。
本发明与现有技术相比具有以下有益效果:(1)该荧光探针的合成相对比较容易,且后处理过程相对简单;(2)该荧光探针实现了次氯酸分子高选择性高灵敏度快速检测,具有抵抗生命体内其它分子干扰的能力;(3)该荧光探针具有近红外发射与较好的光稳定性,能够应用于活体中次氯酸的成像检测,通过降低生命体内自发荧光背景干扰、降低对生物样品的光损伤、提高组织穿透深度等特点,以获得更加准确及稳定的光学信号及成像效果。故而,本发明中的荧光探针在次氯酸检测领域具有广阔的应用前景,对次氯酸在生物体生理和病理过程的作用机制的研究具有重要意义。
附图说明
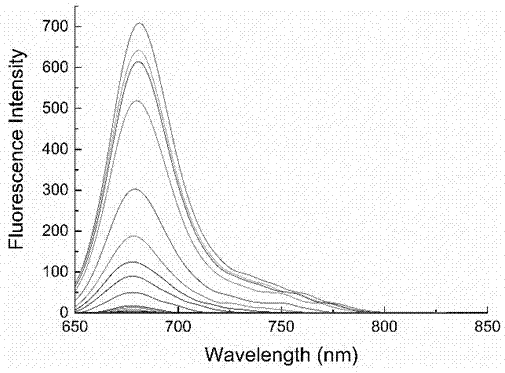
图1是实施例1制得的荧光探针化合物nir-hclo在加入不同浓度次氯酸后的荧光光谱图;
图2是实施例1制得的荧光探针化合物nir-hclo在加入不同浓度次氯酸后的紫外可见吸收光谱图;
图3是实施例1制得的荧光探针化合物nir-hclo在发射波长为680nm处的的荧光强度随次氯酸浓度(0-80μm)变化的关系曲线图,插图为荧光探针化合物nir-hclo在发射波长为680nm处的的荧光强度随次氯酸浓度(0-20μm)变化的关系曲线图;
图4是实施例1制得的荧光探针化合物nir-hclo对次氯酸响应的机理及验证结果图;
图5是实施例1制得的荧光探针化合物nir-hclo与次氯酸反应后产物4与近红外菁染料cy5-n3的体内光稳定性考察图;
图6是实施例1制得的荧光探针化合物nir-hclo对不同离子和分子的选择性柱状图,其中1、pbs;2、k+;3、ca2+;4、mg2+;5、zn2+;6、fe3+;7、cu2+;8、ch3coo-;9、no3-;10、cl-;11、f-;12、i-;13、cys;14、gsh;15、glucose;16、atp;17、adp;18、t-buoo·;19、no2-;20、h2o2;21、onoo-;22、o2·-;23、·oh;24、1o2;25、no;26、t-buooh;27、naclo;
图7是ph对实施例1制得的荧光探针化合物nir-hclo检测次氯酸的影响图;
图8是实施例1制得的荧光探针化合物nir-hclo在体系中含有不同浓度的次氯酸(1μm,5μm,10μm)时,溶液在680nm处的荧光强度随时间变化关系曲线图;
图9是实施例1制得的荧光探针化合物nir-hclo检测hela中不同浓度外源性次氯酸(0μm,50μm)荧光成像图;
图10是实施例1制得的荧光探针化合物nir-hclo在小鼠炎症模型中的荧光成像图。
具体实施方式
以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
实施例1
荧光探针化合物nir-hclo的合成
(1)化合物1的合成
于-78℃,在氩气保护下,将6g3-溴-n,n-二甲基苯胺与60ml无水乙醚加入至干燥的250ml圆底烧瓶中,磁力搅拌5min使其溶解,随后将13.1ml摩尔浓度为2.4mol/l的正丁基锂的正己烷溶液缓慢滴加至反应液中,滴加完毕后于0℃反应2h,再将2.2ml二氯二甲基硅烷溶于10ml无水乙醚中并缓慢滴加至反应液中,滴加完毕后反应至室温搅拌过夜,加入50ml水猝灭反应,并将反应液用乙醚萃取,分液漏斗分取有机相,用水洗涤后(50ml×2),饱和nacl水溶液洗涤(50ml×1),无水na2so4干燥,旋转蒸发仪蒸除溶剂得粗产品,将粗产品用硅胶柱纯化,硅胶颗粒大小为200-300目,洗脱剂体积配比为石油醚/乙酸乙酯=80:1,得到化合物1,黄色油状物,3.35g,产率75%,其合成路线如下:
(2)化合物2的合成
将500mg化合物1、1260mg2-羧基苯甲醛和37.5mg溴化铜加入到100ml玻璃厚壁耐压管中,封管后放置到油浴锅中于140℃加热搅拌5h后自然冷却至室温,然后将反应混合物溶解在50ml二氯甲烷中,用质量浓度为10%的naoh溶液洗涤(50ml×3),除去未反应的2-羧基苯甲醛等酸性副产物,将得到的二氯甲烷相用无水na2so4干燥,旋转蒸发仪蒸除溶剂得粗产品,将粗产品用硅胶柱纯化,硅胶颗粒大小为200-300目,洗脱剂体积配比为石油醚/乙酸乙酯=2:1,得到化合物2,绿色固体,0.33g,产率45%,其合成路线如下:
(3)化合物3的合成
将428.6mg化合物2、50ml乙醇和2ml质量浓度为85%的水合肼加入至100ml的圆底烧瓶,于78℃反应4h后减压除去溶剂得残余物,用50mlch2cl2溶解残余物,饱和nacl水溶液洗涤(50ml×3),无水na2so4干燥,旋转蒸发仪蒸除溶剂得粗产品,将粗产品用硅胶柱纯化,硅胶颗粒大小为200-300目,洗脱剂体积配比为石油醚/乙酸乙酯=1:3,得到化合物3,象牙白固体化合物,250.2mg,产率56.5%。1hnmr(400mhz,cdcl3)δ7.93-7.89(m,1h),7.34-7.29(m,2h),6.91-6.90(m,2h),6.89-6.87(m,1h),6.76(s,1h),6.73(s,1h),6.66-6.65(d,j=3.2hz,1h),6.64-6.63(d,j=2.8hz,1h),3.69(s,2h),2.96(s,12h),0.61(s,3h),0.59(s,3h).hrms(esi):calcdfor[m+h]+443.2262,found443.2264,其合成路线如下:
(4)荧光探针化合物nir-hclo的合成
将化合物3(221.3mg,0.50mmol)、20mldmf和0.1ml异硫氰酸苯酯加入至50ml的圆底烧瓶,于50℃搅拌反应24h,在减压条件下除去溶剂后,用50mlch2cl2溶解残余物,饱和nacl水溶液洗涤(50ml×3),无水na2so4干燥,旋转蒸发仪蒸除溶剂得粗产品。将粗产品用硅胶柱纯化,硅胶颗粒大小为200-300目,洗脱剂体积配比为石油醚/乙酸乙酯=2:1,得到荧光探针化合物nir-hclo,淡黄色固体,90.1mg,产率约40.7%。1hnmr(400mhz,cdcl3)δ8.04-8.02(d,j=7.6hz,1h),7.66-7.57(m,2h),7.22-7.20(d,j=3.6hz,1h),7.18-7.14(m,3h),7.09-7.06(t,j=7.2hz,1h),6.97-6.95(d,j=7.6hz,2h),6.88(s,2h),6.77(s,1h),6.58-6.53(m,4h),2.94(s,12h),0.61(s,3h),0.55(s,3h).hrms(esi):calcdfor[m+h]+578.2404,found578.2406,其合成路线如下:
实施例2
荧光探针化合物nir-hclo与不同浓度次氯酸作用的荧光光谱图的测定
取实施例1制备的nir-hclo次氯酸荧光探针溶于n,n-二甲基甲酰胺(dmf)中,制成10μm储备液。从储备液中取出2ml加入到5ml的离心管当中,加入不同当量(0-16)的次氯酸标准溶液,用pbs缓冲溶液(10mm,ph=7.4)的溶液稀释至4ml(dmf/pbs体积比为1:1)。以620nm为激发光,狭缝宽度设置为5nm/5nm,测量其荧光光谱。荧光光谱如图1所示,随着次氯酸加入,在680nm处的荧光逐渐增强,其荧光强度与次氯酸浓度的关系如图3所示,在5.0×10-8-1.0×10-5m的范围内呈线性关系,所用的荧光测定仪器为perkinelmerls55荧光分光光度计。
实施例3
荧光探针化合物nir-hclo与不同浓度次氯酸作用的紫外可见吸收光谱图的测定
图2为荧光探针化合物nir-hclo与不同浓度的次氯酸作用后的紫外可见吸收光谱图,次氯酸的加入量为0-80μm。从图中2可以看出,在660nm可以观察到一个吸收峰,随次氯酸浓度的增加,其660nm处的吸光度逐渐增加。紫外可见吸收光谱测定用的仪器为tu-1900型紫外可见分光光度计(beijingpurkinjegeneralinstrumentco.,ltd.)。
实施例4
荧光探针化合物nir-hclo对次氯酸响应的机理图及验证
图4为荧光探针化合物nir-hclo与次氯酸作用机理推测及验证。我们推测探针对次氯酸的响应机理如图4a所示。验证如下:从实施例2中的荧光探针储备液中取出2ml加入到5ml的离心管当中,加入一定量次氯酸溶液,用pbs缓冲溶液(10mm,ph=7.4)的溶液稀释至4ml(dmf/pbs体积比为1:1),使探针终浓度为5μm,次氯酸终浓度为100μm。反应半小时后,在高分辨质谱上进行分析,得到质谱峰544.2530(图4b),分子量与化合物4吻合,从而证实探针的响应机理为次氯酸诱导探针分子发生环化反应并打开硅罗丹明的螺内酰胺环,形成化合物4,并产生明显的荧光增强信号。
实施例5
荧光探针化合物nir-hclo与次氯酸反应产物4与近红外菁染料cy5-n3的细胞内光稳定性考察
图5为荧光探针化合物nir-hclo与次氯酸反应的产物4与传统的近红外荧光菁染料cy5-n3的光稳定性考察图。首先,我们通过探针与次氯酸反应制备得到化合物4。将化合物4与cy5-n3的dmso溶液加入到两个育有hela细胞的培养液中,终浓度为10μm。在二氧化碳培养箱中培养30min后,用dpbs洗涤细胞皿3次,然后用共聚焦显微镜进行成像,两者激发波长为635nm,红色通道波长收集范围为650-720nm,成像次数为60次,激光功率为最大功率的15%。从图中可知,随着成像次数的增加,化合物4的信号强度基本保持稳定,而cy5-n3的信号强度则明显下降,表明化合物4具有优异的光稳定性,证明荧光探针化合物nir-hclo能用于细胞内次氯酸的长时间准确的荧光成像研究。
实施例6
荧光探针化合物nir-hclo对不同分子或离子的选择性
从实施例2中的荧光探针储备液中取出2ml加入到5ml的离心管当中,加入待考察竞争物质的标准溶液,用pbs缓冲溶液(10mm,ph=7.4)的溶液稀释至4ml(dmf/pbs体积比为1:1),共考察了26种竞争物质,共配置27个样品,最后一个为次氯酸(40μm)。以620nm为激发光,狭缝宽度设置为5nm/5nm,测量其荧光光谱,结果如图6所示。由图6可以发现,细胞内金属离子、阴离子、中性分子、活性氮、其他活性氧对荧光探针化合物nir-hclo在680nm处的荧光几乎没有影响,而次氯酸溶液的加入使探针nir-hclo在680nm处的荧光显著增强。
实施例7
溶液ph值对荧光探针化合物nir-hclo测定次氯酸的荧光响应的影响
我们分别考察了ph值对空白荧光探针化合物nir-hclo以及nir-hclo+次氯酸(25μm)的两种情况下荧光强度的影响,结果如图7。在ph=3.5-8.0范围内,ph对空白荧光探针化合物nir-hclo的荧光强度基本无影响。而在次氯酸(25μm)存在的情况下,当ph=5.0时,荧光探针化合物nir-hclo的荧光强度最大,表明此时荧光探针对次氯酸的响应最好。而细胞内ph处于7.4左右,从图7中可知,在ph处于7.4附近,荧光探针化合物nir-hclo对次氯酸也显示明显的荧光增强响应,表明荧光探针化合物nir-hclo能够满足细胞内次氯酸检测的需求。
实施例8
荧光探针化合物nir-hclo与次氯酸作用的响应时间的测定
在荧光探针化合物nir-hclo溶液中分别加入1μm、12μm的次氯酸,配制成2个样品,在perkinelmerls55荧光分光光度计的时间模式下,分别测定含不同浓度的次氯酸样品在680nm处的荧光强度随时间的变化情况,结果如图8。从图中可知,在十分钟内探针对次氯酸的荧光响应逐渐稳定,具有较好的响应速度。
实施例9
荧光探针化合物nir-hclo对细胞外源性次氯酸的荧光成像
在hela细胞中,考察荧光探针化合物nir-hclo对外源性的次氯酸的荧光成像情况。具体操作步骤如下:将荧光探针化合物nir-hclo的dmso溶液加入到育有hela细胞的培养液中,终浓度为10μm。在二氧化碳培养箱中培养30min后,向体系中加入不同量次氯酸水溶液,使体系次氯酸浓度分别为0、50μm,等待20min后用共聚焦显微镜进行成像,成像结果如图9所示。从图中可知,随着次氯酸浓度的增加,细胞红色通道的荧光强度逐渐增加。激发波长为635nm,红色通道波长收集范围为650-720nm。
实施例10
荧光探针化合物nir-hclo在小鼠炎症模型中的荧光成像
选定3只四周大小的nih小鼠,编号为1-3号,其中1号为空白小鼠;2号小鼠为腹腔注射了1ml含有荧光探针化合物nir-hclo(50μm,1wt%dmso)的生理盐水的小鼠;3号小鼠为腹腔连续注射了1ml含有探针nir-hclo(50μm,1wt%dmso)的生理盐水、0.5ml含有lps(1mg/l)的生理盐水、0.30ml含有pma(1μg/l)的生理盐水的小鼠。一个小时后,将三只老鼠先后在nightowliilb983型小动物成像仪上成像,激发波长为630nm,信号收集波长范围为720nm(±10nm),结果如图10所示。从图中可知,1号空白小鼠以及2号仅注射了探针分子的小鼠腹腔部位无背景干扰和明显信号。而被lps以及pma诱导产生炎症的3号小鼠腹腔部位出现明显信号,表明炎症诱导了次氯酸的产生,次氯酸进一步作用于探针nir-hclo从而产生信号。以上结果表明荧光探针化合物nir-hclo能够通过对次氯酸的识别进一步实现活体中炎症的监测。
以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!