长链生物素标记物及其制备方法和用途与流程
本发明涉及用于基因测序的生物标记物,具体涉及用于基因测序,特别是二代测序的长链生物素标记物及其制备方法和用途。
背景技术:
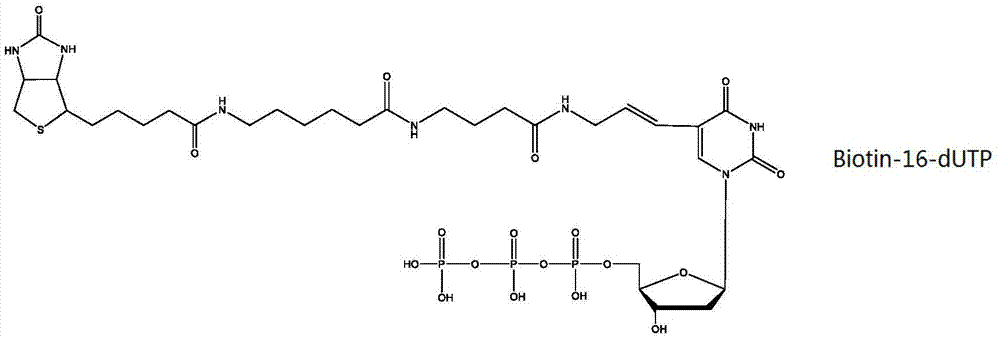
:二代测序在分子生物学和临床医学中起到越来越重要的作用。其中,目标区域捕获测序是二代测序应用中性价比非常高的手段,在遗传性疾病和肿瘤科学研究及临床诊断领域有着广阔的应用空间。其原理是针对感兴趣的基因组区域设计特异性的互补探针,将其与基因组dna进行杂交,富集目标基因组区域的dna片段,然后进行高通量测序。捕获富集的关键步骤是把生物素修饰的单链dna作为捕获试剂,抓到基因组中感兴趣的目标区域,然后利用链霉亲合素(streptavidin,sa)和生物素的天然特异性结合能力,与sa修饰的磁珠结合,在磁场中分离出来。根据杂交时的状态可将区域捕获分为固相杂交法和液相杂交法。固相杂交法所用的探针通常都是固定在固体支持物上,例如基因芯片。杂交后先洗脱未杂交上的dna片段,再将与探针杂交的dna洗脱下来。现在更加流行的是液相杂交。与固相杂交最大的差异的是液相杂交在溶液中使目标dna片段和带有生物素标记的探针直接杂交。目前采用该技术公司包括主要是国外生物科技公司。如安捷伦、罗氏、赛默飞等等。现有的生物素修饰可通过加入生物素修饰的dutp(deoxyuridinetriphosphate脱氧尿苷三磷酸)进行复制的方法随机掺杂在dna链上。生物素与亲合素之间结合的亲合力高、特异性强。生物素分子有两个环状结构,其中咪唑酮环是与亲和素结合的主要部位;另外一个噻吩环的c2上有一戊酸侧链,可以提供一定的空间距离,但是这种侧链长度并不足够。因此,生物素和dna一般通过有机长链状分子连接,从而调节其距离。通常采用的有己烷链、三甘醇(teg)链或者其他长度的链等,例如,dna复制时掺入的biotin-16-dutp(casnumber136632-31-0)采用了16个原子长度的有机分子链。然而,这些有机长链并不能完全满足当前的需求,特别是在二代测序方面的需求。技术实现要素:为解决现有技术中的至少部分技术问题,本发明研究了生物素分子和寡核苷酸之间的有机长链结构对于二代测序中的探针捕获的影响,发现具有特定结构的长链生物素分子特别适合于二代测序,并且在特定链长范围内,捕获效率逐步提高。至少部分地基于上述内容完成了本发明。具体地,本发明包括以下内容。本发明的第一方面,提供一种长链生物素标记物,其包括生物素分子、间隔臂和反应基团,其中,所述生物素分子包括环状结构和戊酸侧链,所述间隔臂具有式(i)所示的结构,所述反应基团具有式(ii)所示的结构,所述生物素分子中的戊酸侧链与间隔臂第一末端的nh连接,所述间隔臂的第二末端的氧与所述反应基团的磷结合形成o-p键,从而将所述间隔臂与所述反应基团连接,-nh(ch2)mo-(-c=o-nh-ch2-ch2o)n-式(i)式(i)中m和n分别独立地表示1-10的整数,在某些实施方案中,本发明的长链生物素标记物中的生物素分子受dmt基团保护。在某些实施方案中,本发明的长链生物素标记物中式(i)中的m为4-6的整数,且n为1-3的整数。本发明的第二方面,提供本发明第一方面所述的长链生物素标记物的制备方法,其包括:(1)在吡啶溶液中,使生物素和dmt-cl反应得到中间产物a;(2)在无水二甲基甲酰胺中,使中间产物a与氨基己醇反应得到中间产物b;(3)在无水乙腈中,用氯甲酸对硝基苯酚酯活化中间产物b,之后与氨基-peg3-醇反应得到中间产物c1,以该中间产物c1代替中间产物b再次重复该步骤n-1次,得到中间产物cn,其中n为1-10的整数;(4)在无水乙腈中,使中间产物cn在四氮唑作用下与磷试剂反应得到长链生物素标记物。在某些实施方案中,本发明的方法的步骤(2)中使用二琥珀酰亚胺基碳酸酯作为催化剂。在某些实施方案中,本发明的方法的步骤(4)中的磷试剂为2-氰乙基-n,n,n’n’-四异丙基亚磷酰二胺。本发明的第三方面,提供本发明第一方面所述的长链生物素标记物在制备基因测序/检测探针中的用途。本发明的第四方面,提供一种寡核苷酸,其包括本发明第一方面所述的长链生物素标记物和寡核苷酸序列,其中所述长链生物素标记物结合至寡核苷酸序列5’端的羟基。本发明的第五方面,提供一种寡核苷酸的制备方法,其包括:(1’)由多个核苷酸合成寡核苷酸序列的步骤;和(2’)长链生物素标记物结合步骤,其包括使用四氮唑混合活化长链生物素标记物,然后使其与步骤(1)得到的寡核苷酸序列5'端最后一个碱基的羟基进行反应;然后进行氧化和去dmt保护。本发明的第六方面,提供本发明第一方面所述的长链生物素标记物或本发明第四方面所述的寡核苷酸在二代测序中的用途。本发明的长链生物素标记物可用于特定基因的捕获测序。经过测序验证,捕获效率可以达到80%以上,可以有效地用于定制化的目标区域基因测序。附图说明图1现有biotin-16-dutp(casnumber136632-31-0)的分子结构。图2本发明得到的分子1-3产物的峰图。其为hplc纯化后,根据紫外吸收在260nm处的吸光值,对洗脱的保留时间做图。图3对照物的峰图,其为hplc纯化后,根据紫外吸收在260nm处的吸光值,对洗脱的保留时间做图。图4本发明得到的产物和对照物两图合并后得到的图。图5长链生物素修饰的产物的质谱鉴定图。图6不同生物素修饰探针杂交捕获效率对比。图中三个柱组成一组。每组柱中左侧的柱表示目标区域被捕获到的比例。中间的柱表示比对到目标区域的碱基比例。右侧的柱表示比对到目标区域的读段比例。具体实施方式现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为具体公开了该范围的上限和下限以及它们之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。除非另有说明,否则“%”为基于重量的百分数。[长链生物素标记物]本发明的第一方面提供一种长链生物素标记物。其为具有长侧链的生物素分子(本文有时也称作长链生物素分子),由于可以作为基因测序等领域内的分子标记物,本文称作长链生物素标记物。与一般生物素标记物相比,本发明的长链生物素标记物至少具有更长的侧链和更高的活性。优选地,本发明的长链生物素标记物中的侧链不包括支链结构,特别是碳支链结构,也不包括任何环状结构,例如苯环或环烷基结构。另外,本发明的长链生物素标记物的侧链还不包括碳碳双键。本发明发现支链结构、环状结构以及碳碳双键等虽然可以使侧链更长,但是这些结构影响侧链的柔性,当结合至寡核苷酸后影响寡核苷酸与其互补序列的结合,因此,上述基团优选不包含于间隔基团。本发明的长链生物标记物包括生物素分子、间隔臂和反应基团。其中,生物素分子包括环状结构和戊酸侧链,间隔臂具有式(i)所示的结构,反应基团具有式(ii)所示的结构。如式(i)所示,间隔臂具有第一延伸段和第二延伸段,第一延伸段的一个末端(即,第一末端)具有nh基团。第二延伸段为重复段。其一个末端(即,第二末端)为氧。生物素分子中的戊酸侧链与间隔臂第一末端的nh连接。间隔臂的第二末端的氧与反应基团的磷结合形成o-p键,从而将间隔臂与反应基团连接。需要说明的是,戊酸与间隔臂第一末端的连接通过羧基与胺基的反应得到。因此,生物素分子中的戊酸侧链与间隔臂第一末端的nh连接是通过-(c=o)-nh-实现的。-nh(ch2)mo-(-c=o-nh-ch2-ch2o)n-式(i)本发明的式(i)中,m和n分别独立地表示1-10的整数。为了提高捕获效率,优选地,m为3-10的整数,更优选m为4-8的整数。例如,m可为5、6或7。另外,n优选为1-5的整数,更优选为1-4的整数。例如,n可为1、2、3或4等。如果m或n大于上述范围,一方面使合成难度增大,另一方面随着链长进一步增大,其与寡核苷酸结合后,对于寡核苷酸的捕获效果没有明显提高。因此,本发明的m和n优选在上述范围内。本发明的式(ii)中,反应基团包括氰乙基和两个异丙基。具有该结构的反应基团特别有利于与核酸中的羟基进行亲核反应,通过核酸中的羟基攻击式(ii)中的磷原子,从而保证长链生物素标记物具有更高的反应活性。在某些实施方案中,本发明的长链生物素标记物的生物素分子受到dmt基团保护。优选地,dmt基团与生物素的咪唑酮环中的n结合。优选地,dmt基团用于保护生物素分子的两个nh中较活泼的那个nh。[长链生物素标记物的制备方法]本发明的第二方面,提供长链生物素标记物的制备方法,其包括至少下述四个步骤。步骤(1)本发明的步骤(1)为进行合成反应前,对生物素分子进行dmt保护的步骤。具体地,包括在吡啶溶液中,使生物素和dmt-cl反应得到中间产物a。更具体地,使原料生物素和dmt-cl按照1:2-1:5的摩尔量,溶在吡啶溶液中,50-90℃(例如80℃)水浴加热1-8小时,优选2-6小时,例如4小时,得到粗产物。然后将粗产物加入水和二氯甲烷,震荡摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到中间产物a。步骤(2)本发明的步骤(2)为得到第一延伸段的步骤。即,在戊酸侧链末端添加氨基己醇的步骤。本发明可使用已知方法来进行。优选地,本发明的步骤(2)包括在无水二甲基甲酰胺中,使中间产物a与氨基己醇反应得到中间产物b。更优选地,步骤(2)包括将中间产物a溶在无水dmf(二甲基甲酰胺)中,在二琥珀酰亚胺基碳酸酯dsc(disuccinimidylcarbonate)等催化剂作用下,和1:1摩尔量氨基己醇反应1小时,缩合得到粗产物。加入水和二氯甲烷,震荡摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到中间产物b。步骤(3)本发明的步骤(3)为得到第二延伸段的步骤。即,在侧链中添加-c=o-nh-(ch2-ch2o)4-重复结构单元的步骤。侧链中-c=o-nh-(ch2-ch2o)4-重复结构单元的重复数n不限定。n的含义参见针对式(i)的说明。本发明的步骤(3)可包括在无水乙腈中,用氯甲酸对硝基苯酚酯活化中间产物b,之后与氨基-peg3-醇反应得到中间产物c1。以该中间产物c1代替中间产物b再次重复该步骤n-1次,得到中间产物cn,其中n的含义与式(i)中n的含义相同。在某些实施方案中,步骤(3)中的n为1,则步骤(3)仅包括在无水乙腈中,用氯甲酸对硝基苯酚酯活化中间产物b,之后与氨基-peg3-醇反应得到中间产物c1,而无需进行后面的重复步骤。此时中间产物c1中仅含有一个-c=o-nh-(ch2-ch2o)4-结构单元。在某些实施方案中,步骤(3)中的n为2,则步骤(3)包括在无水乙腈中,用氯甲酸对硝基苯酚酯活化中间产物b,之后与氨基-peg3-醇反应得到中间产物c1。此后,以中间产物c1代替中间产物b再次重复该步骤1次,得到中间产物c2。中间产物c2中包括两个-c=o-nh-(ch2-ch2o)4-结构单元。在某些实施方案中,步骤(3)中的n为3,则步骤(3)包括在无水乙腈中,用氯甲酸对硝基苯酚酯活化中间产物b,之后与氨基-peg3-醇反应得到中间产物c1。此后,以中间产物c1代替中间产物b重复该步骤1次,得到中间产物c2。然后以中间产物c2代替中间产物c1重复该步骤1次,得到中间产物c3。中间产物c3中包括三个-c=o-nh-(ch2-ch2o)4-结构单元。依此类推,本领域技术人员可容易地理解n个-c=o-nh-(ch2-ch2o)4-结构单元的侧链。步骤(4)本发明的步骤(4)为在最后的中间产物cn的侧链末端添加反应基团的步骤。其包括在无水乙腈中,使中间产物cn在四氮唑作用下与磷试剂反应得到长链生物素标记物。具体地,包括将中间产物cn溶在无水乙腈中,在四氮唑催化下,和1:1摩尔量磷试剂反应10分钟,得到粗产物。加入水和二氯甲烷,摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到本发明的长链生物素分子。步骤(4)中的磷试剂优选为2-氰乙基-n,n,n’n’-四异丙基亚磷酰二胺。[第一用途]本发明的第三方面为本发明第一方面所述的长链生物素标记物在制备基因测序/检测探针中的用途。本文简称为第一用途。本发明的长链生物素标记物可以与寡核苷酸序列结合得到本文所述的寡核苷酸,其可作为分子标记物。优选地,该分子标记物是基因测序或检测时的探针。更优选地,本发明的长链生物素标记物用于特定基因的捕获测序,特别是有效地用于定制化的目标区域基因测序。[寡核苷酸]本发明的第四方面,提供寡核苷酸。本发明的寡核苷酸包括本发明第一方面所述的长链生物素标记物和寡核苷酸序列。其中长链生物素标记物结合至寡核苷酸序列5’端的羟基。长链生物素标记物在与寡核苷酸序列5’端的羟基结合时,由5’端的羟基攻击长链生物素标记物的反应基团中的p原子,使反应基团脱离长链生物素标记物,同时与p原子结合的氧原子与5’端的羟基反应形成本发明的寡核苷酸。本发明的寡核苷酸序列的序列长度一般为50-150bp,优选55-100bp,更优选60-80bp。本发明的长链生物素标记物特别适用于上述长度范围的寡核苷酸序列。如果寡核苷酸序列长度过短,则虽然生物素标记物与寡核苷酸分子具有足够的间隔距离,但是由于生物素标记物分子与寡核苷酸序列分子的大小相近,影响寡核苷酸序列向目标基因序列的靠近,进而影响与目标基因序列特异性结合。另一方面,如果寡核苷酸长度过长,则检测灵敏度降低。[寡核苷酸的制备方法]本发明的第五方面,提供寡核苷酸的制备方法,其至少包括以下步骤。步骤(1’)本发明的步骤(1’)为由多个核苷酸合成寡核苷酸序列的步骤。合成寡核苷酸的步骤可使用本领域已知的方法进行。具体方法包括固相合成法等。在示例性合成方法中,其包括:第一步,三氯乙酸(tca)和预先连接在固相载体(优选,可控多孔玻璃controlled-poreglass,简称cpg)上的第一个核苷酸反应(优选地,其活性基团处于被保护状态),脱去核苷酸5'-羟基的保护基团dmt,获得游离的5'-羟基;第二步,四氮唑混合活化碱基亚磷酰胺单体(nucleosidephosphoramidite),与cpg上面的5'-羟基进行反应;第三步,带帽(capping)反应,缩合反应中可能有极少数5'-羟基没有参加反应(少于2%),用乙酸酐和1-甲基咪唑终止其后继续发生反应;第四步,用碘-吡啶氧化剂,将亚磷酰氧化为稳定的磷酸三酯;重复进行上述步骤,直至合成完所需的寡核苷酸序列(dna序列)。合成过程中可以观察tca处理阶段的颜色判定合成效率。步骤(2’)本发明的步骤(2’)为长链生物素标记物结合步骤,其包括使用四氮唑混合活化长链生物素标记物,然后使其与步骤(1)得到的寡核苷酸序列5’碱基的羟基进行反应;然后进行氧化和去dmt保护。[第二用途]本发明的第六方面,提供本发明第一方面所述的长链生物素标记物或本发明第四方面所述的寡核苷酸在二代测序中的用途。本文简称为第二用途。本发明第二用途包括用作基因测序或检测时的探针。优选地,本发明的长链生物素标记物用于特定基因的捕获测序,特别是有效地用于定制化的目标区域基因测序。除了物质本身不同外,本发明第一用途和第二用途可以相同。实施例1生物素分子的合成:1.分子1的合成分子1的合成线路如下所示:第一步:原料生物素和dmt-cl按照1:3摩尔量溶解于吡啶溶液中,80℃水浴加热4小时,得到的粗产物。向所得粗产物中加入水和二氯甲烷,震荡摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到中间产物a。第二步:将中间产物a溶于无水二甲基甲酰胺中,在dsc催化下,和1:1摩尔量氨基己醇反应1小时,缩合得到粗产物。向粗产物加入水和二氯甲烷,震荡摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到中间产物b。第三步:中间产物b溶在无水乙腈中,在四氮唑催化下,和1:1摩尔量磷试剂反应10分钟,得到粗产物。向粗产物中加入水和二氯甲烷,震荡摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到分子1。本发明中将分子1作为比较例。2.分子2合成分子2的合成路线如下所示:第一步:将中间产物b溶在无水乙腈中,用氯甲酸对硝基苯酚酯活化后,和1:1摩尔量氨基-peg3-醇反应10分钟,得到粗产物。加入水和二氯甲烷,震荡摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到中间产物c1。第二步:中间产物c1溶在无水乙腈中,在四氮唑催化下,和1:1摩尔量磷试剂反应10分钟,得到粗产物。加入水和二氯甲烷,震荡摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到分子2。3.分子3的合成分子3的合成线路如下所示:第一步:中间产物c1溶在无水乙腈中,用氯甲酸对硝基苯酚酯活化后,和1:1摩尔量氨基-peg3-醇反应10分钟,得到粗产物。加入水和二氯甲烷,震荡摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到中间产物c2;第二步:中间产物c2溶在无水乙腈中,在四氮唑催化下,和1:1摩尔量磷试剂反应10分钟,得到粗产物。加入水和二氯甲烷,摇匀,分离出二氯甲烷层,加入无水硫酸钠干燥。二氯甲烷层旋转蒸发后,混合物在硅胶柱上分离,得到分子3。实施例2一、长链生物素分子的dna合成:第一步,三氯乙酸(tca)和预先连接在可控多孔玻璃(cpg)上的第一个核苷酸反应,其中活性基团处于被保护状态,脱去核苷酸5'-羟基的保护基团dmt,获得游离的5'-羟基;第二步,四氮唑混合活化碱基亚磷酰胺单体,与cpg上面的5'-羟基进行反应;第三步,带帽反应,缩合反应中可能有极少数5'-羟基没有参加反应(少于2%),用乙酸酐和1-甲基咪唑终止其后继续发生反应;第四步,用碘-吡啶氧化剂,将亚磷酰氧化为稳定的磷酸三酯;重复进行上述的步骤,直至合成所需长度的寡核苷酸序列(oligodna)。合成过程中可以观察tca处理阶段的颜色判定合成效率。最后四氮唑混合活化生物素亚磷酰胺单体,与cpg上面dna最后一个碱基的5'-羟基进行反应;然后进行氧化和去dmt保护步骤。二、长链生物素分子的dna的分离纯化和鉴定:合成结束后,用氨水将oligodna分子从cpg上切下,再进行hplc纯化。hplc纯化所得的产品,进行质谱鉴定,从而判别长链生物素是否成功接在dna的5’端上。实施例3一、长链生物素分子修饰的dna用于捕获实验实验设计:使用不同长度生物素修饰探针设计合成人目标区域(boke肿瘤基因panel)捕获探针;构建人标准基因组dna文库,配合9种不同的文库标签,参见表1。分别使用分子1、2、3修饰的探针进行捕获试验。表1本实验所用标签标签序列文库标签1cgatgt文库标签2tgacca文库标签3acagtg文库标签4gccaat文库标签5cagatc文库标签6cttgta文库标签7atcacg文库标签8ttaggc文库标签9acttga(1)boke肿瘤基因panel探针合成针对boke肿瘤基因panel进行探针设计,panel目标区域总长为1190775bp,探针总数17448条,分别合成分子1、分子2和分子3修饰探针。(2)文库构建人标准基因组dna配合bioscientific公司nextflexrapiddna-seqkit建库试剂盒,按照标准操作步骤进行,文库分选片段350bp左右。(3)目标区域捕获按照boke杂交捕获实验流程进行杂交捕获,分子1、分子2和分子3修饰探针各做3个平行试验,如表2所示。表2杂交捕获试验探针文库编号探针类型boke_lib001_s01分子1修饰探针boke_lib001_s02分子1修饰探针boke_lib001_s03分子1修饰探针boke_lib001_s04分子2修饰探针boke_lib001_s05分子2修饰探针boke_lib001_s06分子2修饰探针boke_lib001_s07分子3修饰探针boke_lib001_s08分子3修饰探针boke_lib001_s09分子3修饰探针(4)上机测序捕获后文库经质控(文库片段<500bp,浓度3-5nm)后使用hiseqxten进行测序,pe150模式,每个样本预计测序数据量2g碱基。(5)数据hplc纯化后,产物的峰图如图2所示。根据紫外吸收在260nm处的吸光值,对产物洗脱的保留时间做图。收集37分钟出的最大吸收峰,得到长链生物素修饰的长度为60碱基的单链dna产物。hplc纯化后,对照物的峰图如图3所示。根据紫外吸收在260nm处的吸光值,对对照物洗脱的保留时间做图。在30-31分钟出的最大吸收峰,是不含生物素修饰的长度为60碱基的单链dna产物。把hplc纯化后,产物和对照物的以上两个峰图合并,得到如图4所示的比较图。可以明显看到,含有长链生物素的产物和不含长链生物素的对照物,可以在色谱柱上得到有效的分离。二、质谱鉴定hplc纯化后,长链生物素修饰的产物的峰图收集37分钟出的最大吸收峰,进行质谱鉴定。产物的寡核苷酸序列如下所示(5’到3’):tctcggctcctcatgaccgccatgttcttctcctcactgagctgtgcgtagcgcatggct分子量理论值:19128,实测值:19130,其质谱图如图5所示。通过hplc分离提纯,质谱鉴定后表明合成成功。三、不同分子修饰的探针用于捕获实验的测序结果使用bwa、samtools、picard和perl脚本程序对测序数据进行统计分析,结果见表3和图6。从图6中可以看到,分子2和分子3修饰的探针与分子1修饰的探针在比对到目标区域的碱基比例和/或比对到目标区域的读段(reads)比例两个指标上明显更优。更高的比对到目标区域的碱基比例和比对到目标区域的读段(reads)比例预示着可以使用较少的测序数据量达到对目标区域的有效覆盖,进而可以减少测序成本,缩短数据分析时间。表3不同杂交捕获文库测序数据分析结果用于特定基因的捕获测序实验,表明捕获效率比普通的短链生物素明显提高,捕获效率可以达到80%以上,可以有效用于定制化的目标区域基因测序。在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本申请说明书和实施例仅是示例性的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1