基于巯基-烯点击反应的α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷及制备的制作方法
本发明涉及一种α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷及其制备方法,属于有机硅合成技术领域。
背景技术
目前国内外报道的硅烷偶联剂已达100多种,其中三分之一已获得实际应用,用途也深入到各个领域。硅烷偶联剂是继有机硅工业中三大产品:硅油、硅橡胶、硅树脂之后的第四大类产品,其在有机硅工业中的地位日趋重要,己成为现代有机硅工业,有机高分子工业,复合材料工业及相关高技术领域中不可缺少的配套化学助剂,而且是一种重要的高科技含量、高附加值的有机硅产品,被人们形象地称为“工业味精”。
按照硅橡胶交联时脱除的小分子物不同可将其大致分为脱羧酸型,脱酮肟型,脱醇型,脱胺型,脱酰胺型,脱丙酮型及脱羟胺型。脱除的小分子物不同其水解速度不同,且不同型号硅橡胶性质和用途也不同。其中,脱醇型室温硫化硅橡胶固化速度较慢,还需要加入催化剂加快其固化速度。常用的催化剂有有机锡化合物(如二月桂酸二丁基锡、辛酸亚锡)、氨基硅烷等。而有机锡类化合物具有一定毒性,由于催化剂加入后难以在胶料中充分混合均匀而出现局部凝胶化,导致交联反应不够完全。
有机硅化合物结构中,取代基的位置会对有机硅化合物的稳定性产生不同程度的影响。α-官能基硅烷偶联剂由于官能团与硅原子间只隔一个碳原子,因而官能团的电效应对硅原子的影响较大,α-官能基的硅烷偶联剂已被证实具有一定的自催化性能;虽然在碱性条件下容易断裂硅碳键,但是其热稳定性较高;且合成方法简单,不需要用贵金属催化剂。因此开发和研究α-硅烷交联剂有非常大的应用价值。
含硫硅烷偶联剂是硅烷偶联剂中的一大主要的品种,是目前橡胶轮胎企业应用较为广泛的一类有机硅化合物,大致可以分为三类:一类是多硫硅烷偶联剂,主要产品是双(三乙氧基硅基丙基)四硫化物(si69),双(三乙氧基硅基丙基)二硫化物(si75);一类是巯烃基烷氧基硅烷偶联剂,结构为rnsix4-n,其中r为巯烃基,例如ch2sh、ch2ch2ch2sh等,x为och3、och2ch3等。主要产品有γ-巯基丙基三乙氧基硅烷、γ-巯基丙基三甲氧基硅烷;另一类是硫代羧酸酯类硅烷偶联剂,其典型的一种结构为(eto)3sic3h6scor,r=(ch2)nch3(n=0-6)。
在现有技术中已经描述了许多制备含硫有机硅化合物的方法。例如,美国专利文件us5399739描述了制备含硫有机硅烷的方法,该方法包括将碱金属醇化物与硫化氢发生反应形成碱金属硫氢化物,接着将碱金属硫氢化物与碱金属反应以提供碱金属硫化物。然后将生成的碱金属硫化物与硫反应以提供碱金属多硫化物,最后碱金属多硫化物与式x-r2-si(r1)3的硅烷化合物发生反应,其中x是氯或溴,以生成含硫有机硅烷。美国专利文件us5405985、us5663396、us5468893和us5583245中描述了利用相转移催化来制备含硫有机硅化合物,但是在含硫有机硅烷的制备过程中需要控制相催化剂的活性,以便提供能够在工业规模上进行的有效而安全的反应。此外产品的外观、稳定性和纯度并不理想。
“点击”化学概念是2001年诺贝尔化学奖获得者美国化学家sharpless提出的快速合成大量化合物的新方法,点击化学把化学反应过程形象地描述为像鼠标点击一样简单、高效、实用,使其在生物医药、功能材料、表面改性、纳米技术等领域的应用中逐步崭露头角,成为现代合成方法的典范。“点击”化学具有以下特征(1)原料来源广,适用范围广;(2)反应条件温和,对水和氧具有耐受性;(3)立体和区域选择性好;(4)产率高,产品易纯化;(5)反应快速,操作简单。目前,在已报道的点击反应中,研究最多、应用最广的当属cu(i)催化的炔与叠氮之间的1,3—偶极环加成反应(简称cue-aac)。硫醇-烯点击化学是2004年由hoyle系统总结提出的一种新的点击化学类型。xudongwu课题组采用γ-巯基丙基三甲氧基硅烷与乙烯基三乙氧基硅烷于室温下反应24h得到聚合物凝胶,应用于固载铜离子(参见:rscadv.,2014,4:15776-15781.)。中国专利文件cn107345261a公开了一种基于硫醇-烯点击化学法制备的水溶性八羧基倍半硅氧烷鞣剂及其方法,首先通过水解缩合法利用乙烯基三甲氧基硅烷制备了笼型八乙烯基倍半硅氧烷,然后在光引发剂及紫外灯照射条件下,与巯基乙酸发生反应,即得水溶性八羧基倍半硅氧烷鞣剂。由此可见,通过硫醇-烯点击化学实现功能材料的表面改性或功能高分子材料的制备,是一项简捷和高效的研究手段。
作为点击反应的一种,巯基-双键点击反应由于其能在光或热的温和条件下引发而受到人们广泛的关注。它是制备含硫醚键化合物的有效方法,将此方法应用于制备硅烷偶联剂,将大大增加偶联剂的种类,提高制备效率并节约成本。
技术实现要素:
针对现有技术的不足,本发明提供一种α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷及其制备方法。该方法通过光引发的巯基-烯点击反应,使得α-巯甲基三烷氧基硅烷与含双键化合物相连,得到高产率、高纯度的α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷,该方法制备工艺简单,成本低廉,适合大规模工业化生产应用。
本发明的技术方案如下:
一种α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷的制备方法,包括如下步骤:
(1)将醇钠溶解于足量有机溶剂中,然后均匀滴加到氯甲基三氯硅烷中,滴加完后常温反应,常压蒸馏除去有机溶剂并滤去不溶物,减压蒸馏,得到氯甲基三烷氧基硅烷;
(2)将硫脲、氯甲基三烷氧基硅烷和催化剂混合,加热至100~150℃,在氮气氛围中保温反应,反应完毕后将反应体系降温,当反应体系温度降至20~90℃时,向体系缓慢地滴加中和剂,滴加完毕后过滤掉生成的盐,将滤液减压蒸馏,即得α-巯甲基三烷氧基硅烷;
(3)将α-巯甲基三烷氧基硅烷和含双键化合物加入到有机溶剂中,混和均匀,加入引发剂,搅拌均匀,光照进行反应。反应结束后减压蒸馏,在正己烷中沉淀三次,真空干燥至恒重,即得α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷。
根据本发明,优选的,步骤(1)中所述的醇钠为甲醇钠或乙醇钠;进一步优选的,当所述的醇钠为甲醇钠时,所述的溶剂为甲醇,当所述的醇钠为乙醇钠时,所述的溶剂为乙醇;
优选的,所述的溶剂和醇钠的摩尔比为(4~5):1。
根据本发明,优选的,步骤(1)中所述的醇钠和氯甲基三氯硅烷的摩尔比为(2~4):1,进一步优选(3~4):1。
根据本发明,优选的,步骤(1)中所述的醇钠溶液的滴加终点为反应体系ph为中性时,滴加速度为1滴/秒;
优选的,所述的反应温度为室温,反应时间为10min-1h;
优选的,所述的减压蒸馏的压力范围为5mmhg~20mmhg。
根据本发明,优选的,步骤(2)中所述的硫脲和氯甲基三烷氧基硅烷的摩尔比为(1~4):1,进一步优选(1~2):1。
根据本发明,优选的,步骤(2)中所述的催化剂为碘化钾;
优选的,所述的碘化钾的用量是氯甲基三烷氧基硅烷的质量的0~4wt.%,进一步优选1~3wt.%。
根据本发明,优选的,步骤(2)中所述的反应温度为100~150℃,反应时间为1~3小时。
根据本发明,优选的,步骤(2)中所述的中和剂为乙二胺;
优选的,乙二胺的滴加终点为反应体系ph值为6~9时,滴加速度为3滴/秒;
优选的,减压蒸馏的压力范围为5mmhg~20mmhg。
根据本发明,步骤(2)中得到的α-巯甲基三烷氧基硅烷的结构式如式(i)所示:
式(i)中,r为甲基或乙基。
根据本发明,优选的,步骤(3)中所述的含双键化合物为苯乙烯、丙烯酸甲酯、甲基丙烯酸甲酯或1-乙烯咪唑;
优选的,所述的α-巯甲基三烷氧基硅烷与含双键化合物的摩尔比为1:(1~3),进一步优选1:(1~2)。
根据本发明,优选的,步骤(3)中所述的溶剂为四氢呋喃,无水乙醇,无水甲醇,氯仿,二氯甲烷或丙酮,进一步优选四氢呋喃;
优选的,所述的溶剂与α-巯甲基三烷氧基硅烷的重量份比为(1~8):1,进一步优选(1~5):1。
根据本发明,优选的,步骤(3)中所述的引发剂为安息香双甲醚;
优选的,所述的引发剂用量是α-巯甲基三烷氧基硅烷和含双键化合物总质量的0~7wt.%,进一步优选为1~4wt.%。
根据本发明,优选的,步骤(3)中所述的光照时间为0~60min,光波长为200~400nm;
优选的,减压蒸馏以除去溶剂,减压蒸馏的压力范围为5mmhg~20mmhg;
优选的,所述的真空干燥的温度为20~60℃。
根据本发明,基于上述方法所制备的α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷的结构式如式(ii-1)~(ii-4)所示:
式(ii-1)~(ii-4)中,r为甲基或乙基。
本发明的反应路线如下:
其中r为甲基或乙基。
本发明中,氯甲基三氯硅烷与醇钠反应生成氯甲基三烷氧基硅烷和氯化钠为中性,避免了额外加入酸吸收剂的过程;然后以氯甲基三烷氧基硅烷为原料制备α-巯甲基三烷氧基硅烷;以α-巯甲基三烷氧基硅烷为原料,利用巯-烯点击反应制备了一系列α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷,此过程只需要在光引发剂的存在下受到一定强度波长的光照射即可反应,反应条件温和,反应迅速产物纯度高。
本发明的有益效果如下:
(1)本发明α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷的制备方法中,原料为大量的工业副产物氯甲基三氯硅烷,为氯甲基三氯硅烷开辟了高效利用的途径,环保节能,既做到了变废为宝使能源再生利用,又减少了有毒催化剂的使用,符合绿色环保的理念。
(2)本发明的原料和反应试剂易得,产物易通过结晶和蒸馏分离,无需层析柱分离,产品易纯化,符合原子经济。
(3)α-官能团硅烷偶联剂由于官能团和硅原子只相隔一个碳原子,官能团的电子效应更容易传递到硅原子上,使与硅原子直接连接的烷氧基团(ro-)变得比较活泼,容易发生化学反应或偶联作用,具有更大的应用前景。
(4)本发明的合成方法是采用含乙烯基的化合物与带有巯基的三烷氧基硅烷点击加成反应,大大的丰富了硅烷偶联剂的种类。
(5)本发明α-碳上连有硫醚键并含不同官能基的三烷氧基硅烷的制备是一种自由基反应,巯基-烯烃反应不受水和氧的影响,在温和的条件下构筑硫醚键,操作简单。利用点击反应制备含不同官能基的偶联剂不需要昂贵的金属催化剂和手性有机配体,反应条件温和,成本较低。
附图说明
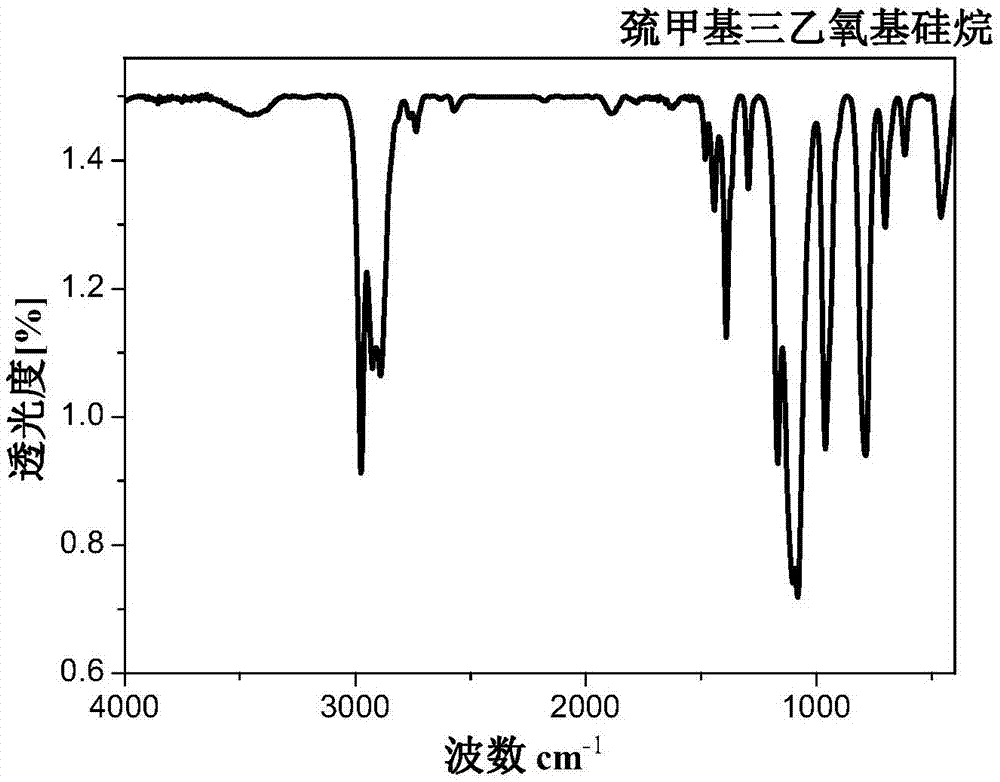
图1为本发明实施例1制得的α-巯甲基三乙氧基硅烷的红外谱图。
图2为本发明实施例1制得的α-巯甲基三乙氧基硅烷的核磁共振氢谱。
图3为本发明实施例2制得的α-(苯乙基)巯甲基三乙氧基硅烷的红外谱图。
图4为本发明实施例2制得的α-(苯乙基)巯甲基三乙氧基硅烷的核磁共振氢谱。
图5为本发明实施例3制得的α-(丙酸甲酯基)巯甲基三乙氧基硅烷的红外谱图。
图6为本发明实施例3制得的α-(丙酸甲酯基)巯甲基三乙氧基硅烷的核磁共振氢谱。
图7为本发明实施例4制得的α-(甲基丙酸甲酯基)巯甲基三乙氧基硅烷的红外谱图。
图8为本发明实施例4制得的α-(甲基丙酸甲酯基)巯甲基三乙氧基硅烷的核磁共振氢谱。
图9为本发明实施例5制得的α-(1-乙基咪唑基)巯甲基三乙氧基硅烷的红外谱图。
图10为本发明实施例5制得的α-(1-乙基咪唑基)巯甲基三乙氧基硅烷的核磁共振氢谱。
图11为本发明实施例6制得的α-巯甲基三甲氧基硅烷的红外谱图。
图12为本发明实施例6制得的α-巯甲基三甲氧基硅烷的核磁共振氢谱。
图13为本发明实施例7制得的α-(苯乙基)巯甲基三甲氧基硅烷的红外谱图。
图14为本发明实施例7制得的α-(苯乙基)巯甲基三甲氧基硅烷的核磁共振氢谱。
图15为本发明实施例8制得的α-(丙酸甲酯基)巯甲基三甲氧基硅烷的红外谱图。
图16为本发明实施例8制得的α-(丙酸甲酯基)巯甲基三甲氧基硅烷的核磁共振氢谱。
图17为本发明实施例9制得的α-(甲基丙酸甲酯基)巯甲基三甲氧基硅烷的红外谱图。
图18为本发明实施例9制得的α-(甲基丙酸甲酯基)巯甲基三甲氧基硅烷的核磁共振氢谱。
图19为本发明实施例10制得的α-(1-乙基咪唑基)巯甲基三甲氧基硅烷的红外谱图。
图20为本发明实施例10制得的α-(1-乙基咪唑基)巯甲基三甲氧基硅烷的核磁共振氢谱。
具体实施方式
下面通过具体实施例对本发明做进一步说明,但不限于此。
实施例中所用原料均为常规原料,市购产品。
实施例1
一种α-巯甲基三乙氧基硅烷的制备方法,包括步骤如下:
(1)将19ml氯甲基三氯硅烷加入到250ml干燥的三口瓶中,将乙醇钠31g溶解于110ml乙醇溶剂中,在氮气保护下通过恒压滴液漏斗将其缓慢滴加到三口瓶中,滴加速度为1滴/秒,当体系ph由酸性变为中性的时候停止滴加。在室温下反应1h后,常压蒸馏除去有机溶剂并滤去不溶物,减压蒸馏,得到氯甲基三乙氧基硅烷,留作后用。
(2)将63.105g氯甲基三乙氧基硅烷和25.120g硫脲和0.957g碘化钾加入250ml干燥三口圆底烧瓶中,加热至110℃,在氮气氛围中保温反应1.5h,降温至90℃,向体系缓慢滴加乙二胺,至体系ph值为7~8时,终止滴加。过滤,将滤液减压蒸馏,真空度为5~6mmhg,收集82~85℃的馏分,即得α-巯甲基三乙氧基硅烷,产率为85%。
所得α-巯甲基三乙氧基硅烷的红外谱图如图1所示,核磁共振氢谱如图2所示。由图1、2可知本实施例制得的产物即为α-巯甲基三乙氧基硅烷。
实施例2
α-(苯乙基)巯甲基三乙氧基硅烷的制备
α-(苯乙基)巯甲基三乙氧基硅烷的结构式如式(iii):
包括步骤如下:
将2.630g实施例1制备的α-巯甲基三乙氧基硅烷和1.302g苯乙烯加入铝箔纸包裹的圆底烧瓶中,然后加入8ml四氢呋喃,混合均匀后,加入0.079g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为5~6mmhg,在正己烷中沉淀三次,在40℃下真空干燥至恒重,即得α-(苯乙基)巯甲基三乙氧基硅烷,纯度为97%,产率为96%。
本实施例所得产物α-(苯乙基)巯甲基三乙氧基硅烷的红外谱图如图3所示,核磁共振氢谱如图4所示。由图3、4可知,本实施例制得的产物即为α-(苯乙基)巯甲基三乙氧基硅烷。
实施例3
α-(丙酸甲酯基)巯甲基三乙氧基硅烷的制备
α-(丙酸甲酯基)巯甲基三乙氧基硅烷的结构式如式(iv):
包括步骤如下:
将2.640g实施例1制备的α-巯甲基三乙氧基硅烷和1.290g丙烯酸甲酯加入铝箔纸包裹的圆底烧瓶中,然后加入8ml四氢呋喃,混合均匀后再加入0.079g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为5~6mmhg,在正己烷中沉淀三次,在40℃下真空干燥至恒重,即得α-(丙酸甲酯基)巯甲基三乙氧基硅烷,纯度为97%,产率为96%。
本实施例所得产物α-(丙酸甲酯基)巯甲基三乙氧基硅烷的红外谱图如图5所示,核磁共振氢谱如如图6所示。由图5、6可知,本实施例制得的产物即为α-(丙酸甲酯基)巯甲基三乙氧基硅烷。
实施例4
α-(甲基丙酸甲酯基)巯甲基三乙氧基硅烷的制备
α-(甲基丙酸甲酯基)巯甲基三乙氧基硅烷的结构式如式(v):
包括步骤如下:
将2.610g实施例1制备的α-巯甲基三乙氧基硅烷和1.800g甲基丙烯酸甲酯加入铝箔纸包裹的圆底烧瓶中,然后加入8ml四氢呋喃,混合均匀后再加入0.088g安息香双甲醚,搅拌均匀后,去掉铝箔纸,在室温下置于功率为20w,波长为365nm紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为5~6mmhg,在正己烷中沉淀三次,在40℃下真空干燥至恒重,即得α-(甲基丙酸甲酯基)巯甲基三乙氧基硅烷,纯度为95%,产率为94%。
本实施例所得产物α-(甲基丙酸甲酯基)巯甲基三乙氧基硅烷的红外谱图如图7所示,核磁共振氢谱如图8所示。由图7、8可知,本实施例制得的产物即为α-(甲基丙酸甲酯基)巯甲基三乙氧基硅烷。
实施例5
α-(1-乙基咪唑基)巯甲基三乙氧基硅烷的制备
α-(1-乙基咪唑基)巯甲基三乙氧基硅烷的结构式如式(vi):
包括步骤如下:
将2.629g实施例1制备的α-巯甲基三乙氧基硅烷和1.176g1-乙烯基咪唑加入铝箔纸包裹的圆底烧瓶中,加入8ml四氢呋喃,混合均匀后再加入0.076g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为5~6mmhg,在正己烷中沉淀三次,在40℃下真空干燥至恒重,即得α-(1-乙基咪唑基)巯甲基三乙氧基硅烷,纯度为96%,产率为96%。
本实施例所得产物α-(1-乙基咪唑基)巯甲基三乙氧基硅烷的红外谱图如图9所示,核磁共振氢谱如图10所示。由图9、10可知,本实施例制得的产物即为α-(1-乙基咪唑基)巯甲基三乙氧基硅烷。
实施例6
一种α-巯甲基三甲氧基硅烷的制备方法,包括步骤如下:
(1)将20ml氯甲基三氯硅烷加入到250ml干燥的三口瓶中,将甲醇钠25g溶解于100ml甲醇溶剂中,在氮气保护下通过恒压滴液漏斗将其慢慢滴加到三口瓶中,滴加速度为1滴/秒,当体系ph由酸性变为中性的时停止滴加。在室温下反应1h后,常压蒸馏除去有机溶剂并滤去不溶物,减压蒸馏,得到氯甲基三甲氧基硅烷,留作后用。
(2)将28.445g氯甲基三甲氧基硅烷和12.690g硫脲和0.430g碘化钾加入三口圆底烧瓶中,加热至110℃,在氮气氛围中保温反应1.5h,降温至90℃,向体系缓慢滴加乙二胺,至体系ph值为7~8时,终止滴加。过滤,将滤液减压蒸馏,真空度为5~7mmhg,收集50~55℃的馏分,即得α-巯甲基三甲氧基硅烷,产率为83%。
本实施例所得α-巯甲基三甲氧基硅烷的红外谱图如图11所示,核磁共振氢谱如图12所示。由图11、12可知,本实施例所得产物为α-巯甲基三甲氧基硅烷。
实施例7
α-(苯乙基)巯甲基三甲氧基硅烷的制备
α-(苯乙基)巯甲基三甲氧基硅烷的结构式如式(vii):
将0.840g实施例6制备的α-巯甲基三甲氧基硅烷和0.625g苯乙烯加入铝箔纸包裹的圆底烧瓶中,然后加入5ml四氢呋喃,混合均匀后,加入0.029g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为7~8mmhg,在正己烷中沉淀三次,在30℃下真空干燥至恒重,即得α-(苯乙基)巯甲基三甲氧基硅烷,纯度为95%,产率为96%。
本实施例所得产物α-(苯乙基)巯甲基三甲氧基硅烷的红外谱图如图13所示,核磁共振氢谱如图14所示。由图13、14可知,本实施例所得产物为α-(苯乙基)巯甲基三甲氧基硅烷。
实施例8
α-(丙酸甲酯基)巯甲基三甲氧基硅烷的制备
α-(丙酸甲酯基)巯甲基三甲氧基硅烷的结构式如式(viii):
包括步骤如下:
将0.336g实施例6制备的α-巯甲基三甲氧基硅烷和0.237g丙烯酸甲酯加入铝箔纸包裹的圆底烧瓶中,然后加入2ml四氢呋喃,混合均匀后,加入0.012g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为7~8mmhg,在正己烷中沉淀三次,在30℃下真空干燥至恒重,即得α-(丙酸甲酯基)巯甲基三甲氧基硅烷,纯度为96%,产率为96%。
本实施例所得产物α-(丙酸甲酯基)巯甲基三甲氧基硅烷的红外谱图如图15所示,核磁共振氢谱如图16所示。由图15、16可知,本实施例所得产物为α-(丙酸甲酯基)巯甲基三甲氧基硅烷。
实施例9
α-(甲基丙酸甲酯基)巯甲基三甲氧基硅烷的制备
α-(甲基丙酸甲酯基)巯甲基三甲氧基硅烷的结构式如式(ix):
包括步骤如下:
将0.504g实施例6制备的α-巯甲基三甲氧基硅烷和0.361g甲基丙烯酸甲酯加入铝箔纸包裹的圆底烧瓶中,然后加入3ml四氢呋喃,混合均匀后,加入0.017g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为7~8mmhg,在正己烷中沉淀三次,在30℃下真空干燥至恒重,即得α-(甲基丙酸甲酯基)巯甲基三甲氧基硅烷,纯度为95%,产率为96%。
本实施例所得产物α-(甲基丙酸甲酯基)巯甲基三甲氧基硅烷的红外谱图如图17所示,核磁共振氢谱如图18所示。由图17、18可知,本实施例所得产物为α-(甲基丙酸甲酯基)巯甲基三甲氧基硅烷。
实施例10
α-(1-乙基咪唑基)巯甲基三甲氧基硅烷的制备
α-(1-乙基咪唑基)巯甲基三甲氧基硅烷的结构式如式(x):
包括步骤如下:
将0.840g实施例6制备的α-巯甲基三甲氧基硅烷和0.565g1-乙烯基咪唑加入铝箔纸包裹的圆底烧瓶中,然后加入5ml四氢呋喃,混合均匀后,加入0.028g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为7~8mmhg,在正己烷中沉淀三次,在30℃下真空干燥至恒重,即得α-(1-乙基咪唑基)巯甲基三甲氧基硅烷,纯度为96%,产率为96%。
本实施例所得产物α-(1-乙基咪唑基)巯甲基三甲氧基硅烷的红外谱图如图19所示,核磁共振氢谱如图20所示。由图19、20可知,本实施例所得产物为α-(1-乙基咪唑基)巯甲基三甲氧基硅烷。
实施例11
将2.625g实施例1制备的α-巯甲基三乙烷氧基硅烷和1.311g苯乙烯加入铝箔纸包裹的圆底烧瓶中,然后加入8ml乙醇,混合均匀后,加入0.080g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为5~6mmhg,在正己烷中沉淀三次,在40℃下真空干燥至恒重,即得α-(苯乙基)巯甲基三乙氧基硅烷,产率为89%。
实施例12
将2.628g实施例1制备的α-巯甲基三乙氧基硅烷和1.302g苯乙烯加入铝箔纸包裹的圆底烧瓶中,然后加入8ml四氢呋喃,混合均匀后,加入0.079g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射20min。反应结束后减压蒸馏除去溶剂,真空度为5~6mmhg,在正己烷中沉淀三次,在40℃下真空干燥至恒重,即得α-(苯乙基)巯甲基三乙氧基硅烷,产率为93%。
实施例13
将2.104g实施例1制备的α-巯甲基三乙氧基硅烷和1.042g苯乙烯加入铝箔纸包裹的圆底烧瓶中,然后加入8ml四氢呋喃,混合均匀后,加入0.063g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为5~6mmhg,在正己烷中沉淀三次,在40℃下真空干燥至恒重,即得α-(苯乙基)巯甲基三乙氧基硅烷,产率为92%。
实施例14
将2.631g实施例1制备的α-巯甲基三乙氧基硅烷和1.313g苯乙烯加入铝箔纸包裹的圆底烧瓶中,然后加入8ml四氢呋喃,混合均匀后,加入0.040g安息香双甲醚,搅拌均匀,去掉铝箔纸,在室温下于功率为20w,波长为365nm的紫外灯下照射30min。反应结束后减压蒸馏除去溶剂,真空度为5~6mmhg,在正己烷中沉淀三次,在40℃下真空干燥至恒重,即得α-(苯乙基)巯甲基三乙氧基硅烷,产率为92%。
- 还没有人留言评论。精彩留言会获得点赞!