PRRSV5’UTR转录物与LPS共感染细胞炎症模型的建立方法与流程
本发明涉及一种免疫细胞炎症模型的建立方法,具体涉及一种prrsv5'utr转录物与lps共感染细胞炎症模型的建立方法。
背景技术:
炎症是临床最常见的病理过程,目前针对炎症的研究在体外主要是采用lps进行造模,但在兽医临床病例中往往是多种病原的混合感染,尤其是病毒与细菌的混合感染。猪繁殖与呼吸综合征(porcinereproductiveandrespiratorysyndrome,prrs)是目前对全球养猪业构成巨大威胁的一类高度接触性传染病,prrs可导致病猪产生严重的多器官全身性炎症反应,尤其是肺部。prrsv主要攻击猪肺泡巨噬细胞(porcinealveolarmacrophage,pam),破坏机体免疫系统,导致猪群免疫抑制,引起一些病毒性或细菌性疾病的继发感染。
技术实现要素:
本发明的目的在于提供一种prrsv5'utr转录物与lps共感染细胞炎症模型的建立方法。
本发明一种prrsv5'utr转录物与lps共感染细胞炎症模型的建立方法,通过转染prrsv5’utrrna转录物进入pam细胞模拟prrsv感染靶细胞启动炎症反应的过程,同时给予lps刺激(抗原),建立prrsv5’utrrna转录物与lps混合感染模型。
进一步的,体外转录prrsv5’utrrna包括以下步骤:
(1)重组质粒pcdna3.1(+)-5’utr的制备;
(2)prrsv5’utrrna的制备。
进一步的,pam细胞的获取方法为筛选4-6周龄prrsv和pcv2抗原抗体均为阴性的仔猪,获取猪肺泡巨噬细胞(pam),具体包括以下步骤:
(1)猪麻醉后,分离气管、食管和肺脏,pbs洗干净肺脏表面,放入超净台中;
(2)止血钳夹紧一侧气管,沿气管注入pbs,轻轻拍打肺脏表面,小心将冲洗液倒入烧杯中;
(3)pbs重复冲洗肺脏2-3次,收集冲洗液;
(4)混匀冲洗液,经8层无菌纱布过滤至新的烧杯中;
(5)混匀过滤好的冲洗液,1500rpm/min,离心5min,收集细胞;
(6)1640培养基重复洗2次;
(7)1640培养基重悬细胞,计数。调整细胞密度为1×107/ml后冻存细胞。
进一步的,所述重组质粒pcdna3.1(+)-5’utr的制备包括以下步骤:
(1)prrsv感染marc-145细胞24h后,收取细胞样品,采用trizol法提取细胞总rna;
(2)普通pcr扩增prrsv5’utr,琼脂糖凝胶电泳后,用tiagen胶回收试剂盒胶回收特异性条带;
(3)对胶回收产物进行双酶切;
(4)t4连接酶连接目的基因(双酶切产物)和载体pcdna3.1(+)dna;
(5)50μldh-5α感受态细胞与连接产物冰上孵育30min,42℃热激60s,冰上孵育3min,加入250μllb液体培养基,37℃,220rpm/min孵育1h;
(6)将上一步的产物涂到lb固体板上,正置吸收后,倒置37℃培养。根据菌落的生长情况,挑取单菌落,放入lb液体培养基中,37℃220rpm/min摇菌12h;
(7)用omega质粒提取试剂盒提取菌液质粒dna,将质粒dna送华大基因测序,用30%甘油保菌,测序结果经ncbiblast与prrsv5’utr序列一致。
进一步的,所述prrsv5’utrrna的制备包括以下步骤:
(1)将100μl上述保存的菌种加入到4ml的lb液体培养基中,37℃220rpm/min摇菌12h,提取质粒dna;
(2)将质粒dna进行单酶切(xho
(3)将酶切产物进行线性化纯化,nd-核酸浓度测定仪测定纯化后的dna浓度;
(4)参照promega公司ribomaxtmlargescalernaproductionsystems-sp6andt7试剂盒(p1300)进行体外rna转录,37℃反应4h;
(5)将步骤(4)中反应得到的rna进行转录纯化;
(6)nd-核酸浓度测定仪测定纯化后rna的浓度,并用琼脂糖凝胶对纯化后的rna进行验证。
进一步的,所述双酶切所用酶为bamh
本发明的有益效果是:本发明通过转染prrsv5’utrrna转录物进入pam细胞模拟prrsv感染靶细胞启动炎症反应的过程,同时给予lps刺激,建立prrsv5’utrrna转录物/lps混合感染模型。相较于直接用prrsv感染细胞,采用prrsv5’utrrna转录物在研究药物的抗炎机理时,可以排除药物对病毒的直接杀灭作用,该模型的建立以期为研究prrsv和细菌混合感染诱导炎症反应的机理以及评价药物对该混合感染造成的炎症反应的影响提供研究模型。
附图说明
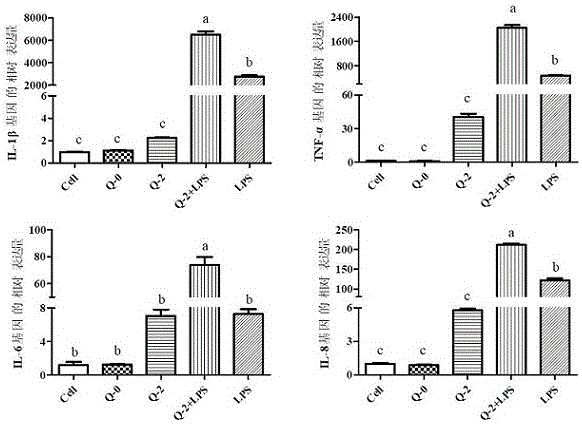
图1为rt-qpcr检测prrsv5’utr对pam细胞炎症因子的影响。
具体实施方式
下面给出的实施例拟对本发明作进一步说明,但不能理解为是对本发明保护范围的限制,本领域技术人员根据本发明内容对本发明的一些非本质的改进和调整,仍属于本发明的保护范围。
本发明一种prrsv5'utr转录物与lps共感染细胞炎症模型的建立方法,通过转染prrsv5’utrrna转录物进入pam细胞模拟prrsv感染靶细胞启动炎症反应的过程,同时给予lps刺激(抗原),建立prrsv5’utrrna转录物与lps混合感染模型。
优选的,体外转录prrsv5’utrrna包括以下步骤:
(1)重组质粒pcdna3.1(+)-5’utr的制备;
(2)prrsv5’utrrna的制备。
优选的,pam细胞的获取方法为筛选4-6周龄prrsv和pcv2抗原抗体均为阴性的仔猪,获取猪肺泡巨噬细胞(pam),具体包括以下步骤:
(1)猪麻醉后,分离气管、食管和肺脏,pbs洗干净肺脏表面,放入超净台中;
(2)止血钳夹紧一侧气管,沿气管注入pbs,轻轻拍打肺脏表面,小心将冲洗液倒入烧杯中;
(3)pbs重复冲洗肺脏2-3次,收集冲洗液;
(4)混匀冲洗液,经8层无菌纱布过滤至新的烧杯中;
(5)混匀过滤好的冲洗液,1500rpm/min,离心5min,收集细胞;
(6)1640培养基重复洗2次;
(7)1640培养基重悬细胞,计数。调整细胞密度为1×107/ml后冻存细胞。
优选的,所述重组质粒pcdna3.1(+)-5’utr的制备包括以下步骤:
(1)prrsv感染marc-145细胞24h后,收取细胞样品,采用trizol法提取细胞总rna;
(2)普通pcr扩增prrsv5’utr,琼脂糖凝胶电泳后,用tiagen胶回收试剂盒胶回收特异性条带;
(3)对胶回收产物进行双酶切;
(4)t4连接酶连接目的基因(双酶切产物)和载体pcdna3.1(+)dna;
(5)50μldh-5α感受态细胞与连接产物冰上孵育30min,42℃热激60s,冰上孵育3min,加入250μllb液体培养基,37℃,220rpm/min孵育1h;
(6)将上一步的产物涂到lb固体板上,正置吸收后,倒置37℃培养。根据菌落的生长情况,挑取单菌落,放入lb液体培养基中,37℃220rpm/min摇菌12h;
(7)用omega质粒提取试剂盒提取菌液质粒dna,将质粒dna送华大基因测序,用30%甘油保菌,测序结果经ncbiblast与prrsv5’utr序列一致。
优选的,所述prrsv5’utrrna的制备包括以下步骤:
(1)将100μl上述保存的菌种加入到4ml的lb液体培养基中,37℃220rpm/min摇菌12h,提取质粒dna;
(2)将质粒dna进行单酶切(xho
(3)将酶切产物进行线性化纯化,nd-核酸浓度测定仪测定纯化后的dna浓度;
(4)参照promega公司ribomaxtmlargescalernaproductionsystems-sp6andt7试剂盒(p1300)进行体外rna转录,37℃反应4h;
(5)将步骤(4)中反应得到的rna进行转录纯化;
(6)nd-核酸浓度测定仪测定纯化后rna的浓度,并用琼脂糖凝胶对纯化后的rna进行验证。
优选的,所述双酶切所用酶为bamh
试验方法:
调整pam细胞密度为1×106/ml,将细胞接种到6孔细胞培养板中,培养2h后弃掉未贴壁细胞,更换细胞培养液继续培养12h。弃掉培养液pbs清洗2-3次后使用qiagen转染试剂(transmessengertransfectionreagent)转染2μgprrsv5’utrrna,转染同时加入1μg/mllps刺激细胞。同时设置细胞对照组、空白转染组、单独prrsv5’utrrna转染组以及lps对照组,分组见表1。转染12h后收集细胞,提取细胞rna,采用rt-qpcr检测il-1β、il-6、il-8和tnf-αmrna表达,引物序列见表2。
表1pam细胞炎症反应模型分组
表25’utr、il-1β、il-6、il-8、tnf-α和gapdh的基因引物序列
试验结果:
经graphpadprismtm5(graphpadsoftware,inc.california,usa)软件进行单因素方差分析(one-wayanova),由图1(不同字母表示差异显著,p<0.05)可以看出,5ˊutrrna转染pam细胞12h后,与细胞对照组、单独5ˊutrrna转染组和lps对照组相比,5ˊutrrna和lps共同作用组中il-1β、il-6、il-8和tnf-αmrna的表达量均显著升高(p<0.05)。
pam细胞转染prrsv5ˊutrrna12h后收集细胞,rt-qpcr检测prrsv5ˊutrrna对pam细胞il-1β、il-6、il-8和tnf-αmrna相对表达量的影响。结果显示:与细胞对照组、单独5ˊutrrna转染组和lps对照组相比,5ˊutrrna和lps共同作用组中il-1β、il-6、il-8和tnf-αmrna的表达量均显著升高。
- 还没有人留言评论。精彩留言会获得点赞!