针对虾早期死亡综合症和白斑病毒的抗体及其应用的制作方法
本发明涉及针对虾早期死亡综合症和白斑病毒的抗体及其应用,更详细地涉及对产卵鸡接种针对虾早期死亡综合症和白斑病毒的抗原,从产卵鸡产下的蛋的卵黄中分离的抗体及其应用技术。
背景技术:
近年来,随着全世界对为了预防成人病而改善饮食生活的关心激增,水产品的需求持续地增加而鱼类养殖的产量正在激增。因此,实际情况是养殖业在许多国家正成为主要的经济手段,养殖鱼类的疾病发生严重影响着经济发展。
养殖鱼类中,作为使虾诱发疾病的主要原因,已知弧菌和白斑病毒。弧菌(vibriogenus)作为革兰氏阴性的杆菌,一端末尾具有1个、根据种类具有2个以上鞭毛(极毛)而活泼地运动,作为代表性的病原菌有引起霍乱的霍乱弧菌(vibriocolera)。作为虾疾病的原因,有被称为肠炎弧菌的副溶血性弧菌(vibrioparahaemolyticus)、哈维氏弧菌(vibrioharveyi)、鳗弧菌(vibrioanguillarum),虾被这样的菌感染时,会在24小时~72小时以内死亡。
白斑病毒(whitespotsyndromevirus,wssv)的形态为具有类似于尾巴的附着物、存在棒(rod)状的衣壳(capsid)及被膜(envelop)。虾被白斑病毒感染时,会在虾的甲壳(carapace)、外肢(appendage)及表皮(cuticle)出现白斑,肝胰脏(hepatopancreas)显现红色,如果感染后经过3~5天则会死亡。
因此,作为用于预防及治疗虾的疾病的方案之一,提出了卵黄抗体(igy)。卵黄抗体是利用鸟类的免疫系统的被动免疫的一种方式,母鸡通过主动免疫而获得的免疫抗体转移到卵黄而向后代传递免疫功能。通过各种研究已证明了卵黄抗体具有疾病的预防及治疗效果,而且也报道了在以高浓度使用卵黄抗体的情况下,能够期待与抗生素几乎相同的治疗效果。此外,由于来自作为完全食品(completefood)的鸡蛋,因此可以说是完全没有对安全性的忧虑的非常有用的物质。
现有专利文献
专利文献
大韩民国注册专利第10-1242821号。
技术实现要素:
发明要解决的问题
本发明的目的在于提供:对产卵鸡接种针对虾早期死亡综合症和白斑综合症的抗原而使其免疫化、从由经免疫化的产卵鸡获得的蛋的卵黄中分离的抗体和利用其的防虾死亡用组合物,饲料或饲料添加剂,疾病预防方法及虾饲养方法。
用于解决问题的方案
本发明提供一种防虾死亡用抗体的制造方法,其包含以下阶段:(a)对产卵鸡接种由作为虾早期死亡综合症的病原体菌的弧菌(vibriogenus)和白斑病毒(whitespotsyndromevirus,wssv)重组蛋白构成的抗原,从而使产卵鸡免疫化的阶段;(b)使经免疫化的产卵鸡产卵的阶段;以及(c)从产卵的蛋的卵黄中分离抗体的阶段。
此外,本发明提供一种防虾死亡用抗体的制造方法,其包含以下阶段:(a)对产卵鸡接种由作为虾早期死亡综合症的病原体菌的弧菌(vibriogenus)、白斑病毒(whitespotsyndromevirus,wssv)重组蛋白以及弧菌外膜蛋白的抗原决定簇部位的重组蛋白构成的抗原,从而使其免疫化的阶段;(b)使经免疫化的产卵鸡产卵的阶段;以及(c)从产卵的蛋的卵黄中分离抗体的阶段。
上述弧菌能够由副溶血性弧菌(vibrioparahaemolyticus)、哈维氏弧菌(vibrioharveyi)以及鳗弧菌(vibrioanguillarum)构成。
上述副溶血性弧菌(vibrioparahaemolyticus)、哈维氏弧菌(vibrioharveyi)以及鳗弧菌(vibrioanguillarum)能够以0.5~1.5:0.5~1.5:0.3~1.0的比混合,优选能够以0.7~1.3:0.7~1.3:0.4~0.7的比混合,更优选能够以1.0:1.0:0.5的比混合。
上述白斑病毒重组蛋白可以为vp28。
上述弧菌外膜蛋白的抗原决定簇部位的重组蛋白可以为ompw(副溶血性弧菌外膜蛋白(outermembraneprotein)w)及ompk(哈维氏弧菌外膜蛋白(outermembraneprotein)k)。
在本发明中,ompw及ompk能够各自表示为v1w及vbk。
此外,本发明提供一种防虾死亡用抗体,其是对产卵鸡接种由副溶血性弧菌(vibrioparahaemolyticus)、哈维氏弧菌(vibrioharveyi)、鳗弧菌(vibrioanguillarum)以及白斑病毒(whitespotsyndromevirus,wssv)重组蛋白构成的抗原后,从产卵鸡产下的蛋的卵黄中分离而得到的。
此外,本发明提供一种虾早期死亡综合症预防或治疗用组合物,其包含以下抗体,上述抗体是对产卵鸡接种由副溶血性弧菌(vibrioparahaemolyticus)、哈维氏弧菌(vibrioharveyi)、鳗弧菌(vibrioanguillarum)以及白斑病毒(whitespotsyndromevirus,wssv)重组蛋白构成的抗原后,从产卵鸡产下的蛋的卵黄中分离而得到的。
此外,本发明提供一种虾白斑综合症预防或治疗用组合物,其包含以下抗体,上述抗体是对产卵鸡接种由副溶血性弧菌(vibrioparahaemolyticus)、哈维氏弧菌(vibrioharveyi)、鳗弧菌(vibrioanguillarum)以及白斑病毒(whitespotsyndromevirus,wssv)重组蛋白构成的抗原后,从产卵鸡产下的蛋的卵黄中分离而得到的。
此外,本发明提供一种虾饲料或饲料添加剂,其包含以下抗体,上述抗体是对产卵鸡接种由副溶血性弧菌(vibrioparahaemolyticus)、哈维氏弧菌(vibrioharveyi)、鳗弧菌(vibrioanguillarum)以及白斑病毒(whitespotsyndromevirus,wssv)重组蛋白构成的抗原后,从产卵鸡产下的蛋的卵黄中分离而得到的。
上述虾饲料或饲料添加剂能够用于预防或治疗虾早期死亡综合症及虾白斑综合症。
此外,本发明提供一种虾的疾病预防方法,其用包含抗体的虾早期死亡综合症预防或治疗用组合物处理虾,上述抗体是对产卵鸡接种由副溶血性弧菌(vibrioparahaemolyticus)、哈维氏弧菌(vibrioharveyi)、鳗弧菌(vibrioanguillarum)以及白斑病毒(whitespotsyndromevirus,wssv)重组蛋白构成的抗原后,从产卵鸡产下的蛋的卵黄中分离而得到的。
此外,本发明提供一种虾的饲养方法,其将包含抗体的虾饲料或饲料添加剂提供给虾,上述抗体是对产卵鸡接种由副溶血性弧菌(vibrioparahaemolyticus)、哈维氏弧菌(vibrioharveyi)、鳗弧菌(vibrioanguillarum)以及白斑病毒(whitespotsyndromevirus,wssv)重组蛋白构成的抗原后,从产卵鸡产下的蛋的卵黄中分离而得到的。
发明效果
根据本发明,对产卵鸡接种针对虾早期死亡综合症及白斑综合症的抗原而使其免疫化,从由经免疫化的产卵鸡获得的蛋的卵黄中分离抗体,从而能够作为防虾死亡用组合物、饲料或饲料添加剂而有用地使用。
此外,本发明的抗体具有如下特征,即,作为虾早期死亡综合症的病原体菌的弧菌和白斑病毒抗原的组成引起协同(上升)效果,因此与单独使用弧菌、白斑病毒的抗体相比显现更优异的抗体效价(potency),由此针对虾早期死亡综合症及白斑病毒的预防或治疗效果优异,而且从产卵鸡生产抗体,因此安全性优越,能够较容易地生产抗体。
附图说明
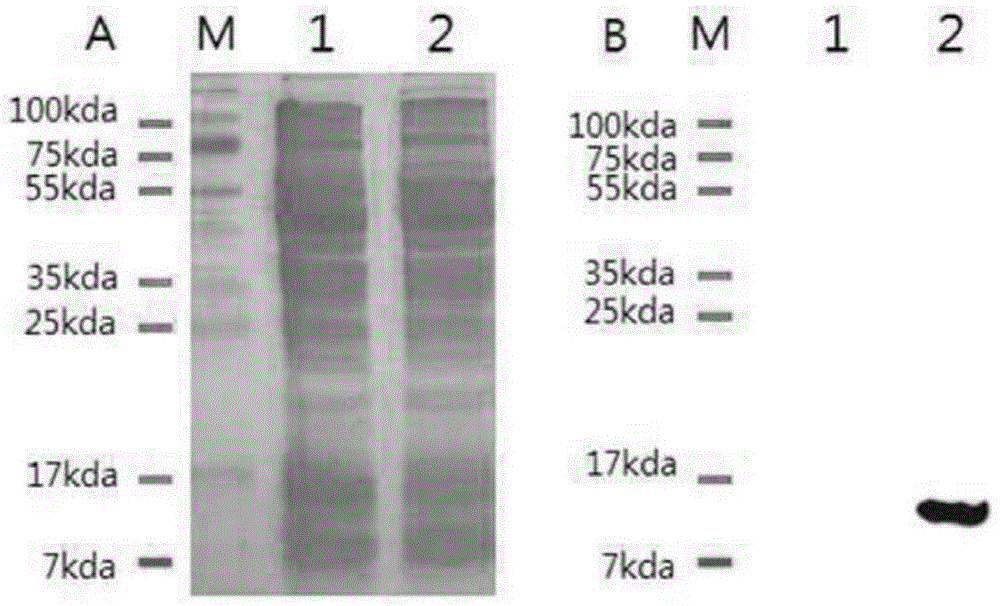
图1为通过sds-page及蛋白质印迹法确认白斑综合症病毒(wssv)的重组蛋白vp28的表达的结果,a:sds-page结果,b:蛋白质印迹法结果,lane1:iptg诱导(induction)前,lane2:iptg诱导后,m:蛋白标记(marker)。
图2为pet-32a(+)ompw质粒的模式图。
图3为pet-32a(+)ompk质粒的模式图。
图4为通过sds-page及蛋白质印迹法确认副溶血性弧菌外膜蛋白的抗原决定簇部位的重组蛋白ompw(v1w)的表达的结果,a:sds-page结果,b:蛋白质印迹法结果,lane1:用iptg诱导(induction)pet-32a(+)原始载体_bl21(de3)前,lane2:用1.0mmiptg诱导(induction)pet-32a(+)原始载体_bl21(de3)iptg后,lane3:用iptg诱导ompw+pet-32a(+)载体_bl21(de3)前,lane4:用1.0mmiptg诱导ompw+pet-32a(+)载体_ompw_bl21(de3)后,m:蛋白标记(marker)。
图5为通过sds-page及蛋白质印迹法确认哈维氏弧菌外膜蛋白的抗原决定簇部位的重组蛋白ompk(vbk)的表达的结果,a:sds-page结果,b:蛋白质印迹法结果,lane1:用1.0mmiptg诱导pet-32a(+)载体_bl21(de3)前,lane2:用1.0mmiptg诱导pet-32a(+)载体_ompw_bl21(de3)后,m:蛋白标记(marker)。
图6为确认在各组别疫苗接种后针对v1(副溶血性弧菌)生成的卵黄抗体效价的结果。横轴表示接种周次(例如:1-1为1次1周),纵轴表示卵黄抗体效价。
图7为确认在各组别疫苗接种后针对vb(哈维氏弧菌)生成的卵黄抗体效价的结果。
图8为确认在各组别疫苗接种后针对va(鳗弧菌)生成的卵黄抗体效价的结果。
图9为确认在各组别疫苗接种后针对wssvvp28(白斑综合症病毒重组蛋白)生成的卵黄抗体效价的结果。
图10为通过sds-page及蛋白质印迹法确认igy的结果。
图11为通过sds-page及蛋白质印迹法确认针对抗原的结合亲和性的结果,1:鳗弧菌(vibrioanguillarum),2:哈维氏弧菌(vibrioharveyi),3:副溶血性弧菌(vibrioparahaemolyticus),4:wssvvp28,m:蛋白标记。
图12为确认在各组别疫苗接种后针对v1(副溶血性弧菌)的生长抑制效果的结果。横轴表示接种后的时间,纵轴表示o.d值。
图13为确认在各组别疫苗接种后针对vb(哈维氏弧菌)的生长抑制效果的结果。
图14为确认在各组别疫苗接种后针对va(鳗弧菌)的生长抑制效果的结果。
具体实施方式
以下,通过实施例对本发明更详细地进行说明。本发明的目的、特征、优点可通过以下的实施例容易地理解。本发明不限定于在此说明的实施例,也能够以其它方式具体化。在此所介绍的实施例是为了能够向本发明所属领域的技术人员充分传达本发明的思想而提供的。因此下述的实施例不对本发明作出限定。
实施例1:防虾死亡用抗体的制造
1-1.早期死亡综合症(earlymortalitysyndrome,ems)抗原的制造
为了准备抗原,获得副溶血性弧菌(vibrioparahaemolyticus)kctc2471、哈维氏弧菌(vibrioharveyi)kctc12724及鳗弧菌(vibrioanguillarum)kctc2711bp,使用添加了3%nacl的胰酶大豆肉汤(trypticsoybroth,tsb),于37℃以120rpm在振荡培养器(shakingincubator)培养20小时。将培养的培养液以6000rpm离心分离(10分钟、4℃)后,回收细胞团(pellet),用pbs清洗2次,制成50ml悬浮液。以使用分光光度计(spectrophotometer)在o.d600nm测定的吸光度值成为0.3的方式进行固定。相对总体积加入37%甲醛(formaldehyde),在室温条件下灭活24小时,作为用于免疫的抗原而使用。
1-2.白斑病毒重组蛋白的制造
为了将白斑病毒的重组蛋白即vp28作为抗原而使用,进行如下准备:制造lb(lysogenybroth)培养基,灭菌后以50ug/ml的浓度添加氨比西林(ampicillin)。在一天前,准备lb培养基量的1%的重组大肠杆菌菌落而进行接种,该菌落表达接种-涂抹于lb琼脂平板(agarplate)而培养的白斑病毒的vp28蛋白(genbank:dq007315.1)。为了生产作为白斑病毒(whitespotsyndromevirus,wssv)的衣壳(capsid)蛋白的vp28重组蛋白而使用大肠杆菌bl21(de3)。通过具有t7启动子的pet30a(+)载体(vector)和vp28基因的连结(ligation)而制造表达载体,将其利用于大肠杆菌的转化。将大肠杆菌涂抹在添加了氨比西林(ampicillin)(50μg/ml)的lb平板培养基(luria-bertaniagarplate),获得转化的菌落,将其接种于15ml添加了氨比西林的lb液体培养基,在37℃振荡培养16小时。将15ml培养液在1.5l添加了氨比西林的新的lb液体培养基中继代培养(subculture),使用分光光度计在600nm波长处测定光学密度(o.d)。在光学密度(o.d)为0.6时以最终1.0mm浓度添加isopropylβ-d-1-thiogalactopyranoside(iptg),由此诱导(induction)基因表达。
添加iptg后追加培养6小时,然后,以6000rpm离心分离30分钟,回收细胞。使通过iptg而过表达的细胞在细胞破碎缓冲液(celllysisbuffer)(50mmtris-hci(ph8.0),1mmedta,100mmnacl)中再悬浮,加入1mg/ml的溶菌酶(lysozyme)和10ug/ml的dnase,在振荡培养器(200rpm、37℃)中搅拌1小时。1小时后,利用超声仪(sonicator)破碎细胞,进行离心分离(6000rpm、30分钟),回收细胞团。利用溶菌酶重复1次上述过程。利用尿素缓冲液(ureabuffer)(100mmtris-hcl(ph8.0),5mmedta,2murea,2%tritonx-100)将用溶菌酶获得的细胞团通过超声仪再破碎一次,回收蛋白质,利用pbs(phosphatebuffersaline)经过透析过程除去尿素,回收的蛋白质在sds-page上最终被确认。sds-page使用10%的sds-page凝胶。
是否表达蛋白质通过蛋白质印迹法(western-blot)进行追加确认。蛋白质印迹法用公知的方法进行。作为试验中使用的第一抗体,使用以1:1000稀释的anti-his-probe-igg,作为试验中使用的第二抗体,使用以1:5000稀释的anti-mouse-igg-hrp。
确认是否表达蛋白质,结果观察到在12kda处的蛋白质的过表达,通过蛋白质印迹法针对附着于重组蛋白靶标的6x-his确认是否表达蛋白质,结果能够确认到以预想蛋白质尺寸表达(图1)。
1-3.弧菌外膜蛋白的重组蛋白的制造
将作为早期死亡综合症的主要抗原的副溶血性弧菌和哈维氏弧菌的外侧外膜蛋白部分中的作为抗原决定簇的表位(epitope)蛋白的重组蛋白即ompw和ompk分别用yuanye,wangxiuli,guosheping,qiuxuemeietal.,genecloningandprokaryoticexpressionofrecombinantoutermembraneproteinfromvibrioparahaemolyticus,chinesejournalofoceanologyandlimnology,vol.29,no.5,p.952-957,2011及liningqiu,baijunjie,wushuqin,fuxiaozhe,laohaihua,yexing,shicunbinetal.,anoutermembraneprotein,ompk,isaneffectivevaccinecandidateforvibrioharveyiinorange-spottedgrouper(epinepheluscoioides),fish&shellfishimmunology,25,829-833,2008中公知的方法进行生产。
为了使ompw和ompk重组蛋白表达,使限制酶bamhⅰ和xhoⅰ在克隆的ta-clone中反应,仅获得插入的基因,使其与novagen公司的pet32a(+)载体(vector)(#69015-3cn)结合,生产重组克隆体(图2、图3)。pet32a(+)载体在n末端具有t7启动子(promoter)基因,能够过表达相当于插入的外部基因的蛋白质,在t7启动子基因后存在6个组氨酸残基重复形成的组氨酸标记(his-tag),因此能够用于检测重组蛋白。将生产的重组克隆体在bl21(de3)感受态细胞(competentcell)(#69450-3cn,novagen)中转化,获得单克隆体,在3ml的lb液体培养基中接种单克隆体,在37℃振荡培养16小时。将培养液在50ml的lb液体培养基再接种后,在37℃振荡培养。利用分光光度计每小时测定吸光度(a600),直至达到0.5~0.6为止进行培养。为了利用表达系统的t7启动子,以最终浓度为1mm的方式添加isopropyl-β-d-thio-galactopyranoside(iptg;sigma,usa)进行培养。然后获得10ml培养液,通过在12000rpm、10min离心分离,仅获得菌体。用1ml裂解缓冲液(lysisbuffer)(50mmnah2po4、300mmnacl)对获得的菌体进行处理使其再悬浮后,添加100μg/ml溶菌酶(lysozyme),使其在25℃反应30分钟。然后,使用超声仪(sonicator)使其溶解(lysis)。接着通过18000rpm、30min离心分离将溶解性部分和不溶性部分分离,不溶性部分通过sds-page确认有无蛋白质表达(图4、图5)。
为了扩增副溶血性弧菌外膜蛋白的抗原决定簇部位的重组蛋白ompw(outermembraneproteinw)的基因,参照注册于genbank的ompw(strainzj2003;genbankaccessionno:dq425109.1)合成引物(primer),将利用它制作的重组克隆体与碱基序列比较,结果显示出99%的相同性。因此,用1.0mm的iptg处理用重组基因pet-32aompw转化的bl21(de3)菌株,培养4小时,结果确认到适合ompw重组蛋白生产(图4)。
并且,为了扩增哈维氏弧菌外膜蛋白的抗原决定簇部位的重组蛋白ompk(outermembraneproteink)的基因,参照注册于genbank的ompk(genbankaccessionno:ay332563.1)制作引物,用pcr将其扩增,确认碱基序列。与参考genbank的碱基序列比较时显示出98%的碱基序列相同性,在使用重组克隆体pet-32aompk将bl21(de3)菌株进行转化时,用1.0mmiptg处理后培养4小时,结果确认到能够高效地生产ompk重组蛋白(图5)。
1-4.用于生产卵黄抗体(igy)的产卵鸡接种用疫苗的制造
为了接种产卵鸡,准备疫苗容器、橡胶盖、pbs(1×)、筛子、镊子、注射器、50ml管、20ul吸量管、20ul移液枪头(tip)、塑料烧杯(500ml、1000ml),将根据实施例1-1至实施例1-3制造的抗原混合的疫苗如下所述制造。
在加热到37±1℃的水槽中加入各种辅助油(adjuvantoil),加热15~20分钟。在灭菌蒸馏水中添加0.1%的37%甲醛溶液,对均质器(homogenizer)进行消毒,除去水汽后,喷洒70%乙醇使其干燥。将冷藏保管的根据实施例1-1至实施例1-3而制造的抗原放置在室温,根据下述表1的组成制造混合抗原。用70%乙醇对混合的抗原进行喷雾,通过用火加热的筛子,以无菌状态进行过滤。混合抗原时,在抗原的最终体积不足的情况下追加灭菌pbs。将混合抗原和辅助油进行混合,运转均质机25分钟,制造产卵鸡接种用疫苗。在包含于表1的疫苗的抗原组成中,将仅由白斑病毒重组蛋白构成的疫苗指定为比较例1、仅由作为虾早期死亡综合症的病原体菌的弧菌构成的疫苗指定为比较例2、由以相同比率混合的弧菌和白斑病毒重组蛋白的混合抗原构成的疫苗指定为实施例1、以1:1:0.5:1:0.5:0.5的比率混合的弧菌、作为白斑病毒重组蛋白及弧菌外膜蛋白的抗原决定簇部位的重组蛋白的ompw(v1w)和ompk(vbk)的混合抗原形成的疫苗指定为实施例2。
表1
-v1:vibrioparahaemolyticus,vb:vibrioharveyi,va:vibrioanguillarum,wssv:whitespotsyndromevirus,v1w:vibrioparahaemolyticusoutermembraneprotein’srecombinantprotein(ompw),vbk:vibrioharveyioutermembraneprotein’srecombinantprotein(ompk)
1-5.产卵鸡的免疫
将根据实施例1-4制造的疫苗对22周龄的hyline-brown系列的产卵鸡的胸肌每次接种1ml。
1-6.卵黄样品的回收
卵黄样品始于每日回收免疫化后的产卵鸡产下的鸡蛋。回收的鸡蛋按日期记录,以七天的间隔进行收集,按周次进行效价的检验。为了采集按各周次的效价确认用样品,按周次随机回收5个鸡蛋,分离卵黄,与相当于重量比10倍的灭菌dw(deionizedwater)进行混合,盛装于50ml管中,冷冻保管24小时。24小时后在37℃加热,然后,在4℃以3500rpm离心分离30分钟,取上清液作为效价分析用样品进行保管。
实施例2:卵黄抗体的效价测定
2-1.ems抗原的omp(outermembraneprotein)分离
当作为早期死亡综合症(ems)的抗原的弧菌的培养结束时,将培养液移到离心管中,在4℃以9000rpm离心分离30分钟,弃去上层液,用pbs清洗离心管2次,用500ml的10mmhepes缓冲液(gibcobrl,usa)使菌悬浮,然后再次进行离心分离,清洗1次。离心分离后弃去上层液,用300ml的10mmhepes缓冲液悬浮细胞团后,每次分配30ml,进行超声波处理使抗原溶解(lysis)。将溶解的上层液在4℃以8000rpm离心分离30分钟,分离上层液,弃去细胞团。对分离的上层液添加1%n-月桂酰基肌氨酸(n-lauroylsarcosine)(sigmausa)后,使其在室温静置10分钟,在4℃以15000rpm离心分离50分钟。弃去上层液,为了除去洗涤剂(detergent),用50ml的10mmhepes缓冲液再次使细胞团悬浮,在4℃以15000rpm离心分离50分钟。离心分离后弃去上层液,用25ml的10mmhepes缓冲液使细胞团(omp)悬浮。细胞团悬浮后进行超声波处理,以0.45um尺寸过滤后,添加福尔马林(formalin)及硫柳汞(thimerosal)。将蛋白质进行定量,为了确认omp抗原的抗原性,使用标准血清以elisa进行检验。
2-2.通过elisa(enzyme-linkedimmunosorbentassay)的卵黄抗体效价确认
卵黄中的特异卵黄抗体的效价应用indirectelisamethod进行测定。首先以按各抗原设定的浓度用碳酸盐涂覆缓冲液(carbonatecoatingbuffer)稀释,在96孔聚苯乙烯板(polystyreneplate)以每孔(well)为100ul的方式进行涂覆,在4℃过夜(overnight)或在37℃放置1小时。用pbs-t(phosphatebuffersaline,0.05%tween20,ph7.4)清洗后,用含有2%bsa(bovineserumalbumin)的pbs缓冲液在37℃进行封闭(blocking),用与上述相同的方法进行清洗。将阴性对照组、阳性对照组及卵黄样品各自稀释2倍,每孔加入100μl,在37℃静置1小时。1小时后清洗3次,将适当量的2次抗体(anti-chicken:sigma,u.s.a)在pbs中稀释,每孔分配100μl后,在37℃反应1小时。然后清洗3次,将作为底物(substrate)的tmb(3,3’,5,5’-tetramethylbenzidine)溶液每孔分配100ul,然后在室温反应约10分钟,分配100ul终止溶液(stopsolution)1.6nh2so4,使反应终止,在450nm的波长处用elisa读取器测定各孔的吸光度而表示elisa值。在测定的结果中代入对阴性样品的平均值进行2倍数处理的卵黄的测定值而表示分析数据的效价。
试验结果如图6~图9所示,能够以各组别确认针对3种弧菌和白斑综合症病毒重组蛋白(wssvvp28)的igy效价。在比较例1的情况下,针对除wssvvp28抗原以外的其它抗原没有形成抗体效价。在比较例2的情况下,显示针对除wssvvp28抗原以外的其它抗原,效价按周次逐渐上升,3次接种以后的效价上升到6400。在实施例1的情况下,显示针对对象抗原,效价按接种周次稳定地上升,但效价上升的极限值显示没有提高到平均6400以上的效价。在实施例2的情况下,显示出以下结果:效价按周次上升,针对所有抗原,提高到平均12800以上的效价,维持上升的效价的期间也比其它组长。上述结果显示:与单独包含弧菌抗原及白斑病毒重组蛋白抗原的比较例1及比较例2相比,实施例2的抗原的效价非常优异。
实施例3:通过硫酸铵(ammoniumsulfate)处理的卵黄抗体的分离
为了纯净地分离生产的特异卵黄抗体蛋白,利用硫酸铵处理法进行分离纯化。回收高效价的卵黄,使用卵黄分离器除去卵白和卵带,用whatmanno.1滤纸(filterpaper)除去卵膜后,在烧杯中仅分离出卵黄。测定分离的卵黄的量,加入重量比4倍的量的1次蒸馏水,搅拌1小时后,使用1mhcl调节为ph5。将该卵黄液在-70℃超低温冰箱中保存一天。将卵黄液在室温放置一天左右,使其融化后,离心分离10分钟(9000rpm、4℃),得到上清液,使用真空泵(vacuumpump)在滤纸上过滤从而进行准备。测定过滤的上清液的体积,将硫酸铵在冰条件下逐渐添加使其充分地融化。将经过硫酸铵处理的溶液在4℃过夜静置后,离心分离(9000rpm、4℃)30分钟,回收细胞团,使其再悬浮于1×pbs缓冲液,回收样品。测定上清液的体积,再次添加硫酸铵,回收细胞团和上清液,通过sds-page和蛋白质印迹法确认特异卵黄抗体的分离纯化纯度。sds-page和蛋白质印迹法用与实施例1-2相同的条件来进行。
试验结果可良好地显示出作为igy抗体的特征的重链(heavychain)(70kda)和轻链(lightchain)(21kda)部分,通过蛋白质印迹法确认的结果,能够确认是卵黄抗体蛋白(图10)。
实施例4:针对抗原的结合亲和性(bindingaffinity)的确认
为了确认针对生产的卵黄抗体的抗原的结合亲和性,使一定量的抗原悬浮于pbs,添加5×样品染料(sampledye)后实施电泳,在膜上进行转移(transfer),利用5%的脱脂乳(skimmilk)封闭后,用pbs-t清洗,将igy抗体以2ug/ml浓度进行处理,在4℃过夜,用pbs-t清洗。用anti-chicken-igg-hrp进行1:20000稀释处理后,利用hrp(horseradishperoxidase)底物来确认结果。
试验结果能够确认到在使用卵黄抗体的各抗原中,卵黄抗体结合在特异性的部位(图11)。
实施例5:针对ems抗原菌的生长抑制的确认
在用卵黄抗体对ems抗原菌进行处理的情况下,为了确认是否显示出生长抑制效能,对1×105cfu/ml浓度的抗原菌同样地用10mg/ml浓度的卵黄抗体进行处理,在o.d600nm处测定0、3、6、9、12、24、36小时的吸光度,确认根据抗原的组成的效果。对ems抗原菌不进行任何处理的试验指定为对照组来进行试验。
试验结果,在比较例1的情况下,由于没有针对ems的抗原,因此显示出与对照组(control)同样的生长曲线,在比较例2的情况下,培养各抗原菌后3~9小时期间,抗原菌的生长稍微减少,但此后与对照组相同的模式显示出生长曲线。在实施例1的情况下,显示出抑制3~9小时为止的抗原菌的生长的效能。在实施例2的情况下,对于所有抗原菌,在3~9小时期间的生长曲线与其它所有试验组相比显示出低的o.d值且低的生长曲线,最终36小时为止的o.d值与其它组相比也显示为低,因此如上述抗体效价试验中确认的一样,维持高的抗体效价而显示出针对抗原的结合力提高(图12~图14)。
实施例6:针对白斑病毒的卵黄抗体效果的确认
为了确认针对白斑病毒(wssv)的卵黄抗体的效果,进行了攻击接种试验。使40天大的白脚虾幼体在25℃的通风性条件的过滤了的海水(盐度30‰)中摄取igy14天。使虾经口感染wssv。根据预试验,因为在第4天虾的死亡率就达到50-70%,所以为了对此进行控制,将1只被wssv感染的虾喂养达到群体当量的约体重的10%的饲料。经过96小时,每日记录累积死亡率,结果用死亡率(%)来表示。同时,将没被wssv感染的虾试验组指定为正常试验组、将被wssv感染的虾的试验组指定为阳性试验组而进行试验。
试验结果,在作为针对wssv的单抗原组成试验组的比较例1的情况下,显示出与阳性对照组(positivecontrol)相比死亡率减少了约11%左右。在没有针对wssv的抗原的比较例2的情况下,显示出死亡率为68.75%。在作为复合抗原组成的实施例1、实施例2的情况下,显示出死亡率与阳性对照组相比减少了15~28.75%左右。在抗原组中确认到,实施例2以41.25%的死亡率在所有试验组中显示出最低的死亡率,因此实施例2的抗原组合最适合作为防虾死亡用疫苗(表2)。
表2
以上详细地记载了本发明内容的特定的部分,对本领域技术人员而言,这样的具体的记载仅为优选的实施方式,本发明的范围并不限定于这些,因此,本发明的实质性的范围可定义为所附的权利要求及其等同物。
- 还没有人留言评论。精彩留言会获得点赞!