一种核壳结构的磁性固定化酶载体及其制备方法和应用与流程
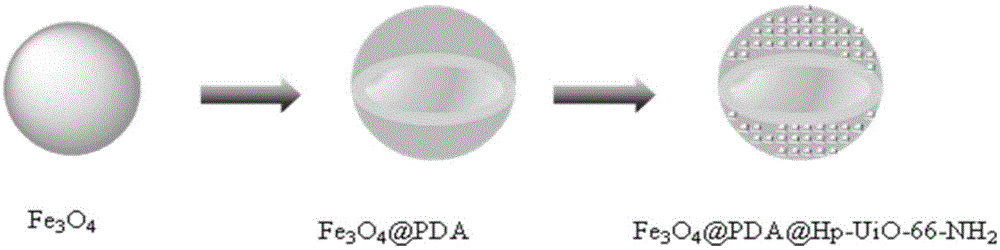
本发明属于生物化工领域,具体涉及一种核壳结构的磁性固定化酶载体及其制备方法和在酰胺酶固定化中的应用。
背景技术:
固定化酶因具有高稳定性、易于产物分离、可循环使用等优点,在生物催化、生物检测等领域得到广泛的应用和发展。酶固定化技术的关键因素之一是固定化载体的筛选和制备。载体的材质和结构对固定化酶的催化性能、稳定性具有重要的影响。因此,开发一种高催化活力、高稳定性的固定化载体在酶固定化和生物催化领域具有重要应用价值。
近年来,随着材料科学及纳米技术的迅速发展,各种新型载体如无机多聚材料、多孔硅(acs.appl.mater.inter.,2014,6,2622-2628)、纳米凝胶、碳纳米载体(j.ind.eng.chem.,2013,19,279-285)、磁性纳米复合材料载体已被广泛地应用于酶的固定化。但是,上述多孔材料由于孔径限制易使传质受限,导致底物与酶活性中心接触障碍;上述纳米凝胶载体制备复杂、条件控制严格,且不易后续分离和重复使用。
其中,磁性纳米复合材料载体由于可以提高固定化酶在溶液中的分散性,同时有效提高共价固定化酶的稳定性,已被大量研究。中国专利文献cn103525805公开了一种可再生的磁性固定化酶载体及其制备方法,包括合成磁性fe3o4纳米颗粒;制备核壳结构的fe3o4@tio2磁性纳米复合物;制备锐钛矿型fe3o4@tio2纳米复合物,对纳米复合物表面进行功能化修饰从而得到fe3o4@tio2固定化酶载体,上述制备方法繁琐,且得到的固定化酶载体的载酶量较低,其载酶的稳定性也有待进一步提高。
金属有机框架(metal-organicframeworks),简称mofs,是由有机配体和金属离子或者团簇通过配位键自组装形成的具有分子内空隙的有机-无机杂化材料,广泛应用于催化、吸附、生物分离、载药等领域。mofs具有合成简单、比表面积大、结构多样和易于功能化修饰等特点,是一种理想的固定化酶载体。但是,目前报道的大多数金属有机框架材料孔径需要改善才能用于固定化,并且分离方法也需要改进。
因此,本发明在改善金属有机框架的基础上,结合磁性材料所构建的新型磁性金属有机框架在酶固定化领域具有重大的应用价值。
技术实现要素:
本发明的目的在于提供了一种核壳结构的磁性固定化酶载体的制备方法,得到的磁性固定化酶载体生物相容性好、可重复利用、酶载量高,还可以应用于酰胺酶固定化中,应用得到的固定化酰胺酶的酶活回收率高、稳定性好。
本发明的技术方案如下:
一种核壳结构的磁性固定化酶载体的制备方法,包括如下步骤:
(1)将四氧化三铁纳米颗粒加入含多巴胺的tris-hcl缓冲溶液中,搅拌、洗涤、烘干后得到四氧化三铁多巴胺核颗粒;
(2)将步骤(1)得到的四氧化三铁多巴胺核颗粒与氯化锆以及月桂酸混合溶于有机溶剂,超声得到混合溶液;再向混合溶液中加入氨基对苯二甲酸,在75~85℃条件下保温1~3h后升温到100~120℃保温10~24h,再经过后处理,得到所述磁性固定化酶载体。
本发明以fe3o4磁性纳米颗粒作为载体的核,并进行表面包裹多巴胺薄层以及外层合成金属有机框架(hp-uio-66-nh2),进而合成多层次核壳结构的磁性固定化酶载体。
本发明在合成磁性多巴胺纳米颗粒的基础上,利用调制剂诱导缺陷形成,通过将金属前驱体氯化锆与过量的调制剂月桂酸混合,再加入不足量的有机配体氨基对苯二甲酸来替代调制剂,最后通过后处理除去调制剂,形成具有调制剂介孔缺陷框架结构,增加了金属有机框架的孔径,得到相对稳定的多级孔金属有机框架。
多级孔金属有机框架利用其增加的孔径使得其作为酶载体有利于酶的加载,增加了载体的酶载量,同时外壳多层次金属有机框架上引入的氨基可以与酶蛋白表面上氨基共价交联进而将酶稳定的固定在磁性多级金属有机框架载体上,使得所得到的固定化酶稳定性好。
步骤(1)中,所述多巴胺溶液的浓度为1~5mg/ml,优选为1~2mg/ml,这是由于所述浓度的多巴胺溶液可以在纳米颗粒表面涂覆一定厚度的多巴胺涂层,既能达到螯合金属目的,又能使得纳米颗粒保留较好的磁场强度,有利于后续分离。
步骤(2)中,所述的氨基对苯二甲酸、氯化锆、月桂酸以及四氧化三铁多巴胺核颗粒的质量比为1:2~6:50~80:60~100,质量比进一步优选为1:2~4:60~70:65~75,合成获得的多孔有机框架孔径最大,有利于后续载酶。
步骤(2)中,所述的后处理方法为:将得到的产物用外部磁铁分离,洗涤后溶于含浓盐酸的有机溶剂中70~90℃保温10~24h,洗涤烘干得到所述磁性固定化酶载体,上述后处理方法可以充分地活化所得到的产物并将反应体系中的竞争性配体除去。
其中,所述浓盐酸的质量百分比浓度为0.1%~0.5%。
步骤(1)和步骤(2)中,所述的有机溶剂为n,n-二甲基甲酰胺。
本发明还公开了一种由上述方法制备的核壳结构的磁性固定化酶载体以及所述磁性固定化酶载体在酰胺酶固定化中的应用。
所述的应用方法具体为:将所述磁性固定化酶载体分散于缓冲液中,超声得到悬浮液;再向悬浮液中加入酰胺酶和硫酸铵,搅拌均匀后加入0.1%~2.0%的戊二醛溶液并在0~5℃下震荡1~5h,最后用外部磁铁分离,洗涤、冷冻、干燥后得到固定化酰胺酶。
所述的酰胺酶与磁性固定化酶载体的质量比为1:2~7。
所述缓冲液的ph值为5.0~9.0,优选地,所述缓冲溶液为ph7.0的k2hpo4-kh2po4缓冲溶液,在此条件下能较好的保留游离酶活性。
所述硫酸铵终浓度为30%~80%,优选为50%的饱和硫酸铵终浓度,这个浓度下所得到的固定化酰胺酶的酶活回收率较高。
本发明与现有技术相比,具有以下有益效果:
(1)本发明制备固定化酶载体的方法简单、反应条件温和、易于操作;
(2)本发明的固定化酶载体具有较好的生物相容性,同时具有易于分离、可重复利用、酶载量高的优势,是一种理想的固定化酶载体;
(3)本发明将磁性固定化酶载体应用于酰胺酶的固定化中,可以使得到的固定化酰胺酶的酶活回收率高、热稳定性和有机溶剂耐受性好。
附图说明
图1为本发明制备核壳结构的磁性固定化酶载体的流程图;
图2为实施例1制备的四氧化三铁多巴胺核颗粒和磁性固定化酶载体的扫描电镜图和透射电镜图;
图3为实施例1制备的四氧化三铁纳米颗粒、四氧化三铁多巴胺核颗粒和磁性固定化酶载体的红外光谱图;
图4为实施例1制备的四氧化三铁纳米颗粒、四氧化三铁多巴胺核颗粒和磁性固定化酶载体的x衍射光谱图;
图5为实施例1制备的四氧化三铁纳米颗粒、四氧化三铁多巴胺核颗粒和磁性固定化酶载体的磁滞曲线;
图6为应用例4制备的固定酰胺酶的热稳定性示意图;
图7为应用例5制备的固定酰胺酶有机溶剂稳定性示意图。
具体实施方式
下面结合具体实施例对本发明作进一步的描述,但本发明的保护范围并不仅限于此。
实施例1
(1)将80ml乙二醇、1.5g聚乙二醇、1.3g三氯化铁、6.0g醋酸钠、1.0g柠檬酸钠和75μl蒸馏水依次加入到100ml的圆底烧瓶,并在室温下磁力搅拌30min形成均匀透明溶液;再将溶液转移到100ml反应釜,在180℃保温3h,升温至200℃保温9h,冷却至室温,用无水乙醇和蒸馏水多次洗涤,最后在50℃条件下真空烘干,得到四氧化三铁纳米颗粒(fe3o4);
(2)将50mg多巴胺溶于10mltris-hcl缓冲溶液(100mm,ph8.5)中,然后将步骤(1)合成的四氧化三铁纳米颗粒(1g)加入到多巴胺溶液中,25℃下搅拌12h,最后用蒸馏水洗涤3次并在50℃真空条件下烘干12h,得到四氧化三铁多巴胺核颗粒(fe3o4@pda);
(3)将氯化锆(0.019g)和月桂酸(0.48g)加入到80ml的n,n-二甲基甲酰胺(dmf)溶液中,再加入四氧化三铁多巴胺核颗粒(0.5g),混匀超声10min得到混合溶液;再向混合溶液中加入氨基对苯二甲酸(0.007g)并转移到反应釜中80℃下保温2h,升温至100℃并保温12h;最后将得到产物用外部磁铁分离,并用dmf洗涤3次,然后加入100ml含有2ml浓盐酸的dmf在80℃下保温12h,最后用dmf洗涤多次并在40℃真空条件下烘干24h,得到核壳结构的磁性固定化酶载体(fe3o4@pda@hp-uio-66-nh2)。
图1为本发明制备核壳结构的磁性固定化酶载体的流程图;
图2为上述fe3o4多巴胺核颗粒和磁性固定化酶载体的扫描电镜图和透射电镜,其中a和b分别为fe3o4@pda,fe3o4@pda@hp-uio-66-nh2扫描电镜图;c和d分别为fe3o4@pda,fe3o4@pda@hp-uio-66-nh2透射电镜图。由图2可知,四氧化三铁颗粒(粒径为200nm)成功被合成并作为核壳结构的核,经过多巴胺涂层的纳米颗粒外观明显光滑,最后在外层成功的合成了多级孔金属有机框架,颗粒增大外观明显粗糙,说明金属有机框架晶体成功合成。
图3为上述fe3o4纳米颗粒、fe3o4多巴胺核颗粒和磁性固定化酶载体的红外光谱图;图3中曲线自上而下依次为fe3o4,fe3o4@pda,fe3o4@pda@hp-uio-66-nh2。由图3可知,四氧化三铁特征波长583cm-1,以及1274cm-1、1324cm-1伸缩振动源于n-h、c-o存在、1513cm-1出现源于c=o化学键形成,进一步确定核壳结构磁性金属有机框架成功合成。
图4为上述fe3o4纳米颗粒、fe3o4多巴胺核颗粒和磁性固定化酶载体的x衍射光谱图;图4中曲线自上而下依次为fe3o4,fe3o4@pda,fe3o4@pda@hp-uio-66-nh2。由图4可知,可以明显观察到四氧化三铁以及金属有机框架的特征衍射峰,说明成功合成核壳结构磁性金属有机框架。
图5为上述fe3o4纳米颗粒、fe3o4多巴胺核颗粒和磁性固定化酶载体的磁滞曲线;图5中曲线自上而下依次为fe3o4,fe3o4@pda,fe3o4@pda@hp-uio-66-nh2。由图5可知,四氧化三铁颗粒经过多巴胺涂层修饰,然后在表面合成多级孔金属有机框架,其磁场强度虽然减弱,但是仍然保留一定的磁性强度,满足后续作为载体用于分离要求。
实施例2
(1)与实施例1中所述步骤(1)一致;
(2)与实施例1中所述步骤(2)一致;
(3)将氯化锆(0.037g)和月桂酸(0.91g)加入到150ml的n,n-二甲基甲酰胺(dmf)溶液中,再加入四氧化三铁多巴胺核颗粒(1.0g),混匀超声20min得到混合溶液;再向混合溶液中加入氨基对苯二甲酸(0.01g)并转移到反应釜中90℃下保温2h,升温到100℃保温10h;最后将得到产物用外部磁铁分离,并用dmf洗涤3次,然后在80ml含有5ml浓盐酸的dmf中70℃保温12h,最后用dmf洗涤多次并在40℃下真空烘干24h,得到核壳结构的磁性固定化酶载体。
应用例1
称取0.5g实施例1制备的磁性固定化酶载体加入到20ml磷酸钾缓冲液(ph7.0),超声混匀10min得到混合液;再将80mg粗酰胺酶加入并溶解在混合液中,然后添加至终浓度为50%饱和硫酸铵,在4℃下搅拌30min,继续添加终浓度0.6%戊二醛(w/v)溶液,搅拌3h完成固定化;最后用磁铁分离固定化酶,所得固定化酶用100mm磷酸钾缓冲液(ph7.0)清洗3次,获得固定化酰胺酶,进行冷冻干燥,再放置于4℃冰箱保存备用。
得到的固定化酰胺酶载酶量达到75mg/g载体,酶活回收率到达93.6%。
应用例2
称取0.5g实施例1制备的磁性固定化酶载体加入到20ml磷酸钾缓冲液(ph7.0),超声混匀10min获得混合液;将130mg粗酰胺酶加入并溶解在该混合液中,然后添加至终浓度50%饱和硫酸铵,在4℃下搅拌30min,再添加终浓度至1.0%戊二醛(w/v)溶液,搅拌3h完成固定化;最后用磁铁分离固定化酶,所得固定化酶用100mm磷酸钾缓冲液(ph7.0)清洗三次,获得固定化酰胺酶,进行冷冻干燥,再放置4℃冰箱保存备用。得到的固定化酰胺酶载酶量达到106.5mg/g载体,酶活回收率到达90.6%。
应用例3
称取1.0g实施例2制备的磁性固定化酶载体加入到30ml磷酸钾缓冲液(ph7.0),超声10min,将200mg粗酰胺酶加入并溶解在ph为7.0的磷酸钾盐缓冲液中,然后添加至终浓度60%饱和硫酸铵,在4℃下搅拌30min,再添加终浓度至0.5%戊二醛(w/v)溶液,搅拌4h,固定化结束;用磁铁分离固定化酶,所得固定化酶用100mm磷酸钾盐缓冲液(ph7.0)清洗三次,获得固定化酰胺酶,进行冷冻干燥,再放置4℃冰箱保存备用。
得到的固定化酰胺酶的载酶量达到186.5mg/g载体,酶活回收率到达85.6%。
应用例4
称取2.0g实施例2制备的磁性固定化酶载体加入到40ml磷酸钾缓冲液(ph7.0),超声10min,将250mg粗酰胺酶加入在ph为7.0的磷酸钾缓冲液中,然后添加至终浓度60%饱和硫酸铵,在4℃下搅拌30min,再添加终浓度至0.8%戊二醛(w/v)溶液,搅拌2h,固定化结束;用磁铁分离固定化酶,所得固定化酶用100mm磷酸钾缓冲液(ph7.0)清洗三次,获得固定化酰胺酶,进行冷冻干燥,再放置4℃冰箱保存备用。
将固定化酰胺酶置于100mm的甘氨酸-氢氧化钠(ph9.0)缓冲溶液中,分别在30℃、40℃、50℃保温20天,不同时间下固定化酰胺酶剩余酶活力如图6所示,由图6可知,在30℃条件下保温20天后还能保留90.1%的原始固定化酰胺酶活力。
应用例5
称取2.0g实施例2制备的磁性固定化酶载体加入到40ml磷酸钾缓冲液(ph7.0),超声10min,将300mg粗酰胺酶加入ph为7.0的磷酸钾盐缓冲液中,然后添加至终浓度60%饱和硫酸铵,在4℃下搅拌30min,再添加终浓度至0.5%戊二醛(w/v)溶液,搅拌2h,固定化结束;用磁铁分离固定化酶,所得固定化酶用100mm磷酸钾盐缓冲液(ph7.0)清洗三次,获得固定化酰胺酶,进行冷冻干燥,再放置4℃冰箱保存备用。
将获得的固定化酰胺酶分别放置在n,n-二甲基酰胺、n,n-二甲基亚砜、乙醇、甲醇中25℃保温24h,固定化酰胺酶在不同有机溶剂中的相对酶活率如图7所示,由图7可知,固定化酰胺酶的残余酶活分别为59.1%、83.2%、53.2%、67.3%,相比于游离酶表现出较好的有机溶剂耐受性。
综上所述,本发明得到的核壳结构的磁性固定化酶载体的载酶量较高,是一种理想的固定化酶载体;将酰胺酶固定在所述载体上得到的固定化酰胺酶的酶活回收率高、热稳定性好。
- 还没有人留言评论。精彩留言会获得点赞!