一种合成α-碘代环戊烯酮类化合物的方法与流程
本发明属于化学合成技术领域,具体涉及一种合成α-碘代环戊烯酮的方法。
背景技术
卤代羰基化合物是有机合成、生物医学以及制药等领域的重要中间体。其中最常见的是α-卤代酮,且大多数具有潜在的生物活性。例如,georgesakoulas等报道了一种新型天然产物merochlorina,具有体外抗多药革兰氏阳性菌的活性,并且具有与其它抗菌剂具有完全不同的骨架结构。卤素原子的引入将为包括天然产物、药物等在内的功能分子的进一步化学转化提供一些新颖的方法。
然而已知的α-碘代酮的合成方法底物仅仅局限于非环状α-碘代酮,而由非环状的前体化合物高效合成α-碘代环状烯酮则未见报道。本发明提供一种条件温和、操作简便、产率较高、底物适用性较好的合成α-碘代环戊烯酮的制备方法,将为α-碘代酮及复杂天然产物的合成提供新的途径。
技术实现要素:
本发明的目的是针对上述问题,提供一种底物官能团兼容性好、产物收率高的合成α-碘代环戊烯酮的方法。
为解决上述技术问题,本发明提供了如下技术方案:本发明的α-碘代环戊烯酮类化合物,所述的α-碘代环戊烯酮类化合物的结构通式:
式中,r1、r2为各自独立的基团,且碳数为1~16;
r1为取代基团,包括苯基、萘基、卤代苯基、环烷基中的任意一种;
r2为取代基团,包括甲基、链状烷基、环烷基、羰基、酯基、苯磺酰基、苯基、含氮杂环基团中的一种或者几种的组合。
本发明所述的合成α-碘代环戊烯酮类化合物的方法,包括如下步骤:先依次加入甲基叔丁基醚、烯炔酯、(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i),搅拌1小时后通过tlc确认原料全部反应完再加入n-碘代丁二酰亚胺,常温常压下搅拌2小时,然后将反应液旋蒸浓缩,并通过硅胶柱层析得到目标产物α-碘代环戊烯酮。
进一步地,所述的烯炔酯包括以下所示烯炔酯类化合物,
式中,r1、r2同上述r1、r2对应一致。
进一步地,所述的烯炔酯在甲基叔丁基醚中的浓度为0.1mol/l。
更进一步地,所述的烯炔酯与(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i)的摩尔比为1∶0.02。
进一步地,所述的烯炔酯与n-碘代丁二酰亚胺的摩尔比为1∶2。
进一步地,所述的旋蒸的转速为150~300rpm,温度为35~45℃,真空度为0.05~0.09mpa,处理时间为5~15min。
更进一步地,所述的硅胶柱层析,采用200~300目柱层析硅胶,洗脱剂为乙酸乙酯∶石油醚=1~30∶100。
有益效果:本发明整个反应在常温常压下进行,具有操作简便、条件温和、底物官能团兼容性好、产物收率高、催化剂与产物易分离等优点。研发制得的α-碘代环戊烯酮类化合物具有较高的反应活性,可以作为一类重要的有机中间体应用于医药、农药以及天然产物的合成等领域。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
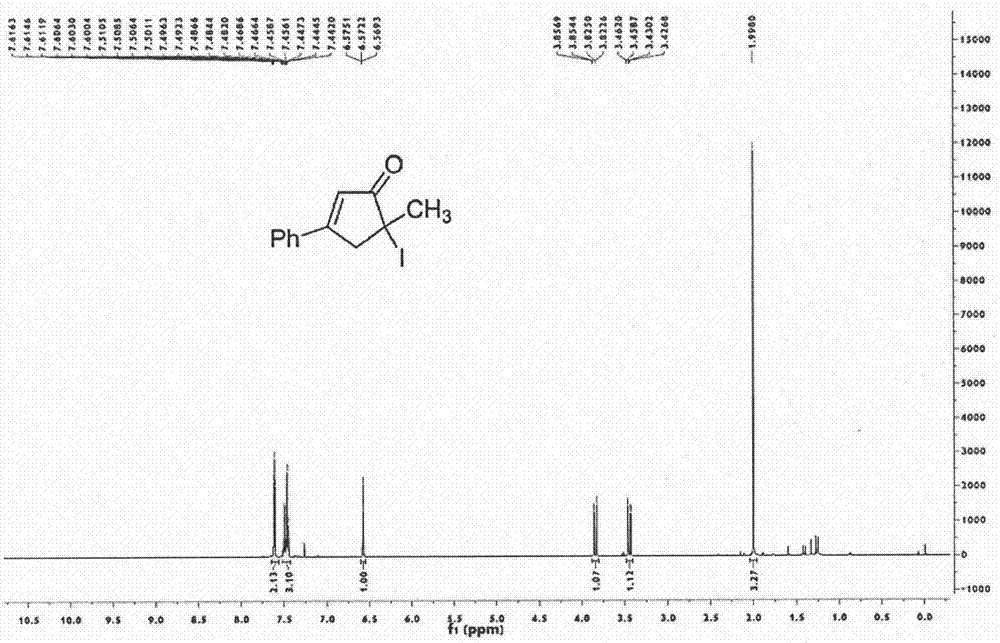
图1为化合物2a的核磁氢谱图;
图2为化合物2a的核磁碳谱图,图1和图2表明化合物2a结构正确;
图3为化合物2b的核磁氢谱图;
图4为化合物2b的核磁碳谱图,图3和图4表明化合物2b结构正确;
图5为化合物2c的核磁氢谱图;
图6为化合物2c的核磁碳谱图,图5和图6表明化合物2c结构正确;
图7为化合物2d的核磁氢谱图;
图8为化合物2d的核磁碳谱图,图7和图8表明化合物2d结构正确;
图9为化合物2e的核磁氢谱图;
图10为化合物2e的核磁碳谱图,图9和图10表明化合物2e结构正确;
图11为化合物2f的核磁氢谱图;
图12为化合物2f的核磁碳谱图,图11和图12表明化合物2f结构正确;
图13为化合物2g的核磁氢谱图;
图14为化合物2g的核磁碳谱图,图13和图14表明化合物2g结构正确;
图15为化合物2h的核磁氢谱图;
图16为化合物2h的核磁碳谱图,图15和图16表明化合物2h结构正确。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
实施例1
取25ml圆底烧瓶,依次加入5ml甲基叔丁基醚、烯炔1a(107.2mg,0.5mmol)、(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i)(7.8mg,0.01mmol),搅拌1小时后通过tlc确认原料全部反应完再加入n-碘代丁二酰亚胺(225mg,1mmol)。常温常压下,以500rpm搅拌2小时。然后使用heidolph旋转蒸发仪旋蒸,其转速为150rpm,温度为42℃,真空度为0.06mpa,处理时间为10min。再通过200~300目硅胶柱层析,洗脱剂为乙酸乙酯∶石油醚=3∶100,分离得到目标产物2a(136.7mg,0.46mmol,产率93%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度高)。
1hnmr(600mhz,cdcl3):δ7.62-7.60(m,2h),7.51-7.44(m,3h),6.60(t,1h,j=1.7hz),3.86(dd,1h,j=19.1,1.5hz),3.47(dd,1h,j=19.1,2.0hz),2.02(s,3h);13cnmr(150mhz,cdcl3):δ204.8,167.2,133.1,131.9,129.1,127.0,121.9,51.2,37.7,30.6.
实施例2
取25ml圆底烧瓶,依次加入5ml甲基叔丁基醚、烯炔1b(151mg,0.5mmol)、(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i)(7.8mg,0.01mmol),搅拌1小时后通过tlc确认原料全部反应完再加入n-碘代丁二酰亚胺(225mg,1mmol)。常温常压下,以500rpm搅拌3小时。然后使用heidolph旋转蒸发仪旋蒸,其转速为150rpm,温度为42℃,真空度为0.06mpa,处理时间为10min。再通过200~300目硅胶柱层析,洗脱剂为乙酸乙酯:石油醚=5:100,分离得到目标产物2b(176.7mg,0.46mmol,产率92%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度高)。
1hnmr(600mhz,cdcl3):δ7.60(d,2h,j=7.3hz),7.50-7.43(m,3h),6.59(s,1h),4.08(t,2h,j=6.3hz),3.69(d,1h,j=19.2hz),3.46(dd,1h,j=19.2,1.8hz),2.20-2.15(m,1h),2.01(s,3h),1.94-1.88(m,1h),1.74-1.63(m,2h).
13cnmr(150mhz,cdcl3):δ204.2,171.0,167.7,132.9,132.0,129.2,127.0,122.5,63.6,48.3,44.6,37.9,27.5,21.0.
实施例3
取25ml圆底烧瓶,依次加入5ml甲基叔丁基醚、烯炔1c(243.8mg,0.5mmol)、(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i)(7.8mg,0.01mmol),搅拌1小时后通过tlc确认原料全部反应完再加入n-碘代丁二酰亚胺(225mg,1mmol)。常温常压下,以500rpm搅拌2小时。然后使用heidolph旋转蒸发仪旋蒸,其转速为150rpm,温度为42℃,真空度为0.06mpa,处理时间为10min。再通过200~300目硅胶柱层析,洗脱剂为乙酸乙酯∶石油醚=20∶100,分离得到目标产物2c(245.7mg,0.43mmol,产率86%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度高)。
1hnmr(600mhz,cdcl3):δ7.57-7.56(m,2h),7.50-7.49(m,1h),7.47-7.43(m,4h),7.30-7.28(m,3h),7.23(d,2h,j=8.0hz),7.05-7.03(m,2h),6.55(t,1h,j=1.6hz),3.63-3.56(m,3h),3.34(dd,1h,j=19.1,1.9hz),2.41(s,3h),2.16(t,1h,j=10.3hz),1.75-1.69(m,2h),1.58-1.54(m,1h).
13cnmr(150mhz,cdcl3):δ204.1,167.7,143.5,139.0,134.9,132.9,131.9,129.4,129.1,129.1,128.7,128.0,127.7,127.0,122.4,49.9,48.5,44.7,38.2,27.1,21.6.
实施例4
取25ml圆底烧瓶,依次加入5ml甲基叔丁基醚、烯炔1d(141.2mg,0.5mmol)、(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i)(7.8mg,0.01mmol),搅拌1小时后通过tlc确认原料全部反应完再加入n-碘代丁二酰亚胺(225mg,1mmol)。常温常压下,以500rpm搅拌2小时。然后使用heidolph旋转蒸发仪旋蒸,其转速为150rpm,温度为42℃,真空度为0.06mpa,处理时间为10min。再通过200~300目硅胶柱层析,洗脱剂为乙酸乙酯∶石油醚=3∶100,分离得到目标产物2d(162.9mg,0.45mmol,产率89%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度高)。
1hnmr(600mhz,cdcl3):δ7.64-7.62(m,2h),7.51-7.44(m,3h),6.63(t,1h,j=1.7hz),3.55(qd,2h,j=19.4,1.9hz),2.36(d,1h,j=12.8hz),2.05-2.00(m,1h),1.89(d,1h,j=13.6hz),1.65(dd,3h,j=10.4,1.4hz),1.37-1.11(m,4h),0.89(qd,1h,j=11.9,2.9hz).
13cnmr(150mhz,cdcl3):δ204.9,168.0,133.2,131.8,129.1,127.0,123.4,54.2,46.4,45.0,31.7,27.2,26.6,26.2,25.6.
实施例5
取25ml圆底烧瓶,依次加入5ml甲基叔丁基醚、烯炔1e(124.4mg,0.5mmol)、(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i)(7.8mg,0.01mmol),搅拌1小时后通过tlc确认原料全部反应完再加入n-碘代丁二酰亚胺(225mg,1mmol)。常温常压下,以500rpm搅拌2小时。然后使用heidolph旋转蒸发仪旋蒸,其转速为150rpm,温度为42℃,真空度为0.06mpa,处理时间为10min。再通过200~300目硅胶柱层析,洗脱剂为乙酸乙酯∶石油醚=3∶100,分离得到目标产物2e(138.1mg,0.42mmol,产率83%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度高)。
1hnmr(600mhz,cdcl3):δ7.54-7.52(m,2h),7.43-7.42(m,2h),6.54(t,1h,j=1.7hz),3.79(dd,1h,j=19.1,1.4hz),3.41(dd,1h,j=19.1,2.0hz),1.99(s,3h).13cnmr(150mhz,cdcl3):δ204.5,165.6,138.0,131.6,129.4,128.2,122.3,51.1,37.3,30.5.
实施例6
取25ml圆底烧瓶,依次加入5ml甲基叔丁基醚、烯炔1f(132.2mg,0.5mmol)、(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i)(7.8mg,0.01mmol),搅拌1小时后通过tlc确认原料全部反应完再加入n-碘代丁二酰亚胺(225mg,1mmol)。常温常压下,以500rpm搅拌2小时。然后使用heidolph旋转蒸发仪旋蒸,其转速为150rpm,温度为42℃,真空度为0.06mpa,处理时间为10min。再通过200~300目硅胶柱层析,洗脱剂为乙酸乙酯∶石油醚=5∶100,分离得到目标产物2f(156.7mg,0.45mmol,产率90%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度高)。
1hnmr(600mhz,cdcl3):δ8.02(s,1h),7.91-7.86(m,3h),7.71(dd,1h,j=8.6,1.8hz),7.60-7.54(m,2h),6.69(t,1h,j=1.7hz),3.99(dd,1h,j=18.9,1.4hz),3.57(dd,1h,j=18.9,2.0hz),2.05(s,3h).
13cnmr(150mhz,cdcl3):δ204.8,166.9,134.8,132.9,130.4,129.0,128.9,128.2,127.9,127.3,127.1,123.8,122.2,51.2,37.8,30.7.
实施例7
取25ml圆底烧瓶,依次加入5ml甲基叔丁基醚、烯炔1g(128.2mg,0.5mmol)、(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i)(7.8mg,0.01mmol),搅拌1小时后通过tlc确认原料全部反应完再加入n-碘代丁二酰亚胺(225mg,1mmol)。常温常压下,以500rpm搅拌2小时。然后使用heidolph旋转蒸发仪旋蒸,其转速为150rpm,温度为42℃,真空度为0.06mpa,处理时间为10min。再通过200~300目硅胶柱层析,洗脱剂为乙酸乙酯∶石油醚=5∶100,分离得到目标产物2g(98.7mg,0.29mmol,产率58%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度高)。
1hnmr(600mhz,c6d6):δ7.18-7.15(m,2h),7.09(t,1h,j=7.4hz),6.97(d,2h,j=7.2hz),5.65(s,1h),2.79(d,1h,j=19.4hz),2.26(t,2h,j=7.5hz),2.13(dd,1h,j=20.3,0.8hz),1.66(s,3h),1.62-1.59(m,2h),1.38-1.33(m,2h);
13cnmr(150mhz,c6d6):δ203.3,173.6,141.2,128.4(d,2c,j=10.3hz),126.1,123.8,53.0,38.0,35.1,31.8,29.8,27.8.
实施例8
取25ml圆底烧瓶,依次加入5ml甲基叔丁基醚、烯炔1h(127.2mg,0.5mmol)、(乙腈)[(2-联苯)二叔丁基膦]六氟锑酸金(i)(7.8mg,0.01mmol),搅拌1小时后通过tlc确认原料全部反应完再加入n-碘代丁二酰亚胺(225mg,1mmol)。常温常压下,以500rpm搅拌2小时。然后使用heidolph旋转蒸发仪旋蒸,其转速为150rpm,温度为42℃,真空度为0.06mpa,处理时间为10min。再通过200~300目硅胶柱层析,洗脱剂为乙酸乙酯∶石油醚=3∶100,分离得到目标产物2h(93.0mg,0.28mmol,产率55%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度高)。
1hnmr(600mhz,cdcl3):δ7.61-7.60(m,2h),7.48-7.46(m,3h),6.50(s,1h),4.01(dd,1h,j=9.4,6.5hz),2.61-2.57(m,1h),2.38-2.33(m,1h),2.14-2.09(m,1h),1.62-1.51(m,3h),1.32-1.16(m,2h).
13cnmr(150mhz,cdcl3):δ203.9,173.8,132.7,131.3,129.1,127.3,121.8,54.0,48.1,36.0,30.7,23.3,20.5.
由此可见,本发明所提供的一种由非环状烯炔酯类化合物合成α-碘代环戊烯酮类化合物的方法。整个反应在常温常压下进行,具有操作简便、条件温和、底物官能团兼容性好、产物收率高、催化剂与产物易分离等优点。研发制得的α-碘代环戊烯酮类化合物具有较高的反应活性,可以作为一类重要的有机中间体应用于医药、农药以及天然产物的合成等领域。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!