一种重组AXL抑制剂的纯化方法与流程
本发明涉及重组载体的纯化领域,尤其涉及一种重组axl抑制剂的纯化方法。
背景技术:
axl受体是酪氨酸蛋白激酶家族的成员之一,被认为是肿瘤治疗的潜在靶标。在许多的肿瘤患者中,axl的所激活的细胞信号通路通常与促进病灶转移、肿瘤抗药性以及病程恶化有关。并且在多种实体瘤和白血病癌细胞中发现其高表达,其表达水平与疾病进程及愈后好坏成正相关。因此,axl可以作为肿瘤治疗的重要靶标,通过寻找axl抑制剂为肿瘤治疗寻找新的治疗途径是有重要意义的。
目前,公开报道或是在研的axl抑制剂大概分为两类:1.axl小分子抑制剂,其主要代表为r428,已经开展非小细胞肺癌、黑色素瘤及急性髓性白血病的临床研究。2.axl抗体及抗体类似物,如genetech公司的yw327.6s2单抗,astellaspharma公司的asp2215其为axl-fc融合蛋白为抗体类似物,还有斯坦福大学研发的axl-fc的突变体myd1。这两类axl的抑制剂都有其各自缺点:1.axl小分子抑制剂其特异性较差,因此在抑制axl该靶标时其对其他类似靶标也会产生抑制,负作用较多。2.axl抗体及抗体类似物,其为糖蛋白,因此在生产过程中主要用哺乳动物细胞进行表达,生产工艺复杂,质控及生产成本高。
金属离子螯合层析(immobilizedmetalionaffinitychromatography,imac)是利用螯合配基将金属离子固定在基架上,通过固定金属离子与蛋白质的配位作用进行分离的一种层析技术。氨基酸中的氨基、羧基以及某些氨基酸残基侧链基团中含有孤对电子的活性院子,均可于金属离子形成配位作用。特别是对于表面含有组氨酸、半胱氨酸和色氨酸残基等的蛋白质,金属离子具有强烈亲和作用。因此该法广泛用于蛋白质的分离与纯化,已成为研究生物大分子不可缺少的工具。最广泛的应用,即利用金属螯合亲和层析纯化带有6×组氨酸标签的重组蛋白质。
因此,一种快速生产、纯化重组axl抑制剂蛋白的方法,是目前需要解决的一个问题。
技术实现要素:
本发明的目的在于提供一种快速生产不带标签的天然n端axl抑制剂序列蛋白的方法。
为实现上述目的,本发明提供一种重组axl抑制剂的纯化方法,其特征在于,将带有axl抑制剂dna序列的重组载体通过诱导表达、菌体收集、菌体破碎得到培养物上清,再将培养物上清分别通过cu2+螯合层析纯化,阳离子交换层析纯化得到重组axl抑制剂。
进一步,所述带有axl抑制剂dna序列如seqidno:3,seqidno:4huoseqidno:5所示。
进一步,所述通过cu2+螯合层析纯化中,纯化的层析柱为:取1ml金属螯合层析填料chelatingsepharoseff装填至gravitrappd-10重力柱中,使用5柱体积蒸馏水冲洗层析柱,添加0.5柱体积0.1m硫酸铜溶液,将cu2+离子螯合至填料中。
进一步,所述通过cu2+螯合层析纯化中,纯化的条件为:流速为1-1.25ml/min;
平衡缓冲液为ph8.0,含0.1%tritonx-100的50mmtris-hclbuffer;
洗脱缓冲液为ph8.0,含300mm咪唑的50mmtris-hclbuffer。
进一步,所述通过cu2+螯合层析纯化中,纯化的步骤为取5cv平衡缓冲液,添加至层析柱中,平衡层析柱;取培养物上清,调节ph至8.0,并添加0.1%tritonx-100,上样至金属螯合层析柱中;上样完毕后,使用平衡缓冲液洗涤5cv,洗涤完毕后,使用洗脱缓冲液洗脱5cv,收集洗脱组分。
进一步,所述阳离子交换层析纯化中,阳离子交换层析的层析柱为hiscreencaptospimpres。
进一步,所述阳离子交换层析纯化中,纯化的条件为:
平衡缓冲液为ph6.5的50mmpb;
洗脱缓冲液为ph6.5,含0.6mnacl的50mmpb;
流速为100cm/h。
进一步,所述阳离子交换层析纯化中,纯化步骤为,样品前处理:调节cu2+螯合层析收集组分ph为6.5、电导至5ms/cm;
用平衡缓冲液平衡柱体积5cv后,加前处理后的样品至层析柱中,上样完毕后使用平衡缓冲液洗涤5cv;洗涤完毕后,线性梯度洗脱15cv。
本发明通过铜离子螯合层析与高效强阳离子交换层析,从e.coli细胞破碎物上清中,分离纯化得到纯的、不含电荷异构体的天然n端axl抑制剂蛋白11b09、17e11和12g12。其氨基酸序列分别为:
11b09对应的氨基酸序列为:
nvspprrarvtdatettitiswersestvvglqvdavpangqtpiqrtikpdvrsytitglqpgtdykiylytltvvgksahgsspvvidastseqidno:1;
17e11对应的氨基酸序列为:
nvspprracvtdatettitiswrlaeskvvgfqvdavpangqtpiqrtihtdtssytitglqpgtdykiylytlntvgksavasspvvidastseqidno:2;
12g12对应的氨基酸序列为:
nvspprrarvtdatettitiswrtktetitgfqvdavpangqtpiqrtitatisgytitglqpgtdykiylytlngygvgtvrsspvvidastseqidno:3。
上述axl抑制剂蛋白均为93个氨基酸残基,分子量约为10kd。预测等电点分别为:8.31、6.76和9.23。序列中,均含有色氨酸、组氨酸和半胱氨酸等与铜离子配位结合的残基。其对应dna序列为:
11b09对应的dna序列为:
aatgtgagcccgccgcgtcgtgcacgtgttaccgatgccaccgaaaccaccatcaccattagctgggaacgcagcgaaagcaccgtggtgggtctgcaggtggatgccgttccggccaatggtcagaccccgattcagcgcaccattaaaccggatgtgcgcagctataccattaccggtctgcagccgggcaccgactacaagatctacctgtacaccctgaccgtggtgggtaaaagcgcccatggtagcagcccggttgtgattgatgccagcaccseqidno:4;
17e11对应的dna序列为:
aatgtgagcccgccgcgtcgtgcctgtgttaccgatgccaccgaaaccaccattaccattagctggcgcctggccgaaagcaaagtggtgggctttcaggtggatgccgtgccggccaatggtcagaccccgatccagcgcaccattcataccgataccagcagctacaccattaccggtctgcagccgggcaccgactataaaatctacctgtataccctgaacaccgtgggcaaaagcgccgtggccagcagtccggtggtgattgatgccagcaccseqidno:5;
12g12对应的dna序列为:
aatgtgagcccgccgcgtcgtgcacgtgttaccgatgccaccgaaaccaccattaccattagctggcgcaccaaaaccgagaccattaccggctttcaggtggatgccgtgccggcaaatggtcagaccccgattcagcgtaccattaccgccaccatcagcggttataccattaccggtctgcagccgggcaccgactacaagatctacctgtacaccctgaacggctatggtgttggtaccgtgcgcagcagcccggtggtgattgatgccagcaccseqidno:6。
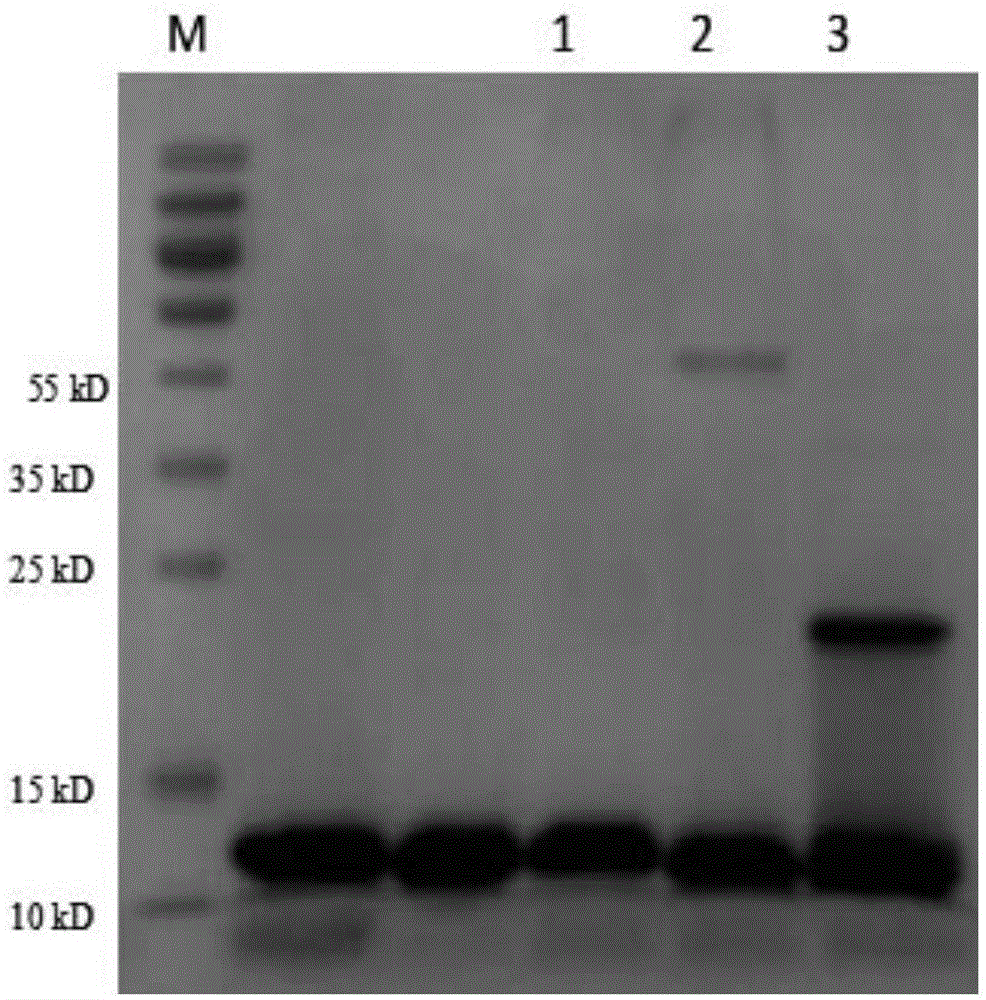
选择不同的金属离子作为螯合配基的结合对象,因其所带电荷、离子半径和电子层结构的不同,对同一蛋白质也会呈现出不同的结合能力。为了使固定金属离子可最大程度地吸附axl抑制剂,在本发明的一个实施例中,使用了ida-cu2+-saepharose(chelatingsepharoseff)金属螯合层析树脂从重组细胞破碎液上清中快速纯化分离了重组axl抑制剂11b09、17e11和12g12。cu2+在形成配位化合物时,1个3d轨道上的电子先跃迁到4p轨道中形成1个3d单电子轨道和1个4p单电子轨道,而后1个3d轨道、1个4s轨道和2个4p轨道杂化形成dsp2杂化轨道,可提供4个配合位点。与3个配合位点的ida结合后,余下一个配合位点与蛋白质形成配位化合物。由于在形成配位化合物过程中,cu2+的3d、4p单电子轨道与配位体的π电子形成大π键,因此cu2+配位化合物更稳定,在纯化的捕获阶段,将目的蛋白快速地从不稳定的、含有污染物(宿主dna、脂类、宿主蛋白等)的环境中富集、分离开来。该实施例中,sds-page(图1)结果显示重组axl抑制剂及其异构体得到了有效分离,实现了快速富集、分离目的蛋白的目的。
原核表达系统(e.coli)具有周期短、蛋白表达量高的特点。但同时,对于真核生物蛋白,其缺乏蛋白表达后折叠、修饰功能。因此,外源蛋白往往以包涵体形式表达。即使达成可溶性胞内表达,产物中往往包含有大量的电荷异构体等折叠不正确形态。本发明中,通过对铜离子螯合层析纯化产物的检测结果得知(图1),12g12和17e11的亲和层析产物中还含有多聚体。通过高分辨率的高效阳离子交换层析,可有效的分离这些电荷异构体和多聚体,提高axl抑制剂的纯度与活性。本发明的实施例中,采用了高分辨率的高效强阳离子层析填料captospimpres(ge)。该层析填料具有分辨率高、耐高反压的特点,通过适当的结合与洗脱条件,可有效的将结构正确的axl抑制剂与电荷异构体、多聚体分离(图2-4)。
附图说明
图1为铜离子螯合层析纯化11b09、17e11和12g12洗脱组分sds-page结果图谱;
图2为高效阳离子交换层析纯化11b09层析图谱;
图3为高效阳离子交换层析纯化17e11层析图谱;
图4为高效阳离子交换层析纯化12g12层析图谱;
图5为高效阳离子交换层析纯化11b09、17e11和12g12洗脱组分sds-page结果图谱。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1:铜离子螯合层析纯化11b09、17e11和12g12
1、重组11b09、17e11和12g12e.coli细胞破碎物上清的制备
将11b09、17e11、和12g12的dna序列(seqidno4,5,6)分别直接合成至pet11a中,获得表达载体pet11a-11b09、pet11a-17e11和pet11a-12g12(委托苏州金唯智生物科技有限公司)。
将上述载体转化入e.colibl21中。通过氨苄筛选阳性克隆。通过iptg诱导表达、菌体收集、菌体破碎,所获得的培养物上清,即为含重组11b09、17e11和12g12的e.coli细胞破碎物上清。
2、cu2+螯合层析纯化
层析柱:取1ml金属螯合层析填料chelatingsepharoseff(gehealthcare)装填至gravitrappd-10重力柱(gehealthcare)中。使用5柱体积(cv)蒸馏水冲洗层析柱,添加0.5柱体积(cv)0.1m硫酸铜溶液,将cu2+离子螯合至填料中。
流速:1-1.25ml/min。
平衡缓冲液:ph8.0,含0.1%tritonx-100的50mmtris-hclbuffer。
洗脱缓冲液:ph8.0,含300mm咪唑的50mmtris-hclbuffer。
取5cv平衡缓冲液,添加至层析柱中,平衡层析柱。分别取上述11b09、17e11和12g12的培养物上清10ml,调节ph至8.0,并添加0.1%tritonx-100,上样至金属螯合层析柱中。上样完毕后,使用平衡缓冲液洗涤5cv,洗涤完毕后,使用洗脱缓冲液洗脱5cv,收集洗脱组分。洗脱组分进行非还原sds-page检测,结果如图1,m泳道为蛋白质质量标准,泳道1为11b09,泳道2为12g12,泳道3为17e11。
从图1中看出,泳道1、2和3中,10kd处均分离得到一单一的蛋白条带,泳道2约50kd处检测得一多聚体,泳道3约25kd处检测得一多聚体。说明cu2+螯合层析可以从e.coli细胞破碎物上清中分离重组axl抑制剂蛋白。凝胶灰度扫描结果显示,11b09纯度为95%,12g12纯度为90%,17e11纯度为80%。
实施例2高效阳离子交换层析纯化11b09
层析柱:hiscreencaptospimpres(gehealthcare)
样品:调节cu2+螯合层析收集组分ph为6.5、电导至5ms/cm。
平衡缓冲液:ph6.5的50mmpb。
洗脱缓冲液:ph6.5,含0.6mnacl的50mmpb。
流速:100cm/h(0.96ml/min)。
层析系统:aktapurifier100(gehealthcare)。
平衡缓冲液平衡柱体积5cv后,加样至层析柱中,上样完毕后使用平衡缓冲液洗涤5cv。洗涤完毕后,线性梯度洗脱15cv。
层析图谱如图所示2。其中实线为紫外280吸收图谱,虚线为电导值图谱。图谱显示,线性盐浓度梯度过程中,大致分离得1个明显的紫外吸收峰,根据11b09的等电点计算,peak1应为折叠正确的蛋白组分。
收集电导6.2-19.0ms/cm间的洗脱组分。分离组分经sds-page检测,结果如图5泳道3所示。结果显示于10kd处分离检测得单一蛋白条带,未检出其他分子量蛋白。凝胶灰度扫描结果显示纯度为100%,说明纯化纯度高。
实施例3高效阳离子交换层析纯化17e11
层析柱:hiscreencaptospimpres(gehealthcare)
样品:调节cu2+螯合层析收集组分ph为6.5、电导至5ms/cm。
平衡缓冲液:ph5.5的50mm乙酸盐缓冲液(ab)。
洗脱缓冲液:ph5.5,含0.6mnacl的50mmab。
流速:100cm/h(0.96ml/min)。
层析系统:aktapurifier100(gehealthcare)。
平衡缓冲液平衡柱体积5cv后,加样至层析柱中,上样完毕后使用平衡缓冲液洗涤5cv。洗涤完毕后,线性梯度洗脱15cv。
层析图谱如图3所示。其中实线为紫外280吸收图谱,虚线为电导值图谱。图谱显示,线性盐浓度梯度过程中,大致分离得2个明显的紫外吸收峰,根据17e11的等电点计算,peak2应为折叠正确的蛋白组分。
收集电导41.5-46.5ms/cm间的洗脱组分。分离组分经sds-page检测,结果如图5泳道2所示。结果显示于10kd处分离检测得单一蛋白条带,未检出其他分子量蛋白。凝胶灰度扫描结果显示纯度为100%,说明纯化纯度高。
实施例4高效阳离子交换层析纯化12g12
层析柱:hiscreencaptospimpres(gehealthcare)
样品:调节cu2+螯合层析收集组分ph为6.5、电导至5ms/cm。
平衡缓冲液:ph6.5的50mmpb。
洗脱缓冲液:ph6.5,含0.6mnacl的50mmpb。
流速:100cm/h(0.96ml/min)。
层析系统:aktapurifier100(gehealthcare)。
平衡缓冲液平衡柱体积5cv后,加样至层析柱中,上样完毕后使用平衡缓冲液洗涤5cv。洗涤完毕后,线性梯度洗脱15cv。
层析图谱如图4所示。其中实线为紫外280吸收图谱,虚线为电导值图谱。图谱显示,线性盐浓度梯度过程中,大致分离得2个明显的紫外吸收峰,根据12g12的等电点计算,peak2应为折叠正确的蛋白组分。
收集电导34.2-52.0ms/cm间的洗脱组分。分离组分经sds-page检测,结果如图5泳道3所示。结果显示于10kd处分离检测得单一蛋白条带,未检出其他分子量蛋白。凝胶灰度扫描结果显示纯度为100%,说明纯化纯度高。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
sequencelisting
<110>未名生物医药有限公司
<120>一种重组axl抑制剂的纯化方法
<130>wmsw-18006-cni
<160>6
<170>patentinversion3.5
<210>1
<211>93
<212>prt
<213>人工合成
<400>1
asnvalserproproargargalaargvalthraspalathrgluthr
thrilethrilesertrpgluargsergluserthrvalvalglyleu
glnvalaspalavalproalaasnglyglnthrproileglnargthr
ilelysproaspvalargsertyrthrilethrglyleuglnprogly
thrasptyrlysiletyrleutyrthrleuthrvalvalglylysser
alahisglyserserprovalvalileaspalaserthr
<210>2
<211>93
<212>prt
<213>人工合成
<400>2
asnvalserproproargargalacysvalthraspalathrgluthr
thrilethrilesertrpargleualagluserlysvalvalglyphe
glnvalaspalavalproalaasnglyglnthrproileglnargthr
ilehisthraspthrsersertyrthrilethrglyleuglnprogly
thrasptyrlysiletyrleutyrthrleuasnthrvalglylysser
alavalalaserserprovalvalileaspalaserthr
<210>3
<211>93
<212>prt
<213>人工合成
<400>3
asnvalserproproargargalaargvalthraspalathrgluthr
thrilethrilesertrpargthrlysthrgluthrilethrglyphe
glnvalaspalavalproalaasnglyglnthrproileglnargthr
ilethralathrileserglytyrthrilethrglyleuglnprogly
thrasptyrlysiletyrleutyrthrleuasnglytyrglyvalgly
thrvalargserserprovalvalileaspalaserthr
<210>4
<211>279
<212>dna
<213>人工合成
<400>4
aatgtgagcccgccgcgtcgtgcacgtgttaccgatgccaccgaaaccaccatcaccatt60
agctgggaacgcagcgaaagcaccgtggtgggtctgcaggtggatgccgttccggccaat120
ggtcagaccccgattcagcgcaccattaaaccggatgtgcgcagctataccattaccggt180
ctgcagccgggcaccgactacaagatctacctgtacaccctgaccgtggtgggtaaaagc240
gcccatggtagcagcccggttgtgattgatgccagcacc279
<210>5
<211>279
<212>dna
<213>人工合成
<400>5
aatgtgagcccgccgcgtcgtgcctgtgttaccgatgccaccgaaaccaccattaccatt60
agctggcgcctggccgaaagcaaagtggtgggctttcaggtggatgccgtgccggccaat120
ggtcagaccccgatccagcgcaccattcataccgataccagcagctacaccattaccggt180
ctgcagccgggcaccgactataaaatctacctgtataccctgaacaccgtgggcaaaagc240
gccgtggccagcagtccggtggtgattgatgccagcacc279
<210>6
<211>279
<212>dna
<213>人工合成
<400>6
aatgtgagcccgccgcgtcgtgcacgtgttaccgatgccaccgaaaccaccattaccatt60
agctggcgcaccaaaaccgagaccattaccggctttcaggtggatgccgtgccggcaaat120
ggtcagaccccgattcagcgtaccattaccgccaccatcagcggttataccattaccggt180
ctgcagccgggcaccgactacaagatctacctgtacaccctgaacggctatggtgttggt240
accgtgcgcagcagcccggtggtgattgatgccagcacc279
- 还没有人留言评论。精彩留言会获得点赞!