一种代谢工程改造谷氨酸棒杆菌高产L-半胱氨酸的方法与流程
本发明属于合成生物学和代谢工程技术领域,具体涉及选择食品安全微生物谷氨酸棒杆菌为宿主,通过代谢工程的策略高产l-半胱氨酸的方法。
背景技术:
l-半胱氨酸是一种重要的含硫氨基酸,广泛应用于饲料,食品,医药以及化妆品等领域。全球市场对l-半胱氨酸的年需求量达到5000吨,并呈现逐年增加的趋势。目前,l-半胱氨酸主要通过蛋白水解的方式生产。但是由于蛋白水解生产工艺过程中存在环境污染和得率较低的问题,限制了l-半胱氨酸的工业化生产的规模和进一步的应用。因此通过环境友好型的微生物发酵法合成l-半胱氨酸的研究越来越受到关注(nonakag,takumik[j].ambexpress,2017,7(1):90.)
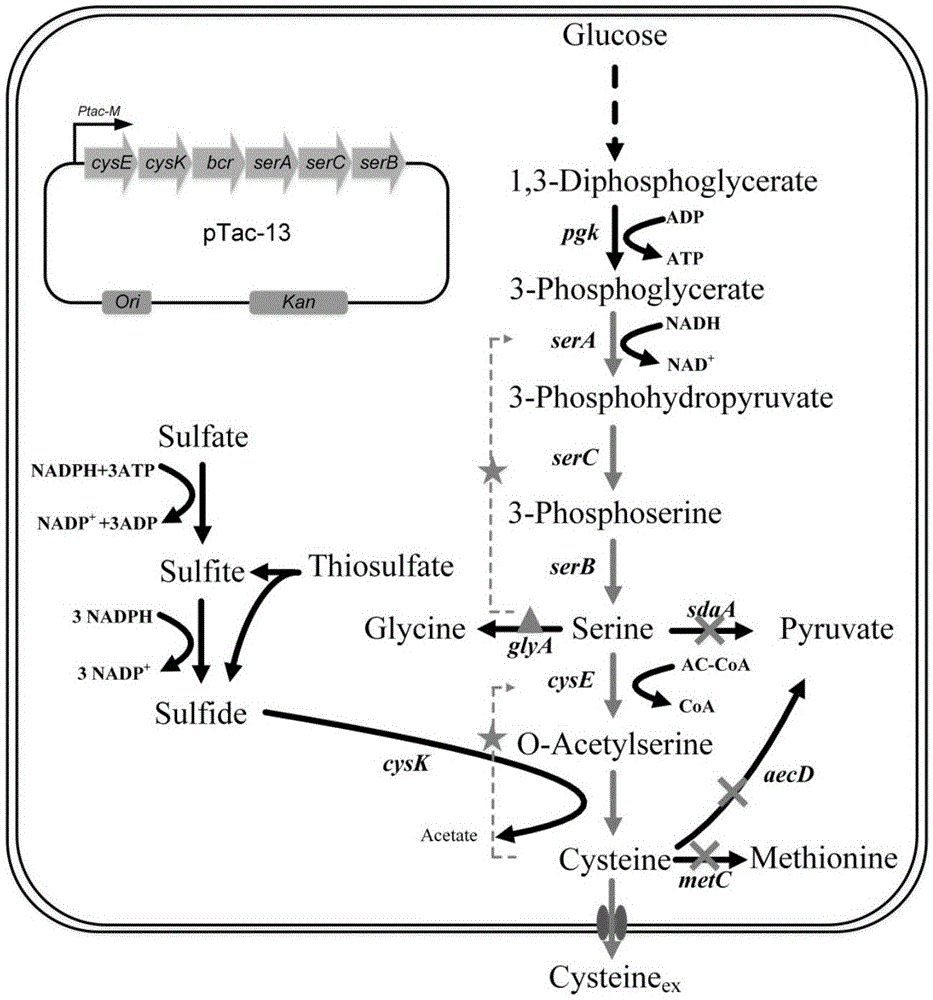
谷氨酸棒杆菌是一种从土壤中分离的,食品安全级的革兰氏阳性菌株,被广泛应用于氨基酸,维生素和核酸等产品的生产(beckerj,wittmannc.[j].currentopinioninbiotechnology,2012,23(4):631-640)。近年来,随着合成生物学的发展,以谷氨酸棒杆菌为底盘的人工细胞工厂用于合成多种生物能源和精细化学产品越来越受到广泛关注。目前,谷氨酸棒杆菌中l-半胱氨酸合成通路已经阐明。糖酵解中间代谢产物磷酸甘油酸首先由3-磷酸甘油酸脱氢酶,磷酸丝氨酸转氨酶和磷酸丝氨酸磷酸化酶催化生成l-丝氨酸。随后,l-丝氨酸依次由丝氨酸乙酰转移酶和乙酰丝氨酸巯解酶催化生成l-半胱氨酸。在之前的研究中,jooetal通过过表达丝氨酸乙酰转移酶基因(cyse)和乙酰丝氨酸巯解酶基因(cysk)使谷氨酸棒杆菌积累60mg/ll-半胱氨酸(jooyc,hyeonje,hanso.[j].jagricfoodchem,2017,65(23).)。但是由于产量较低,难以满足工业化生产需求。
技术实现要素:
本发明的目的是提供一种代谢工程改造谷氨酸棒杆菌高产l-半胱氨酸的方法。
本发明所提供的一种代谢工程改造谷氨酸棒杆菌高产l-半胱氨酸的方法,包括以下步骤:
(1)本发明选择食品安全微生物谷氨酸棒杆菌为宿主菌株。
(2)本发明通过首先通过敲除l-半胱氨酸脱巯基酶基因aecd,同时过表达自身的丝氨酸乙酰转移酶基因cyse,获得了能够积累l-半胱氨酸的菌株。
(3)在(2)获得的菌株的基础上,比较不同cyse基因对l-半胱氨酸产量的影响,过表达不同来源的,具有不同酶活以及抗反馈抑制能力的丝氨酸乙酰转移酶基因cyse,包括来源于拟南芥的cyse基因,以及来源于大肠杆菌的cyse基因及其突变体m256a,m201r,r89p和r89h/t90v/p93a/a94t),获得最利于l-半胱氨酸合成的丝氨酸乙酰转移酶基因。
(4)在(3)获得的菌株的基础上,比较不同转运蛋白对l-半胱氨酸产量的影响,过表达不同来源的转运蛋白,包括来源于大肠杆菌的yded和bcr,以及来源于菠萝泛菌的cefa,获得最利于l-半胱氨酸分泌的转运蛋白。
(5)在(4)获得的菌株的基础上,通过提高l-丝氨酸水平提高l-半胱氨酸产量,包括过表达3-磷酸甘油酸脱氢酶(sera),磷酸丝氨酸转氨酶(serc)和磷酸丝氨酸磷酸化酶(serb)基因,强化前体l-丝氨酸合成;同时敲除l-丝氨酸脱水酶基因sdaa,降低甘氨酸羟甲基转移酶基因glya的表达,促进前体l-丝氨酸的积累。
(6)将获得的谷氨酸棒杆菌工程菌株接种至含有20~25ml种子培养基的250ml三角瓶中,培养12h~16h至对数中期。然后离心收集细胞,用新鲜的发酵培养基悬浮,接种至含有50ml发酵培养基的250ml三角瓶中,起始od600为0.8~1.2,并加入5~15g/lcaco3。发酵条件为32℃,150~200rpm,恒温振荡培养。发酵培养基为:葡萄糖50~60g/l,尿素0.1~0.2g/l,玉米浆5~10g/l,硫酸铵15~20g/l,kh2po45~6g/l,mgso4·7h2o2~5g/l,feso4·7h2o0.2~0.5g/l,mncl2·4h2o0.2~0.4g/l,生物素0.2~0.4mg/l,维生素b11~2mg/l,维生素b61~2mg/l,caco35~15g/l用于发酵培养基的缓冲剂。种子培养基包括10~20g/l葡萄糖,尿素0.1~0.2g/l,玉米浆15~20g/l,硫酸铵15~20g/l,ph为6.5~7.0。最终以50~60g/l的葡萄糖为底物,经3~4天发酵,l-半胱氨酸含量达到800~1000mg/l。
附图说明
图1为代谢工程改造谷氨酸棒杆菌合成l-半胱氨酸策略示意图
图2为比较不同来源的cyse基因对l-半胱氨酸产量的影响
图3为比较不同转运蛋白对l-半胱氨酸产量的影响
图4为质粒ptac-5,ptac-9和ptac-11构建示意图
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例汇总所用的材料、试剂等,无特殊说明。均可从商业途径得到。
实施例1谷氨酸棒杆菌l-半胱氨酸脱巯基酶基因aecd缺失菌株的构建
(1)提取c.glutamicumatcc13032基因组模板
c.glutamicumatcc13032在lb培养基(20~25g/l蛋白胨、10~20g/l酵母粉、20~25g/l氯化钠)中,30℃150~200rpm培养12~16h后,利用基因组提取试剂盒(天根)提取总dna。
(2)以c.glutamicumatcc13032基因组为模板设计引物aecd1-f/aecd1-r,aecd2-f/aecd2-r,其序列分别为:
aecd1-f:cgcggatcccgacagtcaatgcgatgcc;
aecd1-r:acgaagaattttagaaggcctttccgcaacccacaaagg;
aecd2-f:tgtgggttgcggaaaggccttctaaaattcttcgtgagg;
aecd2-r:tgctctagaaacggccaacaccgtatcc。
利用上述设计的引物,通过pcr的方法,获得片段aecd1和aecd2。然后以获得pcr产物aecd1和aecd2为模板,以aecd1-f/aecd2-r为引物,通过融合pcr的方法获得融合片段aecd,用bamhi和xbai双酶切后,连接至载体pcrd206上,获得质粒pcrd-aecd。
(3)aecd基因敲除步骤:将质粒pcrd-aecd电转至c.glutamicumatcc13032细胞中。电转条件为:将100μl感受态细胞置于冰上,加入200ng重组质粒,冰上放置30分钟,转移至0.1cm的bio-rad电击杯中。使用micropulser(bio-rad公司)电穿孔仪。电击参数为电压1.8kv。电击后迅速用1mllbhis培养基转移至电击杯中,吹打5-10次后转移至ep管中,46℃热击6分钟,然后25℃孵育2h。将菌液涂布在含有氯霉素的lbhis平板上。25℃培养2~3天,挑取单菌落转接至lbhis(5g/l蛋白胨,5g/lnacl,2.5g/l酵母粉,18.5g/l脑心浸出液和91g/l山梨醇)培养基中,37℃培养1天。然后再lbhis固体培养基上划线培养1天。挑取单菌落至a+蔗糖培养基中(10g/l葡萄糖,7g/l酪蛋白水解物,5g/l硫酸铵,2gl-1yeastextract,2g/l尿素,0.5g/lkh2po4,0.5g/lk2hpo4·3h2o,0.5g/lmgso4·7h2o,6mg/lfe2so4·7h2o,4.2mg/lmn2so4·h2o,0.2mg/lbiotin,0.2mg/lthiamine,4%葡萄糖,10%蔗糖),培养2~3天。然后划线至a+蔗糖培养基中。挑单菌落在a+卡那霉素和a固体培养基中对点划线。挑选在a培养基中生长,在a+卡那霉素培养基中不能生长的菌株。随后,以野生型菌株为对照,使用引物aecd-cf/aecd-cr对获得菌株进行pcr验证,pcr产物大小减少的为敲除正确菌株。
其引物aecd-cf/aecd-cr序列为:
aecdcf:ggccccagtcatagtcaactgc;
aecdcr:agtacttcacacggatgaaattggc。
pcr体系:ddh2o30μl,模板1μl,fastpfubuffer10μl,fastpfu1μl,引物11.5μl,引物21.5μl,dntp5μl。
pcr条件:step194℃4min,step294℃30s,step360℃30s,step472℃1min,step572℃10min,step64℃保温。
融合pcr条件及方法:(1)ddh2o28μl,模板13μl,模板23μl,fastpfubuffer10μl,fastpfu1μl,dntp5μl。step194℃4min,step294℃30s,step353℃30s,step472℃1.5min,10个循环,step572℃10min。(2)ddh2o30μl,模板1μl,fastpfubuffer10μl,fastpfu1μl,引物11.5μl,引物21.5μl,dntp5μl。step194℃4min,step294℃30s,step353℃30s,step472℃1.5min,30个循环,step572℃10min。
双酶切体系:基因aecd或质粒pcrd20620μl,bamhi1μl,xbai1μl,10×buffer5μl,ddh2o23μl,37℃反应1h。
连接体系:基因aecd片段16μl,pcrd206片段1μl,t4连接酶0.5μl,10×buffer2μl,22℃反应1h。
实施例2过表达自身丝氨酸转乙酰酶基因cyse菌株的构建
(1)以c.glutamicumatcc13032基因组为模板设计引物cgcyse-f/cgcyse-r,其序列为:
cgcyse-f:tccgagctcaaaggaggacaaccatgatccgtgaagatctcgca;
cgcyse-r:cggggtaccatagggcgctaactgttcttaaatg。
利用上述引物,通过pcr的方法获得片段cgcyse。然后用saci和kpni双酶切后,连接至载体ptrcmob上,获得质粒ptrc-1。
pcr体系:ddh2o30μl,模板1μl,fastpfubuffer10μl,fastpfu1μl,引物11.5μl,引物21.5μl,dntp5μl。
pcr条件:step194℃4min,step294℃30s,step360℃30s,step472℃1min,step572℃10min,step64℃保温。
双酶切体系:基因aecd或质粒pcrd20620μl,bamhi1μl,xbai1μl,10×buffer5μl,ddh2o23μl,37℃反应1h。
连接体系:基因aecd片段16μl,pcrd206片段1μl,t4连接酶0.5μl,10×buffer2μl,22℃反应1h。
(2)将质粒ptrc-1电转至谷氨酸棒杆菌l-半胱氨酸脱巯基酶基因aecd缺失菌株细胞中。电转条件为:将100μl感受态细胞置于冰上,加入200ng重组质粒,冰上放置30分钟,转移至0.1cm的bio-rad电击杯中。使用micropulser(bio-rad公司)电穿孔仪。电击参数为电压1.8kv。电击后迅速用1mllbhis培养基转移至电击杯中,吹打5-10次后转移至ep管中,46℃热击6分钟,然后25℃孵育2h。将菌液涂布在含有氯霉素的lbhis平板上。
(3)将上述获得的谷氨酸棒杆菌工程菌株接种至含有20~25ml种子培养基的250ml三角瓶中,培养12h~16h至对数中期。然后离心收集细胞,用新鲜的发酵培养基悬浮,接种至含有50ml发酵培养基的250ml三角瓶中,起始od600为0.8~1.2,并加入5~15g/lcaco3。发酵条件为32℃,150~200rpm,恒温振荡培养。发酵培养基为:葡萄糖50~60g/l,尿素0.1~0.2g/l,玉米浆5~10g/l,硫酸铵15~20g/l,kh2po45~6g/l,mgso4·7h2o2~5g/l,feso4·7h2o0.2~0.5g/l,mncl2·4h2o0.2~0.4g/l,生物素0.2~0.4mg/l,维生素b11~2mg/l,维生素b61~2mg/l,caco35~15g/l用于发酵培养基的缓冲剂。种子培养基包括10~20g/l葡萄糖,尿素0.1~0.2g/l,玉米浆15~20g/l,硫酸铵15~20g/l,ph为6.5~7.0。最终以50~60g/l的葡萄糖为底物,经3~4天发酵,l-半胱氨酸含量达到50~90mg/l。
实施例3探究不同来源丝氨酸转乙酰酶基因cyse对l-半胱氨酸的影响
(1)提取e.colimg1655基因组模板
e.colimg1655在lb培养基(20~25g/l蛋白胨、10~20g/l酵母粉、20~25g/l氯化钠)中,37℃150~200rpm培养12~16h后,利用基因组提取试剂盒(天根)提取总dna。
(2)以e.colimg1655基因组为模板设计引物eccyse-f/eccyse-r,其序列为:
eccyse-f:tccgagctcaaaggaggacaacccaatgtcgtgtgaagaactgga;
eccyse-r:cggggtaccatgattacatcgcatccgg。
利用上述设计的引物,通过pcr的方法,获得片段cgcyse。然后用saci和kpni双酶切后,连接至载体ptrcmob上,获得质粒ptrc-2。
(3)以谷氨酸棒杆菌密码子使用偏好性,密码子优化拟南芥cyse基因,其序列如序列表中所示,交由苏州金唯智科技有限公司合成。以合成的基因序列为模板设计引物
atcyse-f/atcyse-r,其序列为:
atcyse-r:tccgagctcaaaggaggacaaccatggctacctgcatcgacacctgc;
atcyse-r:cggggtaccttagataacgtagtcggaccactcg。
利用设计的引物,通过pcr的方法,获得片段atcyse。然后用saci和kpni双酶切后,连接至载体ptrcmob上,获得质粒ptrc-3。
(4)大肠杆菌cyse突变体m256a,m201r,r89p和r89h/t90v/p93a/a94t的构建,步骤如下:以上述获得的大肠杆菌cyse基因为模板,分别设计引物m256a-f/m256a-r,
m201r-f/m201r-r,r89p-f/r89p-r和89h/t90v/p93a/a94t-f/r89h/t90v/p93a/a94t-r,其序列分别为:
eccyse-m256a-f:agccatcaatggatgcagaccagcatttcaacggtatt;
eccyse-m256a-r:aataccgttgaaatgctggtctgcatccattgatggct;
eccyse-m201r-f:tcgtgaaggtgtgcgcattggcgcgggcgcgaaaatc;
eccyse-m201r–r:gattttcgcgcccgcgccaatgcgcacaccttcacga;
eccyse-r89p-f:atattcaggcggtgcccacccgcgacccggcagtcgat;
eccyse-r89p-r:tcgcgggtgggcaccgcctgaatatcacaggccgcaga;
eccyse-r89h/t90v/p93a/a94t–f:gtgcatgtacgcgacgctacagtcgataaatactcaacc;
eccyse-r89h/t90v/p93a/a94t–r:atcgactgtagcgtcgcgtacatgcaccgcctgaat。
利用上述引物,以质粒ptrc-2为模板,通过pcr方法进行点突变,获得相应的m256a,m201r,r89p和r89h/t90v/p93a/a94t突变体,获得质粒ptrc-4~7。
pcr条件:step194℃4min,step294℃30s,step360℃30s,step472℃6min,step572℃10min,step64℃保温。
(4)将上述获得的质粒ptrc-3~7电转至谷氨酸棒杆菌l-半胱氨酸脱巯基酶基因aecd缺失菌株细胞中。电转条件为:将100μl感受态细胞置于冰上,加入200ng重组质粒,冰上放置30分钟,转移至0.1cm的bio-rad电击杯中。使用micropulser(bio-rad公司)电穿孔仪。电击参数为电压1.8kv。电击后迅速用1mllbhis培养基转移至电击杯中,吹打5-10次后转移至ep管中,46℃热击6分钟,然后25℃孵育2h。将菌液涂布在含有氯霉素的lbhis平板上。
(5)将上述获得的谷氨酸棒杆菌工程菌株接种至含有20~25ml种子培养基的250ml三角瓶中,培养12h~16h至对数中期。然后离心收集细胞,用新鲜的发酵培养基悬浮,接种至含有50ml发酵培养基的250ml三角瓶中,起始od600为0.8~1.2,并加入5~15g/lcaco3。发酵条件为32℃,150~200rpm,恒温振荡培养。发酵培养基为:葡萄糖50~60g/l,尿素0.1~0.2g/l,玉米浆5~10g/l,硫酸铵15~20g/l,kh2po45~6g/l,mgso4·7h2o2~5g/l,feso4·7h2o0.2~0.5g/l,mncl2·4h2o0.2~0.4g/l,生物素0.2~0.4mg/l,维生素b11~2mg/l,维生素b61~2mg/l,caco35~15g/l用于发酵培养基的缓冲剂。种子培养基包括10~20g/l葡萄糖,尿素0.1~0.2g/l,玉米浆15~20g/l,硫酸铵15~20g/l,ph为6.5~7.0。最终以50~60g/l的葡萄糖为底物,经3~4天发酵,l-半胱氨酸含量达到300~400mg/l。
实施例4探究不同来源转运蛋白对l-半胱氨酸的影响
(1)以e.colimg1655基因组为模板设计引物yded-f/yded-r,bcr-f/bcr-r,其序列分别为:
yded-f:tcccccgggagaaggagatataccatgtcgcgaaaagatggggtg;
yded-r:cgcggatccttaacttcccacctttaccgc;
bcr-f:tcccccgggagaaggagatataccatgaccacccgacagcattcgtcg;
bcr-r:cgcggatcctcaccgttttttcggccgactgg。
利用上述获得的引物,通过pcr的方法,获得片段ecyded和ecbcr。然后用smai和bamhi双酶切后,分别连接至载体ptrc-5上,获得质粒ptrc-8,ptrc-9。
(2)提取菠萝泛菌基因组模板
菠萝泛菌在lb培养基(20~25g/l蛋白胨、10~20g/l酵母粉、20~25g/l氯化钠)中,34℃150~200rpm培养12~16h后,利用基因组提取试剂盒(天根)提取总dna。
(3)以菠萝泛菌基因组为模板设计引物cefa-f/cefa-r,其序列为:
cefa-f:tcccccgggaaaggaggacaaccatgctcgatccttccttcttta;
cefa-r:cgcggatccctagagaagcctgaaggcatcgac。
利用上述获得的引物,通过pcr的方法,获得片段cefa。smai和bamhi双酶切后,分别连接至载体ptrc-5上,获得质粒ptrc-10。
pcr条件:step194℃4min,step294℃30s,step360℃30s,step472℃1min,step572℃10min,step64℃保温。
双酶切体系:基因aecd或质粒pcrd20620μl,bamhi1μl,xbai1μl,10×buffer5μl,ddh2o23μl,37℃反应1h。
连接体系:基因aecd片段16μl,pcrd206片段1μl,t4连接酶0.5μl,10×buffer2μl,22℃反应1h。
(4)将上述获得的质粒ptrc-8~10电转至谷氨酸棒杆菌l-半胱氨酸脱巯基酶基因aecd缺失菌株细胞中。电转条件为:将100μl感受态细胞置于冰上,加入200ng重组质粒,冰上放置30分钟,转移至0.1cm的bio-rad电击杯中。使用micropulser(bio-rad公司)电穿孔仪。电击参数为电压1.8kv。电击后迅速用1mllbhis培养基转移至电击杯中,吹打5-10次后转移至ep管中,46℃热击6分钟,然后25℃孵育2h。将菌液涂布在含有氯霉素的lbhis平板上。
(5)将上述获得的谷氨酸棒杆菌工程菌株接种至含有20~25ml种子培养基的250ml三角瓶中,培养12h~16h至对数中期。然后离心收集细胞,用新鲜的发酵培养基悬浮,接种至含有50ml发酵培养基的250ml三角瓶中,起始od600为0.8~1.2,并加入5~15g/lcaco3。发酵条件为32℃,150~200rpm,恒温振荡培养。发酵培养基为:葡萄糖50~60g/l,尿素0.1~0.2g/l,玉米浆5~10g/l,硫酸铵15~20g/l,kh2po45~6g/l,mgso4·7h2o2~5g/l,feso4·7h2o0.2~0.5g/l,mncl2·4h2o0.2~0.4g/l,生物素0.2~0.4mg/l,维生素b11~2mg/l,维生素b61~2mg/l,caco35~15g/l用于发酵培养基的缓冲剂。种子培养基包括10~20g/l葡萄糖,尿素0.1~0.2g/l,玉米浆15~20g/l,硫酸铵15~20g/l,ph为6.5~7.0。最终以50~60g/l的葡萄糖为底物,经3~4天发酵,l-半胱氨酸含量达到500~700mg/l。
实施例5提高l-丝氨酸水平促进l-半胱氨酸合成
(1)sdaa基因的敲除,其步骤如下:以c.glutamicumatcc13032基因组为模板设计引物sdaaupf/sdaaupr,sdaadnf/sdaadnr其序列分别为:
sdaaupf:ggaagatctcaaccctggtcagccaact;
sdaaupr:tccaaactcacgcgattgtcgacggtatgtgaggatgat;
sdaadnf:atcatcctcacataccgtcgacaatcgcgtgagtttgga;
sdaadnr:tgctctagagccaaagtcactcgcattct。
利用上述获得的引物,通过pcr的方法,获得片段sdaa1和sdaa2。然后以获得pcr产物sdaa1和sdaa2为模板,以sdaaupf/sdaadnr为引物,通过融合pcr的方法获得融合片段sdaa,用bamhi和xbai双酶切后,连接至载体pcrd206上,获得质粒pcrd-sdaa。将质粒pcrd-sdaa电转至谷氨酸棒杆菌l-半胱氨酸脱巯基酶基因aecd缺失菌株细胞中。电转条件为:将100μl感受态细胞置于冰上,加入200ng重组质粒,冰上放置30分钟,转移至0.1cm的bio-rad电击杯中。使用micropulser(bio-rad公司)电穿孔仪。电击参数为电压1.8kv。电击后迅速用1mllbhis培养基转移至电击杯中,吹打5-10次后转移至ep管中,46℃热击6分钟,然后25℃孵育2h。将菌液涂布在含有氯霉素的lbhis平板上。25℃培养2~3天,挑取单菌落转接至lbhis(5g/l蛋白胨,5g/lnacl,2.5g/l酵母粉,18.5g/l脑心浸出液和91g/l山梨醇)培养基中,37℃培养1天。然后再lbhis固体培养基上划线培养1天。挑取单菌落至a+蔗糖液体培养基中培养2~3天。然后划线至a+蔗糖固体培养基中。挑单菌落在a+卡那霉素和a固体培养基中对点划线。挑选在a培养基中生长,在a+卡那霉素培养基中不能生长的菌株。随后,以野生型菌株为对照,使用引物sdaa-cf/sdaa-cr对获得菌株进行pcr验证,pcr产物大小减少的为敲除正确菌株。引物sdaa-cf/sdaa–cr序列为:sdaa-cf:aagtcttcatcggcgattctg;sdaa-cr:tacgttgaatctccatgcagaacgac。
pcr体系:ddh2o30μl,模板1μl,fastpfubuffer10μl,fastpfu1μl,引物11.5μl,引物21.5μl,dntp5μl。
pcr条件:step194℃4min,step294℃30s,step360℃30s,step472℃1min,step572℃10min,step64℃保温。
融合pcr条件及方法:(1)ddh2o28μl,模板13μl,模板23μl,fastpfubuffer10μl,fastpfu1μl,dntp5μl。step194℃4min,step294℃30s,step353℃30s,step472℃1.5min,10个循环,step572℃10min。(2)ddh2o30μl,模板1μl,fastpfubuffer10μl,fastpfu1μl,引物11.5μl,引物21.5μl,dntp5μl。step194℃4min,step294℃30s,step353℃30s,step472℃1.5min,30个循环,step572℃10min。
双酶切体系:基因sdaa或质粒pcrd20620μl,bamhi1μl,xbai1μl,10×buffer5μl,ddh2o23μl,37℃反应1h。
连接体系:基因sdaa片段16μl,pcrd206片段1μl,t4连接酶0.5μl,10×buffer2μl,22℃反应1h。
(2)替换glya启动子,降低基因glya的表达。其步骤如下:(1)glya基因的敲除,其步骤如下:以c.glutamicumatcc13032基因组为模板设计引物glyaupf/glyaupr,glyadnf/glyadnr,ndhe-f/ndhe-r,其序列分别为:
glyaupf:tgctctagaggcgtaatgggagaagtggg;
glyaupr:tgagagaaaggagcgcccaggtacgcccacaagcataga;
glyadnf:gtttgcctaggattaggtacatgaccgatgcccaccaag;
glyadnr:agcagatcttccgcctgctggccat;
nade-f:tctatgcttgtgggcgtacctgggcgctcctttctctcatg;
nade-r:gtgggcatcggtcatgtacctaatcctaggcaaacatgg。
利用上述获得的引物,通过pcr的方法,获得片段glya1,glya2和ndhe。然后以上述获得的pcr产物glya1,glya2和ndhe为模板,以glyaupf/glyadnr为引物,通过融合pcr的方法获得融合片段glya,用bamhi和xbai双酶切后,连接至载体pcrd206上,获得质粒pcrd-glya-ndhe。将质粒pcrd-glya-ndhe电转至谷氨酸棒杆菌aecd和sdaa双缺失菌株细胞中。电转条件为:将100μl感受态细胞置于冰上,加入200ng重组质粒,冰上放置30分钟,转移至0.1cm的bio-rad电击杯中。使用micropulser(bio-rad公司)电穿孔仪。电击参数为电压1.8kv。电击后迅速用1mllbhis培养基转移至电击杯中,吹打5-10次后转移至ep管中,46℃热击6分钟,然后25℃孵育2h。将菌液涂布在含有氯霉素的lbhis平板上。25℃培养2~3天,挑取单菌落转接至lbhis(5g/l蛋白胨,5g/lnacl,2.5g/l酵母粉,18.5g/l脑心浸出液和91g/l山梨醇)培养基中,37℃培养1天。然后再lbhis固体培养基上划线培养1天。挑取单菌落至a+蔗糖液体培养基中培养2~3天。然后划线至a+蔗糖固体培养基中。挑单菌落在a+卡那霉素和a固体培养基中对点划线。挑选在a培养基中生长,在a+卡那霉素培养基中不能生长的菌株。随后,以野生型菌株为对照,使用引物glya-cf/glyadnr对获得菌株进行pcr验证,pcr产物大小减少的为敲除正确菌株。引物glya–cf序列为:glyacf:catgacacttaatcgtcgggat。
pcr体系:ddh2o30μl,模板1μl,fastpfubuffer10μl,fastpfu1μl,引物11.5μl,引物21.5μl,dntp5μl。
pcr条件:step194℃4min,step294℃30s,step360℃30s,step472℃1min,step572℃10min,step64℃保温。
融合pcr条件及方法:(1)ddh2o28μl,模板13μl,模板23μl,fastpfubuffer10μl,fastpfu1μl,dntp5μl。step194℃4min,step294℃30s,step353℃30s,step472℃1.5min,10个循环,step572℃10min。(2)ddh2o30μl,模板1μl,fastpfubuffer10μl,fastpfu1μl,引物11.5μl,引物21.5μl,dntp5μl。step194℃4min,step294℃30s,step353℃30s,step472℃1.5min,30个循环,step572℃10min。
双酶切体系:基因glya或质粒pcrd20620μl,bamhi1μl,xbai1μl,10×buffer5μl,ddh2o23μl,37℃反应1h。
连接体系:基因glya片段16μl,pcrd206片段1μl,t4连接酶0.5μl,10×buffer2μl,22℃反应1h。
(3)过表达3-磷酸甘油酸脱氢酶(sera),磷酸丝氨酸转氨酶(serc)和磷酸丝氨酸磷酸化酶(serb)基因,强化前体l-丝氨酸合成。其步骤如下:以c.glutamicumatcc13032基因组为模板设计引物sera-f/sera-r,serc-f/serc-r,serb-f/serb-r,其序列为:
sera-f:ctagtctagaaaaggaggacaaccatgagccagaatggccgtccgg;
sera-r:cggtcatagattcactcctttttaagccagatccatccacacagc;
serc-f:tgtgtggatggatctggcttaaaaaggagtgaatctatgaccgacttccccaccctgc;
serc-r:cgacataagcaacttcctttttacttccttgcaaaaccgccatcg;
serb-f:gcggttttgcaaggaagtaaaaaggaagttgcttatgtcgtgttccgcgctcag;
serb-r:aaaactgcagttaggcattggtcaatggaacgcgg。
利用上述设计的引物,通过pcr的方法,分别获得片段sera,serc和serb。利用上述获得片段sera,serc和serb为模板,以sera-f/serb-r为引物,通过融合pcr的方法获得融合片段seracb,用xbai和ptsi双酶切后,连接至载体ptrc-9上,获得质粒ptrc-11。
pcr条件:step194℃4min,step294℃30s,step360℃30s,step472℃1min,step572℃10min,step64℃保温。
融合pcr条件及方法:(1)ddh2o28μl,模板13μl,模板23μl,fastpfubuffer10μl,fastpfu1μl,dntp5μl。step194℃4min,step294℃30s,step353℃30s,step472℃1.5min,10个循环,step572℃10min。(2)ddh2o30μl,模板1μl,fastpfubuffer10μl,fastpfu1μl,引物11.5μl,引物21.5μl,dntp5μl。step194℃4min,step294℃30s,step353℃30s,step472℃1.5min,30个循环,step572℃10min。
双酶切体系:基因seracb或质粒pptrc-920μl,bamhi1μl,xbai1μl,10×buffer5μl,ddh2o23μl,37℃反应1h。
连接体系:基因seracb片段16μl,ptrc-9片段1μl,t4连接酶0.5μl,10×buffer2μl,22℃反应1h。
将上述获得的质粒ptrc-11电转至上述(2)中构建的谷氨酸棒杆菌菌株细胞中。电转条件为:将100μl感受态细胞置于冰上,加入200ng重组质粒,冰上放置30分钟,转移至0.1cm的bio-rad电击杯中。使用micropulser(bio-rad公司)电穿孔仪。电击参数为电压1.8kv。电击后迅速用1mllbhis培养基转移至电击杯中,吹打5-10次后转移至ep管中,46℃热击6分钟,然后25℃孵育2h。将菌液涂布在含有氯霉素的lbhis平板上。
(5)将上述获得的谷氨酸棒杆菌工程菌株接种至含有20~25ml种子培养基的250ml三角瓶中,培养12h~16h至对数中期。然后离心收集细胞,用新鲜的发酵培养基悬浮,接种至含有50ml发酵培养基的250ml三角瓶中,起始od600为0.8~1.2,并加入5~15g/lcaco3。发酵条件为32℃,150~200rpm,恒温振荡培养。发酵培养基为:葡萄糖50~60g/l,尿素0.1~0.2g/l,玉米浆5~10g/l,硫酸铵15~20g/l,kh2po45~6g/l,mgso4·7h2o2~5g/l,feso4·7h2o0.2~0.5g/l,mncl2·4h2o0.2~0.4g/l,生物素0.2~0.4mg/l,维生素b11~2mg/l,维生素b61~2mg/l,caco35~15g/l用于发酵培养基的缓冲剂。种子培养基包括10~20g/l葡萄糖,尿素0.1~0.2g/l,玉米浆15~20g/l,硫酸铵15~20g/l,ph为6.5~7.0。最终以50~60g/l的葡萄糖为底物,经3~4天发酵,l-半胱氨酸含量达到800~1000mg/l。
序列表
<110>中国科学院天津工业生物技术研究所
<120>一种代谢工程改造谷氨酸棒杆菌高产l-半胱氨酸的方法
<130>2018
<160>1
<170>siposequencelisting1.0
<210>1
<211>945
<212>dna
<213>arabidopsisthaliana
<400>1
atggctacctgcatcgacacctgccgcaccggcaacacccaggacgacgactcccgcttc60
tgctgcatcaagaacttcttccgcccaggcttctccgttaaccgcaagatccaccacacc120
cagatcgaggacgatgacgacgtatggatcaagatgctggaggaggctaagtccgacgtt180
aagcaggagccaatcctgtccaactactactacgcttccatcacctcccaccgctccctg240
gagtccgctctggctcacatcctgtccgttaagctgtccaacctgaacctgccatccaac300
accctgttcgagctgttcatctccgttctggaggagtccccagagatcatcgagtccacc360
aagcaggacctgatcgctgttaaggagcgcgacccagcttgcatctcctacgttcactgc420
ttcctgggcttcaagggcttcctggcttgccaggctcaccgcatcgctcacaccctgtgg480
aagcagaaccgcaagatcgttgctctgctgatccagaaccgcgtttccgagtccttcgct540
gttgacatccacccaggcgctaagatcggcaagggcatcctgctggaccacgctaccggc600
gttgttatcggcgagaccgctgtagttggcgacaacgtaagcatcctgcacggcgttacc660
ctgggcggcaccggcaagcagtccggcgaccgccacccaaagatcggcgacggcgttctg720
atcggcgctggctcctgcatcctgggcaacatcaccatcggcgagggcgctaagatcggc780
tccggctccgttgttgttaaggacgttccagctcgcaccaccgctgttggcaacccagct840
cgcctgatcggcggcaaggagaacccacgcaagcacgacaagatcccatgcctgactatg900
gaccagacctcctacctgaccgagtggtccgactacgttatctaa945
- 还没有人留言评论。精彩留言会获得点赞!