基于CRISPR/Cas9技术编辑HBB-28突变位点的sgRNA、载体及应用的制作方法
本发明属于生物医药领域,具体涉及一种针对hbb-28地中海贫血的致病性点突变的crispr质粒构建方法,以及设计高效准地修复单碱基突变donor的方案。
背景技术:
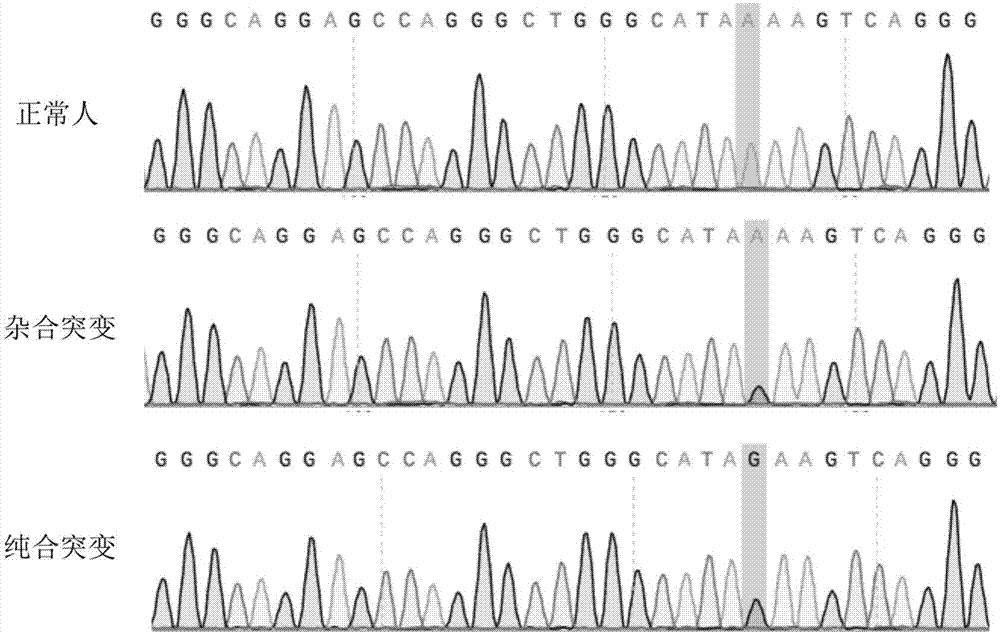
:β地中海贫血病(β地贫)是由于β珠蛋白基因的突变或缺失导致的构成血红蛋白hba(α2β2)的珠蛋白肽链合成减少或不能合成,造成α与β肽链合成失衡所引起的一种常染色体隐性遗传病。β地贫基因常以点突变最为常见,β珠蛋白转录启示区的tata盒-28点突变(a→g)是最早报道的与β地贫疾病相关的点突变之一。据报道,全世界约有4亿地中海贫血症基因携带者。在我国,该疾病好发于南方地区,尤其是广东省境内发生率远远高于其他省份。2012年对广东省21个地市共14332个户籍住院分娩孕妇的筛查研究发现,地贫基因携带率为16.8%,即高达1/6育龄人群携带地贫基因。每例重症地贫患儿的出生给社会和家庭带来的经济负担高达100万到300万元。目前可通过终生输血治疗地中海贫血症,然而绝大多数患儿在积极治疗的情况下仍在成年前死亡。另一种治疗方法则是通过骨髓或造血干细胞移植,但要找到相匹配的异体捐赠者非常困难,且费用不菲。目前只能通过胚胎植入前行遗传学诊断技术或通过胎儿脐血细胞基因检测技术筛选正常的胚胎或胎儿来阻断地贫致病基因的传播。通过利用基因编辑工具crispr精确特异性修复患者体细胞β珠蛋白基因(hemoglobinsubunitbeta,hbb)缺陷基因,然后将基因编辑与修复后的体细胞诱导成多能干细胞,最后移植入体内,从而分裂和分化为相应有功能的红细胞,来治疗和缓解β-地中海贫血患者症状。目前,针对β型地中海贫血的基因治疗,着手对象已从诱导型多能干细胞(ips)和造血干细胞(hsc)过渡到人类胚胎,直接阻断该遗传性疾病的垂直传播。2015年在世界上首次利用crispr/cas9基因编辑技术对异常授精的人类3pn受精卵进行hbb基因编辑修复,观测到crispr/cas9对人胚胎中靶基因切割效率达到51.9%,但同时发现脱靶明显。2017年,申请者再次利用单碱基编辑系统(apobec1)以及核移植技术,第一次在人类胚胎中实现了单碱基编辑,成功地对导致β-地中海贫血的一种单核苷酸突变-28位突变进行校正。这种单碱基编辑系统由crispr-cas9的变体与胞嘧啶脱氨酶构成,通过导向rna直接指向正确dna位置,用胸腺嘧啶(t)替换鸟嘌呤(c)。基因修复效率仅仅只有23%,并且修复后得到胚胎仍然是嵌合体,被修复的卵裂球也只有20%,很难实现完全治愈,且操作起来复杂繁琐。除此之外,该方法也存在较高的脱靶率。技术实现要素:本发明的目的是针对以上要解决的技术问题,提供一种技术方案,其能够精准地编辑hbb-28型突变位点。为此,本发明提供了一种sgrna,其核苷酸序列如seqidno.1或seqidno.2所示。本发明还提供了一种载体,其包括核苷酸序列如seqidno.1或seqidno.2所示的sgrna。优选地,所述载体是crispr/cas9表达载体。更优选地,所述载体是px330。本发明还提供了一种细胞,其包括上述载体。本发明还提供了核苷酸序列如seqidno.1或seqidno.2所示的sgrna用于编辑hbb-28突变位点的应用。本发明还提供了一种基于crispr/cas9技术编辑hbb-28突变位点的方法,其包括使用核苷酸序列如seqidno.1或seqidno.2所示的sgrna构建crispr/cas9表达载体。根据本发明的基于crispr/cas9技术编辑hbb-28突变位点的方法,优选还包括使用供体(donor)ssdna,该供体ssdna为hbb-28突变位点附近的100bp碱基序列,在其中引入hbb-28致病突变和无义突变,并在两端进行硫代修饰。更优选地,在该供体ssdna中引入hbb-28致病突变和无义突变,即将hbb-28的基因表达区上游tatabox-28位碱基由a(腺嘌呤)突变为g(鸟嘌呤),且hbb-28突变点后的第2位碱基由a(腺嘌呤)突变为c(胞嘧啶)。优选地,供体ssdna的核苷酸序列如seqidno.3所示,并对供体ssdna两端的碱基进行硫代修饰,优选在3’端和5’端各两个碱基进行硫代修饰。根据本发明的基于crispr/cas9技术编辑hbb-28突变位点的方法,优选地,包括以下具体步骤:(1)设计并合成所述sgrna,将cas9序列和所述sgrna克隆到crispr/cas9载体上,构建含有cas9序列和所述sgrna的crispr/cas9表达载体;(2)设计并合成所述供体ssdna,所述供体ssdna的核苷酸序列如seqidno.3所示;(3)将所述crispr/cas9质粒和所述供体ssdna共转染293t细胞,并进行培养。本发明针对hbb-28突变的地中海贫血这一转录起始区点突变的常染色体隐性遗传病,构建相应的靶向地中海贫血中该突变位点的crispr/cas表达质粒,同时采用5’和3’端两个碱基硫代修饰的ssdna(单链寡核苷酸),并在其中利用氨基酸简并性原理引入阻断再次编辑的无义突变,合成为donor,将crispr/cas表达质粒和donor二者共同转染到细胞中,在293t细胞中特异性的诱导hbb-28地中海贫血中基因突变位点的无痕定向改造,能以高效率及精度选择性引入单等位基因和双等位基因序列改变,极大地促进精确修复的提高。附图说明图1是正常人(纯合无突变)、轻型hbb-28地贫患者(杂合突变)和重型hbb-28地贫患者(纯合突变)的血液dna测序结果比较。图2示出了crispr/cas9质粒和donor-ssdna共转染293t细胞后,细胞基因组dna的测序结果。图3是t7e1酶切实验结果。图4是t7e1酶切实验结果进行灰度分析量化后所计算的酶切效率及整合效率结果对比。图5是三种不同样品的目标片段测序结果比较。具体实施方式下面结合具体实施例,对本发明的技术方案作进一步的详述,但本发明并不限于以下实施例。如未特别指出,以下所涉及的试剂均可通过商业途径购得。为简便起见,部分操作未详述操作的参数、步骤及所使用的仪器,应当理解,这些都是本领域技术人员所熟知并可重复再现的。crispr/cas9基因编辑系统是来源于化脓性链球菌的细菌适应性免疫系统,由核酸酶cas9和20bp的向导rna(sgrna)组成。crispr/cas9的特异性切割是由sgrna介导的,sgrna通过rna-dna碱基互补配对,与基因组dna上邻近有nggprotospacer-adjacentmotif(pam,前间区序列邻近基序)序列的位点相结合,将cas9酶导向靶位点。这种由可编程sgrna进行的简单目标导航,使crispr/cas9系统有别于早期的技术(如锌指核酸酶或转录激活因子样效应核酸酶(talens),这两种技术都需要复杂的dna结合蛋白结构域的组装来进行位点特异性编辑)。cas9需要有pam和sgrna结合才能在特异性位点引入双链断裂(dsb),这种双链断裂发生在pam上游3bp处。在大多数情况下,这些dsb通过非同源末端连接(nhej)途径修复,导致非特异性插入、缺失或其他突变,通常称为“indels”(插入缺失)。这很容易在目标基因的开放阅读框产生突变导致密码子提前终止翻译或者错误翻译,从而达到基因敲除的目的。然而,nhej修复不允许引入特定的序列改变,对于维持正常生命功能必需的正常基因突变致病这一类型的精准基因治疗来说并不适用。要产生特定的序列改变,例如,引入致病突变或纠正患者衍生细胞系中的突变,必须使用同源定向修复(hdr),这是一种独特的细胞dna修复途径。要做到这一点,最常见的方法是同时引入一个修改的dna修复模板,例如单链寡核苷酸(ssodn),其中包含与dsb周围基因组区域同源的两端侧翼序列,以及预期的序列变化。单链dna(ssdna)常常作为“donortemplate”被广泛应用于基因编辑过程中,可实现定点修复和dna片段敲入,研究表明长度为70-100bp的ssdna作为同源臂具有更高的定点修复和片段敲入效率,更易筛选获得定点编辑和片段敲入的突变体。在哺乳动物细胞中,hdr相对少见,基因组被crispr编辑产生的双链断裂主要由nhej修复,但细胞周期调控、nhej组分抑制或引入修复模板可提高hdr的频率。然而,通过hdr生成所需的基因组编辑事件,也需要通过防止切割后sgrna再次靶向结合来提高编辑的准确性,而这一点在早期的研究中并没有直接解决。这些“不准确”的编辑来源于crispr/cas9复合体对先前编辑过的位点的重新编辑,这将重新出现目标位点,直到它们被充分修改。本发明通过在crispr/cas9靶向的目标序列中,利用氨基酸的简并性,引入无义突变(blockingbase)到hdr-ssdna修复模板中,并对5’和3’端两个碱基进行硫代修饰,可以在很大程度上防止不期望的再次编辑(图2),从而达到无痕修复的目的。值得注意的是,本发明所涉及的基于crispr/cas9技术编辑hbb-28突变位点的方法用于非疾病诊断和治疗目的,其不以人体细胞作为目标进行基因编辑,其直接目的在于对基因编辑进行探索,而不在于直接对人体疾病进行治疗或得到诊断结果,用以获得人体的健康状态或使疾病情况改变。本实施例中使用的引物设计均使用primer3plus在线引物设计工具(http://www.primer3plus.com/cgi-bin/dev/primer3plus.cgi)完成;由苏州金唯智生物科技有限公司合成,整合的硫代修饰型donor-ssdna由苏州金唯智生物科技有限公司合成;鉴定刀子是否切割所使用的工程酶t7e1酶,购自newenglandbiolab(货号为#m0302s),鉴定donor整合修复的工程酶aatii酶以及配套的10×buffer购自thermoscientific公司(货号:fd0994)。sanger测序委托生工生物工程(上海)股份有限公司完成,依据专利申请者设计的序列进行质粒构建由苏州金唯智生物科技有限公司完成等。检测hbb-28突变碱基采取临床样本中正常人(纯合无突变)、轻型hbb-28地贫患者(杂合突变)和重型hbb-28地贫患者(纯合突变)的血液dna进行sanger测序,明确hbb-28突变为a变为g致病(见图1,图示中由于测序从反义链方向开始,因此在峰图上表现为a→g)。具体步骤如下:1.使用采血针采取正常人(纯合无突变)、轻型hbb-28地贫患者(杂合突变)和重型hbb-28地贫患者(纯合突变)的血液样本,并使用全式金dna抽提试剂盒(货号:#m10122),依据操作说明提取血液中的dna。2.通过ncbi数据库,寻找hbb-28突变点的上下游序列,在primer3plus在线引物设计工具网站(http://www.primer3plus.com/cgi-bin/dev/primer3plus.cgi)设计引物,扩增目标突变点的上下游片段,pcr产物送上海生工生物技术公司进行sanger测序,明确hbb-28突变特征为a→g单碱基点突变。引物序列为:正向引物:gcaatttgtactgatggtatgg(seqidno.4)反向引物:ataacagcatcaggagtggac(seqidno.5)所得的测序序列如seqidno.6所示,其中基因表达区上游tatabox-28位碱基为突变碱基。sgrna的合成本发明针对的dna序列为:hbb地贫基因碱基序列(ncbi数据库hgnc:4827orgrch38.p12,gcf_000001405.38)。利用crisprdesign(http://crispr.mit.edu/)在线sgrna设计工具,针对hbb-28型突变位点,设计致病突变点附近的sgrna并通过细胞实验筛选出效果最优的sgrna。依据sgrna的设计原理,在测序所得序列的突变位点附近设计sgrna,设计并挑选2条最佳的sgrna,据此构建crispr质粒。挑选的sgrna序列如下:sgrna1:agggctgggcataaaagtcagttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgc(seqidno.1)sgrna2:cagggctgggcataaaagtcgttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgc(seqidno.2)其中,前20个碱基为sgrna序列,即与靶dna结合的序列,其余碱基部分为scaffold,即sgrna发挥作用的二级结构区域。构建crispr/cas9的表达载体crispr/cas9的表达载体构建方法参考引文中的构建方法按常规操作完成构建,cas9序列和sgrna序列克隆到表达载体px330(plasmid#42230,addgene)上,构建crispr/cas9的真核表达载体质粒。构建完成后,通过常规测序比对确定构建载体序列正确无突变,挑选出完全正确的克隆进行扩增并提取质粒。供体(donor)序列的合成设计并合成定点无痕突变的donor-ssdna序列。截取hbb-28突变点附近的100bp碱基序列,在其中引入hbb-28致病突变(a→g)和无义突变(a→c),并在两端进行硫代修饰(*所示),donor序列如下:t*g*gccaatctactcccaggagcagggagggcaggagccagggctgggcatagacgtcagggcagagccatctattgcttacatttgctt*c*(seqidno.3)序列提交苏州金唯智生物科技有限公司合成。鉴定crispr/cas9质粒刀子的切割作用以及donor是否整合将以上构建的crispr/cas9质粒和donor-ssdna共转染293t细胞后,抽提总细胞基因组dna进行sanger测序验证crispr/cas9质粒刀子的切割作用以及donor是否整合。1.细胞培养293t细胞系用含有10%血清的dmem完全培养基在37℃、5%co2培养箱里培养。待细胞融合度达到90%时用0.25%的胰酶消化后,用dmem完全培养基终止消化,接种到6孔板中,继续培养24小时。2.质粒转染24小时后,确认细胞贴壁良好,细胞融合度达到80%,即可进行转染。每孔转染2ugcrispr/cas9质粒以及100pmol的donor-ssdna,使用roche公司的x-tremegenehpdnatransfectionreagent转染试剂按照说明书要求进行转染,转染后的细胞继续在37℃、5%co2培养箱中培养。3.基因组dna抽提转染48小时后,常规使用0.25%的胰酶消化细胞,收集细胞到离心管中,常温条件下300g离心5分钟,pbs洗涤一次,常温条件下300g离心5分钟。使用全式金dna抽提试剂盒(全式金生物技术有限公司,货号:ee101-01)的试剂组分,按照以下方法抽提细胞基因组dna:(1)加入100μl细胞裂解液lb2,充分混匀,悬浮细胞,加入20μlrnasea以及20μlproteinasek于样品中,涡旋混匀,室温孵育2min。(2)加入500μl结合dna的bb2试剂,立即涡旋5秒钟,室温孵育10min。(3)将全部的溶液加入离心柱中,12000×g离心30秒,弃去流出液。(4)加入500μl溶液cleanbuffer2(cb2),12000×g离心30秒,弃去流出液。然后重复一次。(5)加入500μl溶液washbuffer2(wb2),12000×g离心30秒,弃去流出液。然后重复一次。(6)12000×g离心2分钟,彻底去除残留的wb2。(7)将离心柱置于一干净的离心管中,在柱的中央加入50μl预热(60-70℃)的去离子水(ph>7)室温静置1分钟,12000×g离心1分钟,洗脱dna。测量dna浓度。4.引物的设计采用之前扩增目标突变点的上下游片段的引物,引物两端横跨靶点(产物长度优选~500bp,并且靶点距离引物两段的距离应当差别50bp以上以便在琼脂糖凝胶电泳时能有效的区分酶切开的两个小片段)。pcr产物送上海生工生物技术公司进行sanger测序,扩增引物和测序引物一致,序列为:正向引物:gcaatttgtactgatggtatgg(seqidno.4)反向引物:ataacagcatcaggagtggac(seqidno.5)5.pcr反应以上述提取的基因组dna为模版,用上述引物进行pcr反应。本实验使用的高保真dna聚合酶为北京全式金生物科技有限公司的2×pcrsupermix(货号:as111-02)。pcr反应体系如以下所示:组分体积终浓度模板可变按要求正向引物10.2um反向引物(10um)10.2um2xeasytaqpcrsupermix251x无核酸酶水可变-总体积50μl-pcr反应条件如以下所示:pcr反应完成后,取少量pcr产物进行琼脂糖凝胶电泳,根据电泳结果初步判定pcr产物的浓度以及条带大小是否正确等。6.t7endonucleasei酶切实验及聚丙烯凝胶电泳本实验使用的t7endonucleasei以及配套的10×nebbuffer2购自newenglandbiolabs公司(货号:m0302s)。操作步骤如下:取200ng纯化pcr产物进行如下反应:反应体系如以下所示:10×nebbuffer22μl纯化pcr产物200ngh2o补至19μl总量19μl退火条件如以下所示:95℃5min95-85℃-2℃/sec85-25℃-0.1℃/sec4℃hold退火反应完成后,此时再加入t7endonucleasei1μl,震荡混匀后,37℃孵育20分钟完成切割,加入2μl0.25medta溶液终止酶切反应。反应完成后,使用2%琼脂糖凝胶进行电泳。琼脂糖凝胶电泳结果显示,上述pcr产物能被t7endonucleasei切断,出现一大一小两条条带,说明crispr/cas9在细胞内成功的切割hbb-28基因序列,通过imagej软件对条带的灰度值进行测算,就能估算其切割效率。图2示出了crispr/cas9质粒和donor-ssdna共转染293t细胞后,抽提总细胞基因组dna进行sanger测序验证crispr/cas9质粒刀子的切割作用以及donor是否整合。图2中,wt代表没有转染crispr/cas9质粒;sgrna1和sgrna2分别代表在hbb-28突变位点附近设计的两条sgrna;左边的小方框代表在293t细胞的基因组上引入-28突变,a→g;右边的小方框代表引入无义突变碱基,a→c,即将hbb-28的基因表达区上游tatabox-28位碱基由a(腺嘌呤)突变为g(鸟嘌呤),且hbb-28突变点后的第2位碱基由a(腺嘌呤)突变为c(胞嘧啶)。质粒和ssdna转染到细胞后,质粒表达出来的靶向hbb-28突变位点的crispr/cas9系统,可以迅速的识别hbb-28突变位点序列,发挥切割作用。切割后细胞在有外源ssdna作为修复模板的时候,增加同源修复hdr的效率,从而达到无痕修复,同时引物需要的突变碱基序列,表现在测序峰图上,显示为hbb-28突变位点和无义突变位点的套峰,如箭头所示。在wt组则没有现象出现。7.整合鉴定aatii酶切实验及聚丙烯凝胶电泳同时将抽提的细胞基因组dna进行pcr扩增包含突变的目的片段后开展酶切实验,其中t7e1酶切实验鉴定刀子的切割效率,aatii酶切实验鉴定donor-ssdna整合的效率,两组酶切实验控制为同一批实验,并且模板量一致。结果如图3所示。可观测到实验组(-28-g1和-28-g2)均出现t7e1酶和aatii酶的酶切条带。使用的aatii酶以及配套的10×buffer购自thermoscientific公司(货号:fd0994)。操作步骤如下:取200ng纯化pcr产物进行如下反应:反应体系如以下所示:10×buffer22μl纯化pcr产物200ngaatii1μlh2o补至19μl总体积20μl混匀后,37℃孵育1小时完成切割,加入2μl0.25medta溶液终止酶切反应。反应完成后,使用2%琼脂糖凝胶进行电泳。琼脂糖凝胶电泳结果显示,上述pcr产物能被aatii切断,出现一大一小两条条带,说明crispr/cas9细胞内成功切割hbb基因后,修饰的donor-ssdna整合至了目标位点。通过imagej软件对条带的灰度值进行测算,就能估算aatii切割效率,将其与t7e1酶切效率进行比较,即可计算获得donor的整合效率。图4为通过对图3的胶图进行灰度分析,量化后所计算的效率值。其中,编辑效率的计算公式为:%genemodification=100x(1–(1-fractioncleaved)1/2)。t7e1酶切效率反映了刀子靶向切割的效率;aatii酶切效率表明当donor整合至目标位置时,会被此酶识别并切割;donor的整合效率的计算公式为:整合效率=(aatii酶切效率/t7e1酶切效率)×100%,此效率代表了整合修复引入突变的效率。图4表明,donor有效地整合到了目标位置。图3为crispr/cas9质粒和donor-ssdna共转染293t细胞后,抽提总细胞基因组dna进行pcr扩增包含突变的目的片段后,进行的酶切实验,其中t7e1酶切实验鉴定刀子的切割效率,aatii酶切实验鉴定donor-ssdna整合的效率,两组酶切实验控制为同一批实验,并且模板量一致。donor上引入无义突变同时可产生原本不具有的限制性酶切位点aatii,改良的donor整合后可通过此酶切位点快速鉴定是否整合,以及是否在基因组序列中引入阻断碱基(无义突变)进行了无痕修复;阻断碱基可以避免donor整合修复后被同样的sgrna再次靶向识别。hbb-28突变及无义突变的293t细胞系的鉴定和筛选通过挑选单克隆细胞进一步鉴定筛选出hbb-28突变及无义突变的293t细胞系。取转染48h后的各组细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,并把细胞悬浮在10%胎牛血清的dmem培养液中备用。将细胞悬液作梯度倍数稀释,每组细胞分别以每皿50、100、200个细胞的梯度密度分别接种含10ml37℃预温培养液的皿中,并轻轻转动,使细胞分散均匀,最终使培养孔中最多包含1个细胞。置37℃、5%co2及饱和湿度的细胞培养箱中培养2~3周。经常观察,当培养皿中出现肉眼可见的克隆时,扩增传代至细胞数量达到50万个/孔,收取一部分细胞按前述方法抽提细胞dna,按前述方法pcr扩增后送生工生物工程(上海)股份有限公司测序。单克隆细胞测序结果如图5所示,结果显示,通过此方法成功在正常293t细胞中引入了hbb-28突变及无义突变,从而获得hbb-28突变型293t细胞系,表明了高效定点突变方法的成功使用。序列表<110>广州鼓润医疗科技有限公司<120>基于crisprcas9技术编辑hbb-28突变位点的sgrna、载体及应用<160>6<170>siposequencelisting1.0<210>1<211>96<212>dna<213>人工序列(artificialsequence)<400>1agggctgggcataaaagtcagttttagagctagaaatagcaagttaaaataaggctagtc60cgttatcaacttgaaaaagtggcaccgagtcggtgc96<210>2<211>96<212>dna<213>人工序列(artificialsequence)<400>2cagggctgggcataaaagtcgttttagagctagaaatagcaagttaaaataaggctagtc60cgttatcaacttgaaaaagtggcaccgagtcggtgc96<210>3<211>90<212>dna<213>人工序列(artificialsequence)<400>3tggccaatctactcccaggagcagggagggcaggagccagggctgggcatagacgtcagg60gcagagccatctattgcttacatttgcttc90<210>4<211>22<212>dna<213>人工序列(artificialsequence)<400>4gcaatttgtactgatggtatgg22<210>5<211>21<212>dna<213>人工序列(artificialsequence)<400>5ataacagcatcaggagtggac21<210>6<211>578<212>dna<213>homosapiens<400>6gcaatttgtactgatggtatggggccaagagatatatcttagagggagggctgagggttt60gaagtccaactcctaagccagtgccagaagagccaaggacaggtacggctgtcatcactt120agacctcaccctgtggagccacaccctagggttggccaatctactcccaggagcagggag180ggcaggagccagggctgggcatagaagtcagggcagagccatctattgcttacatttgct240tctgacacaactgtgttcactagcaacctcaaacagacaccatggtgcatctgactcctg300aggagaagtctgccgttactgccctgtggggcaaggtgaacgtggatgaagttggtggtg360aggccctgggcaggttggtatcaaggttacaagacaggtttaaggagaccaatagaaact420gggcatgtggagacagagaagactcttgggtttctgataggcactgactctctctgccta480ttggtctattttcccacccttaggctgctggtggtctacccttggacccagaggttcttt540gagtcctttggggatctgtccactcctgatgctgttat578当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1