一种天然α-syn寡聚体抗体的制备方法及其产品和应用与流程
本发明属于生物技术领域,涉及一种抗体的制备方法及其产品和应用,尤其涉及一种天然α-syn寡聚体抗体的制备方法及其产品和应用。
背景技术:
帕金森病(parkinson’sdisease,pd)是发病率仅次于老年痴呆的一种神经退行性疾病,主要表现为震颤、肌强直、动作迟缓、姿势平衡障碍等运动症状和嗅觉减退、便秘、睡眠行为异常和抑郁等非运动症状。我国65岁以上人群总体患病率为1700/10万,并随年龄增长而升高,给家庭和社会都带来了沉重的负担。据估计目前世界上大约有1000万pd患者,尚无任何特异性治疗药物面世。因此,对pd有效治疗药物的研究刻不容缓。
pd有两个主要的病理特征:一是患者大脑黑质部位多巴胺能神经细胞程序性死亡,在约70-80%多巴胺能神经细胞死亡后,就会出现临床症状;二是患者脑内有不溶性路易斯小体和lewy神经突出现,其主要成分为聚集的α突触核蛋白(α-synuclein,α-syn)。α-syn单体含有140个氨基酸,主要存在于前突触末端,可能与突触的可塑性有关。α-syn单体可聚集形成寡聚体、前纤维和纤维。在各种形式的α-syn聚集体中,寡聚体可能是最具有毒性的,是pd发生发展的主要致病因素。动物模型实验也证实α-syn基因的突变、错误剪切或过表达导致的α-syn聚集与pd的发生直接相关。脑内α-syn聚集体具有神经毒性,能够破坏神经细胞膜,导致活性氧自由基的大量产生,引起氧化应激,线粒体损伤,脂质和蛋白过氧化,钙平衡紊乱,炎症因子释放增加,最终导致神经细胞功能紊乱,甚至凋亡。这些病理变化进而使得病人和转基因动物的行为和认知功能发生明显衰退,加速pd的进程。大量研究也确认,pd的严重程度与病人和转基因动物脑内的α-syn聚集体水平密切相关。
α-syn产生与清除之间的平衡被打破是pd病理学中的关键环节。基于α-syn的致病机理,对pd治疗药物的研究主要从三个方面入手:降低α-syn产生、抑制α-syn的聚集和加快α-syn的清除。基于α-syn的被动或主动免疫治疗是目前pd研究的热点。相对于主动免疫,被动免疫治疗具有更强的可控性,同时被动免疫不含t细胞表位,不会引起t细胞介导的脑膜炎,因而具有更好的安全性。针对α-syn的单克隆抗体有prx002、biib-054、mab4等,其中进展最快的是prx002和biib-054,这两个抗体目前均已进入临床ⅰ期试验。prx002是一株人源化的针对聚集的α-syn的单克隆抗体,临床ⅰ期试验结果表明该抗体具有较好的安全性和耐受性,经抗体治疗后病人血清中α-syn的浓度降低高达94%。biib-054是从健康老人的记忆b细胞中分离出来的全人源的单克隆抗体,该抗体可特异性靶向致病性的α-syn,与α-syn单体不结合,临床ⅰ期试验结果表明该抗体也具有较好的安全性和耐受性。以上两种抗体均进入临床π期,表明利用抗体治疗pd是可行的。
静脉注射免疫球蛋白(intravenousimmunoglobulin,ivig)是从大量健康人群供体血浆中制备的免疫球蛋白混合物。自从1981年imbach等偶然发现ivig具有免疫调节作用以来,ivig已被fda批准用于免疫缺陷、自身免疫疾病及吉兰-巴雷综合症等神经紊乱疾病的治疗。daniela等研究发现pd患者血液循环中的α-syn抗体水平明显降低,推测α-syn抗体水平可能与pd的发生发展相关。除了α-syn抗体水平,健康人中多种多样的天然抗α-syn抗体对防止pd的发生发展也十分重要。同时,该类天然抗体的种类及其之间的比例也是人工制备的α-syn相关抗体无法比拟的。但是ivig中只含有微量抗α-syn寡聚体抗体,以ivig治疗pd时,绝大多数的ivig抗体都是无益的,其用量太高时,易导致副作用的发生,因而限制了ivig对pd的治疗用量。
cn107709361a公开了一种新颖的单克隆抗α-突触核蛋白抗体,可以使用这些抗体治疗突触核蛋白病,例如帕金森氏病(包括帕金森氏病的特发性和遗传性形式)、弥漫性路易体病、阿耳茨海默病的路易体变体、组合型阿耳茨海默和帕金森氏病、纯自主神经衰竭和多系统萎缩。
cn105727285b公开了一种单克隆抗体在治疗神经退行性疾病中的应用。具体地,该发明提供了一种单克隆抗体的用途,用于制备治疗神经退行性疾病的药物组合物。实验证明,该发明的单克隆抗体和制剂对神经退行性疾病有显著的治疗作用,且该作用具有显著的剂量依赖性。
cn104822389a公开了一种单克隆抗体5c1及其相关抗体。该5c1抗体结合到位于α突触核蛋白残基118~126内的表位。该发明的抗体可以用于治疗和/或诊断α突触核蛋白,尤其是α突触核蛋白聚集相关的紊乱。这些紊乱包括帕金森氏病,弥漫性路易体病、阿尔茨海默病路易体变异型,综合阿尔茨海默病和帕金森氏病,单纯性自主神经衰竭和多系统萎缩。
以上抗α突触核蛋白的抗体均为人工型抗体,相对于天然抗体,其制备工艺复杂,操作难度大,因此,开发出一种天然α-syn寡聚体抗体的制备方法及其产品和应用是很有意义的。
技术实现要素:
针对现有技术存在的问题,本发明的目的在于提供一种抗体的制备方法及其产品和应用,尤其提供一种天然α-syn寡聚体抗体的制备方法及其产品和应用。
为达到此发明目的,本发明采用以下技术方案:
一方面,本发明提供一种天然α-syn寡聚体抗体(以下均用nabs-α-syn来表示)的制备方法,所述制备方法包括以下步骤:
利用可装载蛋白的材料和交联的α-syn寡聚体制备得到含有α-syn寡聚体的亲和材料,将其作为洗脱柱的填料,将静脉注射免疫球蛋白(intravenousimmunoglobulin,ivig)稀释后上样于所述洗脱柱,然后用洗脱液将结合的抗体洗脱出来,得到nabs-α-syn。
健康人中多种多样的天然抗α-syn抗体对防止pd的发生发展十分重要,静脉注射免疫球蛋白就是其中一种,但静脉注射免疫球蛋白中只含有微量抗α-syn寡聚体抗体,以静脉注射免疫球蛋白治疗pd时,绝大多数的静脉注射免疫球蛋白抗体都是无益的,其用量太高时,易导致副作用的发生,因而限制了静脉注射免疫球蛋白对pd的治疗用量。而本发明将静脉注射免疫球蛋白中的α-syn的抗体提取出来治疗pd,可以减小静脉注射免疫球蛋白治疗时的副作用,增加抗体有效浓度,而且不影响余下静脉注射免疫球蛋白的使用。
在本发明中,所述利用可装载蛋白的材料和交联的α-syn寡聚体制备含有α-syn寡聚体的亲和材料的方法为:
(1)将可装载蛋白的材料加入至交联缓冲液中;
(2)向步骤(1)得到的可装载蛋白的材料的体系中,加入交联的α-syn寡聚体,将所得到的混合体系进行离心处理,得到α-syn寡聚体亲和凝胶。
在本发明中,所述可装载蛋白的材料包括但不限于聚丙烯酰胺凝胶、琼脂糖凝胶或葡聚糖凝胶中的任意一种,优选聚丙烯酰胺凝胶。
在本发明中,步骤(1)所述缓冲液为ph=10的含0.6m柠檬酸钠和0.2m碳酸钠的缓冲液。
优选地,步骤(2)所述的离心处理包括以下步骤:
a、将混合体系混匀,震荡,离心,弃液相;
b、利用终止缓冲液进行重悬,震荡,离心,弃液相;
c、利用pbs缓冲液进行重悬,震荡,离心,弃液相;
d、利用nacl溶液进行重悬,震荡,离心,弃液相;
e、利用pbs缓冲液进行重悬,震荡,离心,弃液相。
优选地,步骤a所述震荡时间为0.5-2h,例如0.5h、0.7h、0.9h、1h、1.2h、1.4h、1.6h、1.8h或2h等。
优选地,步骤a所述离心时间为0.5-5min,例如0.5min、1min、1.5min、2min、2.5min、3min、3.5min、4min、4.5min或5min等。
优选地,步骤a所述离心力大小为1000-3000g,例如1000g、1200g、1500g、1800g、2000g、2300g、2500g、2800g或3000g等。
在本发明中,步骤b所述缓冲液为ph=9.0的含3.0mnh2(ch2)2oh的缓冲液。
优选地,步骤b所述震荡时间为1-5h,例如1h、1.5h、2h、2.5h、3h、3.5h、4h、4.5h或5h等。
优选地,步骤b所述离心时间为0.5-5min,例如0.5min、1min、1.5min、2min、2.5min、3min、3.5min、4min、4.5min或5min等。
优选地,步骤b所述离心力大小为1000-3000g,例如1000g、1200g、1500g、1800g、2000g、2300g、2500g、2800g或3000g等。
在本发明中,步骤c所述震荡时间为5-60min,例如5min、10min、15min、20min、30min、35min、40min、50min或60min等。
优选地,步骤c所述离心时间为0.5-5min,例如0.5min、1min、1.5min、2min、2.5min、3min、3.5min、4min、4.5min或5min等。
优选地,步骤c所述离心力大小为1000-3000g,例如1000g、1200g、1500g、1800g、2000g、2300g、2500g、2800g或3000g等。
在本发明中,步骤d所述nacl溶液的浓度为1m。
优选地,步骤d所述震荡时间为5-60min,例如5min、10min、15min、20min、30min、35min、40min、50min或60min等。
优选地,步骤d所述离心时间为0.5-5min,例如0.5min、1min、1.5min、2min、2.5min、3min、3.5min、4min、4.5min或5min等。
优选地,步骤d所述离心力大小为1000-3000g,例如1000g、1200g、1500g、1800g、2000g、2300g、2500g、2800g或3000g等。
在本发明中,步骤e共重复进行1-5次,例如1次、2次、3次、4次或5次。
优选地,步骤e所述震荡时间为5-60min,例如5min、10min、15min、20min、30min、35min、40min、50min或60min等。
优选地,步骤e所述离心时间为0.5-5min,例如0.5min、1min、1.5min、2min、2.5min、3min、3.5min、4min、4.5min或5min等。
优选地,步骤e所述离心力大小为1000-3000g,例如1000g、1200g、1500g、1800g、2000g、2300g、2500g、2800g或3000g等。
在本发明中,利用光交联,戊二醛交联或过氧亚硝酸盐交联的方法得到交联的α-syn寡聚体,优选过氧亚硝酸盐交联的方法。
在本发明中,所述稀释为稀释10-20倍,例如10倍、11倍、12倍、13倍、14倍、15倍、16倍、17倍、18倍、19倍或20倍等。
优选地,所述洗脱液为ph=2.0-2.7(例如2.0、2.1、2.2、2.3、2.4、2.5、2.6或2.7)的含0.2m-0.5m(例如0.2m、0.23m、0.25m、0.28m、0.3m、0.33m、0.35m、0.38m、0.4m、0.42m、0.45m、0.48m或0.5m)甘氨酸的洗脱液。
优选地,所述用洗脱液将结合的抗体洗脱出来之前,用pbs缓冲液洗脱未结合的抗体,得到流穿液。
作为本发明的优选技术方案,所述制备方法具体包括以下步骤:
(1)将可装载蛋白的材料加入至ph=10的含0.6m柠檬酸钠和0.2m碳酸钠的缓冲液中,润湿所述可装载蛋白的材料;
(2)向得到的可装载蛋白的材料体系中加入交联的α-syn寡聚体,混匀,震荡0.5-2h,以1000-3000g离心0.5-5min,弃液相;
(3)用ph=9.0的含3.0mnh2(ch2)2oh的缓冲液进行重悬,震荡1-5h,以1000-3000g的速度离心0.5-5min,弃液相;
(4)用pbs缓冲液进行重悬,震荡5-60min,以1000-3000g的速度离心0.5-5min,弃液相;
(5)用1m的nacl溶液进行重悬,震荡5-60min,以1000-3000g的速度离心0.5-5min,弃液相;
(6)用pbs缓冲液进行重悬,震荡5-60min,以1000-3000g的速度离心0.5-5min,弃液相,此过程重复1-5次,得到含有α-syn寡聚体的亲和材料;
(7)将含有α-syn寡聚体的亲和材料作为洗脱柱的填料,将静脉注射免疫球蛋白用pbs缓冲液稀释10-20倍后上样于所述洗脱柱,用pbs缓冲液洗脱未结合的抗体,得到流穿液,然后用ph=2.0-2.7的含0.2m-0.5m甘氨酸的洗脱液将结合的抗体洗脱出来,得到天然α-syn寡聚体抗体。
作为本发明的进一步优选技术方案,所述制备方法具体包括以下步骤:
(1)将聚丙烯酰胺凝胶珠加入至ph=10的含0.6m柠檬酸钠和0.2m碳酸钠的缓冲液中,润湿所述凝胶珠;
(2)向得到的聚丙烯酰胺凝胶珠体系中加入交联的α-syn寡聚体,混匀,震荡0.5-2h,以1000-3000g离心0.5-5min,弃液相;
(3)用ph=9.0的含3.0mnh2(ch2)2oh的缓冲液进行重悬,震荡1-5h,以1000-3000g的速度离心0.5-5min,弃液相;
(4)用pbs缓冲液进行重悬,震荡5-60min,以1000-3000g的速度离心0.5-5min,弃液相;
(5)用1m的nacl溶液进行重悬,震荡5-60min,以1000-3000g的速度离心0.5-5min,弃液相;
(6)用pbs缓冲液进行重悬,震荡5-60min,以1000-3000g的速度离心0.5-5min,弃液相,此过程重复1-5次,得到所述α-syn寡聚体亲和凝胶;
(7)将静脉注射免疫球蛋白用pbs缓冲液稀释10-20倍后上样于α-syn寡聚体亲和凝胶柱,用pbs缓冲液洗脱未结合的抗体,得到流穿液,然后用ph=2.0-2.7的含0.2m-0.5m甘氨酸的洗脱液将结合的抗体洗脱出来,得到nabs-α-syn。
另一方面,本发明提供一种如上所述制备方法制备得到的nabs-α-syn。
再一方面,本发明还提供一种如上所述的nabs-α-syn在制备抗α-syn病变疾病的药物中的应用。
优选地,所述应用为在制备治疗帕金森病的药物中的应用。
相对于现有技术,本发明具有以下有益效果:
本发明涉及的nabs-α-syn的制备方法简单易行,可操作性强,且制备得到的nabs-α-syn靶向性明确、专一,使用剂量易控制,从而能充分发挥该类抗体对pd的治疗作用,能够显著抑制α-syn的聚集,改善α-syn寡聚体的细胞毒性,改善pd转基因小鼠的运动、非运动症状和病理变化,在帕金森病等α-syn相关的疾病治疗方面具有广泛的应用前景。
附图说明
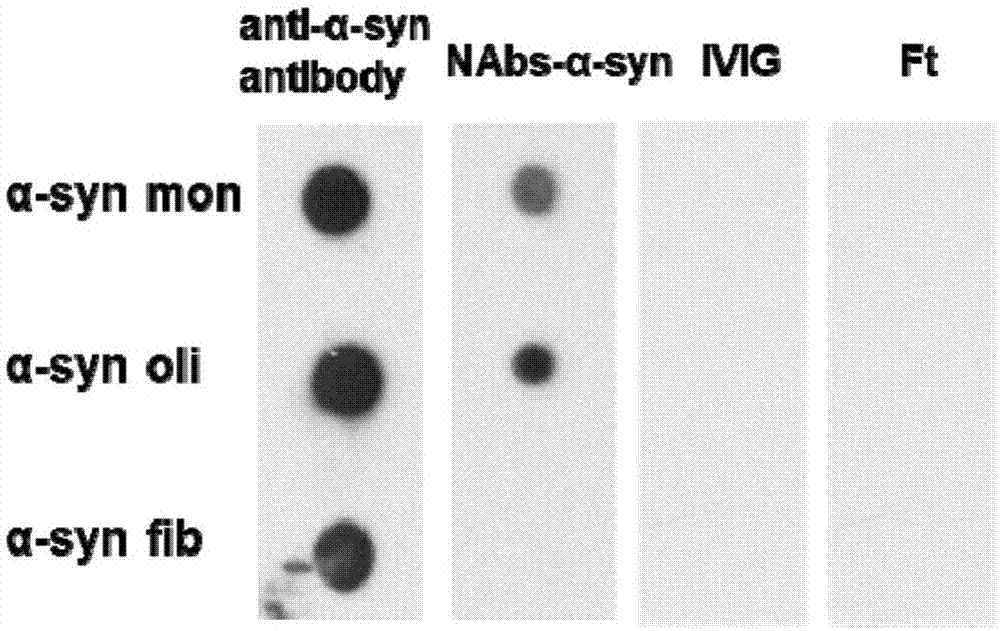
图1a是各抗体对α-syn单体、寡聚体、纤维的结合能力分析图;
图1b是5μg/ml的ivig和ft与α-syn单体、寡聚体、纤维的结合能力分析图;
图1c是5μg/ml的ivig和ft与α-syn单体、寡聚体、纤维的结合水平的定量分析图;
图2是nabs-α-syn、ivig与α-syn寡聚体亲和力比较分析图;
图3是nabs-α-syn对α-syn聚集的抑制分析图;
图4是nabs-α-syn对α-syn寡聚体细胞毒性影响图;
图5a是爬杆试验-下落时间结果统计图;
图5b是爬杆试验-转头时间结果统计图;
图6是身体悬浮试验结果统计图;
图7a是强制性y迷宫试验-在新臂中时间百分比结果统计图;
图7b是强制性y迷宫试验-进入新臂的频率结果统计图;
图8a是nabs-α-syn对a53t小鼠脑干内α-syn的水平影响的免疫组织化学检测结果图;
图8b是nabs-α-syn对a53t小鼠脑干内α-syn的水平影响的定量分析图;
图8c是nabs-α-syn对a53t小鼠脑皮层α-syn的水平影响的免疫组织化学检测结果图;
图8d是nabs-α-syn对a53t小鼠脑皮层α-syn的水平影响的定量分析图;
图9是elisa分析nabs-α-syn降低脑干可溶部分α-syn水平结果统计图;
图10a是dotblot分析nabs-α-syn降低脑干可溶部分α-syn寡聚体水平结果统计图;
图10b是dotblot分析nabs-α-syn降低脑干可溶部分α-syn寡聚体水平定量分析图;
图11a是nabs-α-syn降低a53t小鼠脑内星形胶质细胞活化水平图;
图11b是nabs-α-syn降低a53t小鼠脑内星形胶质细胞活化水平定量分析图;
图11c是nabs-α-syn降低a53t小鼠脑内小胶质细胞活化水平图;
图11d是nabs-α-syn降低a53t小鼠脑内小胶质细胞活化水平定量分析图;
图12a是nabs-α-syn对小鼠脑干内psd95的影响结果图;
图12b是nabs-α-syn对小鼠脑干内psd95的影响定量分析结果图;
图13a是westernblot检测nabs-α-syn对a53t小鼠脑内th水平影响结果图;
图13b是westernblot检测nabs-α-syn对a53t小鼠脑内th水平影响定量分析结果图;
图14a是免疫组化检测nabs-α-syn对a53t小鼠脑内th水平影响结果图;
图14b是免疫组化检测nabs-α-syn对a53t小鼠脑内th水平影响定量分析结果图;
图15a是nabs-α-syn减少a53t小鼠脑内轴突处的α-syn的水平结果图;
图15b是nabs-α-syn减少a53t小鼠脑内轴突处的α-syn的水平定量分析结果图。
图16是nabs-α-syn减少a53t小鼠脑内mcp-1水平定量分析结果图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的pbs缓冲液为ph=7.4的缓冲液(配方为:9gnacl,5.73gna2hpo4·12h2o,0.62gnah2po4·2h2o,用去离子水配成1l,调ph=7.4)。
下述实施例中的ivig是由山东泰邦生物制品有限公司提供。
下述实施例中的所有实验数据表示均为mean±sd形式,数据的统计分析采用graphpadprism软件进行,以p<0.05为差异具有统计学意义。
实施例1
本实施例提供一种nabs-α-syn,其制备方法包括以下步骤:
将聚丙烯酰胺凝胶珠加入至ph=10的含0.6m柠檬酸钠和0.2m碳酸钠的缓冲液中,润湿所述凝胶珠;向得到的聚丙烯酰胺凝胶珠体系中加入交联的α-syn寡聚体,混匀,震荡1h,以1200g离心1min,弃液相;用ph=9.0的含3.0mnh2(ch2)2oh的缓冲液进行重悬,震荡2.5h,以1200g的速度离心1min,弃液相;用pbs缓冲液进行重悬,震荡15min,以1200g的速度离心1min,弃液相;用1m的nacl溶液进行重悬,震荡15min,以1200g的速度离心1min,弃液相;用pbs缓冲液进行重悬,震荡15min,以1200g的速度离心1min,弃液相,此过程重复1次,得到所述α-syn寡聚体亲和凝胶;将ivig用pbs缓冲液稀释10倍后上样于α-syn寡聚体亲和凝胶柱,用pbs缓冲液洗脱未结合的抗体,得到流穿液(以下均由ft来表示),然后用ph=2.2的含0.2m甘氨酸的洗脱液将结合的抗体洗脱出来,得到nabs-α-syn,于-20℃下保存。
实施例2
本实施例提供一种nabs-α-syn,其制备方法包括以下步骤:
将聚丙烯酰胺凝胶珠加入至ph=10的含0.6m柠檬酸钠和0.2m碳酸钠的缓冲液中,润湿所述凝胶珠;向得到的聚丙烯酰胺凝胶珠体系中加入交联的α-syn寡聚体,混匀,震荡0.5h,以1000g离心5min,弃液相;用ph=9.0的含3.0mnh2(ch2)2oh的缓冲液进行重悬,震荡1h,以1000g的速度离心5min,弃液相;用pbs缓冲液进行重悬,震荡5min,以1000g的速度离心5min,弃液相;用1m的nacl溶液进行重悬,震荡5min,以1000g的速度离心5min,弃液相;用pbs缓冲液进行重悬,震荡5min,以1000g的速度离心5min,弃液相,此过程重复3次,得到所述α-syn寡聚体亲和凝胶;将ivig用pbs缓冲液稀释15倍后上样于α-syn寡聚体亲和凝胶柱,用pbs缓冲液洗脱未结合的抗体,得到ft,然后用ph=2.2的含0.2m甘氨酸的洗脱液将结合的抗体洗脱出来,得到nabs-α-syn,于-20℃下保存。
实施例3
本实施例提供一种nabs-α-syn,其制备方法包括以下步骤:
将琼脂糖凝胶加入至ph=10的含0.6m柠檬酸钠和0.2m碳酸钠的缓冲液中,润湿所述凝胶珠;向得到的琼脂糖凝胶体系中加入交联的α-syn寡聚体,混匀,震荡2h,以3000g离心0.5min,弃液相;用ph=9.0的含3.0mnh2(ch2)2oh的缓冲液进行重悬,震荡5h,以3000g的速度离心0.5min,弃液相;用pbs缓冲液进行重悬,震荡60min,以3000g的速度离心0.5min,弃液相;用1m的nacl溶液进行重悬,震荡60min,以3000g的速度离心0.5min,弃液相;用pbs缓冲液进行重悬,震荡60min,以3000g的速度离心0.5min,弃液相,此过程重复5次,得到所述α-syn寡聚体亲和凝胶;将ivig用pbs缓冲液稀释20倍后上样于α-syn寡聚体亲和凝胶柱,用pbs缓冲液洗脱未结合的抗体,得到ft,然后用ph=2.2的含0.2m甘氨酸的洗脱液将结合的抗体洗脱出来,得到nabs-α-syn,于-20℃下保存。
实施例4
nabs-α-syn与α-syn的亲和力试验:
本实施例采用dotblot法检测实施例1制得的nabs-α-syn与α-syn的亲和力,具体操作如下:
将2μgα-syn单体、2μgα-syn寡聚物和2μgα-syn纤维分别点于nc膜上,用5%脱脂牛奶封闭,随后分别与抗α-syn抗体(abcam,ab138501,1:10000)、0.5μg/ml的实施例1制得的nabs-α-syn、ivig和ft进行孵育,用含0.1%tween20的pbs缓冲液洗涤3次,每次10min,再加入二抗孵育1h,然后用含0.1%tween20的pbs缓冲液洗涤3次,并用ecl化学发光试剂盒(piercebiotechnology,rockford,il,usa)显色。
试验结果如图1a所示,抗α-syn抗体与α-syn单体、α-syn寡聚物和α-syn纤维均结合;实施例1制得的nabs-α-syn主要结合α-syn寡聚体,与α-syn单体结合较弱,与α-syn纤维不结合;但ft及ivig未见与各种形式α-syn的明显结合信号。增加ivig与ft的浓度至5μg/ml,结果如图1b和1c所示,ivig与α-syn单体、α-syn寡聚体和α-syn纤维均结合,相比于ivig,ft与α-syn单体及α-syn纤维的结合较弱,与α-syn寡聚体不结合。结果表明ivig中含有与各种形式α-syn结合的抗体,且经分离纯化得到的nabs-α-syn使得结合α-syn寡聚体和α-syn单体的抗体得到了富集。
实施例5
nabs-α-syn与α-syn的亲和活性试验:
本实施例采用elisa法检测实施例1制得的nabs-α-syn与α-syn的亲和活性,具体操作如下:
在96孔板中每孔加入1μgα-syn寡聚体,4℃过夜。用含0.1%tween20的pbs缓冲液洗涤后,用3%bsa封闭96孔板。将梯度稀释的实施例1制得的nabs-α-syn或ivig加入到96孔板中,并在37℃下反应1h。加入hrp标记的山羊抗人二抗后,tmb显色,用spectramaxm5酶标仪在450nm下(moleculardevices,llc,sunnyvale,ca,usa)测量吸光度。
试验结果如图2所示,结果表明,实施例1制得的nabs-α-syn对α-syn寡聚体的亲和力比ivig高75倍。
实施例6
nabs-α-syn对α-syn聚集的影响:
将71μm的α-syn单独孵育或分别与0.5μm由实施例1制得的nabs-α-syn、ivig和ft一起孵育,分别在0,12,24,36,48,60,72,84h收集样品。用ph=6.5的50mmpb缓冲液配置5mm硫磺素t溶液,将其与10μm样品混合(硫磺素t溶液与样品的体积比为19:1),用safire2tm酶标仪(tecangroupltd.,
实验结果如图3所示,结果表明,与ivig和ft相比,实施例1制得的nabs-α-syn能够明显抑制α-syn的聚集,而ivig和ft对α-syn聚集没有明显抑制作用。
实施例7
nabs-α-syn对α-syn细胞毒性的影响:
本实施例采用mtt法检测实施例1制得的nabs-α-syn对α-syn细胞毒性的影响,具体操作如下:
取对数期的sh-sy5y细胞,以8000细胞/100μl/孔的浓度接种于96孔细胞培养板,37℃培养24h后吸去培养基。用新鲜培养基稀释α-syn,并加入相应的ivig、ft和实施例1制得的nabs-α-syn,使各样品的终浓度为ivig(1μm)、ft(1μm)、实施例1制得的nabs-α-syn(0.5μm,1μm),各样品中α-syn的浓度为1μm,每孔100μl,对照组加100μl培养基。细胞继续培养48h后加入25μlmtt溶液,37℃避光作用3h。每孔加入150μldmso,37℃震荡作用10min后用spectramaxm5酶标仪(moleculardevices,llc,sunnyvale,ca,usa)读取570/630nm下od值。每组设6个重复孔,实验重复3次。
实验结果如图4所示,结果表明,与对照组相比,实施例1制得的nabs-α-syn能够明显降低α-syn的细胞毒性。对照组细胞存活率为70.3%,0.5μmnabs-α-syn组细胞存活率为87.8%,1μmnabs-α-syn组细胞存活率为92.0%,1μmivig组细胞存活率为86.7%,1μmft组细胞存活率为79.0%。
为了评估本发明制得的nabs-α-syn对a53t转基因小鼠的治疗作用,对小鼠分别进行了如下行为学试验。
实施例8
(1)被动免疫处理:
将12月龄的a53t转基因小鼠随机分为对照组、低剂量nabs-α-syn组(以下均由nabs-α-syn-l组表示),高剂量nabs-α-syn组(以下均由nabs-α-syn-h组表示),ivig组和ft组,每组6只。同时以6只年龄相同的普通c57bl/6j小鼠作为对照(用wt组表示)。a53t转基因小鼠每组(n=6)分别腹腔注射0.2m甘氨酸,低剂量(0.8mg/kg小鼠体重),高剂量(2.4mg/kg小鼠体重)的由实施例1制得的nabs-α-syn、ivig或ft,一周给药一次,持续四周。
(2)爬杆试验:
在最后一次给药后5天对小鼠进行爬杆试验。
将小鼠头朝上放在一个长度50cm,直径1cm,表面粗糙的木杆顶部,然后让小鼠从顶部往下爬。训练一段时间,让小鼠适应爬杆。24h后,记录小鼠从头朝上转到头朝下(以头朝下开始移动为标准)以及从杆顶部爬到底部所需的时间。每只小鼠至少连续做五次,记录表现最好的五次。
实验结果如图5a和5b所示,对照组小鼠的爬杆时间和转头时间分别为17.25s、15.25s;nabs-α-syn-l组小鼠爬杆时间和转头时间分别为3.9s、4.08s;nabs-α-syn-h组小鼠爬杆时间和转头时间分别为3.45s、3.95s;ft组小鼠爬杆时间和转头时间分别为14.3s、5.4s;ivig组小鼠爬杆时间和转头时间分别为6.19s、4.11s;wt组小鼠爬杆时间和转头时间分别为4.2s、1.4s。结果表明,与对照组相比,nabs-α-syn-l组和nabs-α-syn-h组小鼠运动能力得到改善。
实施例9
身体悬浮试验:
将小鼠的前肢悬挂在直径为2mm的金属棒上,让小鼠抓着金属棒在空中悬挂,直到小鼠从棒上跌落,记录小鼠在金属棒上停留的时间。每只小鼠测试三次。
实验结果如图6所示,对照组小鼠的悬浮时间为16.0s;nabs-α-syn-l组小鼠悬浮时间为17.7s;nabs-α-syn-h组小鼠悬浮时间为43.6s;ft组小鼠悬浮时间为25.3s;ivig组小鼠悬浮时间为33.6s;wt组小鼠悬浮时间为44.3s。结果哦表明,与对照组相比,nabs-α-syn-l组和nabs-α-syn-h组的小鼠平衡能力得到明显改善。
实施例10
强制性y迷宫试验:
该实验使用的y型迷宫由3个互为120度夹角的臂构成。每个臂的末端都标记有不同的图案。随机将三个臂中任意一个指定为起始臂,任意一个臂为检测新臂,一个为探索臂。在训练阶段,将小鼠放入起始臂,让其在起始臂和探索臂中自由探索5分钟,此时,新臂处于关闭状态。30分钟后,新臂打开,将小鼠放入起始臂,让小鼠自由探索5分钟。由轨迹追踪装置记录每只小鼠在新臂的时间和进入新臂的次数。
实验结果如图7a,b所示,对照组在新臂中的时间百分比和进入新臂频率分别为0.27,0.35;nabs-α-syn-l组在新臂中的时间百分比和进入新臂频率分别为0.23,0.30;nabs-α-syn-h组在新臂的中时间百分比和进入新臂频率分别为0.50,0.42;ft对照组在新臂中的时间百分比和进入新臂频率分别为0.14,0.25;ivig对照组在新臂中的时间百分比和进入新臂频率分别为0.28,0.34;wt对照组在新臂中的时间百分比和进入新臂频率分别为0.48,0.51。和对照组组小鼠相比,nabs-α-syn显著增加了小鼠在新臂的时间和次数(p<0.05),表明nabs-α-syn改善了a53t小鼠的记忆能力。
行为学试验结束后,为了评估本发明制得的nabs-α-syn能否改善a53t小鼠的病理变化,对小鼠分别进行了如下试验。
实施例11
nabs-α-syn对a53t小鼠脑内α-syn水平的影响:
免疫组织化学检测:以戊巴比妥钠麻醉小鼠,并用含有肝素(10u/ml)的预冷pbs心脏灌注。4%多聚甲醛固定左脑干,包埋石蜡。用leicacm1850切片机(leicabiosystems,buffalogrove,il,usa)矢状切片,厚度为5μm。切片用80%甲醇(内含0.3%h2o2)浸泡20min,消除内源性的过氧化物酶;pbs洗涤3次,每次5min;用含0.3%triton-x的10%山羊血清封闭液室温封闭2h,加入pser129抗体(abcam,ab59264,1:100),37℃孵育1小时;pbs洗涤4次,每次5min;加hrp标记的二抗(1:100),室温作用1h;pbs洗涤4次,每次5min;dab室温染色1min;bx60显微镜(olympuscorp.,shinjuku,tokyo)采集图像,放大倍数为10×。
实验结果如图8a,8b,8c,8d所示,对照组在皮层区、脑干的α-syn含量分别为1.03%、77.2%;nabs-α-syn-l组在皮层区、脑干的α-syn含量分别为0.6%、39.6%;nabs-α-syn-h组在皮层区、脑干的α-syn含量分别为0.16%、22.7%;ft组在皮层区、脑干的α-syn含量分别为1.1%、79.0%;ivig组在皮层区、脑干的α-syn含量分别为0.79%、40.2%;wt组在皮层区、脑干的α-syn含量分别为0%、0%;表明nabs-α-syn显著减少了小鼠大脑皮层,脑干区域的α-syn水平。
可溶性α-syn水平检测:通过α-synelisa试剂盒(thermoscientific,waltham,ma,usa)来定量a53t小鼠脑干的可溶性α-syn水平,并以每克脑蛋白中的α-syn含量表示。实验结果如图9所示,对照组小鼠脑干内α-syn含量为4026.62pg/g蛋白,nabs-α-syn-l组小鼠脑干内α-syn含量为3257.27pg/g蛋白,nabs-α-syn-h组小鼠脑干内α-syn含量为3462.41pg/g蛋白,ft组小鼠脑干内α-syn含量为4130.11pg/g蛋白,ivig组小鼠脑干内α-syn含量为3655.58pg/g蛋白,wt组小鼠脑干内α-syn含量为0pg/g蛋白。实验结果表明,nabs-α-syn能明显减少a53t小鼠脑干内a-syn的水平。
dotblot检测:使用oc抗体(纤维性寡聚体抗体)作为一抗,通过dotblot测定小鼠脑内的可溶性α-syn纤维性寡聚体水平。实验结果如图10a和10b所示,对照组小鼠脑干内α-syn纤维状寡聚体的含量为0.45(/内参);nabs-α-syn-l组小鼠脑干内α-syn纤维状寡聚体的含量为0.31(/内参);nabs-α-syn-h组小鼠脑干内α-syn纤维状寡聚体的含量为0.28(/内参);ft组小鼠脑干内α-syn纤维状寡聚体的含量为0.36(/内参);ivig组小鼠脑干内α-syn纤维状寡聚体的含量为0.37(/内参);wt组小鼠脑干内α-syn纤维状寡聚体的含量为0.27(/内参)。表明nabs-α-syn减少了a53t小鼠脑干内α-syn纤维状寡聚体的含量。
实施例12
nabs-α-syn对a53t小鼠脑内胶质细胞活化水平的影响:
免疫组织化学检测:一抗分别为抗iba-1抗体(genetex,gtx100042,1:100)和抗gfap抗体(abcam,ab53554,1:100),其他操作与实施例11相同。结果如图11a,11b,11c,11d所示,对照组小鼠脑内gfap、iba-1的含量分别为0.91%、1.11%;nabs-α-syn-l组小鼠脑内gfap、iba-1的含量分别为0.50%、0.60%;nabs-α-syn-h组小鼠脑内gfap、iba-1的含量分别为0.27%、0.26%;ft组小鼠脑内gfap、iba-1的含量分别为1.0%、0.97%;ivig组小鼠脑内gfap、iba-1的含量分别为0.51%、0.83%;wt组小鼠脑内gfap、iba-1的含量分别为0.12%、0.20%。实验结果表明,nabs-α-syn能明显改善a53t小鼠脑内星形胶质细胞和小胶质细胞的活化水平。
实施例13
使用westernblot检测nabs-α-syn对a53t小鼠脑内的突触损伤的影响。方法如下:加入tne缓冲液(含蛋白酶抑制剂混合物,10mmtris-hcl,ph7.4,150mmnacl,5mmedta)到右脑干中,用研磨器研磨,4℃12,000g离心1小时。收集上清即为tne可溶性组分。用10%sds重悬tne不溶性沉淀,于4℃100,000g离心30分钟以除去髓磷脂和相关的脂质,上清液为tne不可溶组分。将可溶性组分进行sds-page电泳分离后,湿法转膜2h;5%脱脂牛奶室温封闭2小时;加抗psd95抗体(abcam,ab18258,1:1000),室温孵育1小时,用含0.1%tween20的pbs缓冲液洗涤3次;加入hrp标记的二抗(1:10,000)室温孵育1小时。用含0.1%tween20的pbs缓冲液洗涤3次。用li-corodysseyir检测系统(odyssey)显色,并统计条带的光密度。
实验结果如图12a和12b所示,对照组小鼠脑干内psd95的含量为8.76%(/内参);nabs-α-syn-l组小鼠脑干内psd95的含量为8.21%(/内参);nabs-α-syn-h组小鼠脑干内psd95的含量为23.7%(/内参);ft组小鼠脑干内psd95的含量为11.9%(/内参);ivig组小鼠脑干内psd95的含量为15.8%(/内参);wt组小鼠脑干内psd95的含量为32.2%(/内参)。表明nabs-α-syn能明显改善a53t小鼠脑内的突触损伤。
实施例14
nabs-α-syn对a53t小鼠脑内的th水平的影响:
westernblot检测:一抗为抗th抗体(abcam,ab152,1:1000),其他操作与实施例13一致。实验结果如图13a和13b所示,对照组小鼠脑干内th的含量为8.76%(/内参);nabs-α-syn-l组小鼠脑干内th的含量为8.21%(/内参);nabs-α-syn-h组小鼠脑干内th的含量为23.7%(/内参);ft组小鼠脑干内th的含量为11.9%(/内参);ivig组小鼠脑干内th的含量为15.8%(/内参);wt组小鼠脑干内psd95的含量为32.2%(/内参)。表明nabs-α-syn能明显提高a53t小鼠脑干内th的水平。
免疫组织化学检测:一抗为抗th抗体(abcam,ab152,1:100),其他操作与实施例12一致。实验结果如图14a和14b所示,对照组小鼠脑内th的含量为3.24%;nabs-α-syn-l组小鼠脑内th的含量为5.46%;nabs-α-syn-h组小鼠脑内th的含量为10.21%;ft组小鼠脑内th的含量为3.41%;ivig组小鼠脑内th的含量为6.39%;wt组小鼠脑内th的含量为10.69%。实验结果表明,nabs-α-syn能明显提高a53t小鼠脑内th水平。
实施例15
nabs-α-syn对a53t小鼠脑干轴突处α-syn水平的影响:
免疫组织化学检测:一抗为α-syn的抗体pser129和轴突marker的抗体smi312,然后加入对应的二抗山羊抗兔抗体(zsgb-bio,1:100)及fitc标记的山羊抗小鼠抗体(zsgb-bio,1:100)。其他操作与实施例12一致,用共聚焦显微镜(leicatcssp5,63×物镜)获得图像。
实验结果如图15a和15b所示,对照组小鼠脑内轴突处α-syn的含量为0.23%;nabs-α-syn-l组小鼠脑内轴突处α-syn的含量为0.076%;nabs-α-syn-h组小鼠脑内轴突处α-syn的含量为0.011%;ft组小鼠脑内轴突处α-syn的含量为0.18%;ivig组小鼠脑内轴突处α-syn的含量为0.11%;wt组小鼠脑内轴突处α-syn的含量为0。实验结果表明,nabs-α-syn能明显减少a53t小鼠脑干轴突处α-syn水平。
实施例16
nabs-α-syn对a53t小鼠脑干内炎症因子水平的影响:
elisa检测:使用elisa试剂盒测定脑干匀浆中mcp-1的水平。按照试剂盒中的实验步骤,并通过accuric6flow8酶标仪(becton,dickinsonandcompany,usa)收集数据。
实验结果如图16所示,nabs-α-syn-l组小鼠脑内mcp-1的含量与对照组(即图中con所示)的比例为0.59;nabs-α-syn-h组鼠脑内mcp-1的含量与对照组的比例为0.48;ft组鼠脑内mcp-1的含量与对照组的比例为0.67;ivig组鼠脑内mcp-1的含量与对照组的比例为0.58;wt组鼠脑内mcp-1的含量与对照组的比例为0.53。实验结果表明,nabs-α-syn能明显减少a53t小鼠脑干炎症因子水平。
申请人声明,本发明通过上述实施例来说明本发明的nabs-α-syn的制备方法及其产品和应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
- 还没有人留言评论。精彩留言会获得点赞!