EGFR/Vimentin/叶酸免疫脂质体磁球、制备方法及试剂盒与流程
本发明涉及生物技术与生物医学领域,具体涉及一种egfr/vimentin/叶酸免疫脂质体磁球、其制备方法及试剂盒。
背景技术:
癌症的晚期经常发生转移,肿瘤的转移而不是原发性肿瘤导致约90%的癌症死亡,使其成为了癌症治疗的核心焦点。肿瘤细胞可以从原发部位迁移到循环系统(例如,血液,淋巴液和脑脊髓液)然后扩散到其他器官。此时癌细胞亚群离开原发肿瘤,通过血液循环迁移并定植新的远端组织形成新的肿瘤块。因此,早期识别通过血液循环传播的癌细胞,即循环肿瘤细胞(ctc),及时准确地检测稀有和极少数ctc,对于癌症治疗的成功和改善患者的生存率是至关重要的。循环肿瘤细胞(ctcs)的存在与预后不良密切相关。早期研究表明,基于ctc的治疗策略可能会影响癌症患者的临床结果,提高其生存率。
然而,血液中的ctc的丰度极低(每毫升血液10-100个),检测ctc,特别是在转移的早期阶段检测ctc是一项挑战,从患者获得的1-7ml血液样本中识别和捕获极少数癌细胞存在一定的困难。
目前,商业上可用的用于识别来自癌症患者血液的ctc的技术较成熟的为cellsearch,其他各种捕获技术,包括免疫磁珠,阵列扫描,功能化微纳米结构表面,微流体混沌微混合器,活体流式细胞仪等也都正在发展与应用中。其中,基于免疫化学的珠子或纳米颗粒可以高效率和高选择性地识别和捕获全血中的ctc。cellsearch就是基于抗体包被的磁性纳米颗粒连接上皮细胞粘附分子(epcam)捕获ctc的技术。但是,cellsearch存在一定的局限性,例如不能够捕获缺乏epcam蛋白的ctc或已经已经发生上皮间质转化的ctc,因此造成后续的荧光鉴定ctc的准确性比较低,检测结果不可靠。
组织及细胞的固定一般采用一下方法:单纯固定液(1)4%中性甲醛固定液:最常用的固定液,能满足常规he及免疫组化、pcr等工作。中性甲醛是以ph7.2-7.4的磷酸缓冲液为溶剂配制的,其固定效果及对组织抗原性的保存均优于一般的4%甲醛固定液。此固定液配制后应密封并保存在阴凉处,保存时间不超过一个月。(2)乙醇固定液:使用时以80%-95%的浓度为宜,具有硬化、固定、脱水等作用,对组织渗透力较弱,因此很少单独使用,但其保存组织中的核酸强于中性甲醛,故常用于有核酸操作的实验或检查,假如用于证实尿酸结晶和保存糖原,可用于100%乙醇固定组织。(3)4%多聚甲醛固定液:主要用于培养细胞的固定。混合固定液(1)乙醇-甲醛(乙醇-福尔马林,af)固定液:适用于皮下组织中肥大细胞的固定,该固定液有固定兼脱水作用,固定后的标本可直接入95%乙醇脱水。(2)b5(醋酸钠-升汞-甲醛)固定液:多用于固定淋巴组织,染色前应进行脱汞沉淀处理。(3)bouin固定液:非常适用于睾丸活检组织的固定。bouin液对组织固定较均匀,收缩很少,不会使组织变硬变脆,需现配现用。(4)carnoy固定液:穿透能力强,可很好的固定细胞质和细胞核,非常适用于固定外膜致密的组织,也适用于糖原及尼氏小体的固定。(5)zenker固定液:经此液固定的标本,细胞核和细胞质染色颇为清楚,但成本较高。
苏木精-伊红染色法(hematoxylin-eosinstaining,hestain),简称he染色法,是石蜡切片技术里常用的染色法之一。苏木精染液为碱性,脱氧核糖核酸(dna)两条链上的磷酸基向外,带负电荷,呈酸性,很容易与带正电荷的苏木精碱性染料以离子键结合而被染色。所以苏木精染液主要使细胞核内的染色质与胞质内的核酸着紫蓝色。伊红是一种化学合成的酸性染料,在水中离解成带负电荷的阴离子,与蛋白质的氨基正电荷的阳离子结合使胞浆染色,细胞浆、红细胞、肌肉、结缔组织、嗜伊红颗粒等被染成不同程度的红色或粉红色,与蓝色的细胞核形成鲜明对比。所以,伊红主要使细胞质和细胞外基质中的成分着红色。故各种组织或细胞成分与病变的一般形态结构特点均可显示出来。he染色法是组织学、胚胎学、病理学教学与科研中最基本、使用最广泛的技术方法。
对于循环肿瘤细胞(ctc)来说,上述固定方法和染色方法均可使用。然而,实践过程中,上述固定液在使用时存在成本以及固定效果方面的各种问题。而上述染色方法在ctc的鉴定中很少使用。
技术实现要素:
本发明是为了解决上述问题而进行的,目的在于提供一种egfr/vimentin/叶酸免疫脂质体磁球、其制备方法及试剂盒。
本发明提供了一种egfr/vimentin/叶酸免疫脂质体磁球,用于捕获非小细胞肺癌患者的外周血中的循环肿瘤细胞,具有这样的特征,该egfr/vimentin/叶酸免疫脂质体磁球连接有egfr抗体、vimentin抗体以及叶酸。
在本发明提供的egfr/vimentin/叶酸免疫脂质体磁球中,还可以具有这样的特征:其中,egfr抗体、vimentin抗体以及叶酸的质量比为egfr抗体:vimentin抗体:叶酸=1:1:1。
在本发明提供的egfr/vimentin/叶酸免疫脂质体磁球中,其特征在于,其通过以下制备方法制成:步骤一,按egfr抗体:vimentin抗体:叶酸:ghdc=1:1:1:1~1:1:1:10的质量比,将egfr抗体、vimentin抗体、叶酸以及ghdc共溶于磷酸缓冲液中,在预定温度下磁力搅拌反应过夜,获得第一溶液;步骤二,用分子量为8000~14000道尔顿的透析袋对第一溶液进行预定时间的透析,透析后进行冻干得到抗体衍生物,该抗体衍生物包括egfr-ghdc、vimentin-ghdc以及fa-ghdc;步骤三,按hqcmc:胆固醇=1:0.5~1:5的质量比,将hqcmc和胆固醇混合,获得混合物;步骤四,按去乙醇后的磁珠溶液:ch2cl2=1:1~1:5的体积比,将去乙醇后的磁珠溶液溶解于ch2cl2,获得第二溶液;步骤五,按第二溶液:混合物=1:1~1:5的体积质量比,将第二溶液加入混合物中,获得第三溶液;步骤六,将第三溶液在冰浴下乳化2min~20min,并在乳化时把溶于水的抗体衍生物按磁珠溶液:抗体衍生物=1:1~1:5的体积质量比,加入正在乳化的第三溶液中,乳化完成后得到第四溶液;步骤七,去除第四溶液中残留的ch2cl2,得到第五溶液;步骤八,将第五溶液进行磁分离并洗涤后,获得egfr/vimentin/叶酸免疫脂质体磁球。
在本发明提供的egfr/vimentin/叶酸免疫脂质体磁球中,还可以具有这样的特征:其中,步骤一中,预定温度为2~8℃。
在本发明提供的egfr/vimentin/叶酸免疫脂质体磁球中,还可以具有这样的特征:其中,步骤二中,预定时间为10h~14h。
在本发明提供的egfr/vimentin/叶酸免疫脂质体磁球中,还可以具有这样的特征:其中,步骤六中,乳化为超声乳化。
本发明还提供了一种非小细胞肺癌循环肿瘤细胞检测试剂盒,用于检测已经脱离肺部进入外周血中的循环肿瘤细胞,其特征在于,包括:上述任意一项所述的egfr/vimentin/叶酸免疫脂质体磁球。
在本发明提供的非小细胞肺癌循环肿瘤细胞检测试剂盒中,还可以具有这样的特征,还包括:第一固定液,用于对被捕获了循环肿瘤细胞的egfr/vimentin/叶酸免疫脂质体磁球进行第一次细胞固定;和第一染色剂,用于对经过第一次固定的循环肿瘤细胞进行第一次染色,其中,第一固定液包括体积分数为4%的多聚甲醛,第一染色剂包括dapi、ck19-fitc以及cd45-pe。
在本发明提供的非小细胞肺癌循环肿瘤细胞检测试剂盒中,还可以具有这样的特征,还包括:第二固定液,用于对经过第一次染色后的循环肿瘤细胞进行第二次固定;和第二染色剂,用于对经过第二次固定的循环肿瘤细胞进行第二次染色,其中,第二固定液包括质量浓度为0.01%~0.04%的琼脂糖溶液,第二染色剂包括苏木精和伊红。
发明的作用与效果
根据本发明所涉及的egfr/vimentin/叶酸免疫脂质体磁球,因为该脂质体磁球连接有egfr抗体、vimentin抗体以及叶酸,而发明人研究发现叶酸受体(frs)是非小细胞肺癌(nsclc)患者的一个重要的潜在药物靶点,nsclc患者中,fr表达上调约75.7%;egfr在多种肿瘤的发生发展过程中发挥关键作用,egfr蛋白在nsclc中的阳性表达率为53%,在性别及有无淋巴结转移之间阳性表达率有显著性差异,而在年龄、病理类型、肿瘤分化程度、吸烟史及临床分期之间无显著性差异;vimentin在侵袭性肿瘤细胞系中的表达显著增高,并与肿瘤的增生、侵袭、转移、进展密切相关,在肺癌中,高表达的vimentin可作为较差预后的独立观测指标,低表达的vimentin则是病人良好生存质量的独立预测因素,因此,本发明的egfr/vimentin/叶酸免疫脂质体磁球能够对非小细胞肺癌患者的循环肿瘤细胞(ctc)进行特异性靶向快速分离从而捕获ctc,解决了现有技术中cellsearch因不能够捕获缺乏epcam蛋白的ctc或已经发生上皮间质转化的ctc而造成的大量检测假阴性问题,能够用于ctc的鉴定、分析并提高ctc鉴定的精确度,因而极具临床应用价值。
根据本发明所涉及的非小细胞肺癌循环肿瘤细胞检测试剂盒,因为该试剂盒具有egfr/vimentin/叶酸免疫脂质体磁球,因此能够对非小细胞肺癌患者的外周血中的ctc进行快速富集分离,非常适用于非小细胞肺癌ctc的检测和分析。
附图说明
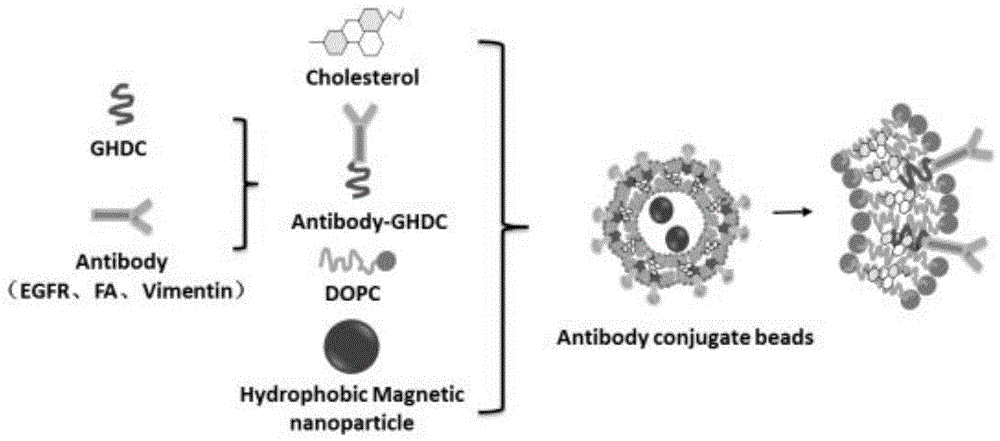
图1是本发明的实施例1中egfr/vimentin/叶酸免疫脂质体磁球的制备过程示意图;
图2是本发明的实施例2中egfr/vimentin/叶酸免疫脂质体磁球与单一抗体制备的脂质磁球的ctc捕获效率比较图;
图3是本发明的实施例4中非小细胞肺癌循环肿瘤细胞检测试剂盒的使用过程示意图;
图4是本发明的实施例中4使用非小细胞肺癌循环肿瘤细胞检测试剂盒对肺癌患者外周血循环肿瘤细胞进行免疫荧光鉴定和he染色的结果图;以及
图5是本发明的实施例4中第二固定液为0.02%琼脂糖时的细胞存留率与将第二固定液换成4%多聚甲醛时的细胞存留率对比结果图。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,以下结合实施例和附图对本发明egfr/vimentin/叶酸免疫脂质体磁球、其制备方法及试剂盒作具体阐述。
<实施例1>
图1是本发明的实施例1中egfr/vimentin/叶酸免疫脂质体磁球的制备过程示意图。
如图1所示,本实施例提供了一种egfr/vimentin/叶酸免疫脂质体磁球的制备方法,包括以下步骤:
步骤一,取表皮生长因子受体(egfr)抗体、波形蛋白(vimentin)抗体、叶酸各20μg,与100μg的环氧丙基十六叔胺(ghdc)共溶于3.0ml磷酸盐缓冲液(pbs,ph=7.4)中,4℃下磁力搅拌反应过夜,获得第一溶液。
步骤二,用分子量为8000~14000道尔顿的透析袋对第一溶液进行12h的透析,期间每2h更换一次pbs缓冲液,透析后进行冻干得到抗体衍生物并称重,该抗体衍生物包括egfr-ghdc、vimentin-ghdc以及fa-ghdc。
步骤三,称取5mg羧甲基壳聚糖十六烷基季铵盐(hqcmc)和5mg胆固醇(chol)加入到一个50ml三口烧瓶中,获得hqcmc和胆固醇的混合物。
步骤四,量取1.0ml磁珠溶液去乙醇后溶解于3.0mlch2cl2中,获得第二溶液。
步骤五,将第二溶液转移到盛有混合物的三口烧瓶中,获得第三溶液。此时,第二溶液:混合物=1:2.5的体积质量比。
步骤六,将第三溶液在冰浴条件下使用探头超声仪进行乳化超声6min,同时将2mg抗体衍生物溶解于6ml双蒸水(ddh2o)中并缓慢加入到正在乳化的第三溶液中,超声乳化完成后得到第四溶液。在本实施例中,将抗体衍生物的水溶液加入到第三溶液时,磁珠溶液:抗体衍生物=1:2的体积质量比。
步骤七,用旋转蒸发仪除去第四溶液中残留的ch2cl2,得到第五溶液。
步骤八,将第五溶液进行磁分离并洗涤3次后,获得egfr/vimentin/叶酸免疫脂质体磁球。
本实施例所制备得到的egfr/vimentin/叶酸免疫脂质体磁球连接有egfr抗体、vimentin抗体以及叶酸,并且连接的egfr抗体、vimentin抗体以及叶酸的质量比为1:1:1。
<实施例2>
本实施例为使用实施例1制备得到的egfr/vimentin/叶酸免疫脂质体磁球对非小细胞肺癌患者的外周血中的ctc进行分离:
抗凝采血管中收集非小细胞肺癌患者7.5ml全血,1500rpm离心10min;取中上层液置于15mlep管中后,加入与其等体积的pbs(ph=7.4)充分混匀,加入egfr/vimentin/叶酸免疫脂质体磁球10μl,室温孵育30min,每5min混匀一次;将ep管插入磁分离架上吸附15min,弃上清液得到沉淀物,该沉淀物为捕获了ctc的egfr/vimentin/叶酸免疫脂质体磁球,简称细胞-磁球。
图2是本发明的实施例2中egfr/vimentin/叶酸免疫脂质体磁球与单一抗体制备的脂质磁球的ctc捕获效率比较图。
如图2所示,图中vimentin、egfr以及fa分别表示单一vimentin抗体、单一egfr以及单一叶酸所制备的脂质体磁球,mix表示实施例1制备得到的egfr/vimentin/叶酸免疫脂质体磁球。从图中可以看出,实施例1制备得到的egfr/vimentin/叶酸免疫脂质体磁球相比于单一抗体制备的脂质磁球具有更高的ctc捕获效率。
<实施例3>
本实施例提供了一种非小细胞肺癌循环肿瘤细胞检测试剂盒,用于捕获已经脱离肺部进入外周血中的循环肿瘤细胞,并对捕获的ctc进行免疫荧光鉴定以及he染色鉴定,包括:egfr/vimentin/叶酸免疫脂质体磁球、第一固定液、第一染色剂、第二固定液以及第二染色剂。
其中,试剂盒中的egfr/vimentin/叶酸免疫脂质体磁球为实施例1制备得到的egfr/vimentin/叶酸免疫脂质体磁球。
第一固定液为体积分数为4%的多聚甲醛,用于对实施例2的细胞-磁球进行第一次细胞固定。
第一染色剂包括dapi、ck19-fitc以及cd45-pe,用于对经过第一次细胞固定的细胞-磁球进行第一次染色。
第二固定液为质量分数为0.02%的琼脂糖溶液,用于对经过第一次染色的细胞-磁球进行第二次固定。其固定原理为把低熔点的琼脂糖融化,冷却至一定温度后将细胞-磁球混合于琼脂糖中,再进一步冷却后细胞-磁球被包埋在固体状态的琼脂糖而被固定。
第二染色剂包括苏木精染液和伊红染液,用于对经过第二次固定的细胞-磁球进行he染色。
<实施例4>
本实施例提供了一种利用实施例3的非小细胞肺癌循环肿瘤细胞检测试剂盒的使用方法,即如何利用实施例3的非小细胞肺癌循环肿瘤细胞检测试剂盒来捕获非小细胞肺癌患者的外周血中的ctc,并对捕获的ctc进行免疫荧光鉴定以及he染色鉴定。
试剂盒在使用时,还需要准备体积分数分别为75%、95%、100%乙醇来配合试剂盒的使用。
图3是本发明的实施例4中非小细胞肺癌循环肿瘤细胞检测试剂盒的使用过程示意图。
如图3所示,试剂盒的使用方法包括以下步骤:
步骤s1,将egfr/vimentin/叶酸免疫脂质体磁球按照与实施例2相同的步骤对非小细胞肺癌患者的外周血中的ctc进行捕获(分离),得到细胞-磁球。
步骤s2,向盛有细胞-磁球的ep管内加入10μl第一固定液(4%多聚甲醛)固定细胞10min。第一次固定结束后使用pbs对细胞-磁球进行磁分离洗涤1次,弃上清液。
步骤s3,向洗涤后的细胞-磁球内加第一染色剂,具体来说加dapi30μl、ck19-fitc30μl、cd45-pe10μl,混匀避光染色15min。第一次染色结束后加入1mlddh2o磁分离架进行磁分离15min,弃上清液。向ep管中加入30μlddh2o对细胞-磁球进行重悬,混匀后的液体均匀涂于防脱载玻片中心,待液滴干后在荧光显微镜下拍照、鉴定。
步骤s4,取出载玻片,在涂片区域加入10μl第二固液(0.02%琼脂糖)固定细胞10min。
步骤s5,将载玻片放入盛有95%乙醇的染色缸中浸润15min后,用蒸馏水漂洗3min,苏木精染色10min,自来水洗至流出的液体清亮,50℃热水浸润5min,自来水再洗一次后,采用伊红染色2min。将载玻片依次放入75%、95%、100%乙醇中脱水各2min,用二甲苯清洗2~3次,加入中性树脂固定,显微镜下观察拍照。
图4是本发明的实施例中4使用非小细胞肺癌循环肿瘤细胞检测试剂盒对肺癌患者外周血循环肿瘤细胞进行免疫荧光鉴定和he染色的结果图。
图5是本发明的实施例4中第二固定液为0.02%琼脂糖时的细胞存留率与将第二固定液换成4%多聚甲醛时的细胞存留率对比结果图。
如图5所示,第二固定液为0.02%琼脂糖时,细胞存留率明显高于第二固定液换成4%多聚甲醛时,因此这种琼脂糖包埋固定的二次固定方式能够克了只采用4%的多聚甲醛固定导致的细胞丢失问题。
实施例的作用与效果
根据本实施例所涉及的egfr/vimentin/叶酸免疫脂质体磁球,因为该脂质体磁球连接有egfr抗体、vimentin抗体以及叶酸,而发明人研究发现叶酸受体(frs)是非小细胞肺癌(nsclc)患者的一个重要的潜在药物靶点,nsclc患者中,fr表达上调约75.7%;egfr在多种肿瘤的发生发展过程中发挥关键作用,egfr蛋白在nsclc中的阳性表达率为53%,在性别及有无淋巴结转移之间阳性表达率有显著性差异,而在年龄、病理类型、肿瘤分化程度、吸烟史及临床分期之间无显著性差异;vimentin在侵袭性肿瘤细胞系中的表达显著增高,并与肿瘤的增生、侵袭、转移、进展密切相关,在肺癌中,高表达的vimentin可作为较差预后的独立观测指标,低表达的vimentin则是病人良好生存质量的独立预测因素,因此利用egfr/vimentin/叶酸免疫脂质体磁球能够对非小细胞肺癌患者的循环肿瘤细胞(ctc)进行特异性靶向快速分离从而捕获ctc,解决了现有技术中cellsearch因不能够捕获缺乏epcam蛋白的ctc或已经发生上皮间质转化的ctc而造成的大量检测假阴性问题,能够用于ctc的鉴定以及下游的基因检测并提高ctc鉴定的精确度,因而极具临床应用价值。
同时,由于本实施例的egfr/vimentin/叶酸免疫脂质体磁球采用首先将egfr抗体、vimentin抗体、叶酸以及ghdc制成抗体衍生物,然后将hqcmc、胆固醇以及磁珠溶液混合后与抗体衍生物混合并乳化的方法制备得到,因此egfr抗体、vimentin抗体以及叶酸都能够连接在脂质体磁球上,从而表现出独特的ctc捕获能力。
根据本实施例所涉及的非小细胞肺癌循环肿瘤细胞检测试剂盒,因为该试剂盒具有egfr/vimentin/叶酸免疫脂质体磁球,因此能够对非小细胞肺癌患者的外周血中的ctc进行快速富集分离,非常适用于非小细胞肺癌ctc的检测和分析。
进一步地,由于本发明所涉及的试剂盒包括第一固定液、第一染色剂,所以通过本试剂盒还能够对富集(捕获)了ctc的egfr/vimentin/叶酸免疫脂质体磁球进行第一次固定和第一次染色,从而能够通过荧光显微镜对被捕获的ctc进行鉴定。
进一步地,由于本发明所涉及的试剂盒还包括第二固定液以及第二染色剂,所以通过本试剂盒还能够对经过荧光显微镜鉴定后的ctc进行第二次固定和第二次染色,从而能够进一步确认ctc的存在以及观察ctc的细胞形态,提高了ctc检测的精准度。
进一步地,第二固定液包括质量浓度为0.01%~0.04%的琼脂糖溶液,这种琼脂糖包埋固定的二次固定方式克服了只采用4%的多聚甲醛固定导致的细胞丢失问题。
上述实施方式为本发明的优选案例,并不用来限制本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!