双向热循环消减SELEX快速筛选核酸适配体的方法及试剂盒与流程
本发明涉及一种核酸适配体的筛选方法,尤其是涉及一种将纳米磁珠材料、selex技术和高通量核酸测序有机结合,建立双向热循环消减selex快速筛选(复合)靶分子核酸适配体的方法;本发明同时还涉及一种双向热循环消减selex快速筛选(复合)靶分子核酸适配体的试剂盒。
背景技术:
selex技术,即指数富集的配基系统进化技术(systematicevolutionofligandsbyexponentialenrichment,selex),利用该技术可以从随机单链核酸序列库中筛选出特异性与靶物质高度亲和的核酸适体(aptamer)。自tuerk等首先运用此技术筛选到特异性吸附噬菌体t4dna聚合酶和有机染料分子的特异寡核苷酸配基后,经过二十多年的发展,selex技术已经成为一种重要的研究手段和工具,被应用于生物化学、基因调控、疾病诊断及新药研发等领域。随着筛选的靶标越来越广泛,从最开始的有机染料和酶逐渐扩展到更小的离子、氨基酸、毒素以及更复杂的癌细胞、干细胞、临床组织切片、血清等,对于不同的靶物质,有必要采用适当的方法,才可以更快更方便地找到亲和力高、特异性强的适配体。
近年来,研究者在原有筛选方法的基础上将石墨烯,碳纳米管,毛细管,流式细胞仪,原子力显微镜等不同的材料和仪器引入了分离步骤以提高分离效率,使经典的selex技术得到发展和完善,衍生出了众多改良的selex技术如:反向筛选(counterselex)、消减筛选(subtractiveselex)、毛细管电泳筛选(ceselex)、基因组selex(genomicselex)、加尾筛选(tailoredselex)、切换筛选(toggleselex)和基于修饰核苷酸的selex等。这些方法的建立,提高了筛选效率,丰富了核酸适配体的应用形式,为核酸适配体的研究和应用奠定了基础。但是,这些筛选方法都存在一定的局限性,如筛选成本高、周期长、操作复杂,针对的靶标单一等。因此建立一种成本较低、操作简单、快速、高效的核酸适配体筛选技术具有重要意义。
技术实现要素:
本发明的目的是针对现有技术中的不足,提供一种双向热循环消减selex快速筛选核酸适配体的方法,可用于血清、细胞、组织、细菌和病毒等样品的筛选。
一、双向热循环消减selex快速筛选方法
本发明双向热循环消减selex快速筛选核酸适配体的方法,包括以下步骤:
(1)靶磁珠制备:分别将捕捉磁珠与目标靶分子、消减靶分子混合,在37±0.3℃孵育30min分钟,洗涤缓冲液洗1次,形成磁珠-目标靶、磁珠-消减靶;再分别加入蛋白封闭液,37±0.3℃封闭1h小时后去上清,用洗涤缓冲液洗至无泡沫,分离磁珠中加入ph值为7.4的1×bindingbuffer缓冲液,含0.1%的叠氮钠。
所述目标靶分子为单一分子、多种分子混合物、以及血清、细胞、组织、细菌和病毒裂解悬液中的一种;所述消减靶分子为靶分子中重复需要消除的对应分子。
所述琼脂磁珠,其结构是由琼脂包裹顺磁磁铁(四氧化铁)周围,经脱脂奶粉封闭,外加活性基团,如羧基、环氧基、氨基等活性基团,具有很好的结合生物分子的能力。琼脂磁珠通过化学键与蛋白质等生物分子结合,并通过结合的生物分子与其他分子发生酶催化、免疫、配体配基等反应,并且与核酸的非特异性吸附少。琼脂磁珠微粒的制备如下:
以油酸作为分散剂制备fe3o4磁流体:在氮气保护下,将19.48gfecl2·4h2o和52.98gfecl3·6h2o置于烧瓶后溶于600ml三蒸水,80℃下磁力搅拌并缓慢加入含25%tween-20的氨水30ml,80℃磁力搅拌30min。反应结束后,向悬浮液中缓慢加入30ml油酸,80℃磁力搅拌30min,用盐酸调节ph至中性,用磁铁分离溶液中的fe3o4,用三蒸水反复洗去过量的油酸后自然干燥。取3g油酸改性fe3o4微粒于广口瓶中,加入10ml三蒸水和120µltween-20超声10min,制备成磁流体,保存于4℃冰箱中备用。
反相聚合包埋法制备琼脂糖磁性微球(amm):有机相:在250ml三口烧瓶中加入2gspan-80,50ml液体石蜡,预热至80℃。水相:在4ml蒸馏水中加入0.125g琼脂糖,加热溶解后加入1ml自制的磁流体,充分混合。在850r/min机械搅拌下,迅速将水相滴入有机相,80℃反应10min后冷却至室温,250r/min搅拌5min使微球成形。微球用10ml石油醚和1ml异丙醇洗涤、抽滤,之后用石油醚和三蒸水分别清洗2次除去有机相后置于20%乙醇中,制得琼脂糖磁性微球,4℃保存冰箱备用。
所述洗涤缓冲液为ph=7.4的0.01mpbs缓冲液(含0.17%tween)。
蛋白封闭液为ph=7.4的0.01mpbs,其中含脱脂奶粉、酪蛋白。蛋白封闭液的作用:用于是寡核苷酸文库与靶分子充分结合。
(2)双向消减结合:将随机寡核苷酸文库(ssdna库)用结合缓冲液溶解,95℃加热5min并置于冰水中迅速冷却。结合缓冲液为ph值为7.4的1×bindingbuffer缓冲液。
正向结合:第一轮消减结合:将随机寡核苷酸文库先和磁珠-消减靶复合物37℃结合1h,磁分离,吸出上清;将上清加入到磁珠-目标靶复合物中,37℃结合1h,用0.5ml洗涤缓冲液充分摇动,洗涤3次,去除未结合的非特异性分子;在磁珠中加入结合缓冲液,95℃加热5min,重复3次,混合吸出的上清,上清为第一轮次级文库;从第二轮开始,将次级文库先与磁珠-目标靶复合物结合,磁分离弃上清,用0.5ml洗涤缓冲液充分摇动,洗涤3次,去除未结合的非特异性分子;在结合目标靶的磁珠中,加入结合缓冲液,95℃加热5min,重复3次,混合吸出的上清,加入磁珠-消减靶复合物中,37℃结合1h,磁分离,吸出上清为次级文库;
反向结合:将磁珠-消减靶复合物视为目标靶,磁珠-目标靶复合物为消减靶进行结合,结合过程同正向结合;
所述随机寡核苷酸文库序列为80-150个碱基,其中两端是固定引物,中间是随机序列,如:
5’-ctatagcaatggtacggtacttcc-n40-caaaagtgcacgctactttgctaa-3’,其中:两端分别为上、下游引物,中间40个碱基为随机序列。
(3)洗涤:用洗涤缓冲液充分摇动,洗涤3次。洗涤的目的:去除未结合的非特异性分子。洗涤缓冲液同上。
(4)洗脱:加入洗脱缓冲液,洗结合有靶分子的磁珠3次后,磁分离,在磁珠中加入结合缓冲液(其作用是保持靶分子结合缓冲体系不变),95℃加热5min,磁分离,吸取上清,重复加热3次,收集上清混匀,加入磁珠-消减复合物中37℃结合1h,磁分离取上清为次级文库。
洗脱缓冲液为3×ssc,含nacl和柠檬酸三钠。洗脱的目的:分离与琼脂磁珠结合的特异性分子。所述结合缓冲液为ph值为7.4的1×bindingbuffer缓冲液。
(5)次级文库的制备:实时荧光定量-pcr对前轮筛选消减获得的ssdna进行富集检测后,用不对称pcr方法和变性聚丙烯酰胺凝胶电泳切胶制备次级文库以步骤(4)所述上清为模板dna,pcr扩增16~20个循环后,得到第一轮筛选产物;再以筛选产物为模板,不对称pcr扩增20~30个循环,取pcr产物进行变性page凝胶电泳,切取单链条带,粉碎,加入洗脱缓冲液300μl,95℃加热5min,3000r/min离心收集上清,重复3次;将上清加入3000dr超滤管中,超滤20min,得到ssdna次级文库。用实时荧光定量-pcr对次级文库进行富集检测,保证了对筛选进程的定量监控。
(6)循环筛选:重复步骤(1)-(5)筛选7~15轮,每轮用实时定量-pcr检测次级库对目标靶和消减靶的结合量,确定富集程度,制备适配体富集文库。循环筛选,不仅方法简单,结果全面,而且实时检测每轮富集文库的结合量,提高了筛选效率。
(7)对适配体富集文库进行高通量测序。对适配体富集文库进行高通量测序,保证了筛选数据的完整性。
二、双向热循环消减selex快速筛选试剂盒
本发明双向热循环消减selex快速筛选试剂盒,包括以下试剂:
试剂1:5~10mlph值为7.4的0.01~0.1mpbs,内溶50%粒径5~50nm的琼脂磁珠微粒;
试剂2:结合缓冲液5~10ml,ph值为7.4的1×bindingbuffer缓冲液;
试剂3:洗涤缓冲液5~10ml,ph值为7.4的0.01mpbs(含0.17%tween);
试剂4:蛋白封闭液5ml,包括脱脂奶粉和酪蛋白;
试剂5:洗脱缓冲液3×ssc1l,包括柠檬酸、氯化钠。
综上所述,本发明相对于现有技术具有以下优点:
1、本发明将纳米磁珠材料、selex技术和高通量核酸测序有机结合,提高了核酸适配体的筛选效率、特异性、亲和性;
2、双向消减结合筛选,不仅可有效地去除目标靶和消减靶中相同的部分,筛选出目标靶特征分子的核酸适配体,而且可以通过双向中的反向消减筛选获得目标靶中没有的特征分子的核酸适配体。因此,双向消减筛选可有效去除相同分子的核酸适配体,同时获得目标靶和消减靶两个靶标的特异性核酸适配体,极大的提高了筛选效率,有助于通过特异性核酸适配体对目标靶和消减靶进行比对分析研究,从而探讨相关疾病的的发病机理;
3、以琼脂磁珠为载体附着靶分子,可机械化完成孵育、结合、分离等步骤,减少了人为操作的误差;
4、血清、细胞、组织、体液等复合靶标能更全面反应和提供许多关于机体健康或疾病状态的信息,针对这些复合靶标进行双向热循环消减selex筛选,可以“盲筛”获得已知或未知靶分子的特异性核酸适配体,从而钓取相关疾病的标志物,为疾病的诊断与治疗提供技术支持;
5、结合高通量核酸测序技术分析和鉴定核酸适配体,具有通量大、精确度高和信息量丰富等优点,可以在短时间内精确定位序列,检测未知序列,获得信息量丰富的核酸适配体序列。
附图说明
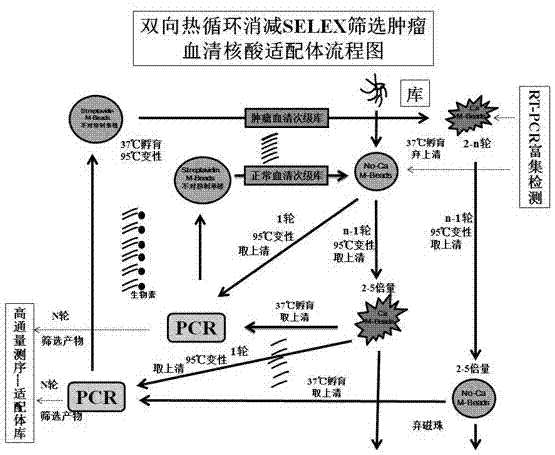
图1为双向热循环消减selex筛选肿瘤血清核酸适配体的流程图。
具体实施方式
下面通过具体实施例,对本发明消减热循环双向筛选核酸适配体的方法及试剂盒作进一步说明。
一、核酸适配体筛选试剂盒
核酸适配体筛选试剂盒,包括以下试剂:
试剂1:5~10ml,ph值为7.4的0.01-0.1mpbs,内溶50%粒径5~50nm的琼脂磁珠微粒;
试剂2:结合缓冲液5~10ml,ph值为7.4的1×bindingbuffer缓冲液(含0.01%叠氮钠的防腐剂)。1l1×bindingbuffer缓冲液的配制:138mmol/lnacl,2.7mmol/lkcl,8.1mmol/lna2hpo4,1.1mmol/lkh2po4,1mmol/lmgcl2,用hcl调节溶液的ph值至7.4,加水定容至1l,高压蒸汽灭菌20min,室温保存。
试剂3:洗涤缓冲液5~10ml,ph=7.4的0.01mpbs缓冲液(含0.17%tween)。1l0.01mpbs的配制:8gnacl,0.2gkcl,3.63gna2hpo4,2h2o,0.24gkh2po4,hcl调节溶液的ph至7.4,加水定容至1l,高压蒸汽灭菌20min,室温保存。
试剂4:蛋白封闭液5ml,ph值为7.4的0.01mpbs,其中含5%脱脂奶粉+1%酪蛋白,4℃保存。
试剂5:洗脱缓冲液3×ssc,包括柠檬酸、氯化钠。1l3×ssc的配制:25.04gnacl,12.6g柠檬酸三钠,加水定容至1l,室温保存。
二、核酸适配体的筛选
实施例1应用双向热循环消减selex快速筛选核酸适配体试剂盒筛选胃癌(肺癌、肝癌等)血清核酸适配体的方法
如图1所示,本实施例包括以下步骤:
(1)将胃癌和正常人血清标本,在4℃,3000r/min,离心20分钟后弃去上层油脂,分别取100µl与50μl琼脂磁珠一起37±0.3℃孵育30min,洗涤缓冲液洗1次,加入蛋白封闭液于37±0.3℃封闭1h后,去上清,用洗涤缓冲液洗3次,磁分离,分别得到正筛管(磁珠胃癌血清复合物)和反筛管(磁珠正常人血清复合物)。
(2)正向结合:第一轮筛选时将随机寡核苷酸文库(ssdna库)用结合缓冲液溶解,95℃加热5min并置于冰水中迅速冷却后,加入至反筛管中37±0.3℃结合1h,磁分离,吸出上清加入到正筛管中37±0.3℃结合1h。从第二轮开始次级文库先与正筛管37±0.3℃结合1h,磁分离,弃上清,加入结合缓冲液,95℃加热5min,磁分离,吸出上清与反筛管37±0.3℃结合1h,磁分离,留上清。反向结合:是将磁珠正常人血清复合物视为目标靶,磁珠胃癌血清复合物为消减靶,结合过程同正向结合。
(3)在正筛管和反筛管中分别加入0.5ml洗涤缓冲液洗磁珠3次后,磁分离,弃上清。
(4)再加入0.5ml洗脱缓冲液洗磁珠3次后,磁分离,在磁珠中加入300μl结合缓冲液95℃加热5min,磁分离,取上清,重复加热3次,收集上清混匀。
(5)分别以收集的正筛管和反筛管的上清为模板dna,pcr扩增16~20个循环后,得到第一轮筛选产物;再以筛选产物为模板,不对称pcr扩增20~30个循环,取pcr产物进行变性page凝胶电泳,切取单链条带,粉碎,加入300μl洗脱缓冲液95℃加热5min,3000r/min离心收集上清,重复3次;将收集的上清加入3000dr超滤管中,超滤20min,得到胃癌和正常人血清ssdna次级文库。并用实时荧光定量-pcr对ssdna文库进行富集检测。
(6)重复步骤(1)~(5),每轮经过37±0.3℃孵育,95℃变性,12轮循环后,获得胃癌和正常人血清适配体富集文库;
(7)将胃癌和正常人血清适配体富集文库进行高通量测序。比对分析测序结果,获得4条胃癌血清标志物核酸适配体。
实施例2、应用双向热循环消减selex快速筛选核酸适配体试剂盒筛选胃癌细胞悬液核酸适配体的方法
(1)从胃癌组织和正常胃粘膜组织中提取胃癌细胞和正常胃粘膜上皮细胞,酶解细胞后,1000r/min,离心5min,弃上清,沉淀加入pbs洗涤2遍,pbs重悬细胞,细胞计数后,分别取约2×106个细胞经超声破碎,制成细胞悬液,取100µl与50μl琼脂磁珠一起37±0.3℃孵育30min,洗涤缓冲液洗1次,加入蛋白封闭液于37±0.3℃封闭1h后,去上清,用洗涤缓冲液洗3次,磁分离,分别得到正筛管(磁珠胃癌细胞悬液复合物)和反筛管(磁珠正常胃粘膜上皮细胞悬液复合物)。
(2)正向结合:第一轮筛选时将随机寡核苷酸文库(ssdna库)用结合缓冲液溶解,95℃加热5min并置于冰水中迅速冷却后,加入至反筛管中37±0.3℃结合1h,磁分离,吸出上清加入到正筛管中37±0.3℃结合1h。从第二轮开始次级文库先与正筛管37±0.3℃结合1h,磁分离,弃上清,加入结合缓冲液,95℃加热5min,磁分离,吸出上清与反筛管37±0.3℃结合1h,磁分离,留上清。反向结合:是将磁珠胃癌细胞悬液复合物视为目标靶,磁珠正常胃粘膜上皮细胞悬液复合物为消减靶,结合过程同正向结合。
(3)在正筛管和反筛管中分别加入0.5ml洗涤缓冲液洗磁珠3次后,磁分离,弃上清。
(4)再加入0.5ml洗脱缓冲液洗磁珠3次后,磁分离,在磁珠中加入300μl结合缓冲液,95℃加热5min,磁分离,取上清,重复加热3次,收集上清混匀。
(5)分别以收集的正筛管和反筛管的上清为模板dna,pcr扩增16~20个循环后,得到第一轮筛选产物;再以筛选产物为模板,不对称pcr扩增20~30个循环,取pcr产物进行变性page凝胶电泳,切取单链条带,粉碎,加入300μl洗脱缓冲液95℃加热5min,3000r/min离心收集上清,重复3次;将收集的上清加入3000dr超滤管中,超滤20min,得到胃癌细胞和正常胃粘膜上皮细胞ssdna次级文库,并用实时荧光定量-pcr对ssdna文库进行富集检测。
(6)重复步骤(1)~(5),每轮经过37±0.3℃孵育,95℃变性,8轮循环后,获得胃癌细胞和正常胃粘膜上皮细胞适配体富集文库;
(7)将胃癌细胞悬液和正常胃粘膜上皮细胞适配体富集文库进行高通量测序。比对分析测序结果,获得7条胃癌细胞标志物核酸适配体。
实施例3、应用双向热循环消减selex快速筛选核酸适配体试剂盒筛选肠致病性大肠杆菌悬液核酸适配体的方法
(1)肠致病性大肠杆菌浓度调整为1×108cfu/ml,超声破碎大肠杆菌,12000r/min,离心3min,弃上清,用100μlpbs重悬,制成大肠杆菌悬液。取100µl与50μl琼脂磁珠一起37±0.3℃孵育30min,洗涤缓冲液洗1次,加入蛋白封闭液于37±0.3℃封闭1h后,去上清,用洗涤缓冲液洗3次,磁分离,即得磁珠细菌悬液复合物。
(2)将随机寡核苷酸文库(ssdna库)用结合缓冲液溶解,95℃加热5min并置于冰水中迅速冷却后,加入至细菌悬液磁珠复合物中37±0.3℃结合1h。
(3)在寡核苷酸文库-细菌悬液磁珠复合物中加入0.5ml洗涤缓冲液洗磁珠3次后,磁分离,弃上清。
(4)再加入0.5ml洗脱缓冲液洗磁珠3次后,磁分离,在磁珠中加入300μl结合缓冲液95℃加热5min,磁分离,取上清,重复加热3次,收集上清混匀。
(5)以收集的上清为模板dna,pcr扩增16~20个循环后,得到第一轮筛选产物;再以筛选产物为模板,不对称pcr扩增20~30个循环,取pcr产物进行变性page凝胶电泳,切取单链条带,粉碎,加入300μl洗脱缓冲液95℃加热5min,3000r/min离心收集上清,重复3次;将收集的上清加入3000dr超滤管中,超滤20min,得到ssdna次级文库。
(6)重复步骤(1)~(5),每轮经过37±0.3℃孵育,95℃变性,7轮循环后,获得肠致病性大肠杆菌适配体富集文库。
(7)将肠致病性大肠杆菌适配体富集文库进行高通量测序。比对分析测序结果,获得2条肠致病性大肠杆菌核酸适配体。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 几种识别灭草松的核酸适配体序列及其衍生物的制作方法