一种埃坡霉素高产菌株选育方法及菌株与流程
本申请涉及微生物选育技术领域,特别是涉及一种埃坡霉素高产菌株选育方法及菌株。
背景技术:
埃坡霉素(epothilone)是纤维堆囊菌产生的一类具有抗肿瘤活性的大环内酯类化合物。与传统的抗癌药物紫杉醇相比,埃坡霉素能够更好地抑制肿瘤细胞增殖,且分子结构简单、水溶性好、毒副作用小、抗肿瘤谱广、可发酵生产,是一种具有重要开发潜力的新型抗肿瘤活性物质。
然而,目前人们对于纤维堆囊菌的遗传背景认知不足,遗传操作系统低效,且缺乏有效的遗传标记,针对纤维堆囊菌的遗传改造及埃坡霉素的异源表达都遇到了较大的困难。
因此,如何对纤维堆囊菌进行遗传改造,从而提高埃坡霉素的产量,是本领域技术人员亟待解决的技术问题。
技术实现要素:
为解决上述技术问题,本发明的第一个目的为提供一种埃坡霉素高产菌株的选育方法;本发明的第二个目的为提供一种由上述选育方法获得的菌株;本申请提供的埃坡霉素高产菌株的选育方法,通过采用genomeshuffling技术,将纤维堆囊菌以诱变获得的菌株作为出发株,然后通过多轮递归原生质体融合的方式,将不同亲本的优良性状高效地整合到融合子中,然后借助高通量筛选的方法获得性状显著改良的突变株。本申请提供的选育方法,简便、高效,耗时短,并能得到埃坡霉素产量显著提高的菌株。
本发明提供的技术方案如下:
一种埃坡霉素高产菌株的选育方法,包括以下步骤:
a、取纯培养纤维堆囊菌,接种在cnst培养基上活化,然后转移至m26培养基培养至指数期,收集菌体;
b、使用溶菌酶处理菌体,获得原生质体;将原生质体分为两份,第一份原生质体热灭活,第二份原生质体紫外灭活,然后将两份灭活后的原生质体融合,使用vy/2培养基再生培养,得到第一代菌株;
c、将第一代菌株中部分进行诱变,将诱变后的菌株与未诱变的菌株使用溶菌酶处理,获得原生质体,然后将原生质体分为两份,第一份原生质体热灭活,第二份原生质体紫外灭活,然后将两份灭活后的原生质体融合,使用vy/2培养基再生培养,得到第二代菌株;
d、重复步骤c1-3次,将每次获得的菌株分别收集、培养,筛选获得高产菌株。
优选地,步骤a中,所述cnst培养基的配方为na2hpo4·12h2o0.025%,kno30.05%,mgso4·7h2o0.1%,微量元素液1ml/l,琼脂2.0%,ph7.2;和/或,
所述纤维堆囊菌在所述cnst培养基上28-30℃加湿培养5-10天。
优选地,步骤a中,所述m26培养基的配方为:土豆淀粉0.8%,豆蛋白胨0.2%,葡萄糖0.2%,酵母粉0.2%,mgso4·7h2o0.1%,cacl20.1%,edta-fe3+1ml/l,ph7.2;和/或,
所述纤维堆囊菌在所述m26培养基中150-250rpm/min摇床28-30℃培养3-6天。
优选地,所述纤维堆囊菌经m26培养基培养至指数期后,搅拌打散培养液中菌体,然后接种到新的m26培养基中,150-250rpm/min摇床28-30℃继续培养2-3天,收集菌体,进入步骤b中使用。
优选地,步骤b或步骤c中,使用溶菌酶处理菌体具体为:将菌体的浓度调整为1*108cell/ml,悬浮在mmm缓冲液中,再加入等体积的浓度为2mg/ml溶菌酶液,混匀,30℃水浴保温25-40min,离心,收集原生质体,用mmm缓冲液洗涤并重悬,获得原生质体悬液;所述mmm缓冲液由甘露醇、氯化镁、马来酸配成。
优选地,所述菌体在使用溶菌酶处理前,先加入edta预处理10-20min。
优选地,步骤b或步骤c中,所述热灭活具体为在60-80℃下水浴1-10min;和/或,
所述紫外灭活具体为:将原生质体置于平皿中,25-40w的紫外灯在平皿上方30-40cm高度照射60-300s。
优选地,步骤b或步骤c中,所述vy/2培养基的配方为:活性干酵母0.5%,vb120.5mg/l,mgso4·7h2o0.05%,cacl20.1%,琼脂2.0%,ph7.2;和/或,
所述原生质体在所述vy/2培养基上30℃恒温培养5-10天,直至长出单菌落。
优选地,步骤d中,所述收集、培养、筛选具体为:将每次获得的菌株再生培养,获得再生菌落,检测再生菌落250nm波长的吸光度,取吸光度最高的1-10株菌株进行发酵培养,hplc定量检测埃坡霉素含量,最终筛选得到埃坡霉素高产菌株。
一株埃坡霉素高产菌株,由上述任一项所述的方法获得。
本申请提供一种埃坡霉素高产菌株的选育方法,将纤维堆囊菌活化、培养至对数期后,采用原生质体融合方式,反复诱变、融合、再生,获得综合性状优良的埃坡霉素高产菌种,作为生产菌种。通过采用genomeshuffling技术,以诱变获得的菌株作为出发株,然后通过多轮递归原生质体融合的方式,将不同亲本的优良性状高效地整合到融合子中,然后借助高通量筛选的方法获得性状显著改良的突变株。本申请使用genomeshuffling技术进行埃坡霉素高产菌种改良,简便、高效,耗时短,并能得到埃坡霉素产量显著提高的菌株。
附图说明
为了更清楚地说明本申请实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
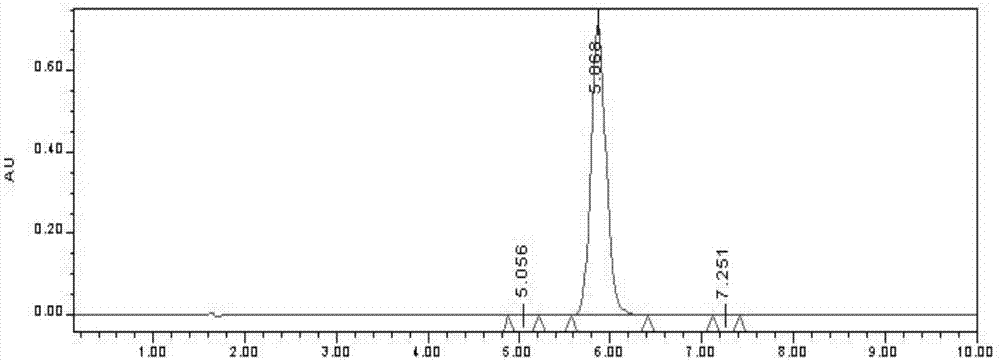
图1为本发明实施例中埃坡霉素b的hplc检测图;
图2为本发明实施例中改良后的菌株在vy/2再生培养基培养24h后菌体形态图;
图3为本发明实施例中获得的原生质体镜检图;
图4为本发明实施例中获得的第一代菌株(即再生原生质体)的再生形态图。
具体实施方式
为了使本技术领域的人员更好地理解本申请中的技术方案,下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本申请保护的范围。
请如图1至图4所示,本发明实施例提供一种埃坡霉素高产菌株的选育方法,包括以下步骤:
a、取纯培养纤维堆囊菌,接种在cnst培养基上活化,然后转移至m26培养基培养至指数期,收集菌体;
b、使用溶菌酶处理菌体,获得原生质体;将原生质体分为两份,第一份原生质体热灭活,第二份原生质体紫外灭活,然后将两份灭活后的原生质体融合,使用vy/2培养基再生培养,得到第一代菌株;
c、将第一代菌株中部分进行诱变,将诱变后的菌株与未诱变的菌株使用溶菌酶处理,获得原生质体,然后将原生质体分为两份,第一份原生质体热灭活,第二份原生质体紫外灭活,然后将两份灭活后的原生质体融合,使用vy/2培养基再生培养,得到第二代菌株;
d、重复步骤c1-3次,将每次获得的菌株分别收集、培养,筛选获得高产菌株。
本申请提供一种埃坡霉素高产菌株的选育方法,将纤维堆囊菌活化、培养至对数期后,采用原生质体融合方式,反复诱变、融合、再生,获得综合性状优良的埃坡霉素高产菌种,作为生产菌种。通过采用genomeshuffling技术,以诱变获得的菌株作为出发株,然后通过多轮递归原生质体融合的方式,将不同亲本的优良性状高效地整合到融合子中,然后借助高通量筛选的方法获得性状显著改良的突变株。本申请使用genomeshuffling技术进行埃坡霉素高产菌种改良,简便、高效,耗时短,并能得到埃坡霉素产量显著提高的菌株。
优选地,步骤a中,所述cnst培养基的配方为na2hpo4·12h2o0.025%,kno30.05%,mgso4·7h2o0.1%,微量元素液1ml/l,琼脂2.0%,ph7.2;和/或,
所述纤维堆囊菌在所述cnst培养基上28-30℃加湿培养5-10天。
优选使用的cnst培养基中含有na2hpo4·12h2o、kno3、mgso4·7h2o、微量元素液,并调节ph为7.2。为便于使用,将cnst培养基制成固体培养基,在上述配方中再加入2.0%琼脂粉,并在121℃、0.1mpa条件下灭菌30min再使用。
纤维堆囊菌在所述cnst培养基上28-30℃加湿培养5-10天,优选在30℃加湿培养7天,形成扩展的菌膜。
优选地,步骤a中,所述m26培养基的配方为:土豆淀粉0.8%,豆蛋白胨0.2%,葡萄糖0.2%,酵母粉0.2%,mgso4·7h2o0.1%,cacl20.1%,edta-fe3+1ml/l,ph7.2;和/或,
所述纤维堆囊菌在所述m26培养基中150-250rpm/min摇床28-30℃培养3-6天。
使用cnst培养基活化的菌株,接种在上述m26培养基上,培养至指数期,指数期的细菌生长速度快,呈几何级数增长,且此时期细菌对外界环境因素的作用敏感,利于选育的进行。
优选先将cnst培养基活化的菌株挑针法接种在固体m26培养基(上述m26培养基中添加2.0%琼脂制成),培养至指数生长期,然后转移到液体m26培养基中,再继续培养至指数期。纤维堆囊菌在所述m26培养基中150-250rpm/min摇床28-30℃培养3-6天,优选是将纤维堆囊菌由固体m26培养基接种至液体m26培养基后,在200rpm/min摇床30℃培养4-5天至指数期。
优选地,所述纤维堆囊菌经m26培养基培养至指数期后,搅拌打散培养液中菌体,然后接种到新的m26培养基中,150-250rpm/min摇床28-30℃继续培养2-3天,收集菌体,进入步骤b中使用。
优选将经过m26培养基培养至指数期的纤维堆囊菌,搅拌打散,扩展接种至新的m26培养基中,150-250rpm/min摇床28-30℃继续培养2-3天,收集菌体,进入步骤b中使用。搅拌打散的菌液,除用于扩展及接种外,还可剩余部分在lb培养基上划线平板法培养,以验证菌种的纯度。
优选地,步骤b或步骤c中,使用溶菌酶处理菌体具体为:将菌体的浓度调整为1*108cell/ml,悬浮在mmm缓冲液中,再加入等体积的浓度为2mg/ml溶菌酶液,混匀,30℃水浴保温25-40min,离心,收集原生质体,用mmm缓冲液洗涤并重悬,获得原生质体悬液;所述mmm缓冲液由甘露醇、氯化镁、马来酸配成。
原生质体融合的第一步是制备原生质体。本申请中采用酶法制备原生质体,将将菌体的浓度调整为1*108cell/ml,悬浮在mmm缓冲液(如30mlmmm缓冲液)中,再加入等体积(30ml)的浓度为2mg/ml溶菌酶液,混匀,30℃水浴保温25-40min进行处理,然后离心,收集原生质体,用mmm缓冲液洗涤并重悬,获得原生质体悬液。
其中,所述mmm缓冲液由甘露醇、氯化镁、马来酸配成,具体是由0.3m甘露醇、0.02mmgcl2·6h2o、0.02m马来酸配成,并调节ph为6.1,灭菌后使用。
获得的原生质体悬液,可以使用vy/2培养基进行再生培养,获得单菌落,以检验原生质体是否有再生功能。
优选地,所述菌体在使用溶菌酶处理前,先加入edta预处理10-20min。
原生质体制备和再生是基因重排的关键步骤,培养基的种类、培养方法、渗透压稳定剂、酶解时间和温度以及酶解前的预处理等因素均会对基因重排产生影响。作为优选,在菌体在使用溶菌酶处理前,先加入edta预处理10-20min。使用edta预处理细胞液,可以提高细胞壁酶解效率。而使用的渗透压稳定剂可以是0.3mol/l甘露醇。
优选地,步骤b或步骤c中,所述热灭活具体为在60-80℃下水浴1-10min;和/或,
所述紫外灭活具体为:将原生质体置于平皿中,25-40w的紫外灯在平皿上方30-40cm高度照射60-300s。
原生质体融合之前需要对原生质体使用不同的灭活方式灭活,然后再进行融合。目前对于灭活原生质体的融合机制有多种说法,例如wrihgt的损伤互补机制,不同灭活方式处理的细胞致死损伤可以互补。本申请中,采用热灭活和紫外灭活分别处理不同的原生质体,以保证其融合能顺利进行。
其中,热灭活具体为在60-80℃下水浴1-10min,优选在70-80℃水浴5-7min。而紫外灭活体为:将原生质体置于平皿中,25-40w的紫外灯在平皿上方30-40cm高度照射60-300s,优选在30w紫外灯下照射120-150s。将原生质体置于平皿中,使得原生质体悬液的厚度变小,提高紫外灭活效率。
经热灭活或紫外灭活的原生质体,可以用再生培养来检验灭活效果。
优选地,步骤b或步骤c中,所述vy/2培养基的配方为:活性干酵母0.5%,vb120.5mg/l,mgso4·7h2o0.05%,cacl20.1%,琼脂2.0%,ph7.2;和/或,
所述原生质体在所述vy/2培养基上30℃恒温培养5-10天,直至长出单菌落。
优选使用的vy/2培养基含有活性干酵母、vb12、mgso4·7h2o、cacl20.1%,并调节ph为7.2。为便于使用,将vy/2培养基制成固体培养基,在上述配方中再加入2.0%琼脂粉。
原生质体在vy/2培养基上30℃恒温培养5-10天、优选30℃恒温培养7天,直至长出单菌落,即为第一代菌株。
取第一代菌株中的部分进行诱变处理,使其基因结构发生变化,并与其它未诱变的第一代菌株分别使用溶菌酶处理,得到原生质体,分为两份分别用不同方式灭活,然后融合,使得变异的基因与原有基因混合、重排,将vy/2培养基再生培养后,得到的第二代菌株中具有多种不同组合的基因。重复上述过程1-3次,优选重复3次,直至在诸多融合突变株中,通过检测生长速度、发酵醪液状态及剩余营养、埃坡霉素产量等情况,选择综合性状优良的菌种作为生产菌种。
诱变可以使用目前常用的诱变手段,如紫外照射诱变等。本申请中具体使用的诱变参数如下:菌株前培养-菌悬液的制备-紫外诱变照射:吸取菌悬液至直径9cm的培养皿中,在距离紫外灯(30w,253.7nm)30cm处打开培养皿吸附3min,期间每隔60s分别光修复30s,照射结束后吸取菌悬液涂布于m26固体培养基平板,用三层报纸包裹平板,30℃培养箱中倒置培养,48小时以内避光。
优选地,步骤d中,所述收集、培养、筛选具体为:将每次获得的菌株再生培养,获得再生菌落,检测再生菌落250nm波长的吸光度,取吸光度最高的1-10株菌株进行发酵培养,hplc定量检测埃坡霉素含量,最终筛选得到埃坡霉素高产菌株。
本申请中,通过测定吸光度来体现细菌含量,取在250nm波长的吸光度(即od250)最高的1-10株细菌培养,是筛选获得的菌株中生长旺盛的菌株的过程。然后对选出的细菌进行发酵培养,然后通过hplc定量检测埃坡霉素的含量,筛选出埃坡霉素高产菌株。
一株埃坡霉素高产菌株,由上述任一项所述的方法获得。
实施例1
所用试剂:
cnst培养基:na2hpo4·12h200.025%,kno30.05%,微量元素液1ml/l,mgso4·7h2o0.1%,ph7.2,加入2.0%琼脂粉,温度121℃,0.1mpa条件下灭菌30分钟。
m26培养基:土豆淀粉0.8%,豆蛋白胨0.2%,葡萄糖0.2%,酵母粉0.2%,mgso4·7h2o0.1%,cacl20.1%,edta-fe3+1ml/l,ph7.2。
再生培养基(vy/2):活性干酵母0.5%,vb120.5mg/l,mgso4·7h2o0.05%,cacl20.1%,琼脂2%,ph7.2。
发酵培养基:葡萄糖0.02%,蔗糖0.07%,糊精0.3%,马铃薯淀粉0.17%,mgso4·7h2o0.17%,无水氯化钙0.3%,edta-fe3+2ml/l,te0.5ml/l,ph7.2,xad-162%。
mmm缓冲液:0.3m甘露醇、0.02mmgcl2·6h2o、0.02m马来酸,ph6.1,灭菌。
edta溶液:80ml水中加入4gedta,搅拌用氢氧化钠调节ph至8.0定容至100ml,灭菌。
溶酶菌(lysozyme),溶于mmm缓冲液中,溶度为2mg/ml。
一种埃坡霉素高产菌株的选育方法,包括以下步骤:
a、取纤维堆囊菌(sorangiumcellulosum)so2161,由山东省微生物工程重点实验室菌种保藏中心保藏,接种在cnst培养基上,30℃加湿培养箱培养7天活化,然后用接种针挑取扩展的菌膜接种于m26培养基上,培养至指数生长期,再转移到液体m26培养基中,200rpm/min摇30℃培养4天至指数期,搅拌大部分培养液,并用剩余的液体冲洗菌体,最后倒入灭菌过的含玻璃珠及搅拌子的三角瓶内,把三角瓶放在磁力搅拌器上打匀菌体,接种10瓶新的m26培养液,200rpm/min摇床30℃继续培养2-3天,离心收集菌体分装保存备用。剩余的菌液在lb培养基上划线平板验证其纯度。
b、将菌体的浓度调整为1*108cell/ml,先加入edta预处理20min,然后悬浮在30mlmmm缓冲液中,再加入30ml浓度为2mg/ml溶菌酶液,混匀,30℃水浴保温30min,2500r/min离心20min,收集原生质体,用mmm缓冲液洗涤一次并重悬于30mlmmm缓冲液中,获得原生质体悬液。获得的原生质体镜检图如图3所示。
本申请考察了不同的原生质体制备条件对制备率的影响,如下表1所示:
表1原生质体制备条件对制备率的影响
将原生质体分为两份,第一份原生质体在80℃下水浴7min热灭活,第二份原生质体置于平皿中,30w的紫外灯在平皿上方30-40cm高度照射150s紫外灭活,然后将两份灭活后的原生质体加入peg溶液进行融合,离心洗涤后再重悬,再取0.5ml悬液加入到vy/2培养基30℃恒温培养7天,直至长出单菌落,得到第一代菌株(f1代);获得的第一代菌株(即再生原生质体)的再生形态图如图4所示。
c、将第一代菌株中部分进行诱变,诱变操作为:菌株前培养-菌悬液的制备-紫外诱变照射:吸取菌悬液至直径9cm的培养皿中,在距离紫外灯(30w,253.7nm)30cm处打开培养皿吸附3min,期间每隔60s分别光修复30s,照射结束后吸取菌悬液涂布于m26固体培养基平板,用三层报纸包裹平板,30℃培养箱中倒置培养,48小时以内避光。将诱变后的菌株与未诱变的菌株的浓度调整为1*108cell/ml,先加入edta预处理20min,然后悬浮在30mlmmm缓冲液中,再加入30ml浓度为2mg/ml溶菌酶液,混匀,30℃水浴保温30min,2500r/min离心20min,收集原生质体,用mmm缓冲液洗涤一次并重悬于30mlmmm缓冲液中,获得原生质体悬液,然后将原生质体分为两份,第一份原生质体在80℃下水浴7min热灭活,第二份原生质体置于平皿中,30w的紫外灯在平皿上方30-40cm高度照射150s紫外灭活,然后将两份灭活后的原生质体加入peg溶液进行融合,离心洗涤后再重悬,再取0.5ml悬液加入到vy/2培养基30℃恒温培养7天,直至长出单菌落,得到第二代菌株(f2代)。
然后重复上述步骤2次,直至获得第四代菌株(f4代)
在第一代菌株至第四代菌株的制备过程中,每轮融合后取100个再生菌落测吸光度,再选取4株高吸光度值的菌株使用发酵培养基液体发酵,最后进行定量检测。
申请人在实验过程中,经过基因重排后考察了1000株再生平板上的诱变融合菌落在96孔板上的生长情况,其中获得了8株吸光度值(od250)超过0.7的融合菌株。剩余菌株的平均吸光度值(od250)为0.452,出发菌株(即so2161)的平均吸光度值(od250)为0.315。
每轮挑选4株高吸光度值的融合菌株进行摇瓶发酵考察,用hplc进行定量检测,最后获得1株高产菌株,命名为so2163。通过摇瓶发酵检测,纤维堆囊菌发酵液细胞密度较原始菌株提高了10.5倍,细胞增殖代时缩短,发酵速度加快,经hplc检测,发现改良后的菌株埃坡霉素产量较原始株提高了3.12倍。改良后的菌株埃坡霉素b的hplc检测图如附图1所示。而在摇瓶发酵培养基培养24小时后,取菌液美蓝染色,在通过显微镜观察菌体形态如图2所示。
hplc检测过程和参数如下:
1)将对数期扩培菌株打散,以15%的接种量接种于50ml液体发酵培养基中,温度30℃、150rpm摇床发酵约7天。
2)发酵结束后用中速定性滤纸抽滤收集树脂,40℃鼓风干燥箱中烘干1h。
3)收集干燥后的树脂于10ml螺口离心管中,分别加入1ml甲醇,30℃、150rpm振荡过夜浸提。
4)10000rpm离心甲醇浸提液10min,用0.45μm微孔滤膜过滤上清液。
5)hplc分析发酵液中埃坡霉素b的含量。
6)hplc色谱条件:色谱柱inertsilc8-35μm,4.6×250mm;流动相70%meoh;
流速1.0ml/min,柱温35℃;检测波长247nm;进样量3μl;理论塔板数按本品计算不低于3000。
将so2163菌株连续传代5次后,进行摇瓶发酵培养,菌株的特征、颜色、生长速度都无明显变化。用hplc分析,菌株发酵合成埃坡霉素的产量没有下降。表明实验筛选的改良菌株的高产性状稳定。
表2高产埃坡霉素菌株不同代数菌株产量
将获得高产菌株so2163,通过斜面保藏法或甘油保藏法保藏。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!