一种栉孔扇贝消化盲囊亚细胞组分分离方法与流程
本发明涉及动物细胞亚细胞组分分离技术领域,具体涉及一种简便、高效的栉孔扇贝消化盲囊亚细胞组分分离技术,属于生物技术领域。
背景技术:
细胞是生物体结构和功能的基本单位,主要由具有一定形态、在细胞内执行特定功能的亚细胞组分构成,包括细胞膜、细胞器、细胞核、细胞骨架和细胞质等。许多催化生化代谢的酶分布在亚细胞组分中,在生理生化代谢中发挥着重要作用,保证细胞执行正常生理功能。目前主要采用超速离心、电泳、亲和纯化等分离技术,研究亚细胞组分的特定功能、生化组成和超微结构,其中超速离心方法是最常用的亚细胞组分分离方法。
在哺乳动物上已通过超速离心技术分离出细胞核、细胞膜、细胞质、线粒体、微粒体、溶酶体等多种亚细胞组分,同时采用标志酶、蛋白质印迹、电镜观察等方法,建立了亚细胞组分种类鉴定、组分分析技术。目前贝类亚细胞组分分离技术主要沿用了哺乳动物的分离方法,通过超速离心方法获得1-2个亚细胞组分,如细胞核、细胞质、线粒体、微粒体等,而且基本上未对亚细胞组分进行种类鉴定和组分分析,难以保证分离效果和质量。本技术针对栉孔扇贝独特的生理条件和组织细胞特征,制备适宜其细胞分散、存活且能维持细胞核正常形态和良好活性的匀浆缓冲液。而且本技术中特异的组织匀浆液配比使匀浆液有一个的合适粘稠度以取得较好的匀浆效率和离心分离的结果。最后,本发明利用超速离心的方法,从栉孔扇贝消化盲囊组织匀浆液中分离获得细胞核、细胞膜、线粒体、微粒体、细胞质5种亚细胞组分,并通过标志酶法对分离对亚细胞组分进行了种类鉴定和组分分析,且首次利用hoechst染色法检验贝类细胞匀浆液破碎率和细胞核存在形态、活性,该方法简便、灵敏,为贝类组织亚细胞组分分离技术提供了技术依据。
技术实现要素:
本发明的目的在于提供一种栉孔扇贝消化盲囊亚细胞组分分离技术,该方法简便、原料利用率高,能够从单一匀浆液中获得多种亚细胞组分,分离得到的细胞核活性好。
为实现上述目的本发明采用以下技术方案:
一种栉孔扇贝消化盲囊亚细胞组分分离方法,其特征在于包括以下步骤:
(1)制备匀浆缓冲液、蔗糖缓冲液和储备缓冲液:
其中,匀浆缓冲液的配方为:
a液:0.02mol/ltris(三羟甲基氨基甲烷)、0.15mol/lkcl、1mmol/ldtt(二硫苏糖醇)、0.5mol/l蔗糖,ph调至7.7,于4℃下保存;
b液:150mmol/lmgcl2,于4℃下保存;
c液:100mmol/lpmsf,于-20℃下保存;
蔗糖缓冲液的配方为:
d液:0.3mol/l蔗糖溶液、50mmol/ltris、1.5mmol/lmgcl2,ph7.7,于4℃下保存;
e液:1.98mol/l蔗糖溶液、50mmol/ltris、1.5mmol/lmgcl2,ph7.7,于4℃下保存;
储备缓冲液的配方为:
f液:20mmol/ltris、1mmol/ldtt,ph7.7,于4℃下保存;
g液:甘油;
(2)对消化盲囊组织进行匀浆;
称取新鲜消化盲囊组织2g,剪碎后,于4℃冰水浴下,加入到含有10mla液、100ulb液、10ulc液的玻璃匀浆器中,充分研磨5min,并通过医用纱布,挤压过滤,滤液挤入预冷的15ml离心管中,即得消化盲囊组织的匀浆液;
(3)离心分离亚细胞组分:
a.取步骤(2)中匀浆液10ml于预冷的15ml离心管中,加入10ulc液,在4℃、600g条件下,离心1h,小心倾倒上清液于另一个预冷的15ml离心管中,残余上清液用200ul移液枪吸取并与之前上清液合并;向沉淀中加入0.2ml的d液后,再加入1.80ml的e液,并用移液枪轻轻吹打,悬浮沉淀,得沉淀重悬液;
b.将步骤a中沉淀重悬液用200ul移液枪头转移到5ml快封管中,加入5ulc液,用封口器热封后,在4℃、70900g条件下,离心60min;离心完毕后,用刀片割开封口,小心倾倒上清液于预冷的15ml离心管中,残余上清液用200ul移液枪吸取并与之前上清液合并,此为细胞膜,加入0.4g的g液后放-80℃保存;向沉淀中加入2ml的f液和0.4g的g液,并用移液枪轻轻吹打,悬浮沉淀,此为细胞核,置于-80℃保存;
c.向步骤a中的上清液中加入10ulc液,于4℃、12000g条件下,离心45min,小心倾倒上清液于预冷的15ml离心管中,残余上清液用200ul移液枪吸取并与之合并;向沉淀中加入2ml的f液和0.4g的g液,并用移液枪轻轻吹打,悬浮沉淀,此为线粒体,置于-80℃保存;
d.向步骤c中的上清液中加入10ulc液,于4℃、100000g条件下,离心60min,小心倾倒上清液于预冷的15ml离心管中,残余上清液用200ul移液枪吸取并与之合并,此为细胞质,加入2g的g液后放-80℃保存;
e.向步骤d中的沉淀中加入10ulc液、2ml的f液和0.4g的g液,并用移液枪轻轻吹打,悬浮沉淀,此为微粒体,置于-80℃保存。
所述的栉孔扇贝消化盲囊亚细胞组分分离方法,其特征在于所述步骤(2)之后还有匀浆破碎率检验:
取100ul滤液于1.5ml的ep管中,加入0.9mla液、90ulb液、10ulc液进行稀释;将100ul上述稀释的匀浆液加入到另一个1.5ml的ep管,加入100ul10ug/mlhoechst33258工作液混合,暗处理10min,之后取2.5ul均匀涂片,于荧光显微镜下用蓝色滤光片(对应荧光激发光波长在346~352nm,发射波长为460~461nm的情况)观察;
以匀浆2min的hoechst33258染色结果为对照,当视野中的完整细胞个数低于对照组的10%,则匀浆质量良好,可进行下步操作;
另外再吸取2.5ul上述稀释的匀浆液,滴于血球计数板盖玻片边缘,让稀释后的溶液自行缓缓渗入,一次性充满计数室,防止产生气泡,充入细胞悬液的量以不超过计数室台面与盖玻片之间的矩形边缘为宜,多余培养液用滤纸吸去,稍待1min,待细胞全部沉降到计数室底部后,将计数板放在载物台的中央,先在低倍镜下找到计数室所在位置后,再转换高倍镜观察、计数并记录;
血球计数板法计算破碎率公式为:1-残留完整细胞个数/初始完整细胞个数=匀浆破碎率(%),其中以匀浆2min时的完整细胞个数作为初始完整细胞个数,匀浆2min以上时的完整细胞个数作为残留完整细胞个数,直至破碎率达到90%以上,则匀浆质量良好,停止匀浆。匀浆质量合格的匀浆液可用于下步离心分离操作。
所述的栉孔扇贝消化盲囊亚细胞组分分离方法,其特征在于还包括步骤(4)hoechst33258荧光染色检验细胞核纯度和活性,以及细胞膜、线粒体、微粒体、细胞质受到细胞核污染的程度:
取步骤4中细胞膜、细胞核、线粒体、微粒体、细胞质悬液各100ul于1.5ml的ep管中,分别依次加入0.9ml的a液、90ul的b液、10ul的c液进行稀释;
将上述五种稀释后的溶液各100ul分别加入到五个1.5ml的ep管,再分别加入100ul10ug/mlhoechst33258工作液混合,暗处理10min,之后取2.5ul均匀涂片,于荧光显微镜下用蓝色滤光片(对应荧光激发光波长在346~352nm,发射波长为460~461nm的情况)观察;从而得到步骤4中细胞膜、线粒体、微粒体、细胞质受到细胞核污染的程度,和细胞核组分的纯度和活性。
本发明的有益效果:本技术针对栉孔扇贝独特的生理条件和组织细胞特征,制备适宜其细胞分散、存活且能维持细胞核正常形态和良好活性的匀浆缓冲液。而且本技术中特异的组织匀浆液配比使匀浆液有一个的合适粘稠度以取得较好的匀浆效率和离心分离的结果。最后,本发明利用超速离心的方法,从栉孔扇贝消化盲囊组织匀浆液中分离获得细胞核、细胞膜、线粒体、微粒体、细胞质5种亚细胞组分,并通过标志酶法对分离对亚细胞组分进行了种类鉴定和组分分析,且首次利用hoechst染色法检验贝类细胞匀浆液破碎率和细胞核存在形态、活性,该方法简便、灵敏,为贝类组织亚细胞组分分离技术提供了技术依据。
附图说明
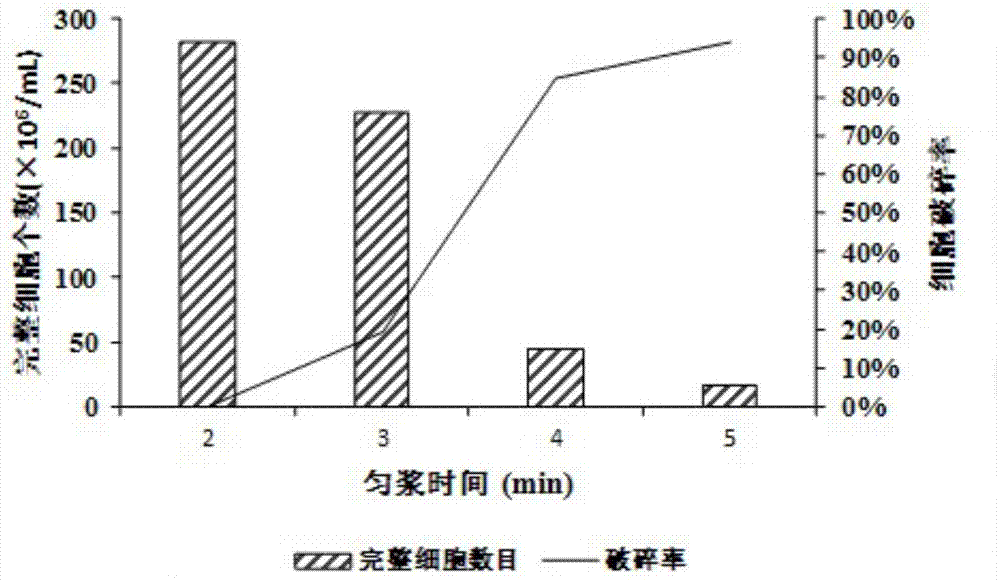
图1血球计数板法计算匀浆破碎率结果图。
图2匀浆2、3、4、5min后的匀浆液经hoechst33258工作液染色后,在100、200、400倍镜下观察到的匀浆破碎率图。
图3标志酶在栉孔扇贝消化盲囊亚细胞组分中的分配,其中:
图3a为五种亚细胞组分中5’-核苷酸酶相对强度;
图3b为五种亚细胞组分中琥珀酸脱氢酶相对强度;
图3c为五种亚细胞组分中葡萄糖-6-磷酸酶相对强度;
图3d为五种亚细胞组分中乳酸脱氢酶相对强度。
图4五种亚细胞组分hoechst33258工作液染色图片,
其中,s2为细胞膜hoechst33258染色图像,p2为细胞核hoechst33258染色图像,p3为线粒体hoechst33258染色图像,s5为细胞质hoechst33258染色图像,p5为微粒体hoechst33258染色图像。
图5亚细胞分离流程图。
具体实施方式
本实施例用来说明该方法得到的栉孔扇贝消化盲囊亚细胞组分的分离效果,其流程如图5所示。
一、主要仪器:
可调式移液器,effendorf公司
ro15型纯水机,上海力申科学仪器有限公司
neofuge15r型台式离心机,上海力申科学仪器有限公司
beckmanoptimaxe超速离心机,beckman公司
spectramax190型酶标仪,moleculardevices公司
二、试剂
hoechst33258工作液,北京索莱宝科技有限公司
三、步骤:
1.制备匀浆缓冲液、蔗糖缓冲液和储备缓冲液:
其中,匀浆缓冲液的配方为:
a液:0.02mol/ltris(三羟甲基氨基甲烷)、0.15mol/lkcl、1mmol/ldtt(二硫苏糖醇)、0.5mol/l蔗糖,ph调至7.7,于4℃下保存;
b液:150mmol/lmgcl2,于4℃下保存;
c液:100mmol/lpmsf,于-20℃下保存;
蔗糖缓冲液的配方为:
d液:0.3mol/l蔗糖溶液、50mmol/ltris、1.5mmol/lmgcl2,ph7.7,于4℃下保存;
e液:1.98mol/l蔗糖溶液、50mmol/ltris、1.5mmol/lmgcl2,ph7.7,于4℃下保存;
储备缓冲液的配方为:
f液:20mmol/ltris、1mmol/ldtt,ph7.7,于4℃下保存;
g液:甘油;
2.对消化盲囊组织进行匀浆:
称取4份2g的新鲜消化盲囊组织,每一份组织用剪刀剪碎后,于4℃冰水浴下,加入到含有10mla液、100ulb液、10ulc液的玻璃匀浆器中,且分别匀浆研磨2、3、4、5min,并通过医用纱布,挤压过滤,滤液挤入预冷的15ml离心管中,即得消化盲囊组织的匀浆液;
3.匀浆破碎率检验:
分别取匀浆2、3、4、5min的匀浆液100ul于1.5ml的ep管中,加入0.9mla液、90ulb液、10ulc液进行稀释;将100ul上述稀释的匀浆液分别加入到另外4个1.5ml的ep管,加入100ul10ug/mlhoechst33258工作液混合,暗处理10min,之后取2.5ul均匀涂片,于荧光显微镜下用蓝色滤光片(对应荧光激发光波长在346~352nm,发射波长为460~461nm的情况)观察;
以匀浆2min的hoechst33258染色结果为对照,当视野中的完整细胞个数低于对照组的10%,则匀浆质量良好,可进行下步操作;
另外再吸取2.5ul上述稀释的匀浆液,滴于血球计数板盖玻片边缘,让稀释后的溶液自行缓缓渗入,一次性充满计数室,防止产生气泡,充入细胞悬液的量以不超过计数室台面与盖玻片之间的矩形边缘为宜,多余培养液用滤纸吸去,稍待1min,待细胞全部沉降到计数室底部后,将计数板放在载物台的中央,先在低倍镜下找到计数室所在位置后,再转换高倍镜观察、计数并记录;
血球计数板法计算破碎率公式为:1-残留完整细胞个数/初始完整细胞个数=匀浆破碎率(%),其中以匀浆2min时的完整细胞个数作为初始完整细胞个数,匀浆2min以上时的完整细胞个数作为残留完整细胞个数,直至破碎率达到90%以上,则匀浆质量良好,停止匀浆。匀浆质量合格的匀浆液可用于下步离心分离操作。
4.离心分离亚细胞组分:
a.取步骤(2)中匀浆液10ml于预冷的15ml离心管中,加入10ulc液,在4℃、600g条件下,离心1h,小心倾倒上清液于另一个预冷的15ml离心管中,残余上清液用200ul移液枪吸取并与之前上清液合并;向沉淀中加入0.2ml的d液后,再加入1.80ml的e液,并用移液枪轻轻吹打,悬浮沉淀,得沉淀重悬液;
b.将步骤a中沉淀重悬液用200ul移液枪头转移到5ml快封管中,加入5ulc液,用封口器热封后,在4℃、70900g条件下,离心60min;离心完毕后,用刀片割开封口,小心倾倒上清液于预冷的15ml离心管中,残余上清液用200ul移液枪吸取并与之前上清液合并,此为细胞膜,记为s2,并加入0.4g的g液后放-80℃保存;向沉淀中加入2ml的f液和0.4g的g液,并用移液枪轻轻吹打,悬浮沉淀,此为细胞核,记为p2,并置于-80℃保存;
c.向步骤a中的上清液中加入10ulc液,于4℃、12000g条件下,离心45min,小心倾倒上清液于预冷的15ml离心管中,残余上清液用200ul移液枪吸取并与之合并;向沉淀中加入2ml的f液和0.4g的g液,并用移液枪轻轻吹打,悬浮沉淀,此为线粒体,记为p3,并置于-80℃保存;
d.向步骤c中的上清液中加入10ulc液,于4℃、100000g条件下,离心60min,小心倾倒上清液于预冷的15ml离心管中,残余上清液用200ul移液枪吸取并与之合并,此为细胞质,记为s5,加入2g的g液后放-80℃保存;
e.向步骤d中的沉淀中加入10ulc液、2ml的f液和0.4g的g液,并用移液枪轻轻吹打,悬浮沉淀,此为微粒体,记为p5,并置于-80℃保存。
5.hoechst33258荧光染色检验细胞核纯度和活性,以及细胞膜、线粒体、微粒体、细胞质受到细胞核污染的程度:
取步骤4中细胞膜、细胞核、线粒体、微粒体、细胞质悬液各100ul于1.5ml的ep管中,分别依次加入0.9ml的a液、90ul的b液、10ul的c液进行稀释;
将上述五种稀释后的溶液各100ul分别加入到五个1.5ml的ep管,再分别加入100ul10ug/mlhoechst33258工作液混合,暗处理10min,之后取2.5ul均匀涂片,于荧光显微镜下用蓝色滤光片(对应荧光激发光波长在346~352nm,发射波长为460~461nm的情况)观察;从而得到步骤4中细胞膜、线粒体、微粒体、细胞质受到细胞核污染的程度,和细胞核组分的纯度和活性。
6.酶活鉴定亚细胞组分:
按照现有文献的方法操作测定5’-核苷酸酶,以鉴定细胞膜,可以参照subcellulardistributionofafactorinactivatingtyrosineaminotransferase.febsjournal;按照现有文献的方法操作测定乳酸脱氢酶,以鉴定细胞质,可以参照isolationofsubcellularorganelles.methodsenzymol;按照现有文献的方法操作测定葡萄糖-6-磷酸酶,以鉴定微粒体,可以参照comparisonofthebiochemicalalterationselicitedinliversfromratstreatedwithcarbontetrachloride,chloroform,1,1,2-trichloroethaneand1,1,1-trichloroethane.biochemicalpharmacology;琥珀酸脱氢酶的测定使用南京建成试剂盒鉴定线粒体。最后标记酶相对强度的计算是以最高单位蛋白量酶活性为标准,然后归一化至其他各亚细胞组分。
四、结果
1.匀浆裂解破碎率
如图1可见:将匀浆2min组作为标准对照组,该组的残存完整细胞个数作为初始值,细胞破碎率记为0%。通过血球计数板法计数发现随着匀浆时间的增加,匀浆液中完整细胞个数减少,破碎率逐渐升高。当匀浆时间为5min时,细胞破碎率达到94.15%。
2.hoechst33258染色观察细胞破碎率
如图2可见:荧光显微镜下,完整细胞形态饱满,呈圆形或椭圆形,细胞膜完整、荧光亮度较高,折光性好;而破碎细胞形态较小,荧光亮度弱,因碎片多而使染色的细胞核轮廓模糊。在匀浆2min对照组中,可以观察到大量完整细胞,背景较为清晰。随着匀浆时间的增加,完整细胞个数减少,荧光亮度弱的颗粒数目增加。在匀浆5min实验组中,基本没有完整细胞的存在,荧光亮度弱的颗粒数目多,背景较混沌。结果与血球计数板法结果一致。
3.匀浆裂解破碎率
如图3可见:5’-核苷酸酶、琥珀酸脱氢酶、葡萄糖-6-磷酸酶、乳酸脱氢酶分别在s2、p3、p5、s5组分中检测出有相对较高的酶活活性和标志酶强度,对应的,s2、p3、p5、s5组分的预期亚细胞组分分别为细胞膜、线粒体、微粒体、细胞质。这些标志酶的分布结果在生化水平上证明了这些亚细胞组分被正确鉴定并含有预期细胞器的主要水平。
4.hoechst33258染色鉴定分析细胞核组分
如图4可见:p2组分即预期细胞核组分的荧光亮度最强,视野中荧光颗粒数目多,颗粒间粘黏比例低,细胞核提纯质量较好。其他组分的视野亮度低,荧光强度弱,基本观察不到荧光颗粒。说明p2为细胞核组分,同时也说明其他组分受细胞核污染程度低。
- 还没有人留言评论。精彩留言会获得点赞!