鹿色霉素(cervinomycin)B1、B2、B3、B4及其生产方法及应用与流程
本发明属于医药生物技术领域,具体而言,涉及一种鹿色霉素(cervinomycin)b1、b2、b3、b4及其生产方法及应用。
背景技术:
随着抗生素的滥用,致病菌对抗生素的耐药性逐渐增加,而耐药基因通过水平转移的方式在同种属或不同种属的菌群间的传播,也使得耐药菌问题更加难以控制。据我国细菌耐药性监测网数据显示,从2005-2016年间,部分耐药菌例如耐甲氧西林金黄色葡萄球菌(mrsa)的临床检出率虽然得到了一定的控制,但依然维持在38%以上;但是有些耐药菌例如耐亚胺培南鲍曼不动杆菌的临床检出率从30%增长至60%以上;在临床检出率最高的大肠埃希菌中,产超广谱β内酰胺酶的耐药菌维持在约50%。这些数据和趋势都说明开发新的抗耐药菌药物十分必要。
鹿色霉素(cervinomycin)是一类由微生物产生的、包含氧杂蒽酮结构的多环化合物。该化合物首次由日本大村智等在20世纪80年代分离得到。它们对普氏消化球菌等厌氧菌的活性很强,最低抑菌浓度在0.012-25μg/ml之间。其中,18-o-去甲鹿色霉素a2经过化学衍生后,还具有了抗革兰氏阴性细菌活性,对大肠埃希菌、克雷白氏杆菌等的最低抑菌浓度(mic)在0.2-3.13μg/ml,曾被作为抗菌药物的先导物进行研究。不仅如此,大多数多环氧杂蒽酮类化合物都有很强的抗菌和抗球虫活性。例如,simaomicinα被认为是抗球虫谱最广的天然产物之一,在鸡饲料中添加量为1.0ppm时即可防止病症产生,并且它对金黄色葡萄球菌等革兰氏阳性细菌的mic均小于0.06μg/ml。2008年,相继发现的neocitremicinsi、ii和citreamicinδ、ε,都具有较强的抗耐药菌活性。其中,neocitremicins对mrsa、耐万古霉素粪肠球菌(vre)的mic在0.06-0.5μg/ml。2018年发现的代号为mdn-0185化合物对3d7恶性疟原虫的ic50为9.0nm。到目前为止,已报道的属于多环氧杂蒽酮类抗生素家族的化合物超过了40个,其中多数具有包括抗菌在内的多种生物活性。
本发明人从一株链霉菌的次级代谢产物中,分离得到一组共4个多环氧杂蒽酮类抗生素——鹿色霉素(cervinomycin)b1、b2、b3、b4,经过紫外光谱、高分辨质谱及核磁共振等波谱学数据的分析,确定(cervinomycin)b1、b2、b3、b4为cervinomycin类新抗生素。对cervinomycinb1、b2、b3、b4进行抗菌活性评价,发现这四个化合物对甲氧西林敏感金黄色葡萄球菌(mssa)、耐甲氧西林金黄色葡萄球菌(mrsa)、甲氧西林敏感表皮葡萄球菌(msse)、耐甲氧西林表皮葡萄球菌(mrse)、万古霉素敏感粪肠球菌(vse)、耐万古霉素粪肠球菌(vre)、万古霉素敏感屎肠球菌(vse)、耐万古霉素屎肠球菌(vre)都有显著的抑制活性。其中,鹿色霉素b1对革兰氏阳性细菌的mic为0.03-0.12μg/ml(对mrsa和vre等耐药性细菌的mic为0.03-0.12μg/ml);鹿色霉素b2对革兰氏阳性细菌的mic为0.06-0.12μg/ml(对mrsa和vre等耐药性细菌的mic为0.06-0.12μg/ml);鹿色霉素b3对革兰氏阳性细菌的mic为0.004-0.03μg/ml(对mrsa和vre等耐药性细菌的mic为0.004-0.03μg/ml);鹿色霉素b4对革兰氏阳性细菌的mic为0.12-0.5μg/ml(对mrsa和vre等耐药性细菌的mic为0.12-0.5μg/ml)。因此,鹿色霉素b1、b2、b3、b4有望成为抗革兰氏阳性细菌及其耐药菌(例如mrsa)的先导化合物,并具有潜在的良好开发前景。
技术实现要素:
本发明首先提供一组新的多环氧杂蒽酮类抗生素,分别为鹿色霉素(cervinomycin)b1、b2、b3、b4,其结构如式(1)、(2)、(3)、(4)所示:
所述的鹿色霉素(cervinomycin)b1是一种金黄色无定形粉末,分子式c29h25o9n分子量531,可溶于二甲基亚砜等有机溶剂,难溶于水。
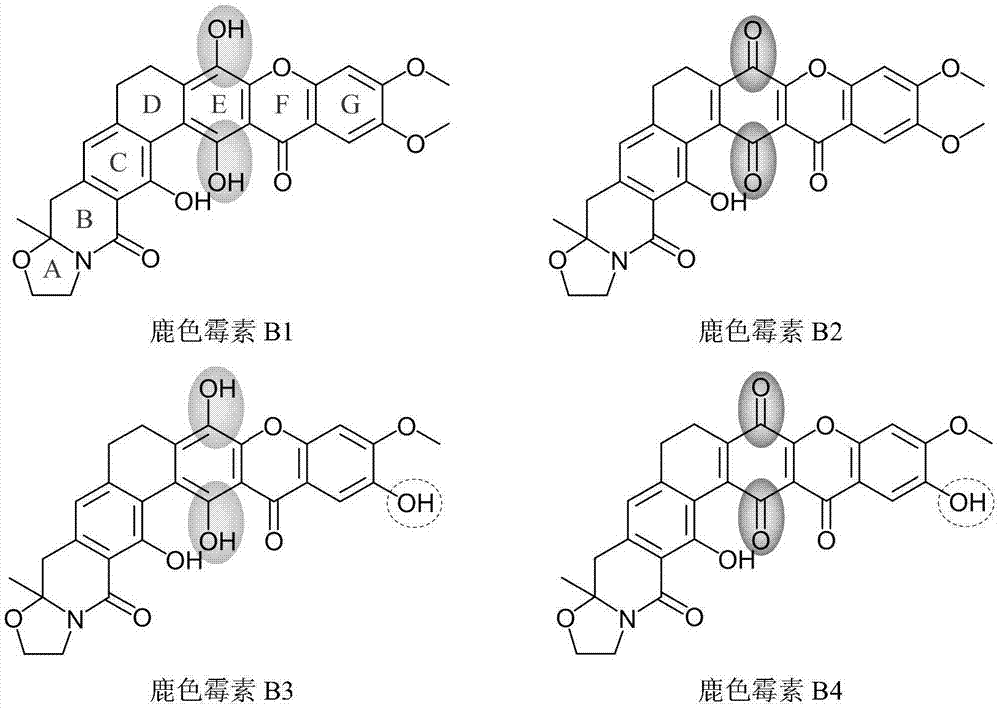
所述的鹿色霉素(cervinomycin)b2是一种砖红色无定形粉末,分子式c29h23o9n,分子量529,微溶于二甲基亚砜等有机溶剂,难溶于水;它与鹿色霉素b1组分结构类似,属于b1组分的e环醌式(氧化)结构。
所述的鹿色霉素(cervinomycin)b3是一种金黄色无定形粉末,分子式c28h23o9n,分子量517,可溶于二甲基亚砜等有机溶剂,难溶于水;它与鹿色霉素b1组分结构类似,是18-o-去甲基鹿色霉素b1。
所述的鹿色霉素(cervinomycin)b4是一种砖红色无定形粉末,分子式c28h21o9n,分子量515,微溶于二甲基亚砜等有机溶剂,难溶于水;它与鹿色霉素b3组分结构类似,属于b3组分的e环醌式(氧化)结构。
本发明还涉及发酵生产上述鹿色霉素(cervinomycin)b1、b2、b3、b4化合物的制备方法,包括如下步骤:
(1)发酵培养链霉菌cgmccno.16425,收获发酵物;
(2)从发酵物中提取、分离并纯化所述的鹿色霉素(cervinomycin)b1、b2、b3、b4。
所述发酵培养步骤为:
(1)种子培养。
首先将于零下70℃冰箱中冷冻保藏的链霉菌cgmccno.16425孢子悬液,融化后接种于孢子培养基平板上进行培养,孢子培养条件为26~30℃、6-10天;
孢子培养基组成为(g/l):淀粉20.0,黄豆饼粉20.0,琼脂粉15.0,ph7.0;
将培养后的孢子用无菌水洗下,振荡悬浮,得新鲜孢子悬液(含约108个孢子/ml),用于接种发酵培养基平板;或者,将孢子平板或斜面挖块,接种到液体发酵培养基。
(2)固态或液态发酵所述链霉菌。
所述固态发酵方法为:
将链霉菌cgmccno.16425的新鲜孢子悬液,接种于发酵培养基平板,接种量为约106个孢子。发酵培养基平板于26~30℃培养8-12天,收获发酵培养物;
发酵培养基的组成为(g/l):玉米淀粉10.0,棉籽饼粉10.0,苏氨酸10.0,琼脂粉15.0,ph7.0。
所述的液态发酵方法为:
将链霉菌cgmccno.16425的新鲜孢子斜面或平板,挖块(大小约1-2cm2)接种于装有液体发酵培养基的摇瓶中,摇瓶于28℃摇床振荡培养5-6天,收集发酵液;
发酵培养基的组成为(g/l):玉米淀粉10.0,棉籽饼粉10.0,苏氨酸10.0,ph7.0。
为了提高链霉菌cgmccno.16425的鹿色霉素b组分产量,在发酵培养基中需要含有丰富碳源与氮源。碳源包括各种单糖(例如葡萄糖和果糖)、双糖(例如麦芽糖和蔗糖)和多糖(例如淀粉和糊精)等;氮源、特别是有机氮源,包括氨基酸、多肽和蛋白胨(动物、植物或微生物来源)、黄豆饼粉、棉籽饼粉、酵母粉、玉米浆和花生饼粉等。这些培养基成分除了为链霉菌cgmccno.16425的生长提供所必需的营养物质和能量之外,还用于提供鹿色霉素b组分生物合成所需的前体或构造单元。因此,链霉菌cgmccno.16425的发酵培养基包括但不限于上述的发酵培养基配方。
所述从发酵物中提取、分离并纯化所述的鹿色霉素(cervinomycin)b1、b2、b3、b4的步骤为:
(1)发酵培养物用有机溶剂例如乙酸乙酯提取,减压旋蒸提取液得到乙酸乙酯粗提物;
(2)乙酸乙酯粗提物采用反相c18色谱柱以除去主要杂质,分别用30%-水、50%-水和70%甲醇-水洗脱2-3个柱体积,收集洗脱液,经tlc或hplc分析后合并含有鹿色霉素b各组分的收集液;减压旋蒸除去洗脱溶剂后,得到含有鹿色霉素b1、b2、b3组分混合物精制品,以及含有鹿色霉素b3、b4组分混合物精制品;
(3)对鹿色霉素b1、b2、b3组分混合物精制品进行正相硅胶色谱柱分离,采用甲醇(0%-10%)-二氯甲烷梯度洗脱,经hplc分析后合并相同成分洗脱液;减压旋蒸除去洗脱溶剂后,得到鹿色霉素b3组分纯品,以及含有鹿色霉素b1、b2组分混合物精制品;
(4)对鹿色霉素b3、b4组分混合物精制品进行反相半制备hplc纯化,分别得到鹿色霉素b3组分和鹿色霉素b4组分纯品;
(5)对鹿色霉素b1、b2组分混合物精制品进行反相制备和半制备hplc纯化,分别得到鹿色霉素b1组分和鹿色霉素b2组分纯品;所述反相hplc使用的流动相为70%或50%乙腈-水,收集含鹿色霉素b1或b2组分的洗脱峰并经减压旋蒸或冷冻干燥后,得到鹿色霉素b1和b2组分纯品。
链霉菌cgmccno.16425的发酵培养物约30l,经上述分离纯化步骤,可以得到鹿色霉素b1组分纯品5.4mg,鹿色霉素b2组分纯品1.0mg,鹿色霉素b3组分纯品753.2mg,以及鹿色霉素b4组分纯品9.7mg。
本发明还涉及以鹿色霉素(cervinomycin)b1、b3为底物,通过氧化反应得到鹿色霉素(cervinomycin)b2、b4的方法,所述方法包括如下步骤:
(1)将鹿色霉素b1(或b3)溶解于二氯甲烷-甲醇(1:1)溶液中,加入与待氧化组分质量相等的弱氧化剂(如氧化银)并室温搅拌,待氧化反应完成后(约需要6或9小时),滤膜过滤除去弱氧化剂(氧化银);
(2)采用硅胶柱对过滤液进行分离纯化,甲醇(0%-10%)-二氯甲烷梯度洗脱,真空旋转蒸发得到鹿色霉素b2(或b4)组分半纯品。对半纯品进行制备型或半制备型反相hplc精制;洗脱液为乙腈(70%或50%)-水。
本发明还涉及所述的鹿色霉素(cervinomycin)b1、b2、b3、b4在制备抗革兰氏阳性细菌的药物中的应用,优选的,所述的革兰氏阳性细菌为葡萄球菌属细菌、肠球菌属细菌,更优选的,所述的革兰氏阳性细菌为耐药革兰氏阳性细菌,最优选的,所述的耐药革兰氏阳性细菌为耐甲氧西林表皮葡萄球菌(mrse)、耐万古霉素肠球菌(vre)。
本发明还涉及一种用于发酵生产所述鹿色霉素(cervinomycin)b1、b2、b3、b4的菌株:链霉菌cgmccno.16425。链霉菌cgmccno.16425由中国医学科学院医药生物技术研究所从四川峨眉山分离得到(原菌株编号:链霉菌cpcc204980)。链霉菌cgmccno.16425已经于2018年9月4日保藏于中国微生物菌种保藏委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,邮政编码100101。该菌株的分类名称为链霉菌streptomycessp.,保藏编号为cgmccno.16425。
附图说明
图1、鹿色霉素b1、b2、b3、b4的化学结构(突出了结构差异)。
图2、鹿色霉素b组分分离纯化流程图。
图3、鹿色霉素(cervinomycin)b1的1h-nmr核磁谱图。
图4、鹿色霉素(cervinomycin)b1的13c-nmr核磁谱图。
图5、鹿色霉素(cervinomycin)b1的1h-1hcosy核磁谱图。
图6、鹿色霉素(cervinomycin)b1的hsqc核磁谱图。
图7、鹿色霉素(cervinomycin)b1的hmbc核磁谱图。
图8、鹿色霉素(cervinomycin)b1的noesy核磁谱图。
图9、鹿色霉素(cervinomycin)b2的1h-nmr核磁谱图。
图10、鹿色霉素(cervinomycin)b2的13c-nmr核磁谱图。
图11、鹿色霉素(cervinomycin)b2的1h-1hcosy核磁谱图。
图12、鹿色霉素(cervinomycin)b2的hsqc核磁谱图。
图13、鹿色霉素(cervinomycin)b2的hmbc核磁谱图。
图14、鹿色霉素(cervinomycin)b2的roesy核磁谱图。
图15、鹿色霉素(cervinomycin)b3的1h-nmr核磁谱图。
图16、鹿色霉素(cervinomycin)b3的13c-nmr核磁谱图。
图17、鹿色霉素(cervinomycin)b3的1h-1hcosy核磁谱图。
图18、鹿色霉素(cervinomycin)b3的hsqc核磁谱图。
图19、鹿色霉素(cervinomycin)b3的hmbc核磁谱图。
图20、鹿色霉素(cervinomycin)b3的noesy核磁谱图。
图21、鹿色霉素(cervinomycin)b4的1h-nmr核磁谱图。
图22、鹿色霉素(cervinomycin)b4的13c-nmr核磁谱图。
图23、鹿色霉素(cervinomycin)b4的1h-1hcosy核磁谱图。
图24、鹿色霉素(cervinomycin)b4的hsqc核磁谱图。
图25、鹿色霉素(cervinomycin)b4的hmbc核磁谱图。
具体实施方式
实施例1:链霉菌cgmccno.16425固态发酵培养
(1)制备新鲜孢子悬液:将零下70℃冰箱中冷冻保藏的链霉菌cpccno.204980孢子悬液,融化后均匀涂布接种于7-10个孢子培养基平板(培养基成分:淀粉20.0g/l,黄豆饼粉20.0g/l,琼脂粉15.0g/l,ph7.0;平板直径9.0cm,每个平板装入约20毫升培养基)。28℃培养8-9天时,在平板培养基表面上长出一层灰色孢子。每个平板用8.0-10.0ml无菌水把孢子洗下,振荡后获得浓度约1×108孢子/ml的孢子悬液,用于接种发酵培养基平板。
(2)固态发酵培养:将孢子悬液均匀涂布于发酵培养基平板(培养基组成:玉米淀粉10.0g/l,棉籽饼粉10.0g/l,苏氨酸10.0g/l,琼脂粉15.0g/l,ph7.0;平板直径15.0cm,每个平板装入约45毫升培养基),每个平板涂布约50μl孢子悬液。28℃培养8-9天,收获每个发酵平板的培养物(含琼脂培养基),用于鹿色霉素b组分分离纯化。
实施例2:鹿色霉素b组分分离纯化
鹿色霉素b1、b2、b3、b4组分的分离纯化流程,可以参见图2。
(1)乙酸乙酯提取:
链霉菌cpccno.204980固态发酵培养物(约30l),加入等体积乙酸乙酯提取,每次浸泡提取2天,共提取2次。收集乙酸乙酯提取液,真空旋转蒸发,得到棕色乙酸乙酯提取物(约21g)。
(2)鹿色霉素b组分混合物精制品(反相硅胶色谱柱除杂):
将棕色乙酸乙酯提取物复溶于适量甲醇(约200ml)中,超声促溶。按照1:1.5比例,称取约31g反相(ods)硅胶色谱柱填料,加入甲醇溶液中,混匀合后真空旋转蒸发除去甲醇溶剂,得到拌样后的ods粉末。
将拌样后的ods粉末装入上样柱,然后连接到装有约120g反相硅胶色谱柱填料的分离柱。采用甲醇-水系统作为流动相,进行反向色谱柱纯化以除去主要杂质。首先用纯水洗脱3-4个柱体积,然后用30%甲醇-水、50%甲醇-水和70%甲醇-水分别洗脱2-3个柱体积,流速20ml/min;收集各阶段洗脱液,每个收集管约70ml;hplc和tlc检测各收集管中的目标产物,合并相同成分收集管。经真空旋转蒸发后,得到含有鹿色霉素b1、b2、b3组分混合物精制品(1.4g),以及含有鹿色霉素b3、b4组分混合物精制品(231.1mg)。
(3)鹿色霉素b3和b4组分纯品(反相制备型hplc纯化):
将含有鹿色霉素b3-4组分的混合物精制品溶于少量乙腈中,反相制备型hplc进行纯化。色谱柱型号:cosmosilpackedcolumn,5c18-paq,10*250mm。采用50%乙腈-水系统等度洗脱,流速2.0ml/min,收集254nm波长下出现在14.8min和17.1min附近的色谱峰,得到分别含鹿色霉素b3和b4组分的洗脱液。真空旋转蒸发除去洗脱液中的乙腈,再经冷冻干燥除去水后分别得到金黄色的鹿色霉素b3纯品(126.4mg)和砖红色的鹿色霉素b4组分纯品(9.7mg),hplc分析纯度95%以上。
(4)鹿色霉素b1、b2组分混合物精制品和鹿色霉素b3组分纯品(正相硅胶柱纯化):
将含有鹿色霉素b1、b2、b3组分的精制品1.4g用约200ml二氯甲烷溶解,之后加入2.1g硅胶色谱柱填料,混匀后在真空旋转蒸发仪中除去溶剂,得到拌样后的硅胶粉末。
将拌样后的硅胶粉末装入上样柱中,使用0%-10%甲醇-二氯甲烷梯度洗脱180min,流速10.0ml/min,收集洗脱液,每个收集管约70ml;hplc或tlc检测各收集管中的化合物,合并含有鹿色霉素b1、b2组分混合物收集液,以及含有鹿色霉素b3组分收集液;真空旋转蒸发除去洗脱溶剂后得到含鹿色霉素b1、b2组分混合物精制品(199.3mg),以及鹿色霉素b3组分纯品626.8mg。
(5)鹿色霉素b1和b2组分半纯品(反相制备型hplc纯化):
将上述含鹿色霉素b1、b2组分混合物的精制品用10.0mldmso溶解,经0.22μm滤膜过滤后进行制备型hplc分离纯化,制备柱型号:ymc-packods-acolumn,20×250mm。采用50%-100%乙腈-水系统梯度洗脱,流速5.0ml/min,分别收集含鹿色霉素b1和鹿色霉素b2组分的洗脱峰,真空旋转蒸发除去洗脱溶剂后得到含鹿色霉素1组分的半纯品(21.5mg)和鹿色霉素b2组分的半纯品(1.9mg)。
(6)鹿色霉素b1和b2组分纯品(反相半制备型hplc纯化):
将鹿色霉素b1组分和鹿色霉素b2组分的半纯品分别溶于少量乙腈中,反相半制备型hplc纯化。色谱柱型号:cosmosilpackedcolumn,5c18-paq,10*250mm。采用70%乙腈-水系统等度洗脱,流速2.0ml/min,收集254nm波长下出现在8.5min和10min附近的色谱峰,得到分别含鹿色霉素b1组分和鹿色霉素b2组分的洗脱液。洗脱液经真空旋转蒸发除去乙腈,再经冷冻干燥后,得到金黄色的鹿色霉素b1组分纯品(5.4mg)和砖红色的鹿色霉素b2纯品(1.0mg);hplc分析纯度在99%以上。
(7)鹿色霉素b1、b2、b3、b4组分化学结构解析:
根据化合物的紫外-可见光谱和高分辨质谱,特别是对1h-nmr、13c-nmr、dept、1h-1h相关谱(1h-1hcosy)、1h-13c相关谱(hsqc)和反向检测远程1h-13c异核多键相关谱(hmbc)的解析,确定了鹿色霉素b1、b2、b3和b4的化学结构(图1)。根据化学结构解析结果,它们属于多环氧杂蒽酮类抗生素,其分子结构骨架为多环(abcdefg,7环)稠合。更具体地它们属于鹿色霉素(cervinomycin)a组分的类似物。与鹿色霉素a组分相比,鹿色霉素b组分分子d环上连接c-9,10的双键均被还原为单键(正是根据这个结构差异,本发明将这些化合物归属并命名为鹿色霉素b组分)。与鹿色霉素a1相比,鹿色霉素b1的d环上c-9,10为单键;与鹿色霉素a2相比,鹿色霉素b2的d环上c-9,10为单键;鹿色霉素b3是18-o-去甲基鹿色霉素b1;鹿色霉素b4是18-o-去甲基鹿色霉素b2。鹿色霉素b1、b2、b3和b4的核磁谱图,见图4-25。鹿色霉素b1、b2、b3、b4的nmr核磁数据,见表1-4。
表1、鹿色霉素b1的nmr核磁数据
表2、鹿色霉素b2的nmr核磁数据
表3、鹿色霉素b3的nmr核磁数据
表4、鹿色霉素b4的nmr核磁数据
实施例3:鹿色霉素b2和b4组分的氧化制备
鹿色霉素b2和b4组分分别为鹿色霉素b1和b3组分的氧化产物。实施例2中通过分离纯化制备鹿色霉素b2和b4组分的得率比较低,因此可以利用实施例2中获得的鹿色霉素b1和b3组分的纯品或半纯品,经过化学氧化方法更加高效地制备鹿色霉素b2和b4组分。具体如下:
(1)称取鹿色霉素b1(或b3)组分25mg(或5mg),超声溶解在25.0ml(5.0ml)二氯甲烷-甲醇(体积比1:1)中;称取25mg(或5mg)氧化银,加入溶液中,室温下搅拌。
(2)每隔1h取反应液上清100μl,用0.22μm滤膜过滤除去氧化银;在真空离心浓缩仪中除去溶剂后,加入100μl乙腈复溶氧化产物,hplc分析监测氧化反应进度,约9h(或6h)后氧化反应完全。hplc分析监测条件为40%-70%乙腈-水系统,梯度洗脱30min,流速1.0ml/min。反应结束后,用0.22μm微米滤膜过滤反应液除去氧化银,在真空旋转蒸发仪中除去有机溶剂,得到含鹿色霉素b2(或b4)组分的样品。
(3)将含鹿色霉素b2(或b4)组分的样品复溶于5.0ml(或3.0ml)二氯甲烷-甲醇(体积比1:1)中,进行制备型硅胶板tlc分离纯化,样品展开系统为二氯甲烷-甲醇(体积比9:1)。展层后的硅胶板晾干后,将鹿色霉素b2(或b4)组分条带刮下,含有少量甲醇的二氯甲烷溶液洗脱;洗脱液在真空旋转蒸发仪中蒸干溶剂,得到鹿色霉素b2(或b4)组分的半纯品18.3mg(或4.3mg)。
(4)将上述鹿色霉素b2(或b4)组分的半纯品用2.0mldmso溶解,上制备型hplc进行精制,所用色谱柱同实施例2。采用50%(或70%)乙腈-水系统等度洗脱,流速2.0ml/min,收集254nm波长下出现在14.8min(或8.5min)附近的色谱峰,经真空旋转蒸发除去洗脱溶剂后,得到砖红色的鹿色霉素b2(或b4)组分的纯品7.1mg(或3.6mg);hplc分析纯度在99%以上。
实施例4:鹿色霉素b组分抗革兰氏阳性细菌活性
(1)准备样品:
称取实施例2或3中获得的鹿色霉素b1-b4组分纯品适量并溶于dmso中,制备浓度为1.28mg/ml的待测样品母液。按照美国临床实验室标准化委员会(nccls)推荐的微量肉汤稀释法,测定其对常见标准和临床分离的革兰氏阳性细菌(包括mrsa和vre)菌株的最低抑制浓度(mic)。
(2)测定:
用mueller-hinton(mh)肉汤培养基倍比稀释溶于dmso中的鹿色霉素b1-b4组分母液后,分别加入到无菌的聚苯乙烯96孔板中,第1-11孔加待测样品稀释液(每孔100μl),,第12孔不加待测样品稀释液(加mh肉汤培养基)作为细菌生长对照。测定菌株为常见的标准和临床分离的革兰氏阳性细菌。
细菌活性测定培养基使用nccls推荐的mueller-hinton(mh)肉汤培养基,ph7.2-7.4。直接取培养18-24h的细菌菌落,用生理盐水调配成0.5麦氏比浊标准的菌悬液,相当于(1-2)×108cfu/ml。用mh肉汤将待测细菌的菌悬液按照1:1000稀释后,每孔中加入100μl,密封于35℃培养16-20h。根据培养基浑浊与否并参照对照判断:浑浊,细菌生长;不浑浊,细菌生长受到抑制。
(3)抗菌活性(mic):
完全抑制细菌生长的样品最低浓度为mic。鹿色霉素b1-b4组分对所有测定的革兰氏阳性细菌菌株、包括mrsa显示了极强的抑制活性。例如,鹿色霉素b3组分的对所有测定菌株的mic为0.004-0.03μg/ml,其中对mrsa和vre耐药菌株的mic为0.004-0.03μg/ml,均优于阳性对照药物左氧氟沙星。
表5鹿色霉素b1-4组分对革兰氏阳性细菌的最低抑制浓度(mic)
注:msse,甲氧西林敏感表皮葡萄球菌;mrse,耐甲氧西林表皮葡萄球菌;mssa,甲氧西林敏感金黄色葡萄球菌;vse,万古霉素敏感肠球菌;vre,耐万古霉素肠球菌。
- 还没有人留言评论。精彩留言会获得点赞!