4-(苯并硒唑-2-基)芳胺类化合物治疗胃癌的用途的制作方法
本发明属于药物化学领域,具体涉及一类4-(苯并硒唑-2-基)芳胺类化合物在治疗胃癌方面的用途。
背景技术:
胃癌是消化系统最常见的恶性肿瘤之一。在全世界范围内,胃癌的发病率在恶性肿瘤中排名第5位,致死率在恶性肿瘤中位居第3位。国际癌症研究中心(iarc)公布的数据表明,2012年全球共有951,600例新发胃癌患者(其中男性病例数约是女性的2倍),以及723,100死亡病例。据统计,胃癌发病率东亚最高(特别是韩国、蒙古、日本和中国),其次为欧洲中、东部和南美洲,而北美洲和大部分非洲地区最低(torrela,brayf,siegelrl,etal.globalcancerstatistics,2012.caacancerjournalforclinicians,2015,65(2):87-108;iarc.allcancers(excludingnon-melanomaskincancer)estimatedincidence,mortalityandprevalenceworldwidein2012;herreror,parkjy,formand.thefightagainstgastriccancer–theiarcworkinggroupreport.bestpracticeandresearchinclinicalgastroenterology,2014,28(6):1107-1114;carcaslp.gastriccancerreview.journalofcarcinogenesis,2014,19:13-14)。
据统计,中国胃癌发病率在恶性肿瘤中位居于第2位,每年新增病例数和死亡人口均超过了全球的40%(torrela,siegelrl,wardem,etal.globalcancerincidenceandmortalityratesandtrends-anupdate.cancerepidemiologyandpreventionbiomarkers,2016,25(1):16-27);且每年有约352,300例患者因胃癌死亡(laykejc,lopezpp.胃癌:诊断和治疗方案的选择.中国全科医学,2015,18(3):248-249)。
胃癌的发病机制至今尚未完全阐明,主要认为胃癌发病与饮食习惯、幽门螺杆菌(helicobacterpylori,hp)感染、血清胃蛋白酶原(pg)、遗传因素、代谢综合征和心理压力等因素都有一定关联。而幽门螺旋杆菌可能是胃癌最大的诱发因素,大约有90%的新增非贲门胃癌病例与此相关(changm,zhangjc,zhouq,etal.researchprogressofclinicalepidemiologyofgastriccancer.chinesejournalofgastroenterology&hepatology,2017,26(9):966-969)。
目前治疗胃癌的手段有限,手术切除仍是根治胃癌的唯一临床方法。对于早期胃癌,虽然术后原则上是无需接受化疗,但患者若出现以下情况,仍需进行化疗:(1)年龄小于40岁;(2)存在多个病灶;(3)病灶面积大于5cm2;(4)病理类型的恶性程度偏高(贺阿青,张成武.探讨胃癌的诊断及治疗.世界最新医学信息文摘,2018,18(14):55)。
中国由于胃癌筛查体系尚不完善,胃癌早期诊断率低,所以多数患者确诊时已处于进展期胃癌或晚期胃癌(advancedgastriccancer)。此时单纯手术治疗往往无法取得较好的疗效,且术后复发转移率较高;有部分患者的肿瘤体积大,无法进行手术,须予以新辅助化疗,待肿瘤体积缩小,才可以进行手术。有研究表明,对于进展期胃癌,联合手术不仅不能带来生存优势,对于部分患者的总生存期甚至低于单纯化疗(gastrectomypluschemotherapyversuschemotherapyaloneforadvancedgastriccancerwithsinglenon-curablefactor(regatta):aphase3,randomizedcontrolledtrial.lancetoncology,2016,17(3):309-318)。因此,以化疗为主的综合疗法是晚期胃癌患者的主要治疗手段,可改善患者预后,提高患者生活质量。
目前,临床上对于晚期胃癌化疗所用的细胞毒性药物主要包括四大类:(1)口服氟尿嘧啶类,如卡培他滨、替吉奥;(2)紫杉类,如紫杉醇,多西他赛;(3)第三代铂类,如奥沙利铂;(4)拓扑异构酶i抑制剂,如伊立替康。另外,已上市的分子靶向药物主要包括人表皮生长因子受体2(her2)抗体,如曲妥珠单抗,血管内皮生长因子受体(vegfr-2)抗体,如雷莫芦单抗,以及靶向vegfr-2的小分子酪氨酸酶抑制剂阿帕替尼等(李开春,李平.进展期胃癌治疗药物的选择.药学服务与研究,2018,18(1):1-5)。
虽然对于胃癌进行化疗联用是nccn指南建议的标准治疗方式(nccnclinicalpracticeguidelineinoncology:gastriccancer(2015version)),但效果却已经达到了一个瓶颈,患者的生存获益无法增加更多,同时,患者都会因化疗药物的细胞毒性引起如白细胞和血小板减少等骨髓抑制等毒副作用,造成患者身体情况进一步恶化。另外,胃癌是一种由多个基因突变和表观遗传异常所驱动的高度异质性疾病,因此靶向药物开发滞后,且已有药物的靶向性差、灵敏度低,如曲妥珠单抗仅仅对胃癌患者中约20%的her2阳性患者有效(bangyj,vancutseme,feyereislovaa,etal.trastuzumabincombinationwithchemotherapyversuschemotherapyalonefortreatmentofher2-positiveadvancedgastricorgastro-oesophagealjunctioncancer(toga):aphase3,open-label,randomizedcontrolledtrial.lancet,2010,376(6):687-697)。因此,目前的化疗和靶向疗法均无法有效对抗胃癌,而增加患者的生存获益。
中国的胃癌发病率和死亡率处于世界较高水平,已严重危害居民的健康,给家庭和社会造成沉重的负担,由于胃癌的高度异质性和目前临床治疗手段的匮乏,因此,急需研制新型的治疗方法或药物以应对胃癌发病率和死亡率日益增长的现状。
硒元素是人体必需的微量元素之一,血中硒元素含量降低会诱发多种包括肿瘤及心血管在内的多种疾病(reevesma,hoffmannpr.thehumanselenoproteome:recentinsightsintofunctionsandregulation.cellularandmolecularlifesciences,2009,66(15):2457-78)。含硒药物由于它在抗肿瘤、抗病毒以及治疗神经系统相关疾病等方面的应用,已成为国内外学者研发的热点,药物研究主要集中在抗肿瘤、抗炎和抗高血压等方面(romualdoc,stefaniac,marinadg,etal,novelselenium-containingnon-naturaldiaminoacids.tetrahedronletters,2007,48(7):1425-1427)。
malcolmf.g.stevens等所申请的美国专利(malcolmf.g.stevens,andrewd.westwell,mei-szechua,etal.substituted2-arylbenzazolecompoundsandtheiruseasantitumouragents.us6858633b1)公布了下式(ii)化合物,并指出了这类化合物在癌症方面的用途,但其说明书内容主要针对的是乳腺癌,由于不同癌症之间发病机理和治疗途径基本上并不相同,而且大部分抗癌化合物仅对某些敏感癌症具有治疗作用,因此该类化合物在其他癌症方面是否能起作用实际上仍然是未知的。
本专利发明人史东方已发表了关于苯并噻唑类化合物的合成及其体内外抗乳腺癌作用的文章(dong-fangshi,traceyd.bradshaw,samanthawrigley,etal.antitumorbenzothiazoles.3.synthesisof2-(4-aminophenyl)benzothiazolesandevaluationoftheiractivitiesagainstbreastcancercelllinesinvitroandinvivo.journalofmedicinalchemistry,1996,39:3375-3384),同时,本专利发明人史东方所申请的中国专利(史东方,傅长金,承曦等.用于治疗或预防乳腺癌的化合物.cn201610299350.1)公布了如式(iii)所示苯并硒唑-2-苯类化合物及其抗乳腺癌的药理活性。这两类化合物均对人乳腺癌细胞具有纳摩尔级别的抑制效果,其中苯并噻唑类化合物对er+(mcf-7和bo细胞株)和er-(mt-1和mt-3细胞株)的乳腺癌裸鼠移植瘤均表现出十分显著的抑瘤效果,但是这两类化合物对其他如前列腺癌、膀胱癌、黑色素瘤、肺癌、肝癌、食管癌等肿瘤细胞株并无抑制活性。
至今,未见有任何关于4-(苯并硒唑-2-基)芳胺类化合物对胃癌模型有作用的报道。
技术实现要素:
本发明的目的是在现有技术的基础上,提供一类4-(苯并硒唑-2-基)芳胺类化合物在治疗胃癌方面的用途。
本发明的目的可以通过以下措施达到:
通式(i)所示的化合物或其药学上可接受的盐在制备治疗或预防胃癌药物方面的应用,
其中,
r1和r2分别独立地选自h、d、卤素、-cn、c1-3烷基、取代的c1-3烷基、c1-3烷氧基或取代的c1-3烷氧基;
r3选自h、卤素、-oh、-cn、-c(=o)nh2、取代的-c(=o)nh2、c1-3烷基、取代的c1-3烷基、c2-3烯基、c2-3炔基、c1-3烷氧基或取代的c1-3烷氧基;
r4选自h、d、卤素、-oh、-cn、-nh2、取代的-nh2、-c(=o)nh2、取代的-c(=o)nh2、c1-3烷基、取代的c1-3烷基、c2-3烯基、c2-3炔基、c1-3烷氧基或取代的c1-3烷氧基中的一种或两种;
n=1或2;
r5选自h、-cn、-oh、c1-3烷基、c1-3烷氧基或氨基酸残基;
z选自ch或n;
r1、r2、r3或r4中的取代基选自d、卤素、oh、c1-3烷基或c1-3烷氧基。
在一种优选方案中,本发明中的r1和r2分别独立地选自h、d、卤素、-cn、c1-3烷基、取代的c1-3烷基、c1-3烷氧基或取代的c1-3烷氧基,所述取代基选自d、f或c1-3烷氧基;
在另一种优选方案中,本发明中的r1和r2分别独立地选自h、d、f、cl、-cn、-ch3、-cf3、-ocf3或-ochf2。
在另一种优选方案中,本发明中的r1选自d、f、cl、-cn、-ch3或-cf3。
在另一种优选方案中,本发明中的r2选自h。
在一种优选方案中,本发明中的r3选自h、卤素、-cn、-c(=o)nh2、c1-2烷基、c2-3烯基、c2-3炔基、c1-3烷氧基或取代的c1-3烷氧基。
在另一种优选方案中,本发明中的r3选自h、f、cl、br、-cn、-c(=o)nh2、-ch3、-ch2ch3、-cf3、-ch=ch2、-c≡ch、-ochf2或-ocf3。
在一种优选方案中,本发明中的r4选自h、d、卤素、-cn、c1-3烷基、取代的c1-3烷基、c1-3烷氧基或取代的c1-3烷氧基中的一种或两种。
在另一种优选方案中,本发明中的r4选自h、d、f、cl、br、i、-cn、-ch3、-cf3、-och3、-och2ch3、-ochf2或-ocf3。
在一种优选方案中,本发明中的r5选自h、c1-3烷基、c1-3烷氧基或氨基酸残基。
在另一种优选方案中,本发明中的r5选自h、-ch3、-cf3、-och3或2,6-二氨基-己酰基。
在一种优选方案中,本发明中所涉及的化合物选自:
2-氨基-5-(5-氟苯并硒唑-2-基)苯甲腈,
2-氨基-3-氟-5-(5-氟苯并硒唑-2-基)苯甲腈,
2-乙炔基-4-(5-氟苯并硒唑-2-基)苯胺,
5-氟-4-(5-氟苯并硒唑-2-基)-2-甲基苯胺,
2-溴-6-(5-氟苯并硒唑-2-基)吡啶-3-氨,
3-氨基-6-(5-氟苯并硒唑-2-基)-2-甲酰胺基吡啶,
4-(5-氟苯并硒唑-2-基)-2-甲基苯胺,
2-溴-4-(5-氟苯并硒唑-2-基)-6-甲基苯胺,
2-溴-6-氟-4-(5-氟苯并硒唑-2-基)苯胺,
2,6-二氟-4-(5-氟苯并硒唑-2-基)苯胺,
2-氟-4-(5-氟苯并硒唑-2-基)-6-甲基苯胺。
如无特别说明,本发明中所涉及的各基团分别具有如下含义。
“h”,即氢,是指氕(1h),它是氢元素的主要稳定同位素。
“d”,即氘,是指氢的一种稳定形态同位素,也被称为重氢,其元素符号为d。
“卤素”,是指氟原子,氯原子,溴原子或碘原子。
“-oh”,是指羟基基团。
“-nh2”,是指氨基基团。
“-conh2”,即c(=o)-nh2,是指酰胺基团。
“-cn”,是指氰基基团。
“-no2”,是指硝基基团。
“烷基”,是指1-10个碳原子的饱和的脂烃基,包括直链和支链基团(本申请书中提到的数字范围,例如“1-10”,是指该基团,此时为烷基,可以含1个碳原子、2个碳原子、3个碳原子等,直至包括10个碳原子)。含1-4个碳原子的烷基称为低级烷基。当低级烷基没有取代基时,称其为未取代的低级烷基。烷基可以选用c1-6烷基、c1-5烷基、c1-4烷基、c1-3烷基、c1-2烷基、c2-3烷基、c2-4烷基等。具体的烷基包括但不限于甲基、乙基、丙基、2-丙基、正丁基、异丁基或叔丁基等。烷基可以是取代的或未取代的。
“烯基”表示具有至少一个碳碳双键的不饱和烃基基团,包括直链和支链基团(本申请书中提到的数字范围,例如“2-5”,是指该基团,此时为烯基,可以含2个碳原子、3个碳原子、4个碳原子等,直至包括5个碳原子)。本发明中的烯基可以为c2-8烯基、c2-6烯基、c2-5烯基、c2-4烯基、c2-3烯基等,具体的烯基包括但不限于乙烯基、丙烯基和丁烯基。
“炔基”表示具有至少一个碳碳三键的不饱和烃基基团,包括直链和支链基团(本申请书中提到的数字范围,例如“2-5”,是指该基团,此时为炔基,可以含2个碳原子、3个碳原子、4个碳原子等,直至包括5个碳原子)。本发明中的炔基可以为c2-8炔基、c2-6炔基、c2-5炔基、c2-4炔基、c2-3炔基等,具体的烯基包括但不限于乙炔基、丙炔基和丁炔基。
“烷氧基”表示-o-(未取代的烷基)和-o-(未取代的环烷基)基团,其进一步表示-o-(未取代的烷基)。代表性实施例包括但不限于甲氧基、乙氧基、丙氧基、环丙氧基等。
“氨基酸残基”是指氨基酸缺少了某一基团(如-oh、-cooh或-nh2)所形成的基团,其中氨基酸包括但不限于通常由三个字母符号指定的20种天然存在的氨基酸,并且还包括β-丙氨酸、瓜氨酸、锁链素(demosine)、γ-氨基丁酸、同型半胱氨酸、同型丝氨酸、4-羟基脯氨酸、羟基赖氨酸、异锁链素(isodemosine)、3-甲基组氨酸、正缬氨酸、甲硫氨酸砜(methioninesulfone)和鸟氨酸等。一种氨基酸残基的例子包括但不限于:2,6-二氨基-己酰基。
“药学上可接受的盐”是包含通式(i)的化合物与有机酸或无机酸形成的盐,表示保留母体化合物的生物有效性和性质的那些盐。这类盐包括:
(1)与酸成盐,通过母体化合物的游离碱与无机酸或有机酸的反应而得,无机酸例如(但不限于)盐酸、氢溴酸、硝酸、磷酸、偏磷酸、硫酸、亚硫酸和高氯酸等,有机酸例如(但不限于)乙酸、丙酸、丙烯酸、草酸、(d)或(l)苹果酸、富马酸、马来酸、羟基苯甲酸、γ-羟基丁酸、甲氧基苯甲酸、邻苯二甲酸、甲磺酸、乙磺酸、萘-1-磺酸、萘-2-磺酸、对甲苯磺酸、水杨酸、酒石酸、柠檬酸、乳酸、扁桃酸、琥珀酸或丙二酸等。
(2)存在于母体化合物中的酸性质子被金属离子代替或者与有机碱配位化合所生成的盐,金属离子例如碱金属离子、碱土金属离子或铝离子,有机碱例如乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、n-甲基葡糖胺等。
“药用组合物”指的是在此描述的一种或多种化合物或者它们的药学上可接受的盐和前药与其它的化学成分,例如药学上可接受的载体和赋形剂的混合物。药用组合物的目的是促进化合物对生物体的给药。
在本发明化合物的应用中,可以将本发明的化合物、药学上可接受的盐或其溶剂合物作为活性成分或主要活性成分,辅以药学上可接受的辅料制成药物组合物,再对病人进行施用。
本发明的化合物可以用本领域已知的方式配制成临床上或药学上可接受的任一剂型。用于口服给药时,可制成常规的固体制剂,如片剂、胶囊剂、丸剂、颗粒剂等;也可制成口服液体制剂,如口服溶液剂、口服混悬剂、糖浆剂等。制成口服制剂时,可以加入适宜的填充剂、粘合剂、崩解剂、润滑剂等。用于肠胃外给药时,可以制成注射剂,包括注射液、注射用无菌粉末与注射用浓溶液。制成注射剂时,可采用现有制药领域中常规方法生产,配制注射剂时,可以不加入附加剂,也可以根据药物的性质加入适宜的附加剂。
本发明还提供了一种治疗人类胃癌的方法,即对患有胃癌的人施以每次剂量0.1-1000mg的本发明的化合物、药学上可接受的盐或其溶剂合物,或者施以每次剂量0.1-1000mg的本发明的药物组合物。
本专利涉及到的4-(苯并硒唑-2-基)芳胺类化合物尽管有抗乳腺癌方面的药理活性,但体外试验表明,对于前列腺癌、膀胱癌、黑色素瘤、肺癌、肝癌、食管癌等肿瘤细胞株均无明显的抑制作用。然而,本专利发现了这类化合物对于胃癌的治疗效果十分优异:对人胃癌细胞株mkn-45、ags和nci-n87具有显著地抑制生长的作用,效果基本接近于阳性对照药物紫杉醇;该类化合物对人胃癌mkn-45和ags裸鼠异种移植瘤也表现出极佳的抑制肿瘤生长的效果,抑瘤率均大于35%。因此这些化合物可以应用在人类胃癌治疗领域。
本发明发现了4-(苯并硒唑-2-基)芳胺类化合物在疾病治疗方面的一种新的用途,为胃癌的治疗提供了一种潜在的药物。
附图说明
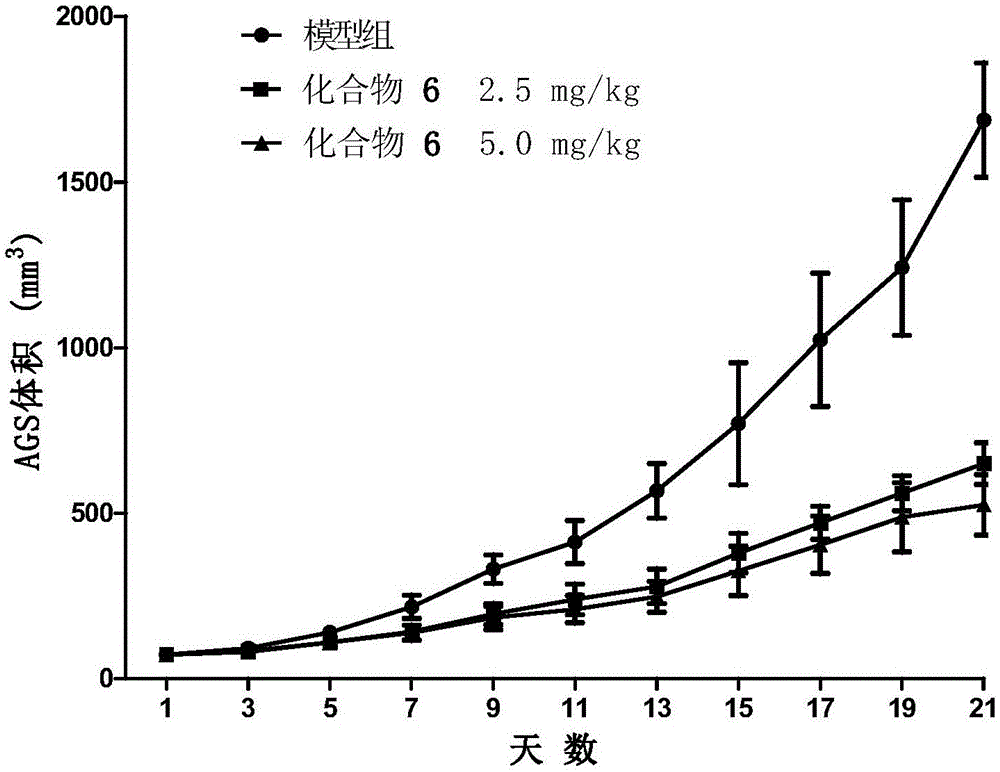
图1是化合物6对人胃癌细胞株ags裸鼠异种移植肿瘤体积的抑制作用;
图2是化合物6对人胃癌细胞株mkn-45裸鼠异种移植肿瘤体积的抑制作用;
图3是化合物22对人胃癌细胞株ags裸鼠异种移植肿瘤体积的抑制作用;
图4是化合物22对人胃癌细胞株mkn-45裸鼠异种移植肿瘤体积的抑制作用;
图5是化合物23对人胃癌细胞株ags裸鼠异种移植肿瘤体积的抑制作用;
图6是化合物23对人胃癌细胞株mkn-45裸鼠异种移植肿瘤体积的抑制作用;
具体实施方式
以下结合实施例对本发明的内容做进一步说明,但本专利的保护范围并不局限于以下各实施例。
实施例1:2-氨基-5-(5-氟苯并硒唑-2-基)苯甲腈(6)的合成
步骤a:在-20~-25℃下将2-硝基-4-氟苯胺(5.0g,32.0mmol)的二氯甲烷(80ml)溶液滴加到三氟化硼乙醚(6.82g,48.1mmol)中。搅拌15分钟,然后在该温度下滴加亚硝酸异戊酯(4.50g,38.4mmol)的二氯甲烷(20ml)溶液。加完后继续搅拌30分钟,然后在-10~0℃下搅拌30分钟。向反应体系中滴加冷却的石油醚(60ml),过滤,滤饼用冷却的甲基叔丁基醚(10ml)洗涤,得2-硝基-4-氟苯基-氟硼酸重氮盐(1)粗品(8.10g)。该化合物不经纯化直接用于下一步反应。
步骤b:在冰水浴下,向化合物1粗品(8.10g)和水(150ml)的混合物中滴加硒氰酸钾(4.35g,30.2mmol)的水(20ml)溶液,加完后继续搅拌1小时。过滤,滤饼用二氯甲烷(150ml)溶解。过滤除去不溶物,滤液用无水硫酸钠干燥。减压蒸除溶剂,得4-氟-2-硝基-1-硒氰酸苯酯(2)粗品(6.10g)。该化合物不经纯化直接用于下一步反应。
步骤c:室温下将金属钠(3.23g,140mmol)加入到化合物2粗品(6.10g)和无水乙醇(90ml)的混合物中,所得混合物在水浴下搅拌1小时。冷却到0~5℃,过滤,滤饼用少量冷却的乙醇洗涤,得1,2-二(4-氟-2-硝基苯基)-二硒(3)粗品(3.90g)。该化合物不经纯化直接用于下一步反应。
步骤d:将化合物3粗品(3.90g)溶解于乙醇(60ml),加入氯化亚锡(7.90g,41.7mmol),所得混合物在氮气下回流搅拌4小时。减压蒸除大部分溶剂,加入水(120ml)和乙酸乙酯(200ml),用2m氢氧化钠溶液调节ph值至8~9。通过硅藻土过滤除去不溶物,分层,水层用乙酸乙酯(60ml×2)萃取,合并的有机层用无水硫酸钠干燥。然后利用减压法柱层析纯化(200-300目硅胶,乙酸乙酯洗脱),所得产物用石油醚重结晶,得6,6’-二硒基-二(3-氟苯胺)(4)(3.0g)。步骤a、b、c和d四步反应总收率为49.6%。
步骤e:向化合物4(3.0g,7.93mmol)和4-氨基-3-溴苯甲酸(1.70g,7.87mmol)的甲苯(50ml)溶液中加入三丁基膦(8.0g,39.5mmol),所得混合物在氮气下回流搅拌48小时。冷却到室温,加入水(50ml),用2m氢氧化钠溶液调节ph值至9~10。用乙酸乙酯(40ml×3)萃取,合并的有机相用饱和食盐水(25ml)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200-300目硅胶,乙酸乙酯:石油醚=1:50~1:5洗脱),得2-溴-4-(5-氟苯并硒唑-2-基)苯胺(5)(1.60g)。收率为54.9%。
步骤f:将含有化合物5(400mg,1.08mmol)、氰化亚铜(145mg,1.62mmol)和nmp(10ml)的混合物在150℃搅拌过夜。冷却到室温,加入水(40ml),用2m碳酸钠溶液调节ph值至8~9。用乙酸乙酯(30ml×3)萃取,合并的有机相用饱和食盐水(20ml×2)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200~300目硅胶,乙酸乙酯:二氯甲烷:石油醚=1:1:20~1:1:8洗脱),得2-氨基-5-(5-氟苯并硒唑-2-基)苯甲腈(6)(84mg)。收率为54.9%。1hnmr(dmso-d6,400mhz)δ8.15-8.12(m,1h),8.06(d,j=2.4hz,1h),7.98-7.96(m,1h),7.79-7.76(m,1h),7.24-7.19(m,1h),6.90(d,j=8.8hz,1h),6.83(s,2h)。ms(ei,m/z):316.0[m-h]-。
实施例2:2-氨基-3-氟-5-(5-氟苯并硒唑-2-基)苯甲腈(9)的合成
步骤a:向化合物4(4.30g,11.4mmol)和4-氨基-3-氟苯甲酸(1.76g,11.3mmol)的甲苯(50ml)溶液中加入三丁基膦(11.5g,39.5mmol),所得混合物在氮气下回流搅拌48小时。冷却到室温,加入水(50ml),用2m氢氧化钠溶液调节ph值至9~10。用乙酸乙酯(40ml×3)萃取,合并的有机相用饱和食盐水(25ml)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200-300目硅胶,乙酸乙酯:石油醚=1:100~1:20洗脱),得2-氟-4-(5-氟苯并硒唑-2-基)苯胺(7)(780mg)。收率为22.3%。
步骤b:将nbs(585mg,3.29mmol)加入到化合物7(780mg,2.52mmol)的dmf(10ml)溶液中,加完后,所得混合物在室温下搅拌30分钟。加入水(40ml),用乙酸乙酯(30ml×2)萃取,合并的有机相依次用水(15ml)、饱和碳酸氢钠水溶液(15ml)和饱和食盐水(15ml)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物用石油醚/乙酸乙酯重结晶,得2-溴-6-氟-4-(5-氟苯并硒唑-2-基)苯胺(8)(720mg)。收率为73.6%。1hnmr(dmso-d6,500mhz)δ8.16-8.13(m,1h),7.90(s,1h),7.79(dd,j=2.0,10.0hz,1h),7.73(dd,j=2.0,10.0hz,1h),7.24-7.20(m,1h),6.12(s,2h)。ms(ei,m/z):388.9[m+h]+。
步骤c:将含有化合物8(520mg,1.34mmol)、氰化亚铜(180mg,2.01mmol)和nmp(10ml)的混合物在150℃搅拌过夜。冷却到室温,加入水(40ml),用2m碳酸钠溶液调节ph值至8~9。用乙酸乙酯(30ml×3)萃取,合并的有机相用饱和食盐水(20ml×2)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200~300目硅胶,乙酸乙酯:石油醚=1:50~1:20洗脱),得2-氨基-3-氟-5-(5-氟苯并硒唑-2-基)苯甲腈(9)(150mg)。收率为33.5%。1hnmr(dmso-d6,400mhz)δ8.19-8.16(m,1h),7.99-7.94(m,2h),7.80(dd,j=2.4,10.0hz,1h),7.27-7.23(m,1h),6.99(s,2h)。ms(ei,m/z):336.0[m+h]+。
实施例3:2-乙炔基-4-(5-氟苯并硒唑-2-基)苯胺(12)的合成
步骤a:将含有化合物5(500mg,1.35mmol)、乙酸酐(0.5ml)、吡啶(10ml)和4-二甲胺基吡啶(10mg,0.0819mmol)的混合物在90℃搅拌过夜。冷却到室温,加入水(50ml),用乙酸乙酯(30ml×3)萃取,合并的有机相用饱和食盐水(15ml×2)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200~300目硅胶,乙酸乙酯:二氯甲烷:石油醚=1:1:25~1:1:10洗脱),得n-[2-溴-4-(5-氟苯并硒唑-2-基)苯基]乙酰胺(10)(500mg)。收率为89.8%。
步骤b:通过注射器将三甲基硅烷乙炔(131mg,1.33mmol)加入到含有化合物10(500mg,1.21mmol)、双三苯基磷二氯化钯(40mg,0.0570mmol)、三乙胺(40ml)和dmf(4ml)的混合物中,加完后,所得混合物在50℃搅拌过夜。减压蒸除大部分溶剂,加入水(30ml),用乙酸乙酯(30ml×3)萃取,合并的有机相用饱和食盐水(15ml×2)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200~300目硅胶,乙酸乙酯:石油醚=1:50~1:20洗脱),得n-{4-(5-氟苯并硒唑-2-基)-2-[(三甲基硅烷基)乙炔基]苯基}乙酰胺(11)(211mg)。收率为40.6%。
步骤c:将含有化合物11(100mg,0.233mmol)、2m氢氧化钠溶液(10ml)、thf(5ml)和甲醇(10ml)的混合物在80℃搅拌1小时。冷却到室温,加入水(30ml),用乙酸乙酯(30ml×3)萃取,合并的有机相用饱和食盐水(15ml×2)洗涤,无水硫酸钠干燥。减压蒸除溶剂,所得产物用石油醚/乙酸乙酯重结晶,得2-乙炔基-4-(5-氟苯并硒唑-2-基)苯胺(12)。1hnmr(dmso-d6,400mhz)δ8.13-8.09(m,1h),7.82(d,j=2.0hz,1h),7.77-7.73(m,2h),7.22-7.19(m,1h),6.81(d,j=8.4hz,1h),6.20(s,2h),4.48(s,1h)。ms(ei,m/z):315.0[m-h]-。
实施例4:5-氟-4-(5-氟苯并硒唑-2-基)-2-甲基苯胺(16)的合成
步骤a:在冰水浴下,将nbs(3.55g,19.9mmol)分批加入到5-氟-2-甲基苯胺(2.50g,20.0mmol)的dmf(20ml)溶液中,加完后,所得混合物在该温度下继续搅拌1小时。加入水(80ml),用乙酸乙酯(60ml×3)萃取,合并的有机相依次用饱和碳酸氢钠溶液(30ml×2)和饱和食盐水(30ml×2)洗涤,无水硫酸钠干燥。减压蒸除溶剂,得4-溴-3-氟-6-甲基苯胺(13)粗品(4.87g)。该化合物不经纯化直接用于下一步反应。
步骤b:将含有化合物13粗品(4.87g)、氰化亚铜(2.63g,29.4mmol)和nmp(15ml)的混合物在氮气下180℃搅拌7小时。加入水(75ml),用乙酸乙酯(50ml×3)萃取,合并的有机相依次用水(30ml×2)和饱和食盐水(30ml)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200-300目硅胶,乙酸乙酯:石油醚=1:30~1:5洗脱),得4-氨基-2-氟-5-甲基苯甲腈(14)(1.74g)。步骤a和b两步反应总收率为58.2%。
步骤c:将含有化合物14(1.74g,11.6mmol)、1m氢氧化钠溶液(50ml)和乙醇(5ml)的混合物在回流下搅拌过夜。冷却到室温,加入水(50ml),用甲基叔丁基醚(20ml×2)萃取,产物在水相。水相用2m盐酸调节ph值至3~4,有固体析出。过滤,滤饼干燥,得4-氨基-2-氟-5-甲基苯甲酸(15)(1.75g)。收率为89.2%。
步骤d:向化合物4(1.0g,2.64mmol)和化合物15(447mg,2.64mmol)的甲苯(30ml)溶液中加入三丁基膦(2.68g,13.2mmol),所得混合物在氮气下回流搅拌36小时。冷却到室温,加入水(40ml),用2m氢氧化钠溶液调节ph值至9~10。用乙酸乙酯(40ml×3)萃取,合并的有机相用饱和食盐水(25ml)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200-300目硅胶,乙酸乙酯:石油醚=1:50~1:10洗脱),得5-氟-4-(5-氟苯并硒唑-2-基)-2-甲基苯胺(16)(655mg)。收率为72.9%。1hnmr(dmso-d6,400mhz)δ8.14-8.10(m,1h),7.90(d,j=8.8hz,1h),7.78(dd,j=2.4,10.0hz,1h),7.22-7.17(m,1h),6.54-6.51(m,1h),6.08(s,2h),2.13(s,3h)。ms(ei,m/z):323.0[m-h]-。
实施例5:2-溴-6-(5-氟苯并硒唑-2-基)吡啶-3-氨(18)的合成
步骤a:向化合物4(1.80g,4.76mmol)和5-氨基吡啶-2-甲酸(657mg,4.76mmol)的甲苯(50ml)溶液中加入三丁基膦(4.82g,23.8mmol),所得混合物在氮气下回流搅拌36小时。冷却到室温,加入水(40ml),用2m氢氧化钠溶液调节ph值至9~10。用乙酸乙酯(40ml×3)萃取,合并的有机相用饱和食盐水(25ml)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200-300目硅胶,乙酸乙酯:二氯甲烷:石油醚=1:1:20~1:1:5洗脱),得6-(5-氟苯并硒唑-2-基)吡啶-3-氨(17)(712mg)。收率为51.2%。
步骤b:在冰水浴下,将nbs(61mg,0.343mmol)分批加入到化合物17(100mg,0.342mmol)的二氯甲烷(6ml)溶液中,加完后,所得混合物在该温度下继续搅拌0.5小时。加入水(15ml),用二氯甲烷(60ml×3)萃取,合并的有机相依次用饱和碳酸氢钠溶液(20ml)和饱和食盐水(20ml)洗涤,无水硫酸钠干燥。减压蒸除溶剂,产物经柱层析纯化(200-300目硅胶,thf:二氯甲烷:石油醚=1:1:20~1:1:10洗脱),得2-溴-6-(5-氟苯并硒唑-2-基)吡啶-3-氨(18)。1hnmr(dmso-d6,400mhz)δ8.15-8.11(m,1h),7.98(d,j=8.4hz,1h),7.80(dd,j=2.4,10.0hz,1h),7.26-7.19(m,2h),6.37(s,2h)。ms(ei,m/z):369.9[m-h]-。
实施例6:3-氨基-6-(5-氟苯并硒唑-2-基)-2-甲酰胺基吡啶(19)的合成
以化合物18为起始原料,合成化合物19的实验操作按照实施例1中步骤f的方法制备(由于本批次化合物18没有经过柱层析纯化,后处理中有少许碳酸氢钠以及水没有除干净,以致在本反应中生成了化合物19)。1hnmr(dmso-d6,400mhz)δ8.16-8.12(m,1h),8.08(d,j=8.8hz,1h),7.82(dd,j=2.4,10.0hz,1h),7.76(s,1h),7.65(s,1h),7.54(s,2h),7.30(d,j=8.8hz,1h),7.26-7.21(m,1h)。ms(ei,m/z):335.0[m-h]-。
实施例7:
化合物4-(5-氟苯并硒唑-2-基)-2-甲基苯胺(20)、2-溴-4-(5-氟苯并硒唑-2-基)-6-甲基苯胺(21)、2-溴-6-氟-4-(5-氟苯并硒唑-2-基)苯胺(22)、2,6-二氟-4-(5-氟苯并硒唑-2-基)苯胺(23)和2-氟-4-(5-氟苯并硒唑-2-基)-6-甲基苯胺(24)的合成参见专利cn201610299350.1或us10005744b2。
实施例8:化合物对人胃癌细胞株ags、mkn-45和nci-n87的生长抑制作用
一、实验材料名称及来源
人胃癌细胞株ags、mkn-45和nci-n87购于中国科学院上海生命科学研究院细胞资源中心。紫杉醇、resazurin和亚甲基蓝购自sigma-aldrichco.,llc;铁氰化钾和亚铁氰化钾购自阿拉丁试剂股份有限公司;dmem培养基、1640培养基、无酚红dmem和胎牛血清购自thermofisherscientificinc;青霉素和链霉素购自碧云天生物技术有限公司。
二、实验方法
ags用dmem培养基(含10%胎牛血清,100u/ml青霉素,0.1mg/ml链霉素),mkn-45用1640培养基(含10%胎牛血清,100u/ml青霉素,0.1mg/ml链霉素),nci-n87用dmem培养基(含20%胎牛血清,100u/ml青霉素,0.1mg/ml链霉素),三株细胞分别在37℃,5%co2孵箱培养至细胞密度达90%左右。
按3×103/孔细胞数接种于96孔板中,置37℃,5%co2孵箱中培养24h。
用培养基配制不同浓度梯度的试验化合物或对照药物紫杉醇,并按100μl/孔加入96孔板中,作为试验化合物孔或对照药物孔;按100μl/孔加入不含试验化合物或对照药物的培养基,做为阴性对照孔。置37℃,5%co2孵箱中,ags和mkn-45细胞培养72h,nci-n87细胞培养120h。
将resazurin(15mg/50ml,200×)、亚甲基蓝(25mg/10ml,1000×)、铁氰化钾(0.329g/100ml,100×)和亚铁氰化钾(0.422g/100ml,100×)溶于pbs(0.1m,ph=7.4)中,配制出10×alamarblue溶液,再用无酚红dmem培养基稀释成1×alamarblue溶液,临用前配制。
96孔板中的细胞用pbs(0.1m,ph=7.4)小心清洗2次,并吸尽pbs,再按100μl/孔加入1×alamarblue溶液;在无细胞的孔中加入100μl1×alamarblue溶液,做为空白对照孔。将96孔板置37℃,5%co2孵箱中培养3h。
用酶标仪victorx4(perkinelmer)在ex530/em590nm处检测细胞荧光值。试验化合物孔的荧光值以f(试验化合物)表示;空白对照孔的荧光值以f(空白对照)表示;阴性对照孔的荧光值以f(阴性对照)表示。按以下公式计算不同药物浓度下的细胞存活率,每个浓度设置3个重复孔,得出平均值和标准偏差。
利用prismgraph软件根据细胞存活率分别计算出试验化合物或对照药物对细胞的半数抑制浓度(ic50)。
三、实验结果
试验结果如表1所示,化合物对人胃癌细胞株ags、mkn-45和nci-n87的生长均有明显地抑制作用。其中化合物6、9、12、19、22和23的抑制效果较优。
表1.试验化合物对人胃癌细胞株ags、mkn-45和nci-n87的半数抑制浓度(ic50,nm)
实施例9:化合物6、22和23对人胃癌ags和mkn-45裸鼠异种移植瘤的生长抑制活性研究
一、试验材料
1.试验动物
spf级balb/c裸小鼠,雌性,开始给药时为6-8周龄,体重为18-20g。由常州卡文斯实验动物有限公司提供(实验动物生产许可证:scxk(苏)2016-0010;实验动物使用许可证:syxk(苏)2017-0007)。所购动物批号:201820473。
2.试验试剂
聚乙二醇400(peg400),批号为20180412,购自成都市科龙化工试剂厂;氯化钠注射液(生理盐水),批号为a17111105,购自河北天成药业股份有限公司;dmso,批号为q6949,购自mpbiomedicals。
3.细胞株
人胃癌ags和mkn-45细胞购自中国科学院上海生命科学研究院细胞资源中心;ags于10%胎牛血清的1640培养基中培养,mkn-45于含10%胎牛血清的dmem培养基中培养。
二、试验方法
1.受试化合物
低剂量组(给药剂量:2.5mg/kg):给药前精确称取2.0mg受试化合物,用静脉注射用溶剂(peg40025%,dmso2.5%,生理盐水72.5%)溶解成8ml的澄清溶液,低剂量组受试化合物的静脉注射溶液终浓度为0.25mg/ml,静脉注射给药体积为0.2ml/20g体重。
高剂量组(给药剂量:5.0mg/kg):给药前精确称取4.0mg受试化合物,用静脉注射用溶媒(peg40050%,dmso5%,生理盐水45%)溶解至8ml的澄清溶液,高剂量组受试化合物的静脉注射溶液终浓度为0.50mg/ml,静脉注射给药体积为0.2ml/20g体重。
2.试验分组与给药方式
取对数生长期的ags和mkn-45细胞,在无菌条件下,分别接种于各60只裸小鼠右侧腋窝皮下,细胞接种量为5×106个/只。用游标卡尺测量移植瘤直径,待肿瘤生长至100mm3左右时,分别挑选生长状态良好且肿瘤大小均一性较好的ags和mkn-45荷瘤裸鼠各56只,随机分成7组,每组8只,即模型组,化合物6、22和23低剂量组及高剂量组。各组均静脉注射给药,分别于0、1、2、3、4天每天连续给药一次,共给药5天,模型组给予等容体积的溶媒对照。用测量瘤径的方法,动态观察受试化合物的抗肿瘤效应。每两天测量一次肿瘤直径,同时称重。第20天时各组脱颈处死裸鼠,手术剥取并准确称重瘤块。
肿瘤体积(tumorvolume,tv)的计算公式为:
其中a、b分别表示长、宽。
抑瘤率%的计算公式为:
三、试验结果
试验结果如表2、表3、图1至图6所示,受试化合物6、22和23在分别连续5天以2.5mg/kg和5.0mg/kg的给药剂量尾静脉注射后,可显著地抑制胃癌细胞ags和mkn-45裸鼠移植瘤的肿瘤生长。
表2化合物对人胃癌细胞株ags裸鼠异种移植肿瘤生长的抑制作用(mean±sd,n=8)
表3化合物对人胃癌细胞株mnk-45裸鼠异种移植肿瘤生长的抑制作用(mean±sd,n=8)
- 还没有人留言评论。精彩留言会获得点赞!