确定马铃薯StALDH基因甲基化位点变化在低温胁迫中作用的方法与流程
本发明涉及基因工程
技术领域:
,具体涉及一种确定马铃薯staldh基因甲基化位点变化在低温胁迫中作用的方法。
背景技术:
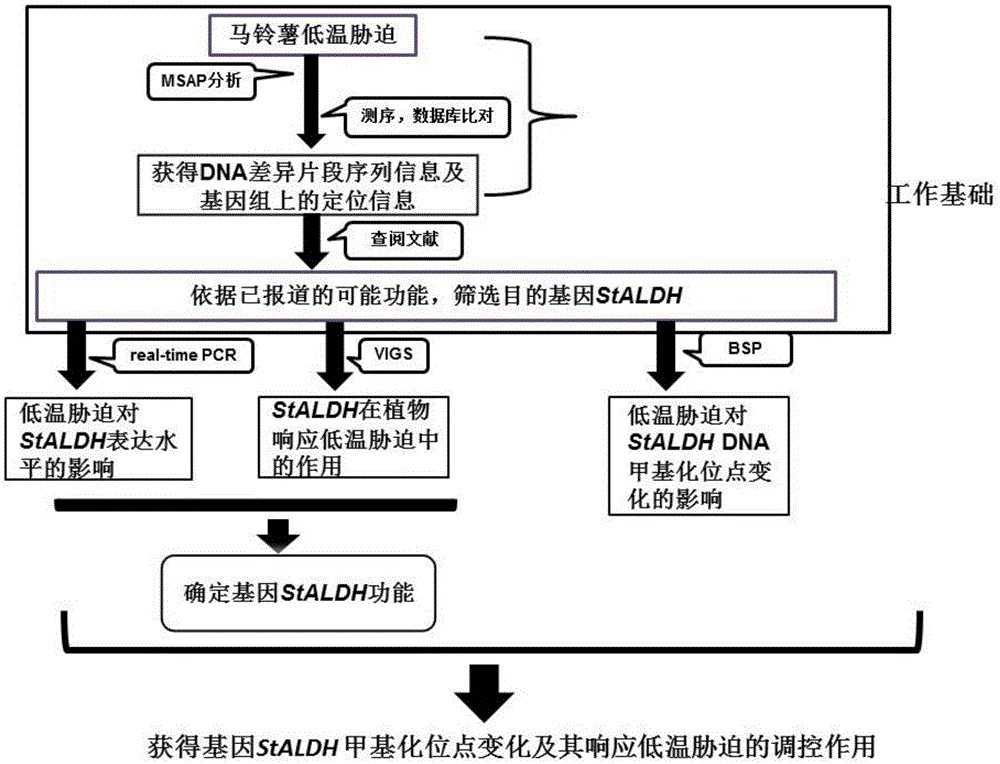
:马铃薯是世界第三大重要农作物,仅次于小麦和水稻。在人口增长、耕地面积减少、水资源不足的影响下,我国食物安全存在着潜在危机。马铃薯产业的不断发展,将对缓解我国食物安全压力起到重要作用。我国是马铃薯生产大国,面积占世界马铃薯种植面积的1/4,产量占1/5,在世界举足轻重。内蒙古自治区是我国马铃薯生产的大区,由于其特有的气候条件,目前已经成为马铃薯种薯及商品薯繁育的主产区。低温胁迫是限制马铃薯生产过程中经常遇到的灾害,常常会引起马铃薯大面积减产,严重制约了马铃薯的丰产增收。在内蒙古自治区低温天气经常发生于早春和晚秋,马铃薯遭受低温危害的报道屡见不鲜,轻者影响当年马铃薯产量和品质,重者甚至导致马铃薯绝产。遭受低温危害的马铃薯更容易受到病虫害的侵染,导致二次减产,对当地马铃薯产业和薯农损失严重。怎样提高马铃薯对低温的耐受性,已成为关系到马铃薯能否正常生产的关键问题之一。目前,对马铃薯耐受低温研究大都利用耐受低温材料进行研究,但这样的耐受低温材料资源相对狭窄,因此,限制了马铃薯耐受低温基因的挖掘及培养耐受低温品种。表观遗传修饰主要是研究dna序列不发生改变的可遗传的基因表达调控。研究表明,表观遗传修饰在生物生长发育和逆境胁迫反应过程中起着极其重要的作用。生物的表观遗传修饰主要包括dna甲基化修饰、组蛋白修饰、非编码rna的调控作用等方面。近年来,有关表观遗传学的研究愈来愈成为基因表达调控研究的热点之一。dna甲基化是表观遗传的重要修饰之一,是广泛存在于真核生物中的一种表观遗传修饰,即在逆境、发育等过程中,虽然核苷酸序列没有发生变化,但基因表达调控发生了变化,通过对基因甲基化或去甲基化来调控基因表达进而响应逆境胁迫。目前,通过dna甲基化修饰研究植物响应逆境胁迫的研究大都仅限于逆境胁迫后基因组dna水平甲基化状态的变化研究,但dna甲基化修饰如何调控植物响应逆境胁迫的分子机制尚不清楚。我们前期的研究发现,低温处理下马铃薯乙醛脱氢酶(aldehydedehydrogenase,aldh)基因甲基化水平增加。aldh酶作为随机组合的四聚体酶,广泛存在于原核生物和真核生物能量代谢旺盛的器官中,在辅酶ⅰ烟酰胺腺嘌呤二核苷酸(nad+)的参与下对外源性或内源性乙醛、4-羟壬烯醛(4-hydroxynonenal,4-hne)等醛类物质的脱氢氧化代谢发挥重要作用。aldh是植物非正常呼吸链的重要水解酶,对乙醛代谢有显著的调控作用,是植物对逆境胁迫的一种代谢性调节。植物在遭受低温胁迫时,活性氧物质(ros)在细胞内大量积累,打破平衡状态,从而造成氧化胁迫,活性氧物质直接损伤蛋白质、氨基酸和核酸,使细胞结构和功能受到破坏,导致膜过氧化和脱脂化,从而产生一些如醛类、羟类和酮类等高活性的有毒化学物质,最终导致细胞衰亡。而aldh可催化醛类物质氧化成羧酸,清除有毒的醛类并减少脂类的过氧化反应,提高植物抗寒性。但到目前为止,鲜有报道马铃薯在低温胁迫下aldh基因甲基化位点如何变化,以及该基因甲基化水平变化后基因表达水平发生了怎样的变化,甲基化变化如何响应低温胁迫及基因甲基化水平变化后对低温胁迫的耐受性如何,这些问题都没有进行深入的研究。技术实现要素:针对现有技术中的缺陷,本发明目的在于提供一种确定马铃薯staldh基因甲基化位点变化在低温胁迫中作用的方法,包括低温胁迫下staldh基因dna甲基化位点变化分析、低温胁迫下staldh基因表达量水平分析和nbaldh在植物发育及响应低温胁迫中功能分析的步骤。低温胁迫下staldh基因dna甲基化位点变化分析依次包括马铃薯基因组dna提取、基因组dna纯化、基因组dna的亚硫酸盐处理、基因扩增纯化、基因连接转化、阳性克隆子鉴定筛选和重组载体测序分析的步骤。,马铃薯的品种是大西洋,基因连接转化采用的载体为pgm-t。本发明中,提取4℃低温处理0h、48h、60h的“大西洋”马铃薯基因组dna,并对上述样品通过亚硫酸盐转化试剂盒进行dna亚硫酸盐转化处理,未发生甲基化的胞嘧啶(c)转变为尿嘧啶(u),而发生甲基化的胞嘧啶(c)不变。得到四类待测样品:低温未处理-亚硫酸盐未转化(original)、低温未处理-亚硫酸盐转化(original-bst)、低温处理48h-亚硫酸盐转化(48h-bst)、低温处理60h-亚硫酸盐转化(60h-bst)。以上述样品为模板,利用特异性引物将staldh基因克隆到t载体中,通过测序结果比较低温处理前后基因的甲基化变化情况。低温胁迫下staldh基因表达量水平分析依次包括马铃薯幼苗总rna的提取、cdna的合成和real-timepcr分析的步骤。优选地,马铃薯的品种是大西洋。本发明中,采用licl法提取4℃处理0h、48h、60h的在ms固体培养基培养20天生理状态一致的国内马铃薯主栽品种“大西洋”幼苗的总rna,反转录成cdna,选择ef1a作为内参基因,利用real-timepcr分析低温胁迫前后staldh基因表达水平的变化。nbaldh在植物发育及响应低温胁迫中功能分析依次包括本生烟草nbaldh基因的pcr扩增、pyy13表达载体线性化、无缝拼接获得重组载体、工程农杆菌获取、注射烟草、vigs植物表型观察、vigs植物基因表达分析、vigs植物光合效率测定和vigs植物耐寒性评价的步骤。优选地,无缝拼接获得重组载体具体包括:将peasy-uniseamlesscloningandassemblykit连接到ptrv2衍生的载体pyy13上,然后转化大肠杆菌top10感受态,复苏和涂板,获得重组载体nbaldh-top10。工程农杆菌获取是将重组载体nbaldh-top10通过三亲融合的方法导入农杆菌gv3101中。本发明采用亚硫酸氢盐处理后测序技术(bisulfitesequencingpcrbsp)技术研究分析马铃薯低温胁迫下staldh基因甲基化位点变化情况;并通过real-timepcr技术分析其在低温处理下表达模式;利用vigs(virusinducedgenesilencing,vigs)技术在本生烟草(nicotianabenthamiana)中对这些基因进行基因沉默,确定目的基因在马铃薯响应低温胁迫中的功能。目前,对马铃薯耐受低温研究大都利用耐受低温材料进行研究,这样的耐受低温材料资源相对狭窄,限制了马铃薯耐受低温基因的挖掘及培养耐受低温品种。本发明从表观遗传学领域研究马铃薯响应低温胁迫机理、筛选分离响应低温胁迫相关基因及其甲基化位点变化,进而培育耐冷抗冻马铃薯品种,可抵御骤然低温对马铃薯生产造成的不良影响,拓宽了马铃薯耐受低温胁迫的研究,对保障我国马铃薯高产稳收,有着非常重要的理论基础与现实指导意义;同时,对dna甲基化修饰在其它植物响应逆境胁迫中的作用研究提供理论参考。本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。附图说明图1为本发明实施例中提供的确定马铃薯staldh基因甲基化位点变化在低温胁迫中作用的方法示意图;图2为本发明实施例中低温处理下staldh基因甲基化位点变化分析图;图3为本发明实施例中低温处理下staldh基因表达水平realtime-pcr分析图;图4为本发明实施例中staldh基因vigs植物表型图;图5为本发明实施例中nbaldhvigs植物基因表达水平分析图;图6为本发明实施例中nbaldh基因vigs后光合效率分析图;图7为本发明实施例中nbaldh基因vigs后耐低温分析图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。以下实施例仅用于更加清楚地说明本发明的技术方案,因此只是作为示例,而不能以此来限制本发明的保护范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,数据为三次重复实验的平均值或平均值±标准差。实施例本实施例中提供一种确定马铃薯staldh基因甲基化位点变化在低温胁迫中作用的方法(如图1所示),具体步骤如下。(一)低温胁迫下staldh基因dna甲基化位点变化分析提取4℃低温处理0h、48h、60h的“大西洋”基因组dna,并对上述样品通过亚硫酸盐转化试剂盒进行dna亚硫酸盐转化处理,未发生甲基化的胞嘧啶(c)转变为尿嘧啶(u),而发生甲基化的胞嘧啶(c)不变。得到四类待测样品:a低温未处理-亚硫酸盐未转化(original)、b低温未处理-亚硫酸盐转化(original-bst)、c低温处理48h-亚硫酸盐转化(48h-bst)、d低温处理60h-亚硫酸盐转化(60h-bst)。以上述样品为模板,利用特异性引物将staldh基因克隆到t载体中,通过测序结果比较低温处理前后基因的甲基化变化情况。具体方法包括:1、基因组dna提取,采用sds提取方法。2、基因组dna纯化,具体方法参照用天根生化(北京)科技有限公司的普通dna产物纯化试剂盒。3、基因组dna的亚硫酸盐处理,方法参照用qiagendna亚硫酸盐转化试剂盒(目录号:ep210)方法。4、基因扩增纯化以original、original-bst、48h-bst、60h-bst的基因组dna为模板进行pcr预扩增,pcr程序为:95℃预变性5min;94℃变性30s,55℃退火30s,72℃复性40s,40cycles;72℃延伸5min,12℃forever。pcr产物经1.5%琼脂糖凝胶电泳检测,采用天根生化(北京)科技有限公司开发的大量琼脂糖凝胶dna回收试剂盒将目标片段割胶纯化。5、基因连接转化采用天根生化(北京)科技有限公司的pgm-t作为载体,按照试剂盒中的产品说明操作,酶连仪中16℃过夜连接。将酶连产物转化大肠杆菌db3.1感受态,过程如下:(1)冰上融化感受态细胞db3.1;(2)每100μl感受态细胞加5μl酶连产物,轻轻混匀,冰浴30min;(3)42℃热激90s,冰浴2min;(4)加入400μl无抗lb液体培养基,37℃180rpm培养1h;(5)于含氨苄抗性的lb固体培养基平板上进行涂板,37℃倒置培养12~16h,直至长出单菌落。6、阳性克隆子鉴定筛选挑取生长良好的单菌落,接种于2ml含氨苄抗性的lb液体培养基中,37℃180rpm培养12~16h。采用天根生化(北京)科技有限公司的的质粒小提试剂盒进行质粒提取。采用采用ecori单酶切鉴定重组质粒,37℃过夜酶切。7、重组载体测序分析酶切法鉴定阳性的菌落挑取质粒送上海捷瑞生物有限公司进行测序,用生物信息学软件对测序结果进行分析。通过测序结果分析,staldh基因dna差异片段区域甲基化水平变化,发现staldh在该区域有3处碱基位点甲基化发生改变(1处碱基位点为c-c-t-t,2处碱基位点为c-t-c-c),如图2所示。说明低温胁迫诱导staldh基因1处位点去甲基化,2处位点甲基化。推测可能这几个位点甲基化变化响应了低温胁迫。(二)低温胁迫下staldh基因表达量水平采用licl法提取4℃处理0h、48h、60h的在ms固体培养基培养20天生理状态一致的国内马铃薯主栽品种“大西洋”幼苗的总rna,反转录成cdna,选择ef1a作为内参基因,利用real-timepcr分析低温胁迫前后staldh基因表达水平的变化。具体包括:1、总rna提取(1)称取0.1g“大西洋”马铃薯幼苗组织于液氮预冷的研钵中,研磨直至粉末状;(2)1.5mlep管中加700μl提取buffer、70μl10%sds和30μlβ-巯基乙醇;(3)样品加至上述1.5mlep管中,上下颠倒混匀,65℃水浴15min;(4)冰上冷却,4℃,12000rpm离心15min;(5)取上清约600μl,加200μlkac,上下颠倒混匀,冰浴30min;(6)4℃,12000rpm离心15min;(7)取500μl上清,加1/2体积的预冷的无水乙醇和0.8倍体积的5mlicl,置于-20℃冰箱过夜沉淀;(8)4℃,12000rpm离心20min;(9)去上清,加入1ml预冷的75%乙醇,4℃,12000rpm离心2min,重复洗涤3次,室温干燥10min;(10)取20μldepc处理的重蒸水回溶,置于-80℃保存备用;(11)用nanodrop2000紫外可见分光光度计测定rna浓度和纯度,甲醛变性琼脂糖凝胶电泳检测rna质量。2、cdna的合成以提取的“大西洋”幼苗组织rna为模板,采用全式金生物公司开发的transscriptone-stepgdnaremovalandcdnasynthesissupermix反转录cdna,具体方法见试剂盒。3、real-timepcr分析将cdna稀释到150ng·μl-1,以ef1-α为内参基因进行普通pcr,扩增产物经1.5%琼脂糖凝胶电泳检测,以确定cdna质量。以基因特异引物组合,使用takara公司的premixextaqtmii进行实时荧光定量pcr,程序采用两步法:95℃30s;95℃5s,65℃34s,40cycles;95℃15s;60℃1min;95℃15s。通过real-timepcr分析发现,staldh基因低温胁迫下表达水平下调,具体见图4,推测其可能由于基因甲基化水平增加,导致基因表达量下降,该结果与基因甲基化水平分析结果相互印证。(三)nbaldh在植物发育及响应低温胁迫中功能分析1、目的基因的pcr扩增以本生烟草cdna文库为模板扩增nbaldh基因,pcr产物经1%琼脂糖凝胶电泳检测,按照天根生化(北京)科技有限公司开发的琼脂糖凝胶回收试剂盒中的产品说明操作,将目标片段割胶纯化。2、pyy13表达载体线性化用限制性内切酶psti对pyy13表达载体进行线性化,37℃过夜酶切,产物纯化。3、无缝拼接获得重组载体上述纯化的pcr产物通过全式金生物公司开发的peasy-uniseamlesscloningandassemblykit连接到ptrv2衍生的载体pyy13上,转化大肠杆菌top10感受态,复苏和涂板,获得重组载体nbaldh-top10。通过菌落pcr和ecori酶切鉴定阳性菌落。送上海捷瑞生物有限公司测序。用生物信息学软件对测序结果进行分析。4、获得工程农杆菌将重组载体nbaldh-top10通过三亲融合的方法导入农杆菌gv3101,即在帮助菌hb101的作用下,通过菌毛的结合作用,将大肠杆菌重组载体转入农杆菌gv3101中。具体步骤如下:(1)rif抗性(50mg·l-1)筛选农杆菌gv3101,28℃倒置培养2天;(2)kan抗性(50mg·l-1)筛选帮助菌hb101、nbaldh-top10、nbtata-top10、nbtatb-top10和nbtatc-top10,37℃过夜倒置培养;(3)1.5mlep管中加入200μl无抗lb液体培养基,分别挑取nbaldh-top10、nbtata-top10、nbtatb-top10、nbtatc-top10,再挑取hb101和gv3101,28℃孵育48h;(4)加400μl无抗lb液体培养基,取200μl稀释后菌体于kan+、rif、gent+三抗lb培养平板上筛选,28℃倒置培养2天;(5)采用冻融法进行菌落pcr,鉴定为阳性的克隆进行保菌,即获得nbaldh-gv3101。5、注射烟草(1)将nbaldh-gv3101、nbpyy13-gv3101、nbpds-gv3101和pyl192-gv3101于rif+、kan+和gent+三抗lb液体培养基中28℃180rpm过夜培养;(2)取pyl192-gv3101分别与nbaldh-gv3101、nbpyy13-gv3101、nbpds-gv3101等体积混合,4000rpm离心5min,收集菌体;(3)倒掉上清,加入等体积注射缓冲液(现配现用,见表1),轻微震荡使菌体重悬,室温静置3-4h,用不含注射针头的1ml注射器注射到本生烟草叶片内。表1vigs注射缓冲液配方试剂浓度mes(ph5.7)1.0mmgcl21.0m乙酰丁香酮(as)0.2m6、vigs植物表型观察vigs2-3周后,观察候选基因沉默后发育表型,见图3。烟草nbaldh沉默后,植物的发育表型出现变化:植物生长严重受到抑制,下部叶缘发黄且出现坏死,叶面向下卷曲呈杯状,叶脉间缺绿且叶脆易折断,植株呈横向生长,新长出的叶片卷曲,叶序也不正常,顶端优势丧失,衰老加快。nbaldhvigs植物的花器官发育也出现变化:有正常的花萼,但是雄蕊、花瓣和柱头都变短,特别是雄蕊太短而不能接触到柱头完成授粉,而对照植株长势正常。7、vigs植物基因表达分析取nbaldhvigs本生烟草和对照植株顶端叶片,进行totalrna提取,采用全式金生物公司开发的easyscriptone-stepgdnaremovalandcdnasynthesissupermix试剂盒反转录cdna。将cdna浓度统一稀释至100ng·μl-1,以此为模板与内参基因ef1a进行pcr,pcr程序为:94℃预变性5min;94℃变性30s,65℃退火30s,65℃复性20s,35cycles;72℃延伸10min,12℃forever,pcr产物经1.5%琼脂糖凝胶电泳检测,调整各模板量使灰度一致。以此模板量与目的基因进行rt-pcr,以nbpyy13为对照,分析vigs后目的基因是否被沉默,结果(见图5)显示nbaldh沉默后基因表达量均低于对照植株nbpyy13的表达量,说明目的基因被沉默。8、vigs植物光合效率测定用handypea植物效率分析仪测定植株pyy13和nbaldhvigs后光合效率,时间设定为1-300s,光源强度为3000μmol·m-2·s-1。叶片暗适应时间通常为10-30min。叶片夹在暗适应夹中,拉开暗适应夹上金属遮光片,将探头放在适应夹上相应的位置。对叶片进行暗适应后测定fv/fm值。利用fv/fm值结合origin8.6进行光和效率变化分析。结果(见图6)表明vigs植物光合效率低于对照pyy13植物。9、vigs植物耐寒性评价将nbpyy13、nbaldhvigs后本生烟草置于4℃冷冻层析柜中,其中nbpyy13组为对照,10天后观察整株植物表型和衰亡速度,以分析vigs后植物对低温胁迫敏感性。结果表明现4℃处理10天后nbpyy13vigs植株几乎无明显变化,而nbaldhvigs植株叶片下垂、明显提早变黄、枯萎、含水量降低,(见图7)说明目的基因沉默后,植物对低温胁迫敏感性增强,进一步说明nbaldh在植物应对低温胁迫中发挥重要作用。需要注意的是,除非另有说明,本申请使用的技术术语或者科学术语应当为本发明所属领域技术人员所理解的通常意义。除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对步骤、数字表达式和数值并不限制本发明的范围。在这里示出和描述的所有示例中,除非另有规定,任何具体值应被解释为仅仅是示例性的,而不是作为限制,因此,示例性实施例的其他示例可以具有不同的值。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的保护范围当中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1