一种表达天冬酰胺氨肽酶的重组毕赤酵母及其构建方法与流程
本发明涉及一种表达天冬酰胺氨肽酶的重组毕赤酵母及其构建方法,属于生物工程及基因工程技术领域。
背景技术:
天冬酰胺氨肽酶(aap)是一种可以在蛋白质及多肽n端识别并切割天冬氨酸或谷氨酸残基的外肽酶,将其应用于大豆蛋白水解液中,可以使肽链末端的天冬氨酸或谷氨酸呈游离状态,提高水解液的水解度。同时天冬氨酸和谷氨酸是鲜味氨基酸,可以有效缓解水解液的苦味,起到抑苦增鲜的作用,在食品中大豆蛋白水解液的脱苦具有重要应用价值,一直受到关注。
米曲霉是一种广泛用于生产的发酵工业菌,但由于其产生的蛋白酶种类繁多,分离纯化步骤繁琐,很难满足市场的需求。
毕赤酵母表达系统目前被广泛应用于表达外源蛋白,其生长速度快,表达量高,外源基因可稳定整合至酵母染色体上,能够对蛋白进行折叠和翻译后修饰,使表达的蛋白具有活性,同时将表达的蛋白分泌至胞外便于分离纯化。
目前对天冬酰胺氨肽酶的研究报道极少,因此,提供一种制备天冬酰胺氨肽酶的方法,对于其在工业上的进一步应用有重要的价值。
技术实现要素:
本发明的第一个目的是提供一种重组毕赤酵母,其表达氨基酸序列如seqidno.1所示的天冬酰胺氨肽酶。
在本发明的一种实施方式中,所述重组毕赤酵母含有如seqidno.2所示的编码所述天冬酰胺氨肽酶的基因。
在本发明的一种实施方式中,所述重组毕赤酵母的宿主包括毕赤酵母gs115;重组毕赤酵母的表达载体包括ppic9k。
本发明的第二个目的是提供上述重组毕赤酵母的构建方法,主要包括以下步骤:
(1)设计引物pcr扩增天冬酰胺氨肽酶基因;
(2)将pcr产物连接到表达载体上,获得重组质粒;
(3)将重组质粒转化至毕赤酵母中表达。
在本发明的一种实施方式中,所述转化包括电击转化法。
本发明的第三个目的是提供上述重组毕赤酵母在天冬酰胺氨肽酶生产中的应用。
在本发明的一种实施方式中,所述应用主要包括以下步骤:
(1)挑取ypd平板上活化的重组毕赤酵母单菌落接种于bmgy培养基中培养;
(2)将(1)中得到的培养液离心,收集沉淀,将沉淀重溶于bmmy培养基中培养,同时进行诱导表达;
(3)将获得的发酵液离心收集上清,即为天冬酰胺氨肽酶胞外粗酶液。
在本发明的一种实施方式中,步骤(1)中的培养具体包括在28-32℃、200-220rpm条件下培养18-22h。
在本发明的一种实施方式中,在本发明的一种实施方式中,步骤(2)具体包括将(1)中得到的培养液离心,收集沉淀,将沉淀重溶于bmmy培养基中,在28-32℃、200-220rpm条件下培养90-100h,每隔24h向培养液中添加体积分数为1-1.5%的甲醇溶液。
在本发明的一种实施方式中,所述bmmy培养基ph为6.0-7.0,装液量为12-15%,添加了6-9g/l的山梨醇。
本发明首次在毕赤酵母中成功表达了来自米曲霉的天冬酰胺氨肽酶基因,经过摇瓶初步优化后发酵液上清中的酶活可达33.5u/ml。本发明方法简单有效,构建的重组毕赤酵母能够高效表达天冬酰氨肽酶,且得到的重组蛋白包含组氨酸标签,利于后期重组蛋白的纯化及为进一步研究天冬酰胺氨肽酶的特性、结构等提供所需蛋白。
附图说明
图1:诱导时间对重组毕赤酵母表达的影响。
图2:甲醇浓度对重组毕赤酵母表达的影响。
图3:ph对重组毕赤酵母表达的影响。
图4:诱导温度对重组毕赤酵母表达的影响。
图5:装液量对重组毕赤酵母表达的影响。
图6:山梨醇的添加量对重组毕赤酵母表达的影响。
具体实施方式
(一)所用培养基:
lb培养基(g/l):酵母粉5,蛋白胨10,氯化钠10,固体培养基中添加20的琼脂粉。
ypd培养基(g/l):酵母粉10,蛋白胨20,葡萄糖20,固体培养基中添加20的琼脂粉。
md培养基(g/l):葡萄糖20,ynb13.4,生物素0.4,琼脂粉20。
bmgy培养基(g/l):酵母粉10,蛋白胨20,ynb13.4,生物素0.4,甘油10,每100ml培养基中添加10ml的1mol/lph6.0的磷酸钾缓冲液。
bmmy培养基(g/l):酵母粉10,蛋白胨20,ynb13.4,生物素0.4,甘油10,每100ml培养基中添加10ml的1mol/lph6.0的磷酸钾缓冲液,甲醇的添加量根据具体情况而定。
ypd-g418高拷贝筛选平板:添加终浓度分别为1、2、3、4mg/ml的g418于ypd固体培养基中。
(二)t4dna连接酶、限制性核酸内切酶sacⅰ、ecorⅰ、notⅰ购自宝生物工程(大连)有限公司。
(三)天冬酰胺氨肽酶酶活的测定:
将20μl含天冬酰胺氨肽酶的发酵液和160μlph8.0的tris-hcl缓冲液混匀,50℃预热2min,再加入20μl10mmol/l的asp-pna溶液,50℃水浴反应10min。反应结束后立即加入200μl40%的乙酸终止反应,在405nm处测定吸光值。
酶活的定义:在一定ph,温度为50℃条件下,每分钟水解天冬酰胺(asp-pna)生成1μg对硝基苯胺(pna)所用的酶量定义为1个酶活力单位,用u表示。
酶活计算公式为:u=(n×20×138.12×a)/10
式中,u表示酶活,u/ml;n表示酶液的稀释倍数;20表示反应总体系对酶液的稀释倍数;138.12表示pna的相对分子质量;a表示根据酶活反应测得的a405nm的值,查标准曲线得到的pna的浓度,mmol/l;10表示反应时间,min。
(四)重组天冬酰胺氨肽酶的纯化:
收集实施例1中得到的重组毕赤酵母发酵液,离心取上清,将其置于透析袋中4℃透析过夜。使用akta蛋白纯化仪,利用histriphpcrude进行蛋白的分离纯化,柱纯化条件如下:用8倍柱体积的缓冲液a(0.5mol/l氯化钠,0.02mol/l磷酸钠,0.02mol/l咪唑,ph=7.4)平衡柱子,设置流速为1ml/min进行上样;上样结束后,用8倍柱体积的缓冲液a平衡柱子;同时以0-100%的缓冲液b(0.5mol/l氯化钠,0.02mol/l磷酸钠,0.5mol/l咪唑,ph=7.4)以1ml/min的流速进行线性洗脱。
实施例1表达天冬酰胺氨肽酶的重组毕赤酵母的构建
为实现天冬酰胺氨肽酶基因在毕赤酵母中的表达,具体实施方法步骤如下:
(1)天冬酰胺氨肽酶基因的扩增
根据ncbi上公开的米曲霉rib40的天冬酰胺氨肽酶基因序列(ncbi编号:xm_001818318),设计一对引物,引物设计如下:
上游引物f:5’-ccggaattcatgacttcgaaaatcgccc-3’(下划线表示ecorⅰ酶切位点);下游引物r:5’-atttgcggccgctcagtggtggtggtggtggtggtaacaaagattgtctttgac-3’(下划线表示notⅰ酶切位点,加粗的碱基表示6×his标签)。
以米曲霉cgmccno.758cdna模板,利用pcr,得到带组氨酸标签的天冬酰胺氨肽酶基因片段,pcr体系如下:
pcr体系为(50μl):extaq酶0.3μl,10×extaqbuffer5μl,dntpmix4μl,上游引物f0.2μl,下游引物r0.2μl,cdna5μl,ddh2o36.3μl。pcr条件为:95℃预变性5min;95℃变性30s,60℃退火2min,72℃延伸30s;25℃保温5min;30个循环。
pcr产物用sds-page验证,结果表明扩增成功。
(2)重组表达载体的构建
将扩增获得的目的基因片段与质粒ppic9k用ecorⅰ和notⅰ双酶切,双酶切体系如下:
双酶切体系(50μl)体系:目的基因或质粒30μl,限制性核酸内切酶各0.5μl,ddh2o14μl,dntpmix5μl。37℃水浴保温2h,琼脂糖凝胶电泳15min后,胶回收目的条带。
将双酶切后的目的基因片段和表达载体片段按照摩尔比为2:3的比例用t4dnaligase进行体外连接,16℃连接过夜,然后转化至e.colijm109中。提取菌落pcr验证为阳性菌株的质粒进行双酶切验证,验证正确的进行测序验证,测序正确的即为重组表达载体ppic9k/aap。
(3)重组毕赤酵母的构建
将重组质粒用sacⅰ线性化,纯化回收后,1500v,5ms电击转化至毕赤酵母gs115感受态细胞中,将转化后的菌液涂布于md平板培养基上,30℃培养2-3天。挑取md平板上长出的单菌落至ypd-g418梯度抗性平板上,挑取5个在4mg/mlg418浓度的ypd平板上长出的单菌落进行摇瓶发酵。
实施例2:对重组毕赤酵母的发酵优化
对实施例1中得到的重组毕赤酵母的发酵方法进行摇瓶水平上的单因素优化,每个实验组设置三个平行,结果取平均值。具体优化条件如下:
(1)起始诱导时间
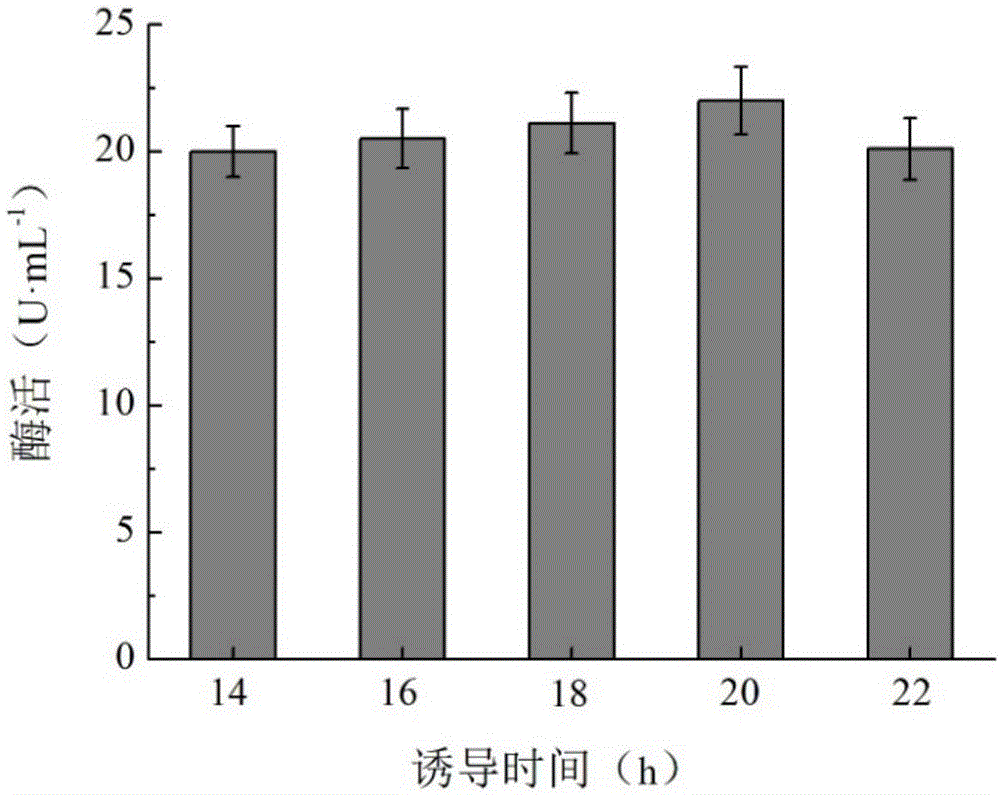
将实施例1中得到的重组毕赤酵母接种于bmgy培养基中,分别在菌体生长14、16、18、20h后转接至bmmy培养基中进行诱导,用体积分数为1%的甲醇进行诱导表达,同时取少量样品测定酶活力。结果如图1所示,菌体生长20h时将菌体从bmgy培养基中转移至bmmy培养基中进行诱导表达,酶的活力最高,为22.0u/ml,此时细胞的活力较大同时具有足够的菌体浓度,最有利于表达。因此,20h为最佳起始诱导时间。
(2)诱导甲醇浓度
将实施例1中得到的重组毕赤酵母接种于bmgy培养基中,在菌体生长20h后,转接至bmmy培养基中,每隔24h添加体积分数分别为0.5%、1%、1.5%、2%的甲醇进行诱导表达,同时取少量样品测定酶活力。结果如图2所示,重组天冬酰胺氨肽酶的酶活随甲醇浓度的升高先增大后减小。甲醇添加量为0.5%和1%时的酶活较低,可能是因为大部分甲醇被用于菌体生长;当甲醇添加量为2%时,酶活也较低,可能由于甲醇浓度太高,对菌体产生了毒害作用,从而使表达量降低;当甲醇添加量为1.5%时,诱导96h后,表达量最高,约为23.1u/ml。
(3)诱导起始ph
将实施例1中得到的重组毕赤酵母接种于bmgy培养基中,在菌体生长20h后,将菌体转接至ph分别为5.0、6.0、7.0、8.0的bmmy培养基中,每隔24h添加体积分数1.5%的甲醇进行诱导表达,同时取少量样品测定酶活力。结果如图3所示,诱导起始ph对对重组毕赤酵母的表达影响较大,ph为5和8时,整体酶活较低,ph为6和7时有利于毕赤酵母的表达。当起始ph为7.0时,诱导96h后,酶活最高,为24.6u/ml。
(4)诱导温度
将实施例1中得到的重组毕赤酵母接种于bmgy培养基中,在菌体生长20h后,将菌体转接至ph为7.0的bmmy培养基后,分别在23、26、30℃的条件下,每隔24h添加体积分数1.5%的甲醇进行诱导表达,同时取少量样品测定酶活力。结果如图4所示,重组天冬酰胺氨肽酶的酶活整体上随温度的上升而增加,可能是因为随着温度的升高,有利于毕赤酵母的生长,菌体密度较大,有利于天冬酰胺氨肽酶的表达,当温度为30℃时,诱导96h后,酶活达到最高,为26.3u/ml。
(5)装液量
将实施例1中得到的重组毕赤酵母接种于bmgy培养基中,在菌体生长20h后,将菌体转接至ph为7.0的装液量分别为10%、15%、20%bmmy培养基后,在30℃的条件下,每隔24h添加体积分数1.5%的甲醇进行诱导表达,同时取少量样品测定酶活力。结果如图5所示,装液量对酶活的影响较为显著,当装液量为15%时,诱导96h后,酶活达到最高,为28.9u/ml,此时的溶氧效果最好,满足了毕赤酵母发酵过程中对氧气的需求。
(6)山梨醇浓度
将实施例1中得到的重组毕赤酵母接种于bmgy培养基中,在菌体生长20h后,将菌体转接至ph为7.0装液量为15%的bmmy培养基后,向bmmy培养基中分别添加3、6、9、12g/l的山梨醇,在30℃的条件下,每隔24h添加体积分数1.5%的甲醇进行诱导表达,同时取少量样品测定诱导96h后的酶活力。结果如图6所示,适宜浓度的山梨醇可以促进重组毕赤酵母的表达,当山梨醇添加量为9g/l时酶活达到最高,为33.5u/ml。但过高的山梨醇反而会抑制重组天冬酰胺氨肽酶的表达,可能是山梨醇导致渗透压过高,阻碍了毕赤酵母表达外源蛋白。
对比例:米曲霉来源的其他氨肽酶在毕赤酵母中的表达情况
根据米曲霉rib40基因组dna序列,设计引物,以米曲霉cgmccno.758cdna模板,pcr扩增得到米曲霉来源的氨肽酶y基因(ncbi:xm_001727123.1),其余条件同实施例1。
根据米曲霉rib40基因组dna序列,设计引物,以米曲霉cgmccno.758cdna模板,pcr扩增得到米曲霉来源的氨肽酶c基因(ncbi:xm_001824930.1),其余条件同实施例1。
根据米曲霉rib40基因组dna序列,设计引物,以米曲霉cgmccno.758cdna模板,pcr扩增得到米曲霉来源的亮氨酸氨肽酶基因(ncbi:xm_001819493.2),其余条件同实施例1。
结果发现,米曲霉cgmccno.758来源的氨肽酶y、氨肽酶c、亮氨酸氨肽酶在毕赤酵母中都几乎不表达。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种表达天冬酰胺氨肽酶的重组毕赤酵母及其构建方法
<160>2
<170>patentinversion3.3
<210>1
<211>498
<212>prt
<213>aspergillusoryzae
<400>1
metthrserlysilealaglnasnleulysglnproalaleuaspphe
151015
leuserphevalasnalaserprothrprophehisalavalglnser
202530
alalysgluleuleuserlysalaglypheglngluilelysglulys
354045
aspsertrpserserthrcysargproglyglylystyrtyrleuthr
505560
argasnserserthrilevalalaphealaileglylyslystrplys
65707580
proglyasnproilesermetileglyalahisthraspserproval
859095
leuargilelysprovalserasnlysargglygluglyphevalgln
100105110
valglyvalgluthrtyrglyglyglyiletrphisthrtrppheasp
115120125
argaspleuglyvalalaglyargalametvalargthrglyaspgly
130135140
serilevalglnlysleuvallysileaspargproileleuargile
145150155160
prothrleualailehisleuaspargglngluthrphealapheasn
165170175
lysgluthrglnleupheproilealaglyleuvalalaalagluleu
180185190
asnargthralaaspserthralathrglyglulysthralaalaasn
195200205
asngluthrglulysglyaspphealaproleulysservalthrglu
210215220
arghishisprotyrleuvalgluleuilealaalaglualaglyval
225230235240
lysproaspaspileleuasppheglumetileleupheaspthrgln
245250255
lyssercysleuglyglyleuleuglugluphevalpheserproarg
260265270
leuaspasnleuasnserserphecysalathrvalglyleuileasp
275280285
servalalaaspalaseralaleuaspaspgluproserileargleu
290295300
ilealaleupheasphisglugluileglyserargthralaglngly
305310315320
alaaspserasnvalleuproalaileileargargleuservalleu
325330335
proserserthrserglyasngluaspleualathralaphegluglu
340345350
thrleuserthrserpheleuleuseralaaspmetalahisalaval
355360365
hisproasntyralaalalystyrgluasnasphisargprogluile
370375380
asnlysglyprovalilelysileasnalaasnalaargtyralathr
385390395400
asnserproglyilevalleuleuglngluvalalaarglysalaala
405410415
gluaspglyglygluglyvalproleuglnleuphevalvalargasn
420425430
aspsersercysglyserthrileglyprometleuseralaalaleu
435440445
glyalaargthrleuaspleuglyasnproglnleusermethisser
450455460
ilearggluthrglyglythrtyraspvalglyhisserileargleu
465470475480
phethrserphephelyshistyrserasnthrserlysthrilephe
485490495
valasp
<210>2
<211>1497
<212>dna
<213>aspergillusoryzae
<400>2
atgacttcgaaaatcgcccaaaatttgaagcagccggctctggacttcttgtcctttgtc60
aatgcttcccccactcccttccacgctgtccaatcggcaaaggaacttctgtcaaaggct120
ggcttccaggagatcaaggagaaagattcttggtcctccacttgtcgtcccggtggaaag180
tattacctgacccgtaatagctcaaccattgtggctttcgctatcggcaagaaatggaag240
cctggaaacccgatatctatgatcggtgcccacacggactctcccgtgttgaggatcaag300
cctgtcagcaacaagcgcggcgaaggcttcgttcaagttggcgtggagacctacggtggc360
ggcatttggcacacctggttcgaccgtgacttgggtgtcgcaggccgggctatggtacgg420
accggtgacggctccattgtgcagaagttggtcaagatcgaccggccgattctccgaatc480
ccgaccttggctatccaccttgatcgccaggagacttttgctttcaataaggagacccaa540
ttgttccctatcgcaggccttgtcgctgctgagctgaaccgcactgctgattctactgca600
actggcgaaaagaccgcggcaaacaacgaaacggagaaaggagactttgctccactaaaa660
tcagtaaccgagcgtcatcacccctacttggtggagcttattgctgccgaagcaggagtt720
aagccggacgacatcttggactttgagatgatcttgttcgacactcagaagtcttgcctt780
ggtggcttgctggaggagttcgttttctcgccccgtctggataacctgaacagctcgttc840
tgtgccactgttggactaatcgactccgttgccgatgcgtcggcgctggacgatgaaccg900
tccattcgtctcattgcgttattcgatcacgaagagatcggcagccgtaccgcacaggga960
gctgactcaaatgtgcttccggcaattatccgtcgcctgtctgttctaccttcttccaca1020
tctggcaatgaagacttggctactgctttcgaggagactttgtcgacttcattcctcctc1080
tctgcggacatggctcatgctgtccaccctaactacgctgctaagtacgagaatgatcac1140
cgaccggagatcaacaagggtcctgtgatcaagatcaacgccaatgctcgctacgcgacg1200
aactcccctggcattgtcctacttcaggaggttgcacgcaaggcagcagaagacggtgga1260
gaaggcgttcctctccaactcttcgtcgttcgcaacgactccagctgcggaagcacaatt1320
ggtcccatgttgtccgctgcgcttggtgcccgcacgctggacttgggtaacccacagcta1380
agcatgcacagtatccgggagactggtggtacatatgatgttgggcattctattcggttg1440
ttcactagcttcttcaagcattactccaacacgtcaaagacaatctttgttgactga1497
- 还没有人留言评论。精彩留言会获得点赞!